Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Похожие презентации:
Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (лекция 6)
Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции
Электрохимия. Окислительно-восстановительные реакции
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции
1. Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронногобаланса для уравнивания
окислительновосстановительных
реакций
2. Вспомним!
Степень окисления – это условныйзаряд, который приобрел бы атом в
молекуле, если бы все электронные
пары его химических связей
сместились в сторону более
электроотрицательных атомов.

1. Степень окисления атомов в простых
веществах равна нулю:
0
0
0
h3, Cl2, Na .
2. В сложных веществах О-2.
3. В сложных веществах Н+1.
4. С.О. металлов всегда положительна,
максимальное значение С.О. металлов
главных подгрупп обычно совпадает с
номером группы, в которой расположен
металл.
Алгебраическая сумма степеней
окисления всех атомов в соединении
всегда равна нулю:
+1 -2
h3SO4
(+1)·2 + (+6)·1 + (–2)·4 = 0
В реакциях ионного обмена составные
части веществ переходили в состав других
веществ без изменений, степени
окисления элементов и заряды ионов не
менялись:
+1 +5 -2
+1 -1
+1 -1
+1 +5 -2
AgNO3 + HCl = AgCl + HNO3
Однако существует огромное
множество реакций, в ходе которых
меняются степени окисления
элементов:
0
0
+2 -2
Fe + S = FeS
Химические реакции, в результате
которых происходит изменение
степеней окисления атомов
химических элементов или ионов,
образующих реагирующие вещества,
называют окислительновосстановительными реакциями
(ОВР).

Элемент, отдающий электроны,
называется восстановителем, а
принимающий электроны окислителем.
Процесс отдачи электронов
называется окислением, а принятия восстановлением.
В процессе окисления степень
окисления повышается, в процессе
восстановления — понижается.
Эти процессы неразрывно
связаны между собой, число
принятых окислителем
электронов должно быть равно
числу отданных
восстановителем электронов. На
этом основании составляется
электронный баланс и
расставляются коэффициенты.
10. Чтобы составить схему о-в процесса, необходимо:
1. Определить степень окисления элементов.2. Определить элементы, изменившие степень
окисления.
3. Составить схему: определить элемент,
теряющий, и элемент, принимающий
электроны.
4. Составить электронный баланс (число
отданных электронов всегда должно равняться
числу электронов, принятых).
5. Расставить коэффициенты в уравнении по
электронному балансу, определить окислитель
и восстановитель.

11. 0 0 +3 -2
02
в — ль
0
-2
Al +3 S = Al2S3
окисление
Al0 — 3ē → Al+3
восстановление
ок — ль
+3
S0 + 2ē → S-2
6
2 2Al0–6ē→2Al+3
3 3S0 +6ē →3S-2
0
0
+2 -2
2 Mg + O2 = 2MgO
в — ль
окисление
Mg0 — 2ē → Mg+2
восстановление
ок — ль
O20 + 4 ē → 2 O-2
4
2 2Mg0-4ē→2Mg+2
1 O20 +4ē → 2O-2
13. Окислительно-восстановительные реакции в природе и технике:
Окислительновосстановительные реакции вприроде и технике:
14. Задание 1.
Определите степени окисления всеххимических элементов, входящих в
состав веществ:
NaOH, MgCl2, K2CO3, AlCl3, h4PO4,
K2SO4, HNO3, CuSO4, Fe, Zn(NO3)2.
15. Задание 2.
Расставьте коэффициенты методомэлектронного баланса в следующих
уравнениях реакций:
1)
2)
3)
4)
5)
HgO = Hg + O2
h3S + O2 = SO2 + h3O
KClO3 = KCl + O2
CuS + O2 = CuO + SO2
N2 + h3 = Nh4
16.
 Домашнее задание: Расставьте коэффициенты в
Домашнее задание: Расставьте коэффициенты вуравнениях методом электронного
баланса:
1)
2)
3)
4)
5)
Fe + Cl2 → FeCl3
Zn + HCl → ZnCl2
HBr + O2 → h3O + Br2
Nh4 + O2 → NO + h3O
Zn + HNO3 → Zn(NO3)2 + N2 + h3O
English Русский Правила
Задачи к разделу Окислительно-восстановительные реакции
В данном разделе собраны задачи по теме Окислительно-восстановительные реакции. Приведены примеры задач на составление уравнений реакций, нахождение окислительно-восстановительного потенциал, и константы равновесия ОВР и другие.
Задача 1. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO, SO2, K2MnO4, Сl2, HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
HNO3 + H2S = H2SO4 + NO + H2O.
Показать решение »
Решение.
Простые вещества, атомы которых не могут отдать электрон, а могут только присоединить его в реакциях являются только окислителями. Из простых веществ только окислителем может быть фтор F2, атомы которого имеют наивысшую электроотрицательность. В сложных соединениях – если атом, входящий в состав этого соединения (и меняющий степень окисления) находится в своей наивысшей степени окисления, то данное соединение будет обладать только окислительными свойствами.
Из предложенного списка соединений, нет веществ, которые обладали бы только окислительными свойствами, т.к. все они находятся в промежуточной степени окисления.
Наиболее сильный окислитель из них – Cl2, но в реакциях с более электроотрицательными атомами будет проявлять восстановительные свойства.
N-3H3, C+2O, S+4O2, K2Mn+6O4, Сl02, HN+3O2
HNO3 + H2S = H2SO4 + NO + H2O.
Составим электронные уравнения:
N+5 +3e— = N+2 | 8 окислитель
S-2 — 8e— = S+6 | 3 восстановитель
Сложим два уравнения
8N+5 +3S-2— = 8N+2 + 3S+6
Подставим коэффициенты в молекулярное уравнение:
8HNO3 +3H2S = 3H2SO4 + 8NO + 4H2O.
Задача 2. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой; б) с HI; в) с KMnO4. Какую функцию выполняет азотистая кислота в этих реакциях?
Показать решение »
Решение.
HN+3O2 — Степень окисления азота в азотистой кислоте равна +3 (промежуточная степень окисления). Азот в этой степени окисления может как принимать, так и отдавать электроны, т.е. может являться как окислителем, так восстановителем.
Азот в этой степени окисления может как принимать, так и отдавать электроны, т.е. может являться как окислителем, так восстановителем.
а) HNO2 + Br2 + H2O = 2HBr + HNO3
N+3 – 2 e = N+5 | 1 восстановитель
Br20 + 2 e = 2Br— | 1 окислитель
N+3 + Br2 = N+5 + 2Br—
б) HNO2 + 2HI = I2 + 2NO + 2H2O
N+3 + e = N+2 | 1 окислитель
2I— — 2 e = I2 | 1 восстановитель
N+3 + 2I— = N+2 + I2
в) 5HNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5HNO3 + K2SO4 + 3H2O
N+3 – 2 e = N+5 | 5 восстановитель
Mn+7 + 5 e = Mn+2 | 2 окислитель
5N+3 + 2Mn+7 = 5N+5 + 2Mn+2
Задача 3. Определите степени окисления всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO2 , HClO3 , Cl2O7 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
Определите степени окисления всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO2 , HClO3 , Cl2O7 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
КСlO3 → КС1 + КСlO4.
Укажите окислитель и восстановитель.
Показать решение »
Решение.
Хлор может проявлять степени окисления от -1 до +7.
Соединения, содержащие хлор в его высшей степени окисления, могут быть только окислителями, т.е. могут только принимать электроны.
Соединения, содержащие хлор в его низшей степени окисления, могут быть только восстановителями, т.е. могут только отдавать электроны.
Соединения, содержащие хлор в его промежуточной степени окисления, могут быть как восстановителями, так и окислителями, т.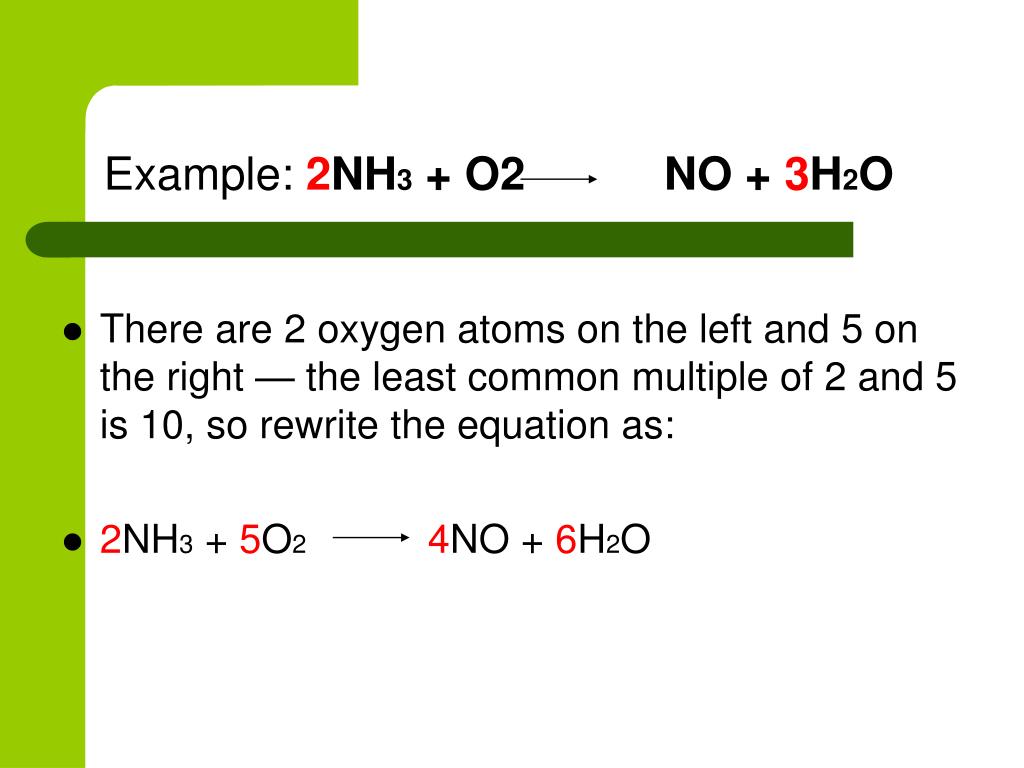 е. могут отдавать, так и принимать электроны.
е. могут отдавать, так и принимать электроны.
H+1Сl-1, Cl02, H+1Cl+3O2-2 , H+1Cl+5O3-2 , Cl2+7O7-2
Таким образом, в данном ряду
Только окислитель — Cl2O7
Только восстановитель – HСl
Могут быть как окислителем, так и восстановителем — Cl2, HClO2 , HClO3
КСlO3 → КС1 + КСlO4.
Составим электронные уравнения
Cl+5 +6e— = Cl— | 2 | 1 окислитель
Cl+5 -2e— = Cl+7 | 6 | 3 восстановитель
Расставим коэффициенты
4Cl+5 = Cl— + 3Cl+7
4КСlO3 → КС1 + 3КСlO4.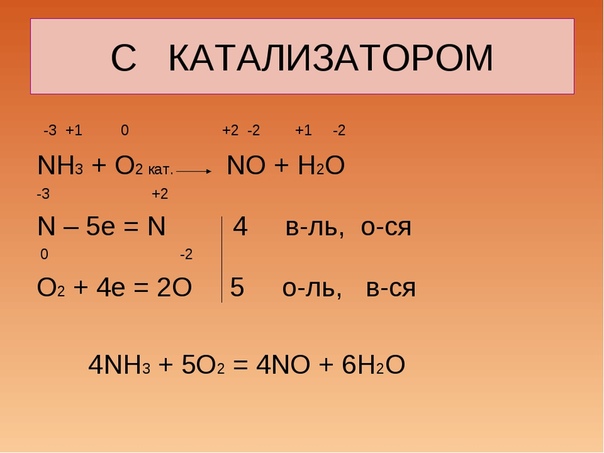
Задача 4. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
а) KNO3 = KNO2 + O2;
б) Mq+ N2 = Mq3N2;
в) KClO3 = KCl + O2.
Показать решение »
Решение.
В реакциях внутримолекулярного окисления-восстановления перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы)
а) 2KNO3 = 2KNO2 + O2 — внутримолекулярная ОВР
N+5 +2e— = N+3 | 2 окислитель
2O-2 -4e— = O20 | 1 восстановитель
2N+5 + 2O-2 = 2N+3 + O20
б) 3Mq + N2 = Mq3N2 — межмолекулярная ОВР
N2 +6e— = 2N-3 | 2 | 1 окислитель
Mg0 -2e— = Mg+2 | 6 | 3 восстановитель
N2 + 3Mg0 = 2N-3 + 3Mg+2
в) 2KClO3 = 2KCl + 3O2 — внутримолекулярная ОВР
Cl+5 +6e— = Cl— | 4 | 2 окислитель
2O-2 -4e— = O20 | 6 | 3 восстановитель
2Cl+5+ 6O-2 = 2Cl— + 3O20
Задача 5. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
а) Cl2 + KOH = KCl + KClO3 + H2O;
б) KClO3 = KCl + KClO4 .
Показать решение »
Решение.
В реакциях диспропорционирования окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления.
а) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O;
Cl20 +2e— = 2Cl— | 10| 5 окислитель
Cl20 -10e— = 2Cl+5 | 2 | 1 восстановитель
5Cl20 + Cl20 = 10Cl— + 2Cl+5
3Cl20 = 5Cl— + Cl+5
б) 4KClO3 = KCl + 3KClO4
Cl+5 +6e— = Cl— | 2 | 1 окислитель
Cl+5 -2e— = Cl+7 | 6 | 3 восстановитель
4Cl+5 = Cl— + 3Cl+7
Задача 6. Составьте электронные уравнения и подберите коэффициенты ионно-электронным методом в реакции
Составьте электронные уравнения и подберите коэффициенты ионно-электронным методом в реакции
KMnO4 + KNO2 + H2SO4 = K2SO4 + MnSO4 + KNO3 + H2O
Показать решение »
Решение.
Составим полуреакции:
MnO4— + 8H+ +5e— = Mn2+ + 4H2O | 2 окислитель
NO2— + H2O — 2e— = NO3— + 2H+ | 5 восстановитель
Сложим две полуреакции, умножив каждую на соответствующий коэффициент:
2MnO4— + 16H+ + 5NO2—+ 5H2O = 2Mn2+ + 8H2O + 5NO3— + 10H+
После сокращения идентичных членов, получаем ионное уравнение:
2MnO4— + 6H+ + 5NO2— = 2Mn2+ + 3H2O + 5NO3—
Подставим коэффициенты в молекулярное уравнение и уравняем его правую и левую части:
2KMnO4 + 5KNO2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5KNO3 + 3H2O
Задача 7. Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O
Zn + H2SO4(конц) = ZnSO4 + SO2 + H2O
Показать решение »
Решение.
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Составим электронные уравнения
Zn0 – 2 e = Zn2+ | 8 | 4 | восстановитель
N+5 + 8 e = N3- | 2 | 1 | окислитель
4Zn0 + N+5 = 4Zn2+ + N3-
Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O
Составим электронные уравнения
Zn0 – 2 e = Zn2+ | 2 | 1 восстановитель
S+6 + 2 e = S+4 | 2 | 1 окислитель
Zn0 + S+6 = Zn2+ + S+4
Задача 8. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2F— -2e— = F2, E0 = 2,85 В
б) 2Сl— -2e— = Cl2, E0 = 1,36 В
в) 2Br— -2e— = Br2, E0 = 1,06 В
г) 2I— -2e— = I2, E0 = 0,54 В
Стандартный окислительно-восстановительный потенциал системы
Cr2O72- + 14H+ + 6e— = 2Cr3+ + 7H2O равен E0 =1,33 В
Показать решение »
Решение.
Для определения возможности протекания ОВР в прямом направлении необходимо найти ЭДС гальванического элемента:
ЭДС = Е0ок — Е0восст
Если найденная величина ЭДС > 0, то данная реакция возможна.
Итак, определим, можно ли K2Cr2O7 использовать в качестве окислителя в следующих гальванических элементах:
F2|F— || Cr2O72-|Cr3+ E = 1,33 – 2,85 = -1,52 В
Cl2|Cl— || Cr2O72-|Cr3+ E = 1,33 – 1,36 = -0,03 В
Br2|Br— || Cr2O72-|Cr3+ E = 1,33 – 1,06 = +0,27 В
I2|I— || Cr2O72-|Cr3+ E = 1,33 – 0,54 = +0,79 В
Таким образом, в качестве окислителя дихромат калия можно использовать только для процессов:
2Br— -2e— = Br2 и 2I— -2e— = I
Задача 9. Вычислите окислительно-восстановительный потенциал для системы
MnO4— + 8H+ +5e— = Mn2+ + 4H2O
Если С(MnO4—)=10-5 М, С(Mn2+)=10-2 М, С(H+)=0,2 М.
Показать решение »
Решение.
Окислительно-восстановительный потенциал рассчитывают по уравнению Нернста:
E = E° + (0,059/n)lg(Cок/Cвос)
В приведенной системе в окисленной форме находятся MnO4— и H+, а в восстановленной форме — Mn2+, поэтому:
E = 1,51 + (0,059/5)lg(10-5*0,2/10-2) = 1,46 В
Задача 10. Рассчитайте для стандартных условий константу равновесия окислительно-восстановительной реакции:
2KMnO4 + 5HBr + 3H2SO4 = 2MnSO4 + 5HBrO + K2SO4 + 3H2O
Показать решение »
Решение.
Константа равновесия K окислительно-восстановительной реакции связана с окислительно-восстановительными потенциалами соотношением:
lgK = (E10 -E20 )n/0,059
Определим, какие ионы в данной реакции являются окислителем и восстановителем:
MnO4— + 8H+ +5e— = Mn2+ + 4H2O | 2 окислитель
Br— + H2O — 2e— = HBrO + H+ | 5 восстановитель
Общее число электронов, принимающих участие в ОВР n = 10
E10 (окислителя) = 1,51 В
E20 (восстановителя) = 1,33 В
Подставим данные в соотношение для К:
lgK = (1,51 — 1,33 )10/0,059
lgK = 30,51
K = 3,22*1030
Примеры ОВР с ответами приведены также в разделе тест Окислительно-восстановительные реакции
Категории ОБЩАЯ ХИМИЯ, Окислительно-восстановительные реакцииNh4 + O2 в NO + h3O
- Курс
- NCERT
- Класс 12
- Класс 11
- Класс 10
- Класс 9
- Класс 8
- Класс 7
- Класс 6
- IIT JEE
- NCERT
- Exam
- JEE MAINS
- JEE ADVANCED
- ПЛАТЫ X
- ПЛАТЫ XII
- NEET 9004 0
- Новый предыдущий год (по годам)
- Физика Предыдущий год
- Химия Предыдущий год
- Биология Предыдущий год
- Нет Все образцы работ
- Образцы работ Биология
- Образцы работ Физика
- Образцы работ Химия
- Скачать PDF-файлы
- Класс 12
- Класс 11
- Класс 10
- Класс 9
- Класс 8
- Класс 7
- Класс 6
- Экзаменационный уголок
- Онлайн-класс
- Викторина
- Задать вопрос в Whatsapp
- Поиск Doubtnut
- Английский словарь
- Toppers Talk
- Блог
- О нас
- Карьера
- Скачать
- Получить приложение
Вопрос
Обновлено: 26/04/2023
КИСЛОРОД-УРОВЕНЬ-3
11 видеоРЕКЛАМА
Ab Padhai каро бина объявления ке
Khareedo DN Про и дехо сари видео бина киси объявление ки рукаават ке!
Похожие видео
స్థిరాంకం సమాసం కింది విధంగా ఉంది. Kc=[Nh4]4[O2]5[NO]4[h3O]6 న రసాయన సమీకరణం రాయండి.
Kc=[Nh4]4[O2]5[NO]4[h3O]6 న రసాయన సమీకరణం రాయండి.
423823856
01:22
Напишите сбалансированное химическое уравнение для равновесной реакции, константа равновесия которой определяется выражением ? 96) Напишите сбалансированное химическое уравнение, соответствующее этому выражению.
642780622
Text Solution
समीकरणों को संतुलित करें : 9015 2 Nh4+O2→N2+h3O
643055954
01:16
को संतुलित करें-
Nh4+O2→N2+h3O
643056005
01:53
Сбалансируйте химическое уравнение
h3+O2→h3O
643261773
02:45
Завершите и сбалансируйте следующее уравнение:
Nh4+O2→ ____________ + ____________
643439666
01:40
निम्न रासायनिक समी करणों को संतुलित करें-
h3S+O2→h3O+SO2
643530481
01:58
निम्न रासायनिक समीकरणों को संतुलित करें-
Ch5+O2→CO2+h3O
643530492
01:41
निम्न रासायनिक समी करणों को संतुलित करें-
CuO+Nh4→Cu+N2+h3O
643530502
01:58 901 31
Баланс химических уравнений PbO +NH_3 в Pb + H_2O + N_2
643924773
01:25
Баланс уравнения: h3O2→h3O+O2
644242421
01:45
Баланс химических уравнений : C_3 H_(8) + O_2 до CO_2 + H_2O
645952289
01:29
Сбалансируйте химические уравнения: CO_2 + H_2O до C_6 H_(12) O_6 + O_2
645952290
02:09
Сбалансируйте химические уравнения:
CuO+Nh4→Cu+h 3O+N2
645952294
01:52
РЕКЛАМА
PEARSON IIT JEE FOUNDATION-AIR AND OXYGEN-LEVEL-3
Сбалансируйте химические уравнения: Nh4 + O2 в NO + h3O
02:27
9000 3Почему морозильная камера в холодильнике вообще на…
03:01
Как небо выглядит с луны ?
02:05
9(@)Ф. Оправдывать.03:11
Ультрафиолетовые лучи находят применение в очистке воды, хотя это…
02:37
Глубоководные водолазы носят кислород, разбавленный гелием, в баллонах вместо… 90 131
06:15
Температура тропосферы уменьшается с увеличением высоты. Есть …
06:19
‘Хоть кислород и является сторонником жизни на земля, присутствие нитр. ..
..
04:49
- Задайте неограниченное количество вопросов
- Видеорешения на нескольких языках (включая хинди)
- Видеолекции экспертов
Doubtnut хочет отправлять вам уведомления. Разрешите получать регулярные обновления!
Слушаем…
Уравновешивание окислительно-восстановительных реакций – примеры
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 277
Окислительно-восстановительные или «окислительно-восстановительные» реакции происходят, когда элементы в химической реакции приобретают или теряют электроны, вызывая увеличение или уменьшение степени окисления. Для балансировки этих реакций используется метод полууравнения.
Для балансировки этих реакций используется метод полууравнения.
В окислительно-восстановительной реакции один или несколько элементов окисляются, а один или несколько элементов восстанавливаются. Окисление — это потеря электронов, тогда как восстановление — это приобретение электронов. Простой способ запомнить это — подумать о зарядах: заряд элемента уменьшается, если он получает электроны (аббревиатура для запоминания разницы: LEO = Lose Electron Oxidation и GER = Gain Electron Reduction). Окислительно-восстановительные реакции обычно происходят в одной из двух сред: кислой или щелочной. Чтобы сбалансировать окислительно-восстановительные уравнения, необходимо понимание степеней окисления.
Некоторые моменты, которые следует помнить при балансировке окислительно-восстановительных реакций:
- Уравнение разделено на два полууравнения, одно для окисления, другое для восстановления.
- Уравнение уравновешивается корректировкой коэффициентов и добавлением H 2 O, H + и e — в следующем порядке:
- Сбалансируйте атомы в уравнении, кроме O и H.

- Чтобы сбалансировать атомы кислорода, добавьте соответствующее количество воды (H
- Чтобы сбалансировать атомы водорода (включая добавленные на шаге 2), добавьте ионы H + .
- Сложите заряды с каждой стороны. Их нужно сделать равными, добавив достаточное количество электронов (e — ) к более положительной стороне.
- Сбалансируйте атомы в уравнении, кроме O и H.
- e — с каждой стороны должны быть равными; если они не равны, их нужно умножить на соответствующие целые числа, чтобы сделать их одинаковыми.
- Полууравнения складываются вместе, исключая электроны, чтобы сформировать одно сбалансированное уравнение. Отмените как можно больше.
- (Если уравнение уравновешивается в основном растворе, необходимо добавить соответствующее количество OH — , чтобы превратить оставшиеся H + в молекулы воды)
- Теперь уравнение можно проверить, чтобы убедиться, что оно сбалансировано.

Далее эти шаги будут показаны в другом примере:
Пример \(\PageIndex{1A}\): в кислом водном растворе 9{-}}\) ион с зарядом -1. Если мы сложим эти два заряда, то сможем вычислить, что в левой части уравнения общий заряд равен +7. В правой части есть атом \(\ce{Mn}\) с зарядом +2, а затем 4 молекулы воды с зарядом 0. Таким образом, общий заряд правой части равен +2. Мы должны добавить 5 электронов в левую часть уравнения, чтобы убедиться, что обе части уравнения имеют одинаковые заряды +2.
Шаг 5: Умножьте обе стороны обеих реакций на наименьшее общее кратное, что позволит полуреакциям иметь одинаковое количество электронов и компенсировать друг друга. 9{2+} + 8 H_2O} \nonumber\]
В этой задаче в обеих частях уравнения нет ничего, что можно было бы сократить, кроме электронов. Наконец, дважды проверьте свою работу, чтобы убедиться, что масса и заряд сбалансированы. Чтобы еще раз проверить это уравнение, вы можете заметить, что все сбалансировано, потому что обе части уравнения имеют общий заряд +4.


