Нитрат аммония – свойства, молярная масса, происхождение и структура
Нитрат аммония представляет собой химическое соединение, которое имеет множество применений и состоит из атомов азота, водорода, кислорода. Нитрат аммония обладает отличными химическими и физическими свойствами, которые используются для многих целей.
Нитрат аммония представляет собой химическое соединение, которое образуется при соединении иона аммония с ионом нитрата. Молекула аммиачной селитры образована соединением 2 атомов азота, 4 атомов водорода и 3 атомов кислорода. Аммоний имеет химическую формулу NH 4+ , а нитрат имеет химическую формулу NO 3-. Когда эти два соединения объединяются, они образуют нитрат аммония с формулой NH 4 NO 3 . Это белые твердые кристаллы, хорошо растворимые в воде. Широко используется в сельском хозяйстве в качестве удобрения. Он также используется в качестве взрывчатого вещества. Однако из-за опасений по поводу его неправильного использования многие страны ведут дебаты о прекращении использования нитрата аммония.
Каковы физические свойства нитрата аммония?
Нитрат аммония представляет собой твердое бесцветное кристаллическое вещество. Он кристаллический. Он не имеет собственного запаха, то есть не имеет запаха. Нитрат аммония в чистом виде имеет белый или серый цвет. Плотность вещества указана как 1,725 г на см³, что делает его легко растворимым в различных веществах. Нитрат аммония действует стабильно в нормальных условиях при его использовании и хранении, но выделяет закись азота, обычно известную как веселящий газ, при нагревании до разложения. Он имеет тенденцию поглощать влагу из воздуха, делая его гигроскопичным.
Какова молярная масса нитрата аммония?
Молярная масса нитрата аммония составляет 80,043 г на моль.
Как рассчитать молекулярную массу нитрата аммония?
Давайте посмотрим, как рассчитать молекулярную массу данного соединения:
Молярная масса нитрата аммония = сумма молярных масс всех его составляющих в правильной пропорции.
Молекулярная масса азота = 14,0067·
Молекулярная масса водорода = 1,00784
Молекулярная масса кислорода = 15,9999
Молекулярная масса нитрата аммония = 2 * масса атома азота + 4 * масса атома водорода + 3 * масса атома кислорода
= 28,0134 + 4,03136 + 47,9997
= 80,043.
Где в природе встречается нитрат аммония?
В природе нитрат аммония встречается как природный минерал. Встречается в виде гигабайта, который называют аммиачным аналогом селитры. Обычно встречается в пустыне Атакама в Чили. Только самые засушливые районы пустыни подходят для нахождения аммиачной селитры. В этих регионах он встречается в виде корки на земле. Он часто встречается в сочетании с другими соединениями, а именно нитратами, йодатами и другими галоидными минералами.
Раньше в этих регионах добывали нитрат аммония как минерал. Однако в настоящее время большая часть, если не вся аммиачная селитра производится химическим путем.
Как в промышленности производится нитрат аммония?
Большая часть производимого нитрата аммония синтезируется химическим путем. Промышленное производство аммиачной селитры основано на кислотно-щелочной реакции между аммиаком и азотной кислотой. Молекула азотной кислоты (кислой) соединяется с молекулой аммиака (основной) с образованием одной молекулы нитрата аммония. Реакция резюмируется как:
HNO 3 + NH 3 → NH 4 NO 3
Для этого процесса аммиак используется в газообразной или безводной форме. Затем этот газообразный аммиак добавляют к концентрированной азотной кислоте с образованием нитрата аммония. Эта реакция сильно экзотермична. Это означает, что он производит большое количество тепловой энергии во время процесса.
Полученный раствор содержит до 83% нитрата аммония. Затем раствор выпаривают, чтобы удалить избыток воды и получить содержание нитрата аммония 95-99% (в зависимости от сорта продукта).
Этот высококонцентрированный нитрат аммония называется расплавом нитрата аммония или расплавом AN. Затем этот АН превращается в мелкие шарики в распылительной башне. Эти бусины называются приллами. Расплав AN также преобразуется в гранулы путем распыления, а также кувыркания во вращающемся барабане. Затем эти гранулы или шарики дополнительно сушат и охлаждают. Для предотвращения слеживания эти таблетки или гранулы покрыты покрытием. Затем они готовятся и продаются как коммерческие продукты И.
Для этого процесса требуется аммиак, который производится в процессе Габера объединения водорода и азота. Аммиак, полученный в процессе Габера, затем окисляется до азотной кислоты в процессе Оствальда.
Другим методом производства нитрата аммония, который используется в промышленных масштабах, является процесс Одда.
В этом процессе одна молекула нитрата кальция реагирует с двумя молекулами аммиака, одной молекулой двуокиси углерода и одной молекулой воды с образованием карбоната кальция и нитрата аммония. Реакция резюмируется следующим образом:
Реакция резюмируется следующим образом:
CA (№ 3 ) 2 + 2 NH 3 + CO 2 + H 2 O → 2 NH 4 NO 3 + CACO 3
. этой реакции являются карбонат кальция и нитрат аммония. Эти соединения могут быть разделены и очищены перед продажей. Или они могут продаваться вместе как смесь.
Другим методом, используемым для синтеза нитрата аммония, являются реакции метатезиса.
Реакция первого типа включает реакцию одной молекулы сульфата аммония с одной молекулой нитрата бария. В результате реакции образуются две молекулы нитрата аммония и одна молекула сульфата бария.
(NH 4 ) 2SO 4 + BA (№ 3 ) 2 → 2 NH 4 NO 3 + BASO 4
Во второй реакции, одна молекула глиса аммония. реагирует с одной молекулой азотнокислого серебра.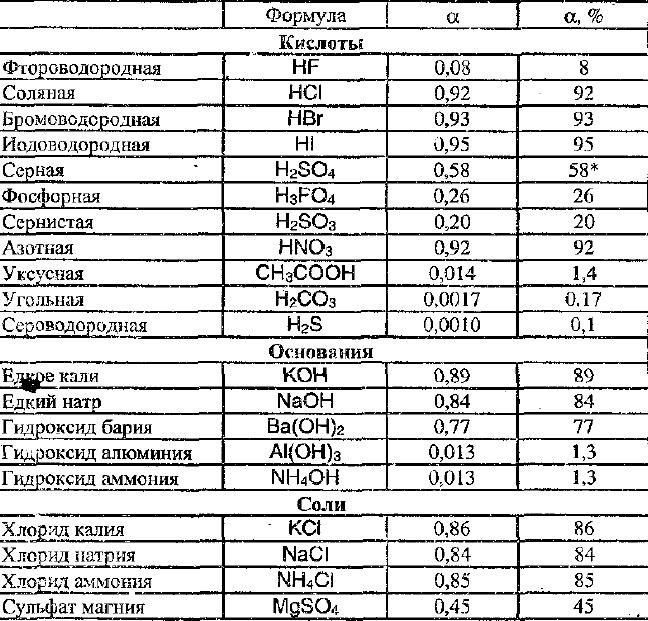 В результате получается одна молекула аммиачной селитры и одна молекула хлорида серебра.
В результате получается одна молекула аммиачной селитры и одна молекула хлорида серебра.
NH 4 Cl + AgNO 3 → NH 4 NO 3 + AgCl
Каковы некоторые важные реакции для нитрата аммония?
Нитрат аммония вступает во многие важные реакции. Некоторые из них перечислены ниже:
1. Реакции с гидроксидами металлов.
При взаимодействии гидроксидов металлов с нитратом аммония образуются нитраты щелочных металлов. Наряду с нитратами щелочных металлов выделяются также аммиак и вода. Реакция представлена ниже:
NH 4 NO 3 + MOH → NH 3 + H 2 O + MNO 3 (M = Na, K)
2.
При разложении нитрат аммония выделяет закись азота и воду. Оба эти результата находятся в газообразной форме. Таким образом, при нагревании нитрат аммония разлагается, но не оставляет следов.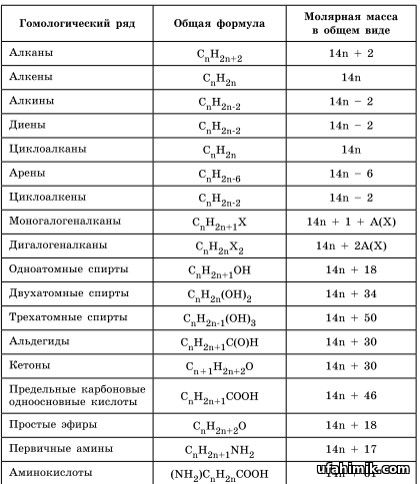 Реакция представлена ниже:
Реакция представлена ниже:
NH 4 NO 3 → N 2 O + 2H 2 O
окись. Однако в случае, если соединение подвергается быстрому нагреванию, при разложении соединения образуются азот, кислород и вода. Эта реакция также происходит, когда нитрат аммония подвергается взрыву. Реакция резюмируется как:
2NH 4 NO 3 → 2N 2 + O 2 + 4H 2 O.
Какова химическая структура нитрата аммония?
Это соединение образуется за счет ионной связи, объединяющей ион аммония и ион нитрата.
Нитрат-ионы стабилизированы в резонансе, а их пи-электроны делокализованы. Суммарный заряд иона рассчитывается ниже:
Заряд атома азота = +1
Заряд кислорода = — ⅔
Таким образом, чистая стоимость аммиачной селитры составляет -1.
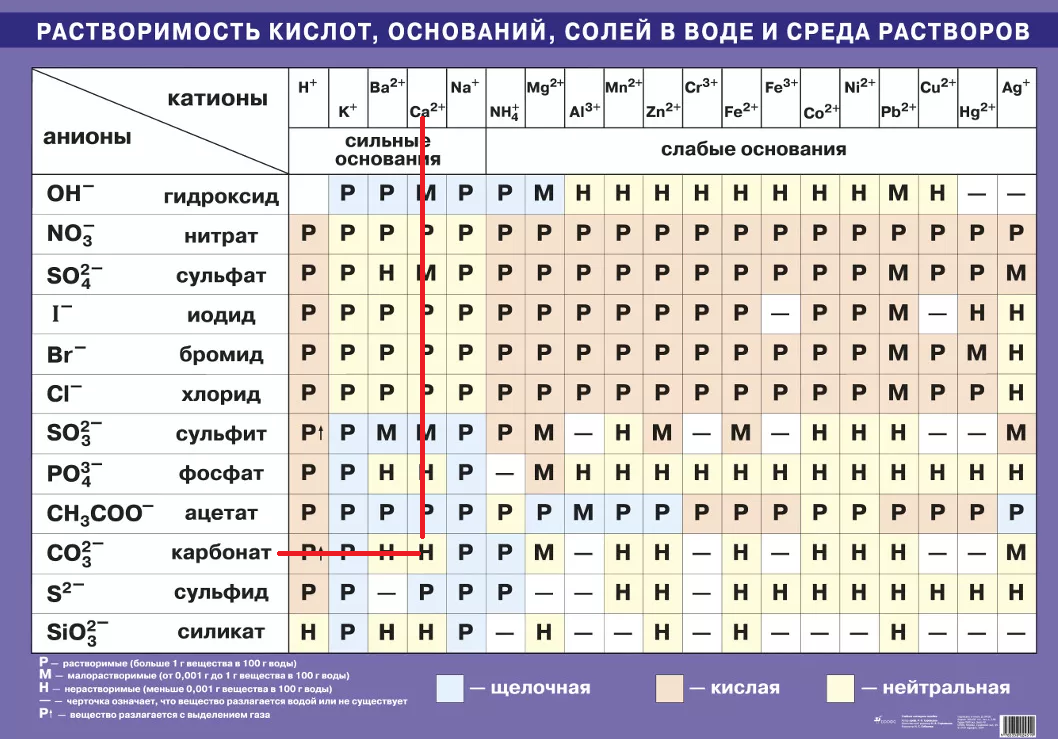
Это кислотное соединение. Эта соль легко растворяется в воде с образованием HNO 3 , которая является сильной кислотой, и NH 3 , которая является слабым основанием.
Эта соль легко растворяется в воде с образованием HNO 3 , которая является сильной кислотой, и NH 3 , которая является слабым основанием.
Какие условия вызывают взрыв аммиачной селитры?
Аммиачная селитра сама по себе не горит. Он вызывает взрыв, обеспечивая кислород и создавая подходящие условия для горения других веществ, т.е. для возникновения возгорания. Он действует как окислитель. Гранулы аммиачной селитры выделяют высококонцентрированный кислород; концентрация кислорода намного больше, чем концентрация, уже присутствующая в воздухе, что делает процесс горения различных веществ быстрым и огромным.
Хотя при высоких температурах нитрат аммония способен быстро разлагаться и выделять различные газы, в основном оксид азота и водяной пар, что приводит к опасным взрывам. Поэтому очень рискованно хранить горючие материалы и нитрат аммония вместе, особенно в местах с высокой температурой и с детонаторами (составами, вызывающими возгорание).
Различные инциденты показали разрушительные свойства аммиачной селитры, если с ней не обращаться с чрезмерной осторожностью. Одна такая авария произошла на фабрике в восточном Китае в 2015 году, а другой взрыв произошел недавно в Бейруте, столице Ливана.
Из-за своей опасной и воспламеняющейся природы нитрат аммония был запрещен к использованию в различных странах, включая Пакистан, Австралию, Ирландию, Великобританию и Германию.
Однако в Индии его использование не запрещено, а разрешено только лицензированным компаниям. Соединение или смесь с содержанием нитрата аммония более 45% по весу помечены как легковоспламеняющееся вещество, что ограничивает его использование.
Инновации, которые привели к более безопасному использованию аммиачной селитры?
Аммиачная селитра, несомненно, является одним из самых важных и исключительно используемых удобрений в мире из-за ее свойства обеспечивать значительное количество азота для выращивания сельскохозяйственных культур по низкой цене. Однако из-за его воспламеняемости, которая стала причиной взрывоопасных ситуаций в разных странах, ученые всего мира разработали инновации, обеспечивающие более эффективное и безопасное использование этого химического вещества. Такие инновации включают в себя различные формы покрытия, смешивания, рецептуры и методы гигроскопичности (влагопоглощения), которые ограничивают вредное воздействие нитрата аммония. Например, производимые сейчас аммиачно-нитратные удобрения имеют безопасное покрытие, которое блокирует проникновение мазута в поры удобрения, что делает его более безопасным для использования в сельском хозяйстве. Точно так же были изобретены различные гигроскопические методы, которые включают смешивание такого вещества, как двойная соль мочевины, что делает используемые удобрения более безопасными.
Однако из-за его воспламеняемости, которая стала причиной взрывоопасных ситуаций в разных странах, ученые всего мира разработали инновации, обеспечивающие более эффективное и безопасное использование этого химического вещества. Такие инновации включают в себя различные формы покрытия, смешивания, рецептуры и методы гигроскопичности (влагопоглощения), которые ограничивают вредное воздействие нитрата аммония. Например, производимые сейчас аммиачно-нитратные удобрения имеют безопасное покрытие, которое блокирует проникновение мазута в поры удобрения, что делает его более безопасным для использования в сельском хозяйстве. Точно так же были изобретены различные гигроскопические методы, которые включают смешивание такого вещества, как двойная соль мочевины, что делает используемые удобрения более безопасными.
Также было доказано, что соединения калия снижают воспламеняемость нитрата аммония в удобрениях и других материалах и обеспечивают его эффективное использование во всем мире. В качестве альтернативы сульфат алюминия действует как осушающий химикат при добавлении к нитрату аммония, что значительно снижает вероятность его взрыва.
В качестве альтернативы сульфат алюминия действует как осушающий химикат при добавлении к нитрату аммония, что значительно снижает вероятность его взрыва.
Какие меры предосторожности при хранении аммиачной селитры?
Хранение аммиачной селитры в подходящих условиях является абсолютным требованием, чтобы уменьшить разрушительные последствия его воспламеняющихся свойств.
Ниже приведены способы и условия хранения аммиачной селитры, сводящие к минимуму ее вредное воздействие:
В вентилируемых складских помещениях: Складские помещения, в которых хранится аммиачная селитра, должны иметь достаточную вентиляцию на случай пожара. Поскольку это вещество легко воспламеняется и всегда существует вероятность его воспламенения, вентиляция является первостепенной необходимостью в хранилищах аммиачной селитры.
Негорючие материалы: Негорючие вещества необходимо хранить вместе с веществами аммиачной селитры, чтобы действовать как стойкие соединения во время взрывной вспышки.

Идеальная температура : Температура в хранилищах должна быть 130 градусов по Фаренгейту или ниже, так как нитрат аммония более склонен к воспламенению при высоких температурах.
Идеальный объем: Вместе следует хранить только 2270 тонн аммиачной селитры. Необходимо хранить только ограниченное количество, так как чем больше количество, тем выше риск воспаления.
Полное противопожарное и противопожарное оборудование: Для компаний, хранящих нитрат аммония (в любой форме), не только рекомендуется, но и необходимо иметь под рукой противопожарные инструменты и оборудование для контроля и ограничения ущерба в случае взрывов. .
6.9: Состав в массовых процентах по химической формуле
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 289389
⚙️ Цели обучения
- Определить процентное содержание каждого элемента в соединении по химической формуле.

Азот является питательным веществом, необходимым для роста растений. Двумя распространенными удобрениями, которые фермеры используют для подачи азота, являются аммиак (NH 3 ) и нитрат аммония (NH 4 NO 3 ). Аммиак применяется в виде газа под давлением, называемого безводным аммиаком. Аммиачная селитра применяется в твердом виде. Оба имеют особые меры предосторожности при обращении. Аммиак хорошо растворяется в воде и быстро растворяется в любой воде, которая подвергается воздействию. В больших концентрациях можно быстро победить аммиак, так как он растворяется в воде во рту, носу, легких и глазах. С другой стороны, нитрат аммония очень взрывоопасен и стал причиной нескольких крупных взрывов со смертельным исходом за последние несколько десятилетий.
Рисунок \(\PageIndex{1}\): Резервуары с безводным аммиаком на поле фермы (Андреа Ганц через Flickr).
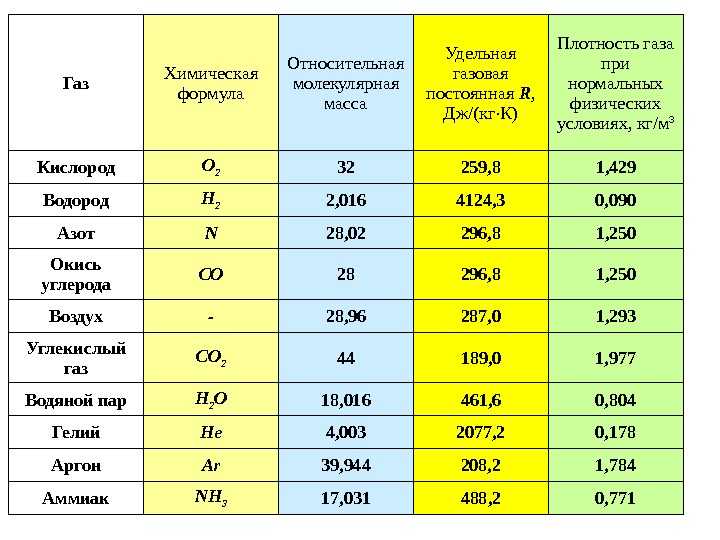 Порт Бейрута через несколько дней после мощного взрыва нитрата аммония в августе 2020 года (Рашид Хрейсс через Unsplash).
Порт Бейрута через несколько дней после мощного взрыва нитрата аммония в августе 2020 года (Рашид Хрейсс через Unsplash).
Несмотря на опасность, оба удобрения по-прежнему широко используются, поскольку каждое из них содержит значительный процент азота по массе. Но какой из двух поставляет наибольшее количество азота по массе? Самый простой способ сделать это — рассчитать молярную массу каждого соединения и использовать часть этой массы, обеспечиваемую азотом, для расчета процентного содержания.
\[\text{% элемента по массе}=\frac{\text{масса элемента в соединении}}{\text{молярная масса соединения}}\times100\%\]
✅ Пример \(\PageIndex{1}\)
Какое вещество обеспечивает наибольший процент азота по массе, NH 3 или NH 4 NO 3 ? Приведите расчеты, подтверждающие ваш ответ.
Решение
| НХ 3 | NH 4 НЕТ 3 | |
|---|---|---|
| 1 N = 1(14,01) = 14,01 г N 3 H = 3(1,008) = 3,024 г H | 2 N = 2(14,01) = 28,02 г N |
| молярная масса = 17,03 г NH 3 | молярная масса = 80,05 г NH 4 NO 3 |
| \(\%\mathrm N=\dfrac{14.01\;\cancel{\mathrm g}}{17.03\;\cancel{\mathrm g}}\times100\%=\boxed{82. | \(\text{\%N=}\dfrac{28,02\;\cancel{\mathrm g}}{80,05\;\cancel{\mathrm g}}\times100\%=\boxed{35,00\%\ ;\mathrm N}\) |
| Из расчетов выше видно, что NH 3 поставляет наибольшее процентное содержание азота по массе. | |
Процентный состав также можно использовать для определения массы определенного элемента, содержащегося в любой массе соединения.
В примере \(\PageIndex{1}\) было обнаружено, что нитрат аммония состоит из 35,00% N. Это означает, что на каждые 100,00 г NH 4 NO 3 приходится 35,00 г N. Поскольку массовые отношения остаются неизменными независимо от размера образца, это также означает, что на каждые 100,00 кг NH 9 приходится 35,00 кг N. 0009 4 NO 3 или даже 35,00 мг N на каждые 100,00 мг NH 4 NO 3 .
0009 4 NO 3 или даже 35,00 мг N на каждые 100,00 мг NH 4 NO 3 .
✅ Пример \(\PageIndex{2}\)
Используя результаты примера \(\PageIndex{1}\), какая масса азота содержится в 50,0-килограммовом мешке азотно-аммиачного удобрения? (Фото: Майк Спиллер через Flickr)
Solution
Нитрат аммония содержит 35,00% N. Это означает, что на каждые 100,00 г NH приходится 35,00 г N 4 NO 3 . Поскольку массовые соотношения остаются одинаковыми независимо от размера пробы, это также означает, что на каждые 100,00 кг NH 4 NO 3 приходится 35,00 кг N. Следовательно,
\(50,0\;\cancel{\mathrm{kg}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}\times\dfrac{35,00\;\mathrm{kg}\ ;\mathrm N}{100.00\cancel{\;\mathrm{kg}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}}=\boxed{17,5\;\mathrm{kg}\ ;\mathrm N}\)
Решение также можно найти, используя массы из расчета молярной массы для NH 4 NO 3 в Примере \(\PageIndex{1}\), в котором было обнаружено, что на каждые 80,05 г NH 4 NO 3 приходится 28,02 г N. Поскольку массовые отношения остаются неизменными независимо от размера образца, это также означает, что на каждые 80,05 кг NH приходится 28,02 кг N 4 NO 3 . Следовательно,
Поскольку массовые отношения остаются неизменными независимо от размера образца, это также означает, что на каждые 80,05 кг NH приходится 28,02 кг N 4 NO 3 . Следовательно,
\(50,0\;\cancel{\mathrm{kg}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}\times\dfrac{28,02\;\mathrm{kg}\ ;\mathrm N}{80,05\отмена{\;\mathrm{кг}\;{\mathrm{NH}}_4{\mathrm{NO}}_3}}=\в коробках{17,5\;\mathrm{кг}\ ;\mathrm N}\)
Обратите внимание, что ответы совпадают.
✏️ Упражнение \(\PageIndex{1}\)
Фторид бария — это прозрачный кристалл, который можно найти в природе в виде минерала франкдиксонита. Определите процентный состав фторида бария.
- Ответить
- 78,32% Ba и 21,67% F
✏️ Упражнения \(\PageIndex{2}\)
Добавка железа содержит 25,0 мг FeSO 4 . Какова масса железа в этом образце?
- Ответить
- 9,19 мг Fe
Резюме
- Описаны процессы расчета процентного состава соединения на основе химической формулы.





 27\%\;\mathrm Н}\)
27\%\;\mathrm Н}\)