Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Составить схемы электролиза водных растворов h3SO4, CuCl2, Pb(NO3)2 с платиновыми электродами
Решено
Mg + HNO3(разб.
ch4-ch(oh)-ch4+h3so4(140C)=….
Пользуйтесь нашим приложением
Zn-ZnO-Zn(NO3)2-Zn(OH)2-Zn3(PO4)2 помогите пожалуйста реш… -reshimne.ru
Новые вопросы
Ответы
2Zn + O2 = 2ZnO;ZnO2 + h3O = Zn(OH)2;3Zn(OH)2 + 2h4PO4 = Zn3(PO4)2 + 6h3O;Zn3(PO4)2 + 6HNO3 = 3Zn(NO3)2 + 2h4PO4;;Zn(NO3)2 + h3SO4 = ZnSO4 + 2HNO3.
Похожие вопросы
Ребят
Срочно
Решите
Очень надо!!!!!!!!…
P — P2O5 — h4PO4 — Mg3(Po4)2 — MgCl2 — Mg(Oh3) — MgO — Mg…
Сколько литров кислорода надо для окисления 6 г магния…
Закончите уравнение реакций kcl+baco3=
NaOH+HNO3=.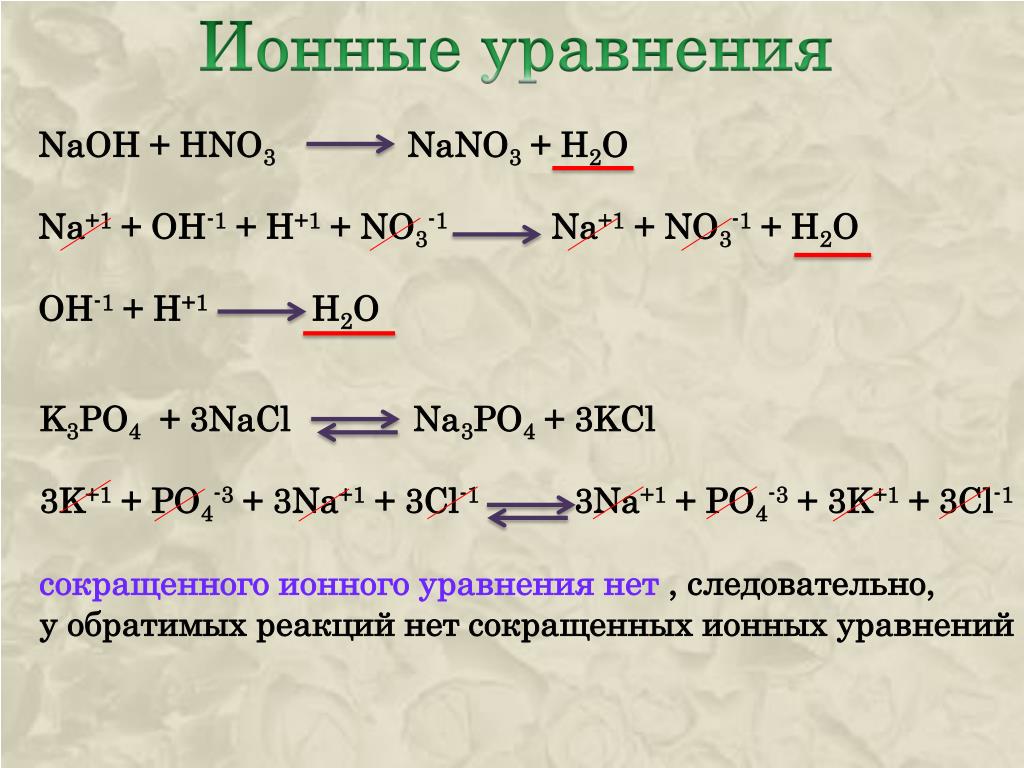 ..
..
Записать химические свойства и примеры химического уравнения
Основные оксиды
1.реагируют с кислотами , образуя соль и воду
2реугирует с кислотными оксидами , образуя соль
3 реагирует с водой (только оксиды щелочных и щелочноземельных металлов)образуя щелочи…
Визначте валентність єлиментіа у сполуках з одновалетним хлором
CaCl2
HCl
PCl5
AlCl3…
Математика
Литература
Алгебра
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
ИсторияОбществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Уравновешивание окислительно-восстановительных реакций в щелочном растворе
Уравновешивание окислительно-восстановительных реакций в щелочном раствореУравновешивание окислительно-восстановительных реакций в основном растворе
Пятнадцать примеров
| Проблемы 1-10 | Задачи 26–50 | Балансировка в кислом растворе |
| Проблемы 11-25 | Только примеры и проблемы | Вернуться в меню Redox |
Следует помнить:
1) Электроны НИКОГДА не фигурируют в правильном, окончательном ответе.Чтобы получить равные электроны в каждой полуреакции, одна или обе сбалансированные полуреакции будут умножены на коэффициент. 2) Повторяющиеся элементы всегда удаляются. Обычно это электроны, вода и гидроксид-ион.
3) Приведенная ниже методика почти всегда уравновешивает полуреакции, как если бы они были кислыми. Затем вы должны добавить гидроксид в конце, чтобы преобразовать его в основной. Иногда (см. пример № 5) вы можете сбалансировать напрямую, используя гидроксид.
Пример #1: NH 3 + ClO¯ —> N 2 H 4 + Cl¯
Решение:
1) Две полуреакции, уравновешенные как бы в кислом растворе:
2NH 3 —> N 2 H 4 + 2H + + 2e¯
2e¯ + 2H + + ClO¯ —> Cl¯ + H 2 O
2) Электроны уже равны, перевести в основной раствор:
2OH¯ + 2NH 3 —> N 2 H 4 + 2H 2 O + 2e¯
2e¯ + 2H 2 O + ClO¯ —> Cl¯ + H 2 О + 2ОН¯Комментарий: это 2 OH¯, а не 20 H¯.
Неправильное прочтение O в OH как ноль является распространенной ошибкой.
3) Окончательный ответ:
2HN 3 + ClO¯ —> N 2 H 4 + Cl¯ + H 2 O
Обратите внимание, что в окончательном ответе нет гидроксида. Это означает, что это реакция, катализируемая основанием. Чтобы реакция произошла, раствор должен быть щелочным, а гидроксид израсходован. Он просто регенерируется в том же количестве, поэтому в окончательном ответе он отменяется.
Пример #2: Au + O 2 + CN¯ —> Au(CN) 2 ¯ + H 2 O 2
4 :
3 Решение
1) Две полуреакции, уравновешенные как бы в кислом растворе:
2CN¯ + Au —> Au(CN) 2 ¯ + e¯
2e¯ + 2H + + O 2 —> H 2 O 2
2) Уравниваем электроны, переводим в основной раствор:
4CN¯ + 2Au —> 2Au(CN) 2 ¯ + 2e¯ 2e¯ + 2H 2 O + O 2 —> H 2 O 2 + 2OH¯
3) Окончательный ответ:
4CN¯ + 2Au + 2H 2 O + O 2 —> 2Au(CN) 2 ¯ + H 2 O 2 + 2OH¯
Комментарий: CN¯ не восстанавливается и не окисляется, но необходим для реакции. Например, вы можете увидеть такой способ написания задачи:
Например, вы можете увидеть такой способ написания задачи:
Золото + О 2 —> Au(CN) 2 ¯ + H 2 O 2
Обратите внимание, что CN¯ появляется не слева, а справа. Поскольку вы ДОЛЖНЫ сбалансировать уравнение, это означает, что вы можете использовать CN¯ в своей балансировке. Важным моментом здесь является то, что вы знаете, что многоатомный ион цианида имеет отрицательный заряд.
Пример №3: Br¯ + MnO 4 ¯ —> MnO 2 + BrO 3 ¯
Решение:
1) Две полуреакции, уравновешенные как бы в кислом растворе:
3H 2 O + Br¯ —> BrO 3 ¯ + 6H + + 6e¯
3e¯ + 4H + + MnO 4 ¯ —> MnO 2 + 2H 2 O
2) Приравнять количество электронов:
3H 2 O + Br¯ —> BrO 3 ¯ + 6H + + 6e¯
6e¯ + 8H + + 2MnO 4 ¯ —> 2MnO 2 + 4Н 2 О3) Преобразовать в основной раствор, добавив 6OH¯ в первую полуреакцию и 8OH¯ во вторую:
6OH¯ + Br¯ —> BrO 3 ¯ + 3H 2 O + 6e¯
6e¯ + 4H 2 O + 2MnO 4 ¯ —> 2MnO 2 + 8OH¯4) Окончательный ответ:
H 2 O + 2MnO 4 ¯ + Br¯ —> 2MnO 2 + BrO 3 ¯ + 2OH¯5) Что произойдет, если сложить две полуреакции, не переводя их в основные?
Вы получаете это:2H + + 2MnO 4 ¯ + Br¯ —> 2MnO 2 + BrO 3 ¯ + H 2 OЗатем добавьте 2OH¯ с каждой стороны:
2H 2 O + 2MnO 4 ¯ + Br¯ —> 2MnO 2 + BrO 3 ¯ + H 2 O + 2OH¯Устраните одну воду, чтобы получить окончательный ответ:
H 2 O + 2MnO 4 ¯ + Br¯ —> 2MnO 2 + BrO 3 ¯ + 2OH¯Ответ на вопрос? Ничего не произошло.
Вы получите правильный ответ, если конвертируете до добавления полуреакций или после. Будут даже случаи, когда можно легко уравновесить одну полуреакцию с использованием гидроксида, в то время как другая полуреакция уравновешивается в кислом растворе перед преобразованием. Вы можете добавить две полуреакции, пока одна является основной, а другая кислотной, а затем преобразовать после добавления (примеры этого см. Пример № 5 и пример № 8 ниже).
Пример #4: AlH 4 ¯ + H 2 CO —> Al 3+ + CH 3 OH
Решение:
1) Две полуреакции, уравновешенные как бы в кислом растворе:
AlH 4 ¯ —> Al 3+ + 4H + + 8e¯
2e¯ + 2H + + H 2 CO —> CH 3 OH2) Превращается в щелочную путем добавления гидроксида, вторая полуреакция умножается на 4 (обратите внимание, что водород окисляется от -1 до +1):
4OH¯ + AlH 4 ¯ —> Al 3+ + 4H 2 O + 8e¯
8e¯ + 8H 2 O + 4H 2 CO —> 4CH 3 OH + 8OH¯3) Окончательный ответ:
AlH 4 ¯ + 4H 2 O + 4H 2 CO —> Al 3+ + 4CH 3 OH + 4OH¯Пример #5: Se + Cr(OH) 3 —> Cr + SeO 3 2 ¯
Решение:
1) Неуравновешенные полуреакции:
Se —> SeO 3 2 ¯
Cr(OH) 3 —> Cr2) Обратите внимание, что только первая полуреакция уравновешивается с использованием метода баланса первого в кислоте, вторая уравновешивается с использованием гидроксида:
Se + 3H 2 O —> SeO 3 2 ¯ + 6H + + 4e¯
3e¯ + Cr(OH) 3 —> Cr + 3OH¯3) Преобразуйте первую полуреакцию, добавив 6 гидроксидов с каждой стороны, устраните дублирующиеся воды, затем уравняйте электроны (коэффициент 3 для первой полуреакции и коэффициент 4 для второй).
Окончательный ответ:
6OH¯ + 3Se + 4Cr(OH) 3 —> 4Cr + 3SeO 3 2 ¯ + 9H 2 O4) Что произойдет, если мы не сделаем первую полуреакцию основной, а просто добавим их?
Уравнять электроны:3Se + 9H 2 O —> 3SeO 3 2 ¯ + 18H + + 12e¯
12e¯ + 4Cr(OH) 3 —> 4Cr + 12OH¯Добавить:
3Se + 4Cr(OH) 3 + 9H 2 O —> 4Cr + 3SeO 3 2 ¯ + 18H + + 12OH¯Объедините ион водорода и гидроксид-ион в правой части:
3Se + 4Cr(OH) 3 + 9H 2 O —> 4Cr + 3SeO 3 2 ¯ + 6Н + + 12Н 2 ОУдаление воды:
3Se + 4Cr(OH) 3 —> 4Cr + 3SeO 3 2 ¯ + 6H + + 3H 2 OДобавить шесть гидроксидов:
6OH¯ + 3Se + 4Cr(OH) 3 —> 4Cr + 3SeO 3 2 ¯ + 9H 2 OОбратите внимание, что я объединил H + и OH¯, чтобы получить шесть вод, а затем добавил его к трем водам, которые уже были там.
Кроме того, я мог бы добавить шесть гидроксидов до удаления воды. Вы можете попробовать это, если хотите.
Пример #6: Au + NaCN + O 2 + H 2 O —> NaAu(CN) 2 + NaOH
Решение:
1) Сетевой ионный:
Au + CN¯ + O 2 —> Au(CN) 2 ¯ + OH¯Я решил рассматривать Au(CN) 2 ¯ как многоатомный ион. Я мог бы удалить цианид и добавить его обратно после балансировки сетевых ионов.
2) Полуреакции:
Au + CN¯ —> Au(CN) 2 ¯
О 2 —> ОХ¯3) Баланс:
Au + 2CN¯ —> Au(CN) 2 ¯ + e¯
4e¯ + 2H + + O 2 —> 2OH¯4) Уравнивание электронов:
4Au + 8CN¯ —> 4Au(CN) 2 ¯ + 4e¯
4e¯ + 2H + + O 2 —> 2OH¯5) Добавить:
4Au + 8CN¯ + 2H + + O 2 —> 4Au(CN) 2 ¯ + 2OH¯Отменяются только электроны.
6) Преобразование в основное решение:
4Au + 8CN¯ + 2H 2 O + O 2 —> 4Au(CN) 2 ¯ + 4OH¯Пример #7: Ag 2 S + CN¯ + O 2 —> Ag(CN) 2 ¯ + S 8 + OH¯
Решение:
1) Исследование показывает, что сульфид окисляется, а кислород восстанавливается. Однако сульфид присоединяется к серебру. Что делать? Оставим его в полуреакции:
Ag 2 S —> S 8
O 2 —> OH¯Обратите внимание на отсутствие ионов цианида. Я добавлю это во время балансировки.
2) Уравновесить только полуреакцию сульфида серебра:
8Ag 2 S —> S 8 8Ag 2 S —> S 8 + 16Ag(CN) 2 ¯ 8Ag 2 ¯ 8Ag 22
8 + 16Ag(CN) 2 ¯ 8Ag 2 S + 32CN¯ —> S 8 + 16Ag(CN) 2 ¯ + 16e¯
3) Уравновесить только кислородную полуреакцию:
О 2 —> 2ОН¯ 2Н + + О 2 —> 2ОН¯ 2Н 2 О + О 2 —> 4ОН¯ 907 2 0¯ 90 + 2Н О + О 2 —> 4OH¯4) Запишите обе уравновешенные полуреакции:
8Ag 2 S + 32CN¯ —> S 8 + 16Ag(CN) 2 ¯ + 16e¯
4e¯ + 2H 2 O + O 2 —> 4OH¯5) Уравнять электроны:
8Ag 2 S + 32CN¯ —> S 8 + 16Ag(CN) 2 ¯ + 16e¯
16e¯ + 8H 2 O + 4O 2 —> 16OH¯6) Добавить:
8Ag 2 S + 32CN¯ + 4O 2 + 8H 2 O —> S 8 + 16Ag(CN) 2 ¯ + 9003OH¯Пример #8: N 2 H 4 + Cu(OH) 2 —> N 2 + Cu
Решение:
1) Полуреакции:
N 2 H 4 —> N 2
Cu(OH) 2 —> Cu2) Баланс:
N 2 H 4 —> N 2 + 4H + + 4e¯
2e¯ + Cu(OH) 2 —> Cu + 2OH¯Обратите внимание, что одна полуреакция уравновешивается в кислой, а другая в щелочной.
Это не создаст проблемы.
3) Уравнять электроны:
N 2 H 4 —> N 2 + 4H + + 4e¯
4e¯ + 2Cu(OH) 2 —> 2Cu + 4OH¯4) Добавить
N 2 H 4 + 2Cu(OH) 2 —> N 2 + 4H + + 2Cu + 4OH¯5) Объедините ион водорода и гидроксид-ион, чтобы получить воду:
N 2 H 4 + 2Cu(OH) 2 —> N 2 + 2Cu + 4H 2 OПример № 9: MNO 4 ¯ + C 2 O 4 2 ¯ —> MNO 2 + CO 2
444.1) Полуреакции:
MnO 4 ¯ —> MnO 27
C 2 O 4 2 ¯ —> CO 26
2) Баланс:
3e¯ + 4H + + MnO 4 ¯ —> MnO 2 + 2H 2 О
C 2 O 4 2 ¯ —> 2CO 2 + 2e¯3) Уравнять электроны:
6e¯ + 8H + + 2MnO 4 ¯ —> 2MnO 2 + 4H 2 O
3C 2 O 4 2 ¯ —> 6CO 2 + 6e¯4) Добавить:
8H + + 2MnO 4 ¯ + 3C 2 O 4 2 ¯ —> 2MnO 2 2 6 + 36CO0037 + 4Н 2 О5) Преобразование в основное путем добавления восьми гидроксидов с каждой стороны (и последующего удаления четырех вод с каждой стороны):
4H 2 O + 2MNO 4 ¯ + 3C 2 O 4 2 ¯ —> 2MNO 2 + 6CO 2 + 8OH 7.Пример №10: Zn + NO 3 ¯ —> Zn(OH) 4 2 ¯ + NH 3
5 Решение:1) Полуреакции:
Zn —> Zn(OH) 4 2 ¯
НЕТ 3 ¯ —> NH 32) Баланс:
Zn + 4OH¯ —> Zn(OH) 4 2 ¯ + 2e¯
8e¯ + 9H + + NO 3 ¯ —> NH 3 + 3H 2 O3) Уравнять электроны:
4Zn + 16OH¯ —> 4Zn(OH) 4 2 ¯ + 8e¯
8e¯ + 9H + + НЕТ 3 ¯ —> NH 3 + 3H 2 O4) Добавить:
4Zn + 9H + + 16OH¯ + NO 3 ¯ —> 4Zn(OH) 4 2 ¯ + NH 3 + 3 3H 25) Дайте прореагировать девяти ионам водорода и девяти ионам гидроксида (и затем удалите три повторяющихся воды):
4Zn + 6H 2 O + 7OH¯ + NO 3 ¯ —> 4Zn(OH) 4 2 ¯ + NH 3та же сторона.
Обычно они находятся на противоположных сторонах.
Пример №11: Составьте уравнение реакции иона двухвалентного олова с пертехнетатом в щелочном растворе. Продуктами являются ионы олова, Sn 4+ и технеция(IV), ионы Tc 4+ .
Решение:
1) Чистая ионная:
TcO 4 ¯ + Sn 2+ —> Tc 4+ + Sn 4+2) Полуреакции:
TcO 4 ¯ —> Tc 4+
Sn 2+ —> Сн 4+3) Кислотный баланс:
3e¯ + 8H + + TcO 4 ¯ —> Tc 4+ + 4H 2 O
Sn 2+ —> Sn 4+ + 2e¯4) Уравнивание электронов:
6e¯ + 16H + + 2TcO 4 ¯ —> 2Tc 4+ + 8H 2 O
3Sn 2+ —> 3Sn 4+ + 6e¯5) Добавить:
16H + + 2TcO 4 ¯ + 3Sn 2+ —> 2Tc 4+ + 3Sn 4+ + 8H 2 O6) Преобразовать в основной, добавив по 16 гидроксидов с каждой стороны:
8H 2 O + 2TcO 4 ¯ + 3Sn 2+ —> 2Tc 4+ + 3Sn 4+ + 16OH¯Пример #12: Cr 2 O 7 2 ¯ + I 2 —> Cr 3+ + IO
7 ¯ 90
Решение:
1) Разделить на полуреакции:
Cr 2 O 7 2 ¯ —> Cr 3+
I 2 —> IO 3 12) Баланс в кислом растворе:
6e¯ + 14H + + Cr 2 O 7 2 ¯ —> 2Cr 3+ + 7H 2 O
6H 2 O + I 2 —> 2IO 3 ¯ + 12H + + 10e¯3) Уравнять электроны:
30e¯ + 70H + + 5Cr 2 O 7 2 ¯ —> 10Cr 3+ + 35H 2 O
18H 2 O + 3I 2 —> 6IO 3 ¯ + 36H + + 30e¯4) Добавить и удалить дубликаты:
34H + + 5CR 2 O 7 2 ¯ + 3i 2 —> 6IO 3 ¯ + 10cr 3+ + 17H 2 0037 О5) Добавьте 34 OH¯ с каждой стороны и удалите дубликаты:
17H 2 O + 5CR 2 O 7 2 ¯ + 3i 2 —> 6IO 3 ¯ + 10cr 3+ + 34OH ¯Пример #13: Bi 3+ + MnO 4 ¯ —> MnO 2 + BiO 3 ¯
Решение:
1) Полуреакции:
Bi 3+ —> BiO 3 ¯
MnO 4 ¯ —> MnO 22) Баланс в кислом растворе:
3H 2 O + Bi 3+ —> BiO 3 ¯ + 6H + + 2e¯
3e¯ + 4H + + MnO 4 ¯ —> MnO 2 + 2H 2 O3) Уравнять электроны:
9H 2 O + 3Bi 3+ —> 3BiO 3 ¯ + 18H + + 6e¯
6e¯ + 8H + + 2MnO 4 ¯ —> 2MnO 2 + 4H 2 O4) Добавлять и удалять похожие элементы:
5H 2 O + 3Bi 3+ + 2MnO 4 ¯ —> 3BiO 3 ¯ + 2MnO 2 + 10H
6 2 + 10H
6 4 ¯5) Переход на базовое решение:
10OH¯ + 5H 2 O + 3BI 3+ + 2MNO 4 ¯ —> 3BIO 3 ¯ + 2MNO 2 + 10.12 O
6) Удаление воды:
10OH¯ + 3Bi 3+ + 2MnO 4 ¯ —> 3BiO 3 ¯ + 2MnO 2 + 5H 2 OПример #14: Co(OH) 2 (т) + SO 3 2 ¯(водн.) —> SO 4 2 ¯()водн.)
Решение:
1) Полуреакции:
Co(OH) 2 (к) —> Co(к)
SO 3 2 ¯(водн.) —> SO 4 2 ¯(водный)3) Баланс:
Co(OH) 2 (тв) —> Co(тв) + 2OH¯
H 2 O + SO 3 2 ¯(водн.) —> SO 4 2 ¯(водн.) + 2H + + 2e¯3) Электроны равны, поэтому добавьте:
H 2 O + SO 3 2 ¯(водн.) + Co(OH) 2 (т) —> Co(s) + 2OH¯ + SO 4 2 90 (водн.) + 2H +
4) H + и OH¯ справа объединяются, образуя воду. Напишите окончательный ответ:
SO 3 2 ¯(водн.) + Co(OH) 2 (т) —> Co(s) + SO 4 2 ¯(водн.) + H7 O
6 2
Пример #15: PtO 4 2 ¯ + Be —> BeO 3 2 ¯ + Pt(OH) 6 7 5
Решение:
1) Полуреакции:
PtO 4 2 ¯ —> Pt(OH) 6 2 ¯
Be —> BeO 3 2 ¯2) Баланс:
2e¯ + 2H + + 2H 2 O + PtO 4 2 ¯ —> Pt(OH) 6 2 ¯
3H 2 O + Be —> BeO 3 2 ¯ + 6H + + 4e¯3) Уравнять электроны:
4e¯ + 4H + + 4H 2 O + 2PtO 4 2 ¯ —> 2Pt(OH) 6 2 ¯
3H 2 O + Be —> BeO 3 2 ¯ + 6H + + 4e¯4) Добавить:
7H 2 O + 2PTO 4 2 ¯ + BE —> 2PT (OH) 6 2 ¯ + BEO 3 2 ¯ + 2H + 2 дет5) Преобразовать в базовый:
2OH¯ + 5H 2 O + 2PTO 4 2 ¯ + BE —> 2PT (OH) 6 2 ¯ + BEO 3 2 ¯Бонус Пример: CuS + HNO 3 —> Cu(NO 3 ) 2 + NO + H 2 SO 4 + H 2 O
Решение:
Это немного странная утка.
Это потому, что это уравнение всегда видно на кислой стороне. За почти 40 лет преподавания в классе я ни разу не видел, чтобы это уравнение было сбалансировано в базовом решении. Итак, вот мы идем. . . . . .
1) Запишите уравнение в чисто-ионной форме:
S 2 ¯ + НЕТ 3 ¯ —> НЕТ + ТАК 4 2 ¯2) Полуреакции:
S 2 ¯ —> SO 4 2 ¯
НЕТ 3 ¯ —> НЕТ3) Баланс в базовом:
8OH¯ + S 2 ¯ —> SO 4 2 ¯ + 4H 2 O + 8e¯
3e¯ + 2H 2 O + NO 3 ¯ —> NO + 4OH¯Я использовал технику старой школы, чтобы выровнять кислород. Он основан на идее, что два ОН (не обращая внимания на отрицательный заряд) равны одной воде плюс один «остаточный» кислород. Это была техника за несколько дней до того, как на смену пришла техника «сначала баланс в кислоте».
4) Уравнивание электронов:
24OH¯ + 3S 2 ¯ —> 3SO 4 2 ¯ + 12H 2 O + 24e¯
24e¯ + 16H 2 O + 8NO 3 ¯ —> 8NO + 32OH¯5) Добавить:
4H 2 O + 3S 2 ¯ + 8NO 3 ¯ —> 3SO 4 2 ¯ + 8NO + 8OH¯6) Начните восстанавливать молекулярное уравнение, добавляя три иона Cu 2+ :
4Ч 2 O + 3CuS + 8NO 3 ¯ —> 3Cu 2+ + 3SO 4 2 ¯ + 8NO + 8OH¯7) Добавьте шесть нитратов:
4H 2 O + 3CuS + 14NO 3 ¯ —> 3Cu(NO 3 ) 2 + 3SO 4 900¯8) Добавьте 14 ионов водорода:
4H 2 O + 3CuS + 14HNO 3 —> 3Cu(NO 3 ) 2 + 3H 2 SO 8 +HNO 7 8036 2 ОСправа шесть H + произвели серную кислоту и восемь прореагировали с гидроксидом 8.
9) Исключите воду для окончательного ответа:
3CuS + 14HNO 3 —> 3Cu(NO 3 ) 2 + 3H 2 SO 4 + 8NO + 4H 7 O 2 2 + 3H 2
Проблемы 1-10 Задачи 26–50 Балансировка в кислом растворе Проблемы 11-25 Только примеры и проблемы Вернуться в меню Redox Zn(OH)(NO3)·h3O (Zn[NO3][OH][h3O]) Кристаллическая структура – SpringerMaterials
Неорганические твердые фазы
Получить доступ СИФ Скачать справку (pdf)
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные
Космическая группа
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время COVID-19пандемия,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
и б в α β γ а/б д/к к/с В Координаты атома
Стандартизированный
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время COVID-19пандемия,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Опубликовано
г.
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Параметры смещения
изотропный
Влияние пандемии COVID-19
- г.
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Порошковый узор
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
г.Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Детали эксперимента
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Ссылка
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
3D интерактивная структура
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Об этом контенте
Имя базы данных PAULING FILE Multinaries Edition – 2012 г.
Идентификатор набора данных sd_1408158
Авторские права © Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Главный редактор Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс.

 02.21
02.21
 Неправильное прочтение O в OH как ноль является распространенной ошибкой.
Неправильное прочтение O в OH как ноль является распространенной ошибкой. Вы получите правильный ответ, если конвертируете до добавления полуреакций или после. Будут даже случаи, когда можно легко уравновесить одну полуреакцию с использованием гидроксида, в то время как другая полуреакция уравновешивается в кислом растворе перед преобразованием. Вы можете добавить две полуреакции, пока одна является основной, а другая кислотной, а затем преобразовать после добавления (примеры этого см. Пример № 5 и пример № 8 ниже).
Вы получите правильный ответ, если конвертируете до добавления полуреакций или после. Будут даже случаи, когда можно легко уравновесить одну полуреакцию с использованием гидроксида, в то время как другая полуреакция уравновешивается в кислом растворе перед преобразованием. Вы можете добавить две полуреакции, пока одна является основной, а другая кислотной, а затем преобразовать после добавления (примеры этого см. Пример № 5 и пример № 8 ниже). Окончательный ответ:
Окончательный ответ:

 Это не создаст проблемы.
Это не создаст проблемы.
 Обычно они находятся на противоположных сторонах.
Обычно они находятся на противоположных сторонах. 2 O
2 O ) + 2H +
) + 2H +  Это потому, что это уравнение всегда видно на кислой стороне. За почти 40 лет преподавания в классе я ни разу не видел, чтобы это уравнение было сбалансировано в базовом решении. Итак, вот мы идем. . . . . .
Это потому, что это уравнение всегда видно на кислой стороне. За почти 40 лет преподавания в классе я ни разу не видел, чтобы это уравнение было сбалансировано в базовом решении. Итак, вот мы идем. . . . . .








