Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Допоможіть, будь ласка, розв’язати задачу.
Помогите вопрос жизни очень нужно Контрольная работа по химии 10 класс. Азотсодержащие органические соединения Вариант 2. ЧАСТЬ А. Тестовые задания с выбором ответа 1 (2 балла). Амины…
Cu+HCl Закончить возможные уравнения реакций
Структурная формула всех изомеров С7Н16
Пользуйтесь нашим приложением
«Окислительно-восстановительные реакции «
1. Степень окисления фосфора в соединении, имеющем формулу H4P2O7:
1) +7;
2) +3;
3) +5;
4) -3.
2.Степень окисления серы уменьшается в ряду веществ:
1)SO2; Na2SO3; Na2S;
2)SO2 ;Na2S2O3 ;KHS;
3) S ;SO3; BaSO
4; 4) H2SO4; SOCl2 ;H2SO3.
3) Соединение, содержащее Mn+7 в кислотной среде восстанавливается до :
1) Mn+4;
2) Mn+6;
3) Mn+2;
4) Mn0.
4.Уравнение реакции диспропорционирования :
1)2H2S+SO2=3S+2H2O;
2)NH4NO3=N2+2H20;
3)2KNO3=KNO2+O2;
4)6KOH+3S=2K2S+K2SO4+3H2O.
5) В окислительно-восстановительной реакции, схема которой:K
1)K2S ;
2)K2SO3;
3)H2SO4;
4)S.
6) В превращении, схема которого HClO3+H2SO3=HCl+H2SO4 число электронов, отданных одной молекулой восстановителя равно:
1)3;
2)2;
3)5;
4)6.
7) В окислительно-восстановительной реакции, схема которой NH3+O2=NO+H2O сумма всех коэффициентов равна:
1)9;
2)11;
3)16;
4)19.
8)В окислительно-восстановительной реакции, схема которой
KI+NaNO2+H2SO4 ->I2+NO+K2SO4+Na2SO4+H2O сумма коэффициентов перед формулами продуктов реакции равна:
1)7 ;
2)9 ;
3)11 ;
4)14.
9.Коэффициент перед формулой продукта окисления в реакции, схема которой Fe3O4+HNO3=Fe(NO3)3+NO+H2O, равен:
1)1;
2)3;
3)8;
4)9.
10. В уравнении окислительно-восстановительной реакции
Cu+HNO3(разб.)->Cu(NO3)2+NO+H2O коэффициент перед окислителем:
1)8;
2)10;
3)6;
4)4.
11.Окислительные свойства оксида серы(IV) проявляет в реакции:
1)SO2+NaOH=NaHSO3;
2)SO2+Br2+2H2O=H2SO4+2HBr;
3)SO2+H2S=3S+2H2O;
4)2SO2+O2=2S03.
12. Хлор является и окислителем и восстановителем в реакции, уравнение которой :
1) 2FeCl2+Cl2=2FeCl3;
2) Fe+2HCl=FeCl2+H2;
3) 2KOH+Cl2=KCl+KClO3+H2O;
4) MnO2+4HCl=Cl2+MnCl2+2H2O
.
13. Реакция, уравнение которой 4NH3+5O2=4NO+6H2O соответствует схеме превращения азота :
1)N+3-> N+2;
2)N-3-> N-2;
3)N+3-> N-3;
4)N-3 -> N+2.
14.Окислительно-восстановительной является реакция, уравнение которой:
1)CaCO3+SiO2=CaSiO3+CO2;
2)BaSO3=BaO+SO2;
3)CuCl2+Fe=FeCl2+Cu ;
4)CuSO4+2KOH=Cu(OH)2+K2SO4.
1.Исключите лишний элемент,являющийся неметаллом :
1)Na;
2)Mg;
3)Al;
4)Si.
2.Какая из перечисленных групп элементов содержит только металлы :
1)Li, Be, B;
2)K, Ca, Sr;
3)H, Li, Na;
4) Se, Te, Po .
3) Металлами являются :
1)все s-элементы ;
2) все p-элементы ;
3) все элементы таблицы Д.И. Менделеева;
4) все элементы главных подгрупп .
4.Какое свойство не является общим для всех металлов :
1)электропроводность;
2)теплопроводность;
3)твёрдое агрегатное состояние при стандартных условиях ;
4)металлический блеск.
5) Исключите «лишний» сплав:
1)сталь;
2)булат;
3)латунь;
4)титан.
6) При производстве алюминия из бокситов добавка к ним криолита значительно удешевляет процесс, так как он:
1)понижает температуру плавления бокситов;
2)увеличивает электропроводность бокситов;
3)является катализатором процесса;
4)защищает электроды от разрушения.
7) Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имют степень окисления +1.
Б.С галогенами они образуют соедининия с ионной связью.
1)верно только А;
2)верно только Б;
3)верны оба суждения;
4)оба суждения неверны.
8)Хлорид железа(II) не может быть получен взаимодействием:
1)раствора хлорида меди(II) с железом;
2)железа с хлоридом натрия;
3)железа с соляной кислотой;
4)хлорида железа(III) с железом.
9.Какой из оксидов является кислотным:
1)MnO;
2)Mn2O3;
3)MnO2;
4)Mn2O7.
10.Какое из природных веществ можно назвать рудой:
1)известняк;
2)песок;
3)мрамор;
4)магнитный железняк.
11. Какая из следующих групп в Периодической
системе содержит только неметаллы :
Какая из следующих групп в Периодической
системе содержит только неметаллы :
1IIA;
2)VIA;
3)VA;
4)IVA.
12.Выберите верное утверждение:»Все простые вещества неметаллы:
1)газообразны;
2)диэлектрики;
3)не имеют металлического блеска;
4)не имеют общих физических свойств .
13.Какой тип химической связи может иметь место только между атомами неметаллов ?
1)ковалентная;
2)металлическая;
3)ионная;
4)водородная .
14.Какие неметаллы не взаимодействуют друг с другом?
1)углерод и водород ;
2)хлор и фосфор ;
3)хлор и кислород;
4)кремний и водород .
15.В лаборатории водород не получают
1)электролизом водного раствора гидроксида натрия;
2)конверсией метана;
3)взаимодействием кальция с водой;
4)взаимодействием цинка с соляной кислотой
16. Какой из неметаллов встречается в
свободном виде?
Какой из неметаллов встречается в
свободном виде?
1)кремний;
2)сера;
3)хлор;
4)фосфор .
17.Какой из оксидов не является солеобразующим:
1)CO2;
2)P2O5;
3)NO;
4)SiO2 .
Реакция диоксида серы и сероводорода, SO2 + h3S = S + h3O, сбалансированное уравнение
Диоксид серы и сероводород являются газами, и они реагируют друг с другом в присутствии влаги с образованием сера и вода как продукты. Эта реакция представляет собой реакцию образования серы, а также окислительно-восстановительную реакцию.
Окислительно-восстановительная реакция
Реакция, в которой одновременно происходят окисление и восстановление, определяется как окислительно-восстановительная реакция.
ТД
2 + H 2 S = S + H 2 O реакция Это окислительно-восстановительная реакция (окисление — восстановление).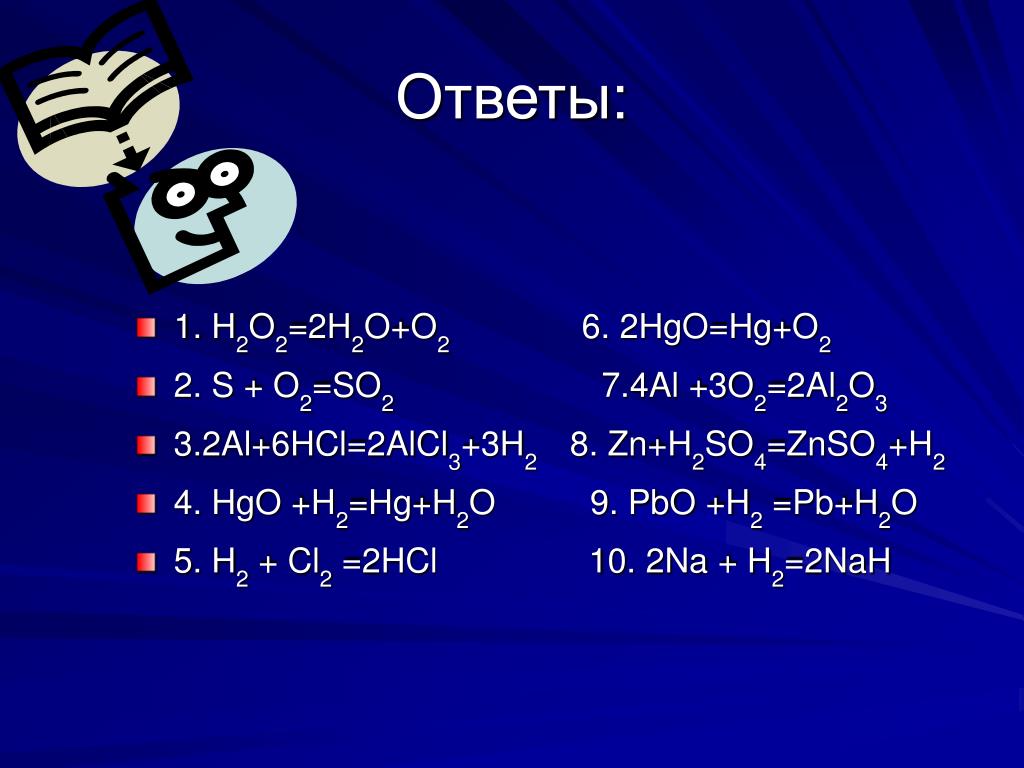 Атом серы в молекуле диоксида серы восстанавливается до серы, а атом серы
в сероводород окисляется до серы. Эта реакция происходит в присутствии влаги. СО 2 и H 2 S находятся в газообразном состоянии, а полученная сера представлена в виде бледно-желтого твердого вещества.
Атом серы в молекуле диоксида серы восстанавливается до серы, а атом серы
в сероводород окисляется до серы. Эта реакция происходит в присутствии влаги. СО 2 и H 2 S находятся в газообразном состоянии, а полученная сера представлена в виде бледно-желтого твердого вещества.
- SO 2 восстанавливается до серы. Степень окисления атома серы в SO 2 молекула +4. Этот атом серы восстанавливается до степени окисления 0, когда образуется сера.
- H 2 S окисляется до серы. Атом серы молекулы H 2 S находится в степени окисления -2 и окисляется до нулевой степени окисления.
Балансировка уравнения
Из-за образования серы как H 2 S, так и SO 2 , мы следуем специальному методу, чтобы сбалансировать это уравнение. Помните, как сбалансировать окислительно-восстановительную реакцию и ее этапы!
- Найдите степени окисления каждого атома, чтобы определить, какие атомы окисляются, а какие восстанавливаются.
 При нахождении степеней окисления мы видим, что SO 2 восстанавливается, а H 2 S окисляется.
При нахождении степеней окисления мы видим, что SO 2 восстанавливается, а H 2 S окисляется. - В исходной ситуации в левой части уравнения два атома серы. Но правая сторона имеет только один. Поэтому добавьте еще один атом серы с правой стороны.
- Затем возьмите разницу степеней окисления при окислении и восстановлении. Различия степеней окисления окисления и восстановления составляют 2 и 4 соответственно. Затем обменяйте различия. Посмотрите на рисунок, как происходит обмен.
- Наконец сбалансируйте H 2 O, проверив атомы кислорода слева и справа.
Окислительно-восстановительная реакция между сероводородом и диоксидом серы — сбалансированная реакция
Одна молекула диоксида серы реагирует с двумя молекулами сероводорода с образованием трех атомов серы и двух атомов воды молекулы.
SO
2 свойства газа- Бесцветный
- Кислотный
- Токсичный
- Тяжелее воздуха
H
2 S HAS Properties- Colurless
- Очень токсичный
- Слабые кислые
- тяжелее воздуха
Safety
SO 2 и H 2 SOMERSERSE
SO ARISERES ARSELIRES SO 2
2
. для людей, животных и всей окружающей среды. Вдыхание H 2 S
в очень малых количествах достаточно, чтобы вызвать смерть. H 2 S токсичные уровни указаны ниже.
для людей, животных и всей окружающей среды. Вдыхание H 2 S
в очень малых количествах достаточно, чтобы вызвать смерть. H 2 S токсичные уровни указаны ниже.
Уровни токсичности сероводорода
Эти уровни токсичности H 2 S и эффекты были взяты в разделе «Безопасность и здоровье» / Сероводород в https://www.osha.gov . Концентрации выражены в значениях ppm. В этом эксперименте вы должны быть очень осторожны, чтобы защититься от этих опасных химических веществ.
Вопросы
что вредно для двуокиси серы (так
2 ) и сероводорода И двуокись серы, и сероводород являются токсичными соединениями и могут нанести вред людям. Сероводород опаснее двуокиси серы
Какова степень окисления серы в h3s
Сначала определите, какой атом имеет более высокую электроотрицательность. Значения электроотрицательности серы и водорода равны 2,5 и 2,1 соответственно. Таким образом, водород должен иметь положительную степень окисления, а сера – отрицательную.
Мы знаем, что единственная положительная степень окисления водорода равна +1.
Использование уравнения для определения степени окисления
- (+1 * 2) + x = 0
- x = -2
Степень окисления серы в H 2 S равна -2.
Как найти SO
2 и H 2 S в больших масштабах?

При переработке нефти H 2 S образуется в результате удаления или снижения содержания серы в топливе. Некоторые нефтеперерабатывающие заводы (старые) сжигают H 2 S перед выбросом в окружающую среду. При горении H 2 S образуется O 2 SO 2 .
Является ли H
S + SO 2 окислительно-восстановительной реакцией?Да. H 2 S окисляется до серы, а SO 2 восстанавливается до серы.
Как идентифицировать H
2 S и SO 2 ? Оба бесцветных газа. К газам направляют раздельно два раствора хлорида бария.
- В одном растворе образуется белый осадок. Это BaSO 3 .
- В других растворах осадок не образуется.
уравнение диоксида серы
Диоксид означает оксид с двумя атомами кислорода. Поэтому химическое уравнение диоксида серы SO 2 .
Поможет ли реакция H
2 S + SO 2 уменьшить воздействие сероводорода на окружающую среду?Если H 2 S производится или выделяется на заводе в больших количествах, эта реакция является хорошим способом извлечения H 2 S. Но это зависит от наличия газообразного диоксида серы.
что такое сера + h3O?
Сера не вступает в реакцию с водой, а также не растворяется в воде.
окисление сероводорода до диоксида серы
При нагревании сероводорода с газообразным кислородом в качестве продукта образуется диоксид серы. Здесь двуокись серы окисляется до двуокиси серы.
натрий реагирует с серой с образованием сульфида натрия, это окислительно-восстановительная реакция
Степень окисления сульфид-иона в сульфиде натрия равна -2.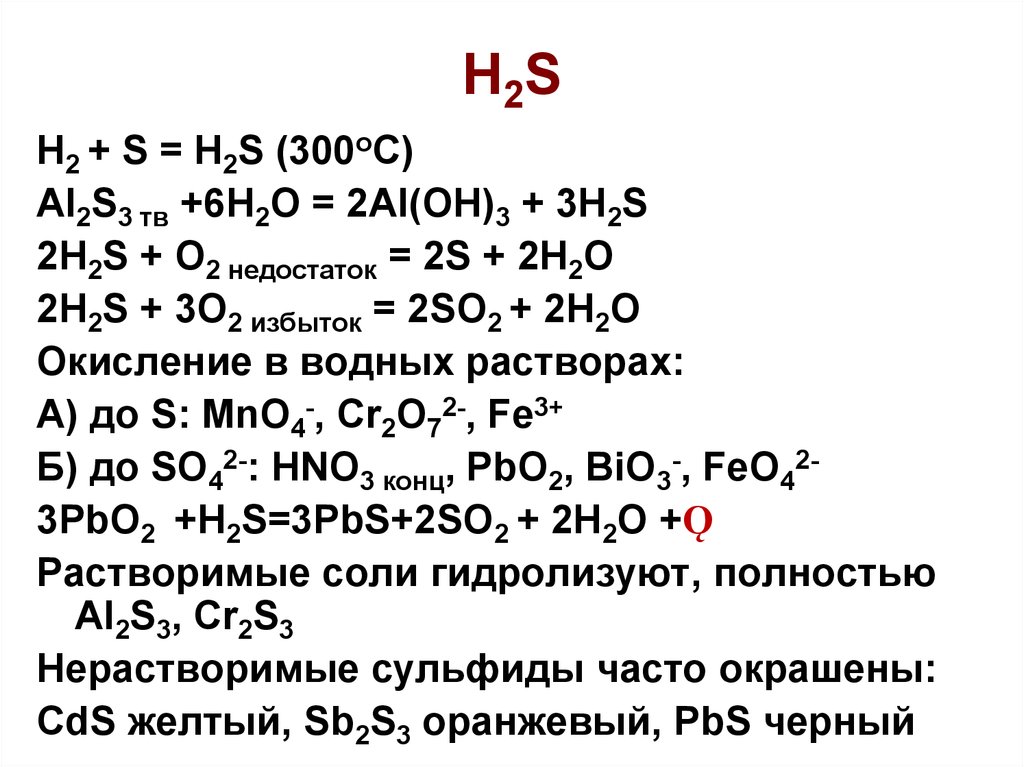 Поэтому степень окисления серы изменяется от 0 до -2. Следовательно, эта реакция натрия и серы должна быть окислительно-восстановительной реакцией.
Поэтому степень окисления серы изменяется от 0 до -2. Следовательно, эта реакция натрия и серы должна быть окислительно-восстановительной реакцией.
реакция вода + сероводород
При растворении сероводорода в воде образуется слабый кислый раствор.
Темы, относящиеся к SO 2 и H 2 S
Степень окисления S и H в H 2 S
Диоксид серы
подготовка и реакции
окислительно-восстановительная реакция
(Снижение окисления)
Вопросы безопасности и охраны здоровья / Сероводород
Реакция иона никеля +2 и раствора аммиака
Реакции с щелочноземельными металлами
степени окисления
Элементы периодической таблицы
Реакции щелочных металлов
Идентифицировать катионы путем осаждения
Осаждает составные цвета
Реакции подготовки аммиака
В реакции $S{O_2} + {H_2}S \\to 2{H_2}O + 3S$ восстановителем является А. $S{O_2}$B. ${H_2}S$C. ${H_2}O$D. $S$
Ответить
Проверено
222,9 тыс.+ просмотров
Подсказка: Мы можем определить окислительно-восстановительные реакции как химические реакции, в которых происходит перенос электронов между двумя реагентами.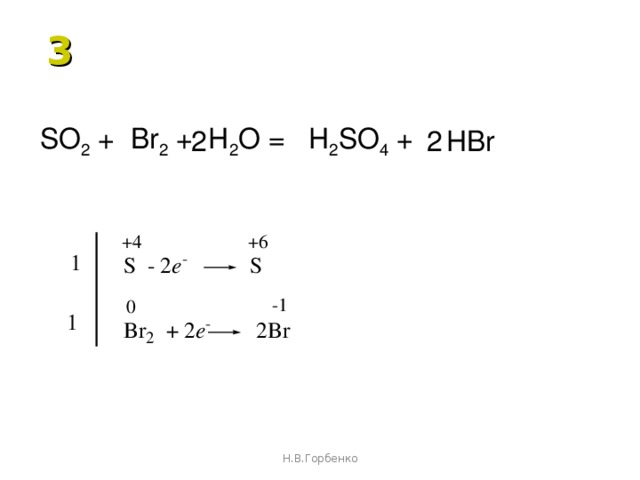 Мы можем определить перенос электронов, наблюдая за изменением степени окисления реагирующих веществ. Батареи (или) электрохимические элементы являются примерами окислительно-восстановительных реакций.
Мы можем определить перенос электронов, наблюдая за изменением степени окисления реагирующих веществ. Батареи (или) электрохимические элементы являются примерами окислительно-восстановительных реакций.
Полный пошаговый ответ:
Мы можем определить реакции окисления как потерю электронов веществом.
Точно так же реакции восстановления определяются как приобретение электронов.
Окисляющие вещества представляют собой соединения (молекулы/ионы), которые принимают электроны, а восстановители представляют собой соединения (молекулы/ионы), которые отдают электроны. Вещество, которое окисляется, действует как восстановитель, а вещество, которое восстанавливается, действует как окислитель.
Восстановитель представляет собой химическое вещество, которое отдает электроны другим веществам в окислительно-восстановительной реакции и окисляется до более высокой степени окисления.
В реакции $S{O_2} + {H_2}S \to 2{H_2}O + 3S$,
В $S{O_2}$ удаляется кислород, поэтому диоксид серы восстанавливается до серы, а затем в ${H_2 }S$, водород удаляется, поэтому сероводород окисляется до серы.
Мы можем рассчитать степень окисления серы в $S{O_2}$ как,
$x + 2\left( { — 2} \right) = 0$
$ \Rightarrow $$x — 4 = 0$
$ \Rightarrow $$x = + 4$
Степень окисления серы в $S{O_2}$ равна $ + 4$.
Мы можем рассчитать степень окисления серы в ${H_2}S$ как,
$x + 2\left( 1 \right) = 0$
$ \Rightarrow $$x + 2 = 0$
$ \Rightarrow $$x = — 2$
Степень окисления серы в ${H_2}S $ это $-2$.
Степень окисления элементарной серы равна нулю.
$\theme$ ${H_2}S$ окисляется, поэтому восстановителем является ${H_2}S$. Поскольку $S{O_2}$ восстанавливается, окислителем является $S{O_2}$.
Итак, правильный ответ — вариант Б.
Примечание:
Мы можем обсудить некоторые распространенные восстановители. Примеры некоторых распространенных восстановителей:
1.Алюмогидрид лития $\left( {LiAl{H_4}} \right)$ действует как сильный восстановитель=
2.Диборан
3.Йодиды, такие как йодид калия
4.Тиосульфаты
5.

 05.15
05.15 При нахождении степеней окисления мы видим, что SO 2 восстанавливается, а H 2 S окисляется.
При нахождении степеней окисления мы видим, что SO 2 восстанавливается, а H 2 S окисляется.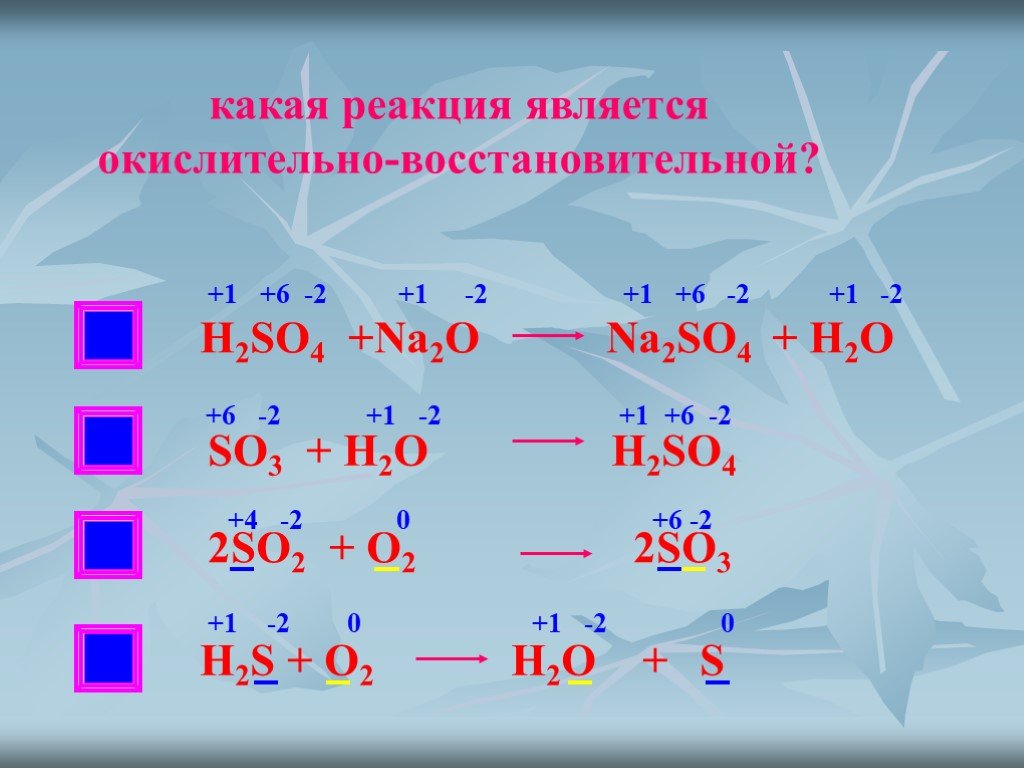 для людей, животных и всей окружающей среды. Вдыхание H 2 S
в очень малых количествах достаточно, чтобы вызвать смерть. H 2 S токсичные уровни указаны ниже.
для людей, животных и всей окружающей среды. Вдыхание H 2 S
в очень малых количествах достаточно, чтобы вызвать смерть. H 2 S токсичные уровни указаны ниже.