Оксид свинца (II, IV) — frwiki.wiki
Оксид свинца (II, IV) или тетраокись свинца , также называемый красный свинец , представляет собой неорганическое соединение формулы Pb 3 O 4 . Это твердый ярко-красный апельсин, который используется, прежде всего, при производстве пигментов , батарей , кристаллов и грунтовочной ржавчины . Это пример соединения с несколькими степенями окисления, состоящего из свинца (II) и свинца (IV). Он присутствует в природе в виде минерала, миниума .
Резюме
- 1 Структура
- 2 Синтез
- 3 См. Также
- 4 Примечания и ссылки
Состав
Свинец (II, IV) оксид кристаллизуется в тетрагональной структуры при комнатной температуре, но развивается в ромбической структуре ( Пирсона символ oP28, пространственная группа = Pbam , п о 55 ) ниже приблизительно -103 & deg ; С
 Этот фазовый переход только изменяет симметрию кристалла и немного изменяет межатомные расстояния и углы.
Этот фазовый переход только изменяет симметрию кристалла и немного изменяет межатомные расстояния и углы.Синтез
Свинец (II, IV) оксид может быть получен путем обжига оксид свинца (II) , на воздухе при температуре около 450- 480 ° C :
- 6 PbO + O 2 → 2 Pb 3 O 4
Продукт такой реакции обычно нечистый и всегда содержит PbO. Для его очистки из него можно извлечь PbO, добавив раствор гидроксида калия :
- PbO + KOH + H 2 O → K [Pb (OH) 3 ]
Кроме того , можно подготовить его отжига на карбонат свинца (II) в воздухе:
- 6 PbCO 3 + O 2 → 2 Pb 3 O 4 + 6 CO 2
Другой метод включает окислительный отжиг свинцовой белила :
- 3 Pb 2 CO 3 (OH) 2 + O 2 → 2 Pb 3 O 4 + 3 CO 2 + 3H 2 O
В растворе, свинца (II, IV) , оксид может быть получен путем реакции между метаплюмбаты калия и свинца (II) ацетат , производя нерастворимый желтый свинец (II, IV) , моногидрата оксида, Pb 3 O 4 · H 2 O, который может затем преобразовать безводную форму мягким нагреванием:
- K 2 PbO 3 + 2 Pb (OCOCH 3 ) 2 + H 2 O → Pb 3 O 4 + 2 KOCOCH 3 + 2 CH 3 COOH
Сурик естественно бывает редко, образуя только в сильно окислительных условиях свинцовой руды.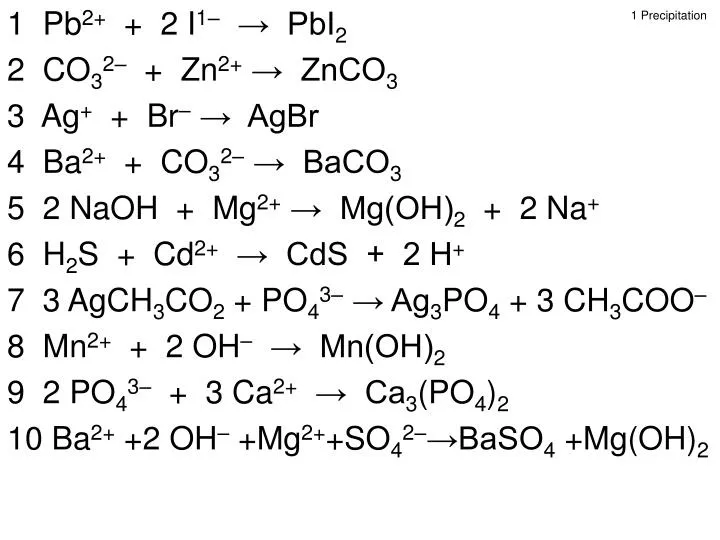 Лучшие экземпляры происходят из Брокен-Хилла , Новый Южный Уэльс (Австралия), где они образовались после минного пожара.
Лучшие экземпляры происходят из Брокен-Хилла , Новый Южный Уэльс (Австралия), где они образовались после минного пожара.
Смотрите также
- Свинцовая краска
Примечания и ссылки
- (ru) Эта статья частично или полностью взята из английской статьи в Википедии под названием « Оксид свинца (II, IV) » ( см. список авторов ) .
- ↑ a b c и d ТЕТРАОКСИД СВИНЦА , Паспорт (-ы) безопасности Международной программы по химической безопасности , проверено 9 мая 2009 г.
- ↑ « Свинец осмия » в базе данных химических веществ Reptox в CSST (организации Квебека , ответственного за охрану труда и здоровья), доступ к 25 апреля 2009
- ↑ (in) Норман Н.
 Гринвуд и Алан Ирншоу , Химия элементов , Баттерворт-Хайнеманн ,( ISBN 0080379419 )
Гринвуд и Алан Ирншоу , Химия элементов , Баттерворт-Хайнеманн ,( ISBN 0080379419 ) - ↑ Гаварри, Доминик Вейгель и А.В. Хеват , « Оксиды свинца. IV. Структурная эволюция оксида Pb 3 O 4 между 240 и 5 ° К и механизм перехода », Journal of Solid State Chemistry , vol. 23 Без костей 3-4,, стр. 327 ( DOI 10.1016 / 0022-4596 (78) 90081-6 )
- ↑ Энциклопедия промышленной химии Ульмана , Weinheim, Wiley-VCH,( DOI 10.1002 / 14356007.a15_249 )
- ↑ Миниум
Свинцовые соединения | |||
|---|---|---|---|
| Свинец (II) |
| ||
| Свинец (II, IV) |
| ||
| Свинец (IV) |
| ||
Оксиды | |
|---|---|
| Различные состояния | Четырехокись сурьмы ( Sb 2 O 4 ) · Оксид серебра (I, III) ( Ag O) · Оксид кобальта (II, III) ( Co 3 O 4 ) · Оксид железа (II, III) ( Fe 3 O 4 ) Трехводородный монооксид (H 3 O) · Оксид марганца (II, III) ( Mn 3 O 4 ) · Оксид свинца (II, IV) ( Pb 3 O 4 ) |
| Степень окисления +1 | Оксид серебра ( Ag |
| Степень окисления +2 | Оксид алюминия (II) ( Al O) · оксид бария ( Ba O) · оксид бериллия ( Be O) · оксид кадмия ( Cd O) · оксид кальция ( Ca O) · оксид углерода ( C O) · оксиды кобальта (II ) ( Co O) · оксиды хрома (II) ( Cr O) · оксид меди (II) ( Cu O) · оксид германия ( Ge O) · оксид железа (II) ( Fe O) · оксид иридия ( Ir O) · Оксид магния ( Mg O) · оксид ртути (II) ( Hg O) · оксид никеля (II) ( Ni O) · оксид азота ( N O) · оксид палладия (II) ( Pd O) · оксид свинца (II) ( Pb O) · оксид стронция ( Sr O) · оксид серы ( S O) · диоксид серы ( S 2 O 2 ) · оксид олова (II) ( Sn O) · оксид титана (II) ( Ti O) · ванадий ( II) оксид ( V O) · оксид цинка ( Zn O) · оксид циркония ( Zr O) |
| Степень окисления +3 | Полуторный оксид актиния ( Ac 2 O 3 ) · оксид алюминия ( Al 2 O 3 ) · триоксид сурьмы ( Sb 2 O 3 ) · триоксид мышьяка ( As 2 O 3 ) · оксид висмута (III) ( Bi 2 O 3 ) · триоксид бора ( B 2 O 3 ) · оксид хрома (III) ( Cr 2 O 3 ) · оксиды кюрия (III) (Cm 2 O 3)) · Триоксид диазота ( N 2 O 3 ) · оксид эрбия (III) ( Er 2 O 3 ) · Оксиды европия (III) ( Eu 2 O 3 ) · оксид железа (III) ( Fe 2 O 3 ) · оксид гадолиния (III) ( Gd |
| Степень окисления +4 | Диоксид углерода ( C O 2 ) · триоксид углерода ( C O 3 ) · оксид церия (IV) ( это O 2 ) · диоксид хлора ( Cl O 2 ) · диоксид хрома ( Cr O 2 ) · оксид кюрия (IV) (CmO 2) · Пероксид азота ( N 2 O 4 ) · диоксид германия ( Ge O 2 ) · оксид гафния (IV) ( Hf O 2 ) · оксид иридия (IV) ( Ir O 2 ) · диоксид свинца ( Pb O 2 ) · марганец диоксид ( Mn O 2 ) · диоксид азота ( N O 2 ) · оксиды нептуния (IV) ( Np O |
| Степень окисления +5 | Пятиокись сурьмы ( Sb 2 O 5 ) · пятиокись мышьяка ( As 2 O 5 ) · пятиокись азота ( N 2 O 5 ) · пятиокись ниобия ( Nb 2 O 5 ) · пятиокись фосфора ( P 2 O 5 ) · Оксиды протактиния (V ) ( Pa 2 O 5 ) · оксид тантала (V) ( Ta 2 O 5 ) · оксид ванадия (V) ( V 2 O 5 ) |
| Степень окисления +6 | Триоксид хрома ( Cr O 3 ) · триоксид иридия ( Ir O 3 ) · триоксид молибдена ( Mo O 3 ) · триоксид рения ( Re O 3 ) · триоксид селена ( As O 3 ) · триоксид серы ( S O 3 ) · теллур триоксид ( Te O 3 ) · триоксид вольфрама ( W O 3 ) · триоксид урана ( U O 3 ) · триоксид ксенона ( Xe O 3 ) |
| Степень окисления +7 | Гептоксид хлора ( Cl 2 O 7 ) · гептоксид марганца ( Mn 2 O 7 ) · оксид рения (VII) ( Re 2 O 7 ) · оксиды технеция (VII) ( Tc 2 O 7 ) |
| Степень окисления +8 | Четырехокись осмия ( Os O 4 ) · четырехокись рутения ( Ru O 4 ) · четырехокись ксенона ( Xe O 4 ) · оксид иридия (VIII) ( Ir O 4 ) · четырехокись гассия ( Hs O 4 ) |
| похожие темы | Окись углерода · Двуокись хлора · Оксид · оксокислота · озонид |
<img src=»//fr. wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
Pb(OH)2 = h3O + PbO
| Поиск |
Дигидроксид свинца = вода + оксид свинца(ii) | Температура: 100 — 145
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| 121139000000-download.jpg» substance-weight=»18.01528 ± 0.00044″> H 2 O | + | png» substance-weight=»223.1994″> PbO | |||
| Дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; Lead(II)dihydoxide | water | lead(ii) oxide | |||
| 1 | 1 | 1 | Hệ số | ||
| Nguyên — Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Хой лунг (г) |
Реклама
Дополнительная информация об уравнении Pb(OH)
2 → H 2 O + PbOКаковы условия реакции Pb(OH)2 (дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; дигидроксид свинца(II))?
Температура: 100–145°C
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.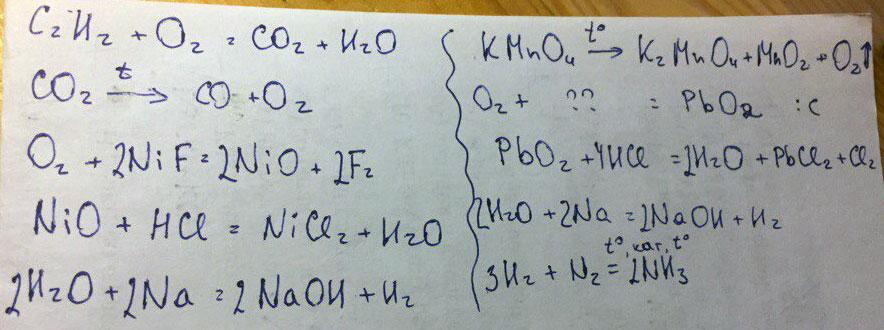 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (вода) и PbO (оксид свинца(ii)) ?
В полном предложении вы также можете сказать Pb(OH)2 (дигидроксид свинца; гидроксид свинца (II); гидроксид свинца; дигидроксид свинца (II)) и произвести h3O (вода) и PbO (оксид свинца (ii))
Явление после Pb(OH)2 (дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; дигидроксид свинца(II)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта PbO (оксид свинца(ii)), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов Pb(OH)2 (Дигидроксид свинца; Гидроксид свинца(II); Гидроксид свинца; Дигидроксид свинца(II), исчезает
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями Pb(OH)
2 → H 2 O + PbOВопросы, связанные с реагентом Pb(OH)2 (дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; дигидроксид свинца(II))
Каковы химические и физические характеристики Pb(OH)2 (дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; дигидроксид свинца(II)? ; дигидроксид свинца(II) в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (дигидроксида свинца; гидроксида свинца(II); гидроксида свинца; дигидроксида свинца(II))? Каковы химические реакции, в результате которых образуется вода?
Вопросы, связанные с продуктом PbO (оксид свинца(ii))
Каковы химические и физические характеристики PbO (дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; дигидроксид свинца(II))?Каковы химические реакции которые содержат PbO (оксид свинца (ii)) в качестве продукта?
Essentt — Подобранные продукты
Подобранные вручную продукты незаменимы при работе из дома!
Уравнения с Pb(OH)2 в качестве реагента
дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; Свинца(II)дигидроксид
2HNO 3 + PB (OH) 2 → 2H 2 O + PB (№ 3 ) 2 2KOH + PB (OH) 2 → 2H 2 O + K 2 O + K O + K 2 O + K 2 O + K 2 O + K (OH) 2 PbO 2 H 2 O 2 + Pb(OH) 2 → 2H 2 О + PbO 2 Просмотреть все уравнения с Pb(OH)2 в качестве реагента
Реклама
Уравнения с Pb(OH)2 в качестве продукта
дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; Свинца(II)дигидроксид
2H 2 O + O 2 + 2PB → 2PB (OH) 2 2NAOH + PB (CH 3 COO) 2 → 2CH 3 COONA + PB (OH) 2NA 29 2NA 29 2NA 2 . + Pb(НО 3 ) 2 → 2NaNO 3 + Pb(OH) 2 Просмотреть все уравнения с Pb(OH)2 как произведение
+ Pb(НО 3 ) 2 → 2NaNO 3 + Pb(OH) 2 Просмотреть все уравнения с Pb(OH)2 как произведение
Уравнения с Pb(OH)2 в качестве продукта
дигидроксид свинца; гидроксид свинца(II); гидроксид свинца; Свинца(II)дигидроксид
2H 2 O + O 2 + 2PB → 2PB (OH) 2 2NAOH + PB (CH 3 COO) 2 → 2CH 3 COONA + PB (OH) 2NA 29 2NA 29 2NA 2 . + PbCl 2 → 2NaCl + Pb(OH) 2 Просмотреть все уравнения с Pb(OH)2 как произведение
PbCO3·PbO·2h3O (Pb2[CO3]O[h3O]2) Кристаллическая структура – SpringerMaterials
Неорганические твердые фазы
Получить доступ СИФ Скачать справку (pdf)
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа | У вас нет доступа к этому содержимомуВарианты доступаДополнительные параметры доступа
| |||
| и | ||||
| б | ||||
| с | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| д/к | ||||
| к/с | ||||
| В | ||||
Координаты атома
Стандартизированный
У вас нет доступа к этому содержимомуПараметры доступаДополнительные возможности доступа
| |||||||||
Опубликовано
У вас нет доступа к этому содержимомуВарианты доступаДополнительные параметры доступа
| |||||||
Детали эксперимента
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Ссылка
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
3D интерактивная структура
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Об этом контенте
PAULING FILE Multinaries Edition — 2022 г.
sd_1701419
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред.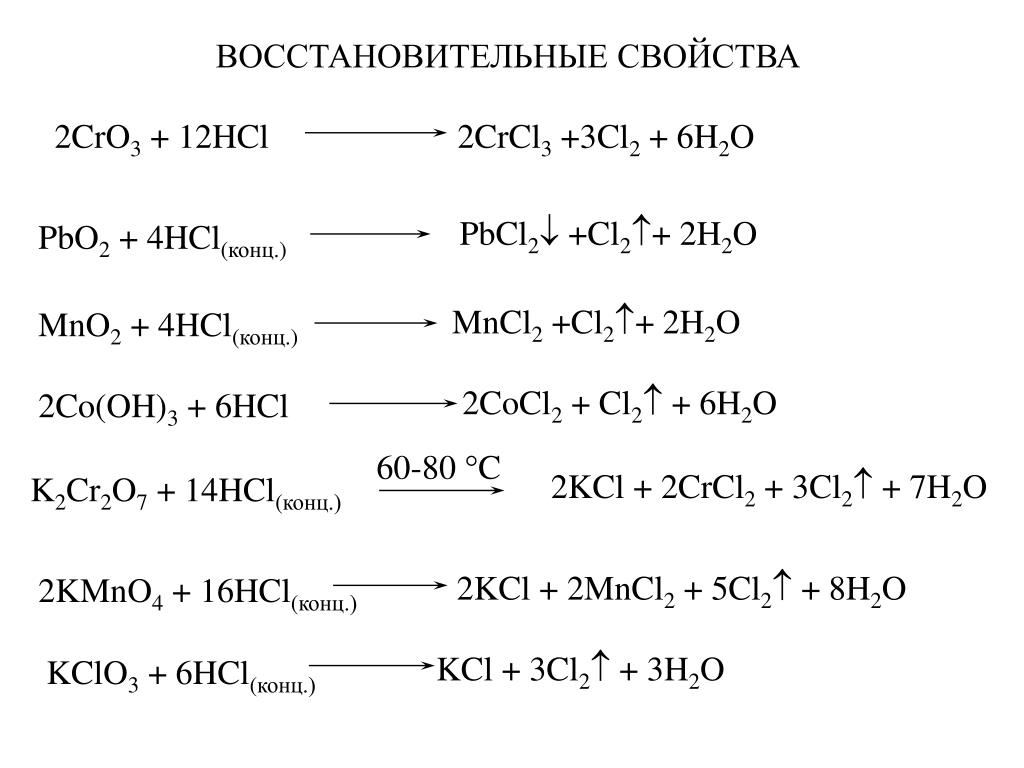

 Гринвуд и Алан Ирншоу , Химия элементов , Баттерворт-Хайнеманн ,( ISBN 0080379419 )
Гринвуд и Алан Ирншоу , Химия элементов , Баттерворт-Хайнеманн ,( ISBN 0080379419 )