Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
чему равны индуктивность и энергия магнитного поля соленоида , если при силе тока, равной 4А, магнитный поток через соленоид и равен 0,4 вб
Решено
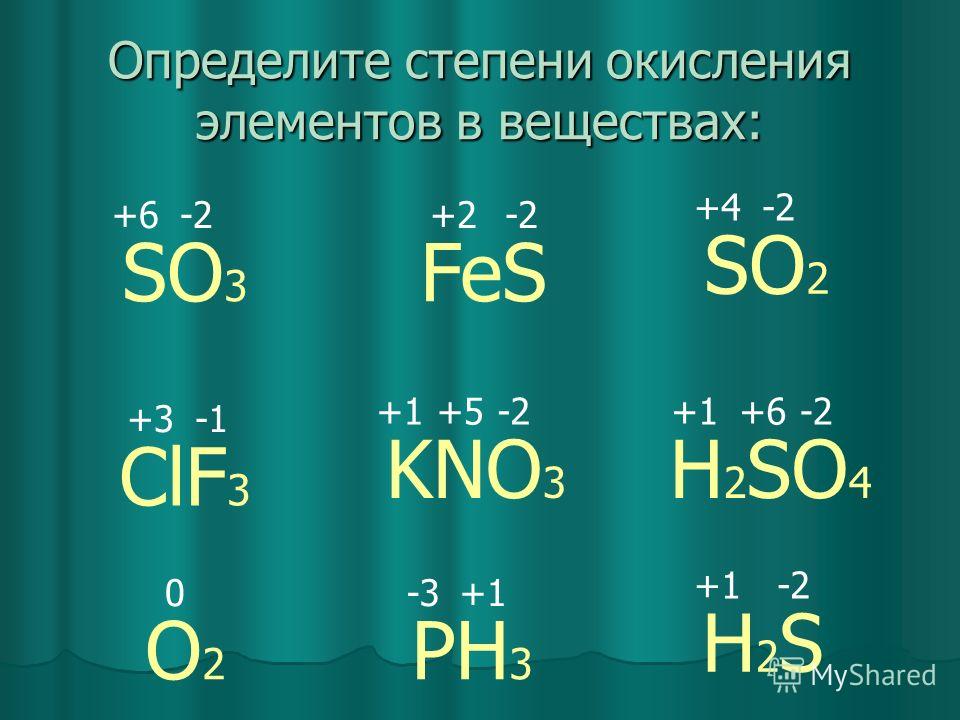
Вычислить f(A),если f(x)=x^2+3x-3,A-матрица 2 1
3 5 . 2
2
Решено
На множестве натуральных чисел рассматривается свойство «быть кратным 7» Сколько классов разбиение множества N она определяет ?Назовите по два элемента каждого!
Пользуйтесь нашим приложением
Степень окисления брома (Br), формула и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общие сведения о степени окисления брома
Ядовит. Плотность 3,19 г/см3 (при to = 0oC). При кипении (to = 58,6oC) бром из жидкого состояния переходит в газообразное – образует буро-коричневый пар.
При кипении (to = 58,6oC) бром из жидкого состояния переходит в газообразное – образует буро-коричневый пар.
Молекула брома двухатомна Br2.
Степень окисления брома в соединениях
Бром образует двухатомные молекулы состава Br2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Для брома характерен целый спектр степеней окисления, среди которых есть как положительные, так и отрицательные.
Степень окисления (-1) бром проявляет в ионных бромидах: NaBr-1, MgBr-12, AlBr — 13, SiBr-14, PBr-15, SbBr-16 и т.д.
Степень окисления (+1) бром проявляет во фториде Br+1F, оксиде Br+12O и нитриде Br+13N, а также соответствующих им анионах [Br+1F2]—, [Br+1O]— и [Br+1N]2-.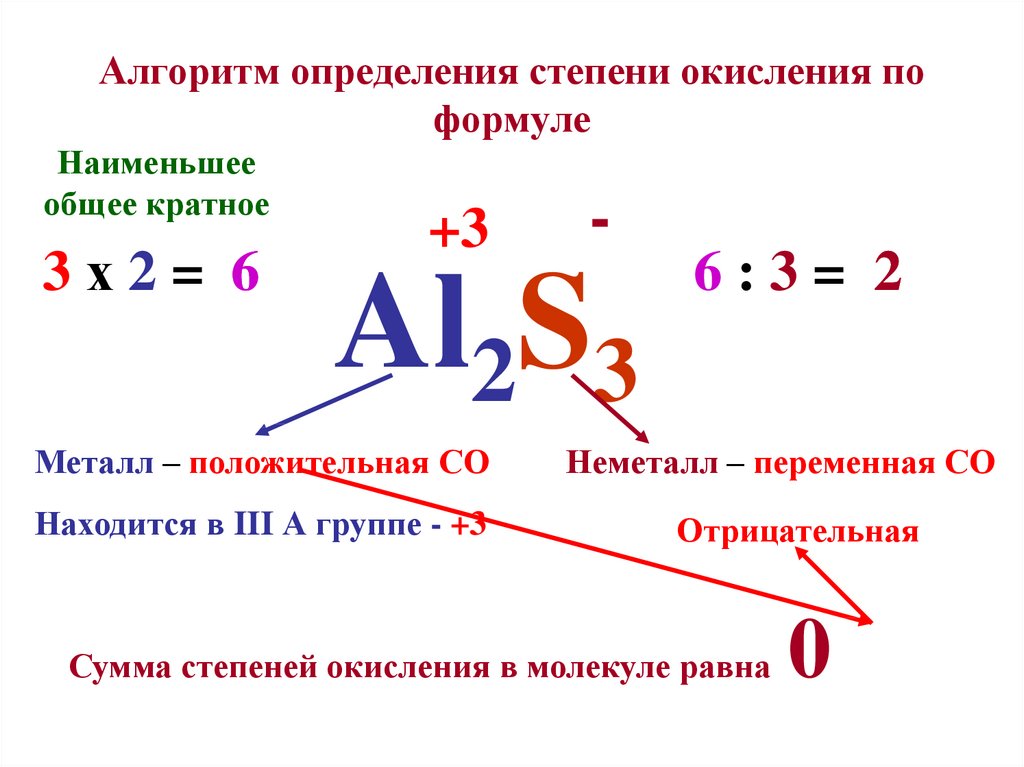
Степень окисления (+3) бром проявляет в соединениях трифториде Br+3F3 и тетрафторобромид(III)-анионе [Br+3F4]—, а также в диоксобромат (III)-анионе [Br+3O2]—.
Из соединений, в которых хлор проявляет степень окисления (+5) известны пентафторид Br+5F5, оксотрифторид Br+5OF3, диоксофторид Br+5O2F и производные триоксобромат(V)-аниона [Br+5O3]—, диоксодифторобромат(V)-аниона [Br+5O3F2]2-, триоксофторобромат(V)-аниона [Br+5O3F]2- и оксотетрафторобромат(V)-аниона [Br+5OF4]2-.
Высшая степень окисления брома(+7) проявляется в его оксиде, ряде оксофторидов и отвечающих им анионных комплексах: Br+72O7, KBr+7O4, Br+7O3F, NaBr+7O3F2, Br+7O2F3, Br+7OF5 и т. д.
д.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
WebElements Periodic Table » Фосфор » пентабромид фосфора
- Формула: PBr 5
- Формула системы Хилла: Br 5 P 1
- Регистрационный номер CAS: [7789-69-7]
- Вес формулы: 430.494
- Класс: бромид
- Цвет: оранжевый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: >100°C (разлагается)
- Температура кипения: 106°C
- Плотность: 3600 кг·м -3
Ниже приведены некоторые синонимы пентабромида фосфора :
- пентабромид фосфора
- бромид фосфора(V)
- бромид фосфора
- бромид фосфора
Степень окисления фосфора в пентабромиде фосфора составляет 5 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия фосфора: 4 координата: тетраэдрическая
- Прототип структуры:
Элементный анализ
В таблице показано процентное содержание элементов для PBr 5 (пентабромид фосфора).
| Элемент | % |
|---|---|
| Бр | 92,81 |
| П | 7,19 |
Изотопная схема PBr
5На приведенной ниже диаграмме показана расчетная изотопная картина для формулы 9.0004 PBr 5 с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.

- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Баттерворт, Великобритания, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Wyckoff, in Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (редактор) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.

- Дж.В. Меллор в Всеобъемлющий трактат по неорганической и теоретической химии , тома 1–16, Longmans, Лондон, Великобритания, 1922–1937 гг.
- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1–3, Chapman & Hall, Лондон, Великобритания, 1992.
Исследуйте периодические свойства по этим ссылкам
Свойства пентабромида фосфора (PBr5) (25 полных фактов) с пятью атомами Br. Давайте исследуем PBr
5 подробнее.Все осевые и экваториальные длины связей равны для PBr 5 согласно псевдовращению Берри. Как правило, Br, присутствующие в аксиальном участке, имеют менее s-характер и по этой причине более длинные, чем экваториальные. За счет гибридизации sp 3 d 3d-орбиталь P участвует в образовании связи с атомами Br.
Пентабромид фосфора также превращает карбоновую кислоту в ацетилбромид. Здесь следует обсудить некоторые основные свойства PBr 5 с надлежащим объяснением, таким как степень окисления, кристаллизация, кислотность и основность в следующей части статьи.
1. PBr
5 Название IUPACНазвание IUPAC PBr 5 представляет собой пентабромид фосфора, поскольку бром присутствует в виде анионной части, поэтому «de» добавляется в качестве суффикса, а пять называется Пента, которая добавляется в качестве префикса анионной части. Он также известен как пентабромфосфин.
2. ПБр 5 химическая формулаPBr 5 представляет собой химическую формулу пентабромида фосфора, так как фосфор и бром присутствуют в пропорции 1:5, поскольку P несет катионную часть, поэтому он идет первым, за ним следуют три иона брома.
PBR 5 Структура3. PBR
5 CAS Номер 7789-69-7 — Количество CAST (до 10 цифр, предоставленных химическим абстрактным услугой) PBR) PBR) PBR) PBR) PBR) 5 и по этому номеру мы можем получить информацию о молекуле.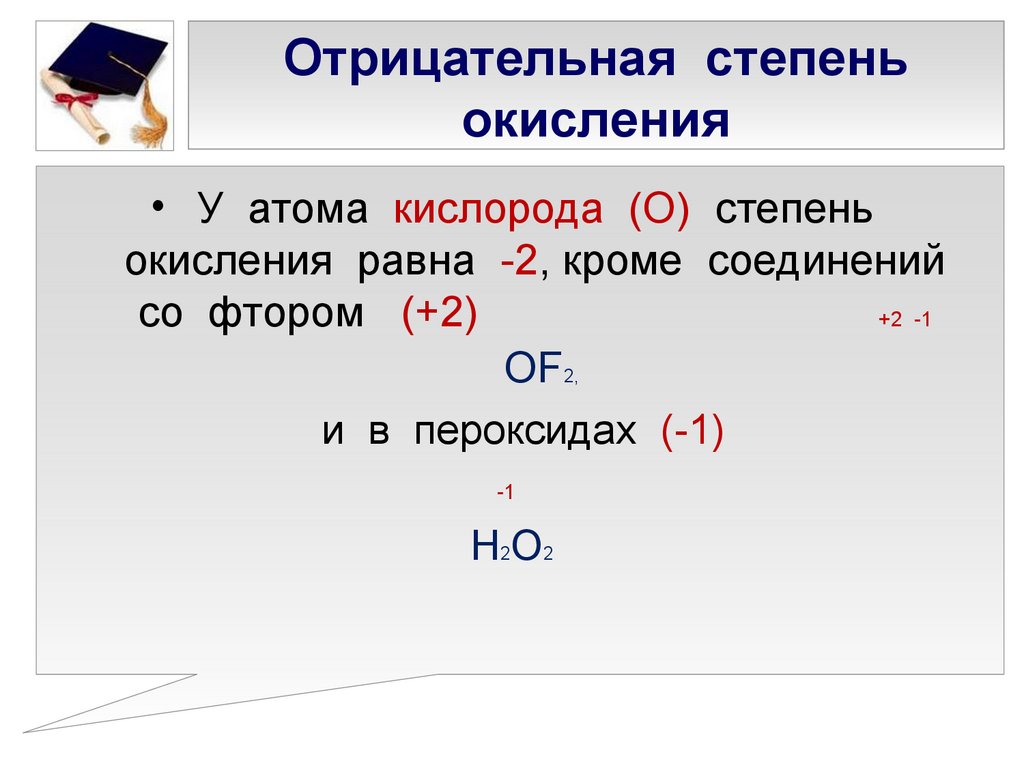
4. PBr5 Chem Spider ID
PBr 5 имеет идентификатор chem Spider ID 56429 (присваивается Королевским научным обществом, как и номер CAS, уникальный для каждой молекулы).
5. PBr
5 химическая классификация PBr 5 классифицируется по следующим категориям:0005 PBr 5 имеет молярную массу 430,49 г/моль, которая представляет собой сумму общей атомной массы одного атома фосфора и пяти атомов брома. P имеет атомную массу 30,97 г / моль, а каждый Br имеет атомную массу 79.0,884 г/моль, поэтому в PBr 5 общая молярная масса составляет 30,97 + (79,884*5) = 430,49 г/моль, так как присутствуют пять атомов Br. PBr 5 имеет характеристики желтого цвета из-за электронного перехода между d-орбиталью P и p-орбиталью атомов Br. Вязкость PBr 5 в жидкой форме очень низкая и составляет около 0,000954 Па при комнатной температуре, поскольку при комнатной температуре он существует в твердом состоянии. Твердая или газообразная форма не имеет вязкости, так как она присуща только жидкости. Молярная плотность твердого PBr 5 составляет 3,49 г/л, так как он имеет молярную массу 430,49 г/моль, а согласно расчету Авогардо объем каждого элемента составляет 22,4 л, а здесь присутствуют шесть элементов, поэтому молярная плотность PBr 5 будет 430,49/(22,4*6) = 3,49 г/л. Температура плавления PBr 5 ниже 100 0 C из-за своей слабой кристаллической решетки, поэтому он может разлагаться в жидкое состояние при 100 0 C. 106 0 C или 279K температура кипения пентабро фосфин из-за слабой силы притяжения Ван-дер-Ваальса требует меньше энергии для выкипания и перехода в газообразное состояние , но выше температуры его плавления. PBr 5 представляет собой твердую молекулу желтого цвета при комнатной температуре и при нагревании может разлагаться на PBr 3 и Br 2 . Он принимает орторомбический кристалл в твердом состоянии при комнатной температуре в форме решетки из рентгеновского кристалла, это подтверждено. Все связи, присутствующие в PBr 5 , по своей природе ковалентны и образуются за счет sp 3 d гибридизации центрального P подобно другой ковалентной связи. Фосфор и бром имеют ковалентные радиусы 195 и 185 пм, поскольку для молекул не найден ковалентный радиус, поэтому мы можем предсказать ковалентный радиус отдельных атомов-заместителей. Электронная конфигурация – это расположение электронов в определенной оболочке, имеющей определенное квантовое число элемента. Найдем электронную конфигурацию PBr5. Электронные конфигурации P и Br: [Ne]3s 2 3p 3 и [Ar]3d 10 4s 2 4p 5 , которые сами по себе не являются электронной конфигурацией P 60 50 90 P потому что для молекул мы не можем предсказать конфигурацию . Центральный P находится в степени окисления +5 в PBr 5 , где все Br находятся в степени окисления -1. PBr 5 имеет кислую природу, а является сильной кислотой Льюиса из-за наличия вакантной d-орбитали P, поэтому он может принимать электроны от подходящего основания Льюиса или электрона -богатая система. За счет пяти электроотрицательных атомов Br они стягивают электронную плотность с P-узла, и его льюисовская кислотность еще больше возрастает. PBr 5 имеет резкий запах из-за гидролиза молекулы с образованием бромистоводородной кислоты. Парамагнитная природа молекулы зависит от наличия неспаренных электронов на валентной оболочке. Посмотрим, является ли PBr 5 парамагнитным или нет. PBr 5 не является ни парамагнитным, ни диамагнитным, поскольку все пять валентных электронов P используются для образования связи с пятью атомами Br. Итак, не имея электронов ни в неспаренной, ни в парной форме, мы не можем предсказать его магнитные свойства. В кристаллической форме молекулы PBr 5 такой гидратированной части нет, но она может подвергаться быстрому гидролизу из бромистоводородной кислоты. Это гидрофобная молекула. Электроотрицательные атомы F могут быть присоединены к молекуле воды водородной связью, поскольку они образуют наилучшую водородную связь. В форме решетки PBr 5 принимает орторомбический кристалл, где значения a, b и c для кристаллической решетки равны 792, 836 и 1122 пм, а значения α, β и γ равны 90 0 . Всего в монокристалле присутствует 16 атомов, что означает четыре молекулы PBr 5 на кристалл, и это трехмерная кристаллическая решетка. PBR 5 является проводящей и неполясной из-за следующей причины, 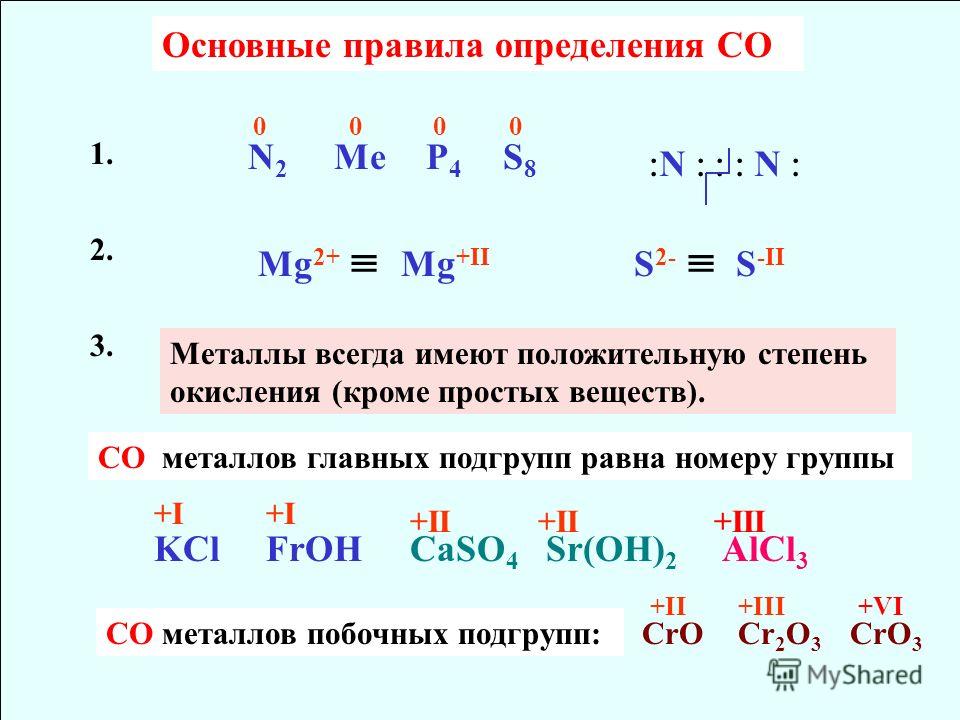
7. PBr
5 цвет 8. PBr
5 вязкость 9. PBr
5 молярная плотность 10. PBr
5 температура плавления
11. PBr
5 точка кипения 12. PBr
5 состояние при комнатной температуре 13. Ковалентная связь PBr
5  Итак, здесь каждый Br и P делят свои электроны для создания каждой связи, и все связи образуются за счет совместного использования электронов.
Итак, здесь каждый Br и P делят свои электроны для создания каждой связи, и все связи образуются за счет совместного использования электронов. 14. PBr
5 ковалентный радиус 15. Электронные конфигурации PBr5
 Степень окисления можно оценить по их стабильной валентности. Из-за степени окисления -1 атомов Br 5 молекула не имеет заряда и ей удовлетворяет степень окисления +5 P.
Степень окисления можно оценить по их стабильной валентности. Из-за степени окисления -1 атомов Br 5 молекула не имеет заряда и ей удовлетворяет степень окисления +5 P. 17. PBr
5 кислотность 18. Имеет ли PBr
5 запах? 19. Является ли PBr5 парамагнитным?

20. PBr
5 гидраты 21. Кристаллическая структура PBr
5 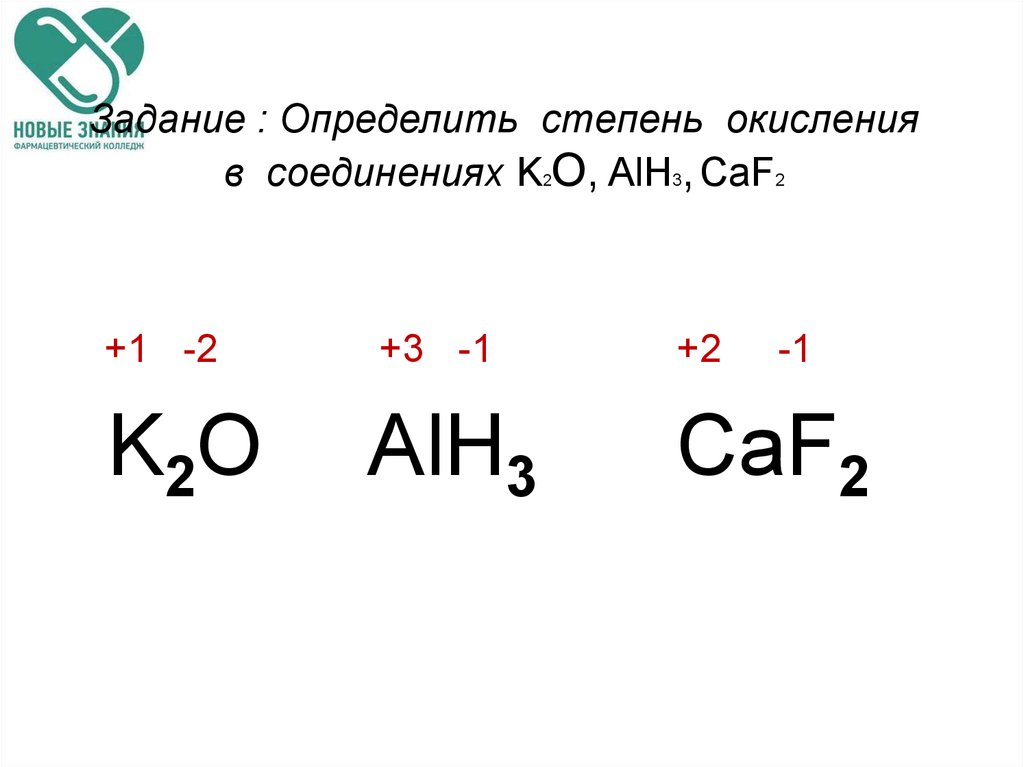
22. PBR
5 Полярность и проводимость Он также известен как галогенирование Ада-Фольхарда-Зелинского.
Он также известен как галогенирование Ада-Фольхарда-Зелинского.
24. PBr
5 реакция с основаниемБудучи кислотой Льюиса, она может реагировать с основаниями Льюиса, принимать от них неподеленные пары или электронную плотность и образовывать аддукт или комплекс.
PBR5 + NH 3 = H 3 N-PBR5
25. PBR
5 Реакция с оксидомPBR 5 Can React с оксидом гидроидрома. может очень быстро и энергично реагировать с водой. Кроме того, он может конвертировать в PBr 3 и реагирует с группой -ОН в органической химии с образованием алкилбромида.
- PBR 5 + H 2 O = HBR
- CH 3 -CH 2 -OH + PBR 5 = CH 3 -CH 2 -BR 5 = CH 3 -CH 2 -BR 5 = CH 3 -CH 2 -BR 5 = CH 3 -CH 2 -BR .


 09.19
09.19