|
Агат плотность агата |
2600 | 2,6 |
|
Азот плотность азота |
1250 | 1,25 |
|
Азот сжиженный (-195°C) плотность сжиженного азота |
850 | 0,850 |
|
Азота закись N2O плотность закиси азота |
1,98 | 0,00198 |
|
Азота окись NO плотность окиси азота |
1,3402 | 0,00134 |
|
Азота фторокись NO2F плотность фторокиси азота |
2,9 | 0,0029 |
|
Азота хлорокись NO2Cl |
2,57 | 0,00257 |
|
Азотная кислота, HNO3 водный раствор 91% плотность азотной кислоты |
1505 | 1,505 |
|
Актиний плотность актиния |
10070 | 10,07 |
|
Алебастр плотность алебастра |
1800-2500 | 1,8-2,5 |
|
Алмаз плотность алмаза |
3510 | 3,51 |
|
Алюминиевая бронза (3-10% Al) плотность алюминиевой бронзы |
7700-8700 | 7,7-8,7 |
|
Алюминиевая фольга плотность алюминиевой фольги |
2700 -2750 | 7,7-2,75 |
|
Алюминий плотность алюминия |
2710 | 2,71 |
|
Алюминий крупнокусковой плотность крупнокускового алюминия |
880 | 0,88 |
|
Алюминий порошкообразный плотность порошкообразного алюминия |
750 | 0,75 |
|
Алюминий фтористый (криолит) плотность фтористого алюминия |
1600 | 1,6 |
|
Алюминия оксид Al2O3 (чистый сухой) плотность оксида алюминия |
1520 | 1,52 |
|
Америций чистый плотность амерция |
13670 | 13,67 |
|
Аммиак плотность аммиака |
770 | 0,77 |
|
Аммиачная селитра (нитрат аммония) плотность аммиачной селитры |
730 | 0,73 |
|
Аммония сульфат; сернокислый аммоний (мокрый) плотность сульфата аммония |
1290 | 1,29 |
|
Аммония сульфат; сернокислый аммоний (сухой) плотность сульфата аммония |
1130 | 1,13 |
|
Андезит цельный плотность андезита |
2770 | 2,77 |
|
Анилин плотность анилина |
1020 | 1,02 |
|
Апатит плотность апатита |
3190 | 3,19 |
|
Арахис нечищенный (земляной орех) плотность арахиса |
270 | 0,27 |
|
Арахис чищенный (земляной орех) плотность арахиса |
650 | 0,65 |
|
Аргон плотность аргона |
1784 | 1,784 |
|
Асбест кусками плотность асбеста |
1600 | 1,6 |
|
Асбест цельный плотность асбеста |
2350-2600 | 2,35-2,6 |
|
Асфальтобетон плотность асфальтобетона |
2250 | 2,25 |
|
Асфальтовая крошка плотность асфальтовой крошки |
720 | 0,72 |
|
Ацетилен C2H2 плотность ацетилена |
1,17 | 0,00117 |
|
Ацетон плотность ацетона |
800 | 0,8 |
|
Ацетонитрил плотность ацетонитрила |
780 | 0,78 |
|
Баббит плотность баббита |
7270 | 7,27 |
|
Базальт дробленый плотность базальта дробленного |
1950 | 1,95 |
|
Базальт цельный плотность базальта цельного |
3000 | 3 |
|
Бакелит цельный плотность бакелита цельного |
1360 | 1,36 |
|
Барий чистый плотность бария чистого |
3590 | 3,59 |
|
Бариллиево-медный сплав, бериллиевая бронза плотность сплава |
8100 — 8250 | 8,1 — 8,25 |
|
Бария сульфат (барит), дробленый плотность сульфата бария |
2880 | 2,88 |
|
Бензин плотность бензина |
750 | 0,75 |
|
Бензол плотность бензола |
0,88 | |
|
Бериллий плотность бериллия |
1848 | 1,848 |
|
Берклий чистый плотность берклий чистый |
14780 | 14,78 |
|
Бетон плотность бетона |
2300 | 2,3 |
|
Бетонит сухой плотность бетонита сухого |
600 | 0,6 |
|
Бобы какао плотность какое бобов |
600 | 0,6 |
|
Бобы касторовые плотность бобов касторовых |
580 | 0,58 |
|
Бобы соевые плотность соевых бобов |
720 | 0,72 |
|
Бокситы дробленые плотность дробленых боксидов |
1282 | 1,282 |
|
Бор плотность бора |
2460 | 2,46 |
|
Бор фтористый плотность фтористого бора |
2,99 | |
|
Бром чистый плотность блома |
3120 | 3,12 |
|
Бронза плотность бронзы |
8700-8900 | 8,7-8,9 |
|
Бронза свинцовистая плотность свинцовой бронзы |
7700 — 8700 | 7,7-8,7 |
|
Бронза фосфористая плотность бронзы фосфористной |
8780 — 8920 | 8,78-8,92 |
|
Бумага обычная плотность бумаги |
1201 | 1,201 |
|
Бура (пироборнокислый натрий) плотность буры |
850 | 0,85 |
|
Буровой раствор глинистый жидкий плотность раствора |
1730 | 1,73 |
|
Бутан (i-Бутан) C4h20 плотность бутана |
2,67 | |
|
Бутан (n-Бутан) C4h20 плотность бутана |
2,7 | |
|
Бытовые отходы, бытовой мусор плотность мусора |
480 | 0,48 |
|
Ванадий чистый плотность ванадия |
6020 | 6,02 |
|
Винипласт плотность винипласта |
1380 | 1,38 |
|
Висмут чистый плотность висмута |
9750 | 9,75 |
|
Вода дистиллированная плотность воды дистиллированной |
998 | 0,998 |
|
Вода морская плотность морской воды |
1020 | 1,02 |
|
Водород плотность водорода |
0,09 | |
|
Водород сжиженный плотность сжиженного водорода |
72 | 0,072 |
|
Водород бромистый HBr плотность бромистого водорода |
3,66 | |
|
Водород иодистый Hl плотность иодистого водорода |
5,79 | |
|
Водород мышьяковистый h4As плотность мышьяковистого водорода |
3,48 | |
|
Водород селенистый h3Se плотность селенистого водорода |
3,66 | |
|
Водород сернистый h3S плотность сернистого водорода |
1,54 | |
|
Водород теллуристый h3Te плотность теллуристного водорода |
5,81 | |
|
Водород фосфористый h4P плотность фосфористого водорода |
1,53 | |
|
Водород хлористый HCl плотность хлористого водорода |
1,64 | |
|
Водяной пар (100°C) плотность водяного пара |
880 | 0,88 |
|
Воздух плотность воздуха |
1290 | 1,29 |
|
Воздух сжиженный плотность воздуха |
861 | 0,861 |
|
Вольфрам плотность вольфрама |
19100 | 19,1 |
|
Гадолиний чистый Gadolinium Gd плотность гадолиния |
7895 | 7,895 |
|
Галлий чистый плотность галлия |
5900 | 5,9 |
|
Гафний чистый Hafnium Hf плотность гафния |
13310 | 13,31 |
|
Гелий плотность гелия |
0,18 | |
|
Гелий сжиженный плотность гелия |
147 | |
|
Гематит (красный железняк) дробленый плотность гематита |
2100-2900 | 2,1-2,9 |
|
Гематит (красный железняк) цельный плотность гематита |
5095 — 5205 | 5,095 — 5,205 |
|
Германий чистый плотность германия |
5300 | 5,3 |
|
Глицерин плотность глицерина |
1260 | 1,26 |
|
Гранит плотность гранита |
2800 | 2,8 |
|
Двуокись углерода плотность углекислого газа |
1980 | 1,98 |
|
Дедерон плотность дедерона |
1100 | 1,1 |
|
Дизельное топливо (солярка) плотность дизельного топлива |
850 | 0,85 |
|
Дуб плотность дуба |
800 | 0,8 |
|
Дюралюминий плотность дюралюминия |
2790 | 2,79 |
|
Дюралюминий плотность дюралюминия |
2790 | 2,79 |
|
Железо плотность железа |
7800 | 7,8 |
|
Золото плотность золота |
19300 | 19,3 |
|
Инвар плотность инвара |
8700 | 8,7 |
|
Иридий плотность иридия |
22400 | 22,4 |
|
Каменный уголь плотность каменного угля |
1400 | 1,4 |
|
Керосин плотность керосина |
800 | 0,8 |
|
Кислород плотность кислорода |
1470 | 1,47 |
|
Кокс плотность кокса |
600 | 0,6 |
|
Криптон плотность криптона |
3743 | 3,743 |
|
Ксенон плотность ксенона |
5851 | 5,851 |
|
Латунь плотность латуни |
8600 | 8,6 |
|
Лед (вода ниже 0°С) плотность льда |
900 | 0,9 |
|
Литий плотность лития |
535 | 0,535 |
|
Магний плотность магния |
1738 | 1,738 |
|
Медь плотность меди |
8900 | 8,9 |
|
Метан плотность метана |
717 | 0,717 |
|
Молоко плотность молока |
1030 | 1,03 |
|
Натрий плотность натрия |
968 | 0,986 |
|
Неон плотность неона |
900 | 0,9 |
|
Окись углерода плотность угарного газа |
1250 | 1,25 |
|
Пертинакс плотность пертинакса |
1350 | 1,35 |
|
Песчаник плотность песчаника |
2400 | 2,4 |
|
Платина плотность платины |
21500 | 21,5 |
|
Пропан плотность пропана |
2200 | 2,2 |
|
Органическое стекло плотность органического стекла |
1180 | 1,18 |
|
Пробковая кора плотность пробковой коры |
150 | 0,15 |
|
Ртуть плотность ртути |
13500 | 13,5 |
|
Свинец плотность свинца |
11340 | 11,34 |
|
Серебро плотность серебра |
10500 | 10,5 |
|
Серная кислота (концентрированная) плотность серной кислоты |
1830 | 1,83 |
|
Сосна плотность сосны |
500 | 0,5 |
|
Спирт (ректификат) плотность спирта |
830 | 0,83 |
|
Стекло оконное плотность оконного стекла |
2500 | 2,5 |
|
Титан плотность титана |
4500 | 4,5 |
|
Углерод плотность углерода |
2260 | 2,26 |
|
Фтор плотность фтора |
1696 | 1,696 |
|
Хлор плотность хлора |
3220 | 3,22 |
|
Цинк плотность цинка |
7100 | 7,1 |
|
Электрон плотность электрона |
1800 | 1,8 |
|
Этилен плотность этилена |
1260 | 1,26 |
|
Этиловый спирт плотность этилового спирта |
790 | 0,79 |
|
Эфир плотность эфира |
720 | 0,72 |
Плотность — кислород — Большая Энциклопедия Нефти и Газа, статья, страница 1
Плотность — кислород
Cтраница 1
Плотность кислорода при температуре 300 К и давлении 1 6 — Ю5 Па равна 2 05 кг / м3; масса кислорода, занимающего при заданных условиях объем 200 0 м3, составляет 410 кг. [1]
[1]
Плотность кислорода при температуре 27 С и давлении 1200 мм рт. ст. равна 2 05 кг / м3; масса 200 лг3 кислорода при этих условиях равна 410 кг. [2]
Плотность кислорода больше потому, что масса молекулы кислорода примерно в 16 раз больше массы молекулы водорода. [3]
Здесь плотность кислорода определена при средней его температуре а экономайзерном участке, ориентировочно принятой f эк 94 2 К. [4]
Из этого графика видно, что плотность кислорода уменьшается вдвое на высоте z да 5 км, тогда как плотность водорода становится вдвое меньше на высоте 2 80 км; для гелия такая высота г равна 40 км. [5]
Более точные определения, основанные на данных измерения плотности кислорода при низком давлении, когда по своим свойствам он приближается к идеальному газу, позволили получить значение 22 4140 л для молярного объема газа. [6]
[6]
Во сколько раз отличается плотность метана ( СН4) от плотности кислорода ( 02) при одинаковых условиях. [7]
Па — давление газа, р01 43 кг / мэ — плотность кислорода при нормальных условиях, р0 1 013 — 105 Па — нормальное атмосферное давление, ц32 — 10 — 3 кг / моль — молярная масса кислорода, 8 314 Дж / ( моль — К) — молярная газовая постоянная. [8]
На глубине Нл от поверхности пластины ( см. рис. 14) плотность распределенного кислорода примерно вдвое меньше плотности, соответствующей стехиометрическому соотношению. [9]
Плотность смеси оксидов углерода ( II) и ( IV) равна плотности кислорода. [10]
Далее, из графика видно, что при подъеме на одну и ту же высоту плотность кислорода убывает гораздо быстрее, чем плотность более легких газов. [11]
[11]
Найдите в периодической таблице элемент, образующий газообразное водородное соединение, плотность которого почти равна плотности кислорода. [12]
На рис. 14 представлены кривые распределения средней плотности пропитанного жидким кислородом пенополистирола рр по толщине пластины и плотности распределенного кислорода р при пропитке с одной стороны в зависимости от расстояния Н до поверхности пластины. [14]
Какой объем озона следует добавить к 1 л воздуха, чтобы получить газовую смесь, плотность которой равна плотности кислорода при той же температуре. [15]
Страницы: 1 2 3
Плотность, теплопроводность, теплоемкость кислорода O2
Плотность, теплоемкость, свойства кислорода O
2В таблице представлены теплофизические свойства кислорода такие, как плотность, энтальпия, энтропия, удельная теплоемкость, динамическая вязкость, коэффициент теплопроводности. Свойства в таблице даны для газообразного кислорода, находящегося при атмосферном давлении, в зависимости от температуры в интервале от 100 до 1300 К.
Свойства в таблице даны для газообразного кислорода, находящегося при атмосферном давлении, в зависимости от температуры в интервале от 100 до 1300 К.
Плотность кислорода равна 1,329 кг/м3при комнатной температуре. При нагревании кислорода, его плотность уменьшается. Теплопроводность кислорода равна 0,0258 Вт/(м·град) при комнатной температуре и при повышении температуры этого газа увеличивается.
Удельная теплоемкость кислорода при комнатной температуре равна 919 Дж/(кг·град). Теплоемкость кислорода увеличивается при росте его температуры. Также при нагревании кислорода увеличиваются значения таких его свойств, как энтальпия, энтропия и вязкость.
Примечание: будьте внимательны! Теплопроводность в таблице указана в степени 102. Не забудьте разделить на 100.
Теплопроводность кислорода в жидком и газообразном состояниях
В таблице приведены значения коэффициента теплопроводности кислорода в жидком и газообразном состояниях при различных температурах и давлениях. Теплопроводность указана в интервале температуры от 80 до 1400 К и давления от 1 до 600 атм.
Теплопроводность указана в интервале температуры от 80 до 1400 К и давления от 1 до 600 атм.
Значения теплопроводности в таблице, находящиеся выше черты, относятся к жидкому кислороду, а ниже ее — к газообразному. По данным таблицы видно, что теплопроводность жидкого кислорода выше, чем газообразного и при росте давления увеличивается.
Примечание: Будьте внимательны! Теплопроводность в таблице дана в степени 103. Не забудьте разделить на 1000. Размерность Вт/(м·град).
Теплопроводность кислорода при высоких температурах
В таблице даны значения коэффициента теплопроводности кислорода при высоких температурах (от 1600 до 6000 К) и давлении от 0,001 до 100 атм.
При температурах выше 1300°С кислород начинает диссоциировать, и при некотором давлении его теплопроводность достигает максимальных значений. По данным таблицы видно, что теплопроводность диссоциированного кислорода при высоких температурах может достигать величин до 3,73 Вт/(м·град).
Примечание: Будьте внимательны! Теплопроводность в таблице дана в степени 103. Не забудьте разделить на 1000.
Теплопроводность жидкого кислорода на линии насыщения
В таблице указаны значения коэффициента теплопроводности жидкого кислорода на линии насыщения. Теплопроводность дана в диапазоне температуры от 90 до 150 К. Следует отметить, что теплопроводность жидкого кислорода при увеличении температуры снижается.
Примечание: Будьте внимательны! Теплопроводность в таблице дана в степени 103. Не забудьте разделить на 1000.
Источники:
1. Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей.
2. Чиркин В.С. Теплофизические свойства материалов ядерной техники.
Таблица плотности веществ
Плотность — физическая величина, которая равна отношению массы тела к его объему:
Плотности некоторых твердых тел (при норм. атм. давл., t = 20ºC)| Твердое тело | ρ, кг / м 3 | ρ, г / cм 3 | Твердое тело | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Осмий | 22 600 | 22,6 | Мрамор | 2700 | 2,7 |
| Иридий | 22 400 | 22,4 | Стекло оконное | 2 500 | 2,5 |
| Платина | 21 500 | 21,5 | Фарфор | 2 300 | 2,3 |
| Золото | 19 300 | 19,3 | Бетон | 2 300 | 2,3 |
| Свинец | 11 300 | 11,3 | Кирпич | 1 800 | 1,8 |
| Серебро | 10 500 | 10,5 | Сахар-рафинад | 1 600 | 1,6 |
| Медь | 8 900 | 8,9 | Оргстекло | 1 200 | 1,2 |
| Латунь | 8 500 | 8,5 | Капрон | 1 100 | 1,1 |
| Сталь, железо | 7 800 | 7,8 | Полиэтилен | 920 | 0,92 |
| Олово | 7 300 | 7,3 | Парафин | 900 | 0,90 |
| Цинк | 7 100 | 7,1 | Лёд | 900 | 0,90 |
| Чугун | 7 000 | 7,0 | Дуб (сухой) | 700 | 0,70 |
| Корунд | 4 000 | 4,0 | Сосна (сухая) | 400 | 0,40 |
| Алюминий | 2 700 | 2,7 | Пробка | 240 | 0,24 |
 атм. давл., t = 20ºC)
атм. давл., t = 20ºC)| Жидкость | ρ, кг / м 3 | ρ, г / cм 3 | Жидкость | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Ртуть | 13 600 | 13,60 | Керосин | 800 | 0,80 |
| Серная кислота | 1 800 | 1,80 | Спирт | 800 | 0,80 |
| Мёд | 1 350 | 1,35 | Нефть | 800 | 0,80 |
| Вода морская | 1 030 | 1,03 | Ацетон | 790 | 0,79 |
| Молоко цельное | 1 030 | 1,03 | Эфир | 710 | 0,71 |
| Вода чистая | 1000 | 1,00 | Бензин | 710 | 0,71 |
| Масло подсолнечное | 930 | 0,93 | Жидкое олово(при t = 400ºC) | 6 800 | 6,80 |
| Масло машинное | 900 | 0,90 | Жидкий воздух(при t = -194ºC) | 860 | 0,86 |
 атм. давл., t = 20ºC)
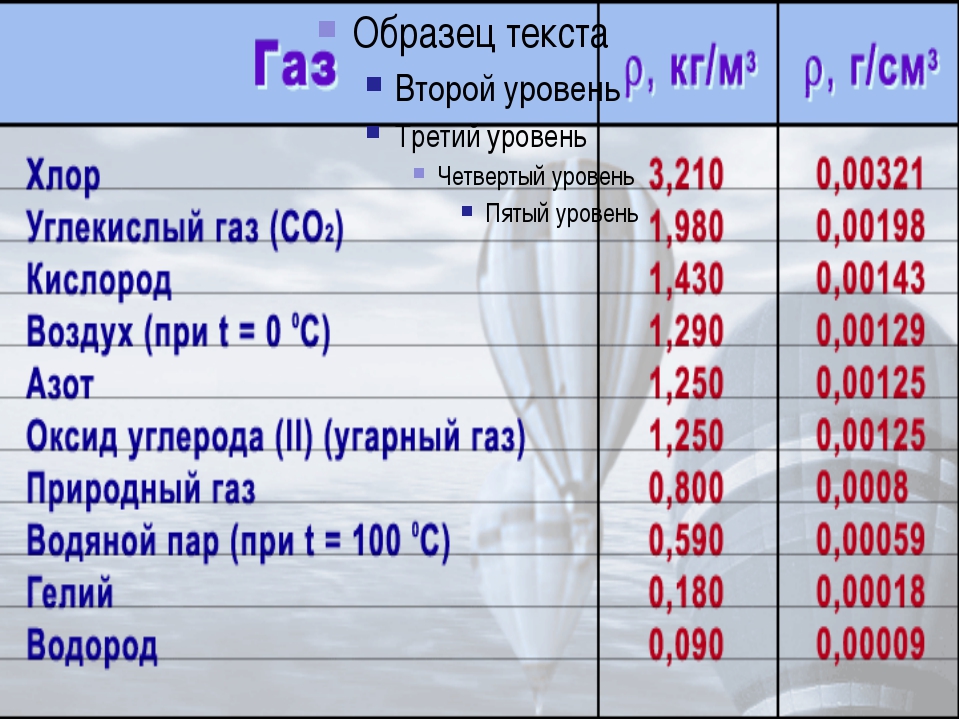
атм. давл., t = 20ºC)| Газ | ρ, кг / м 3 | ρ, г / cм 3 | Газ | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Хлор | 3,210 | 0,00321 | Оксид углерода (II)(угарный газ) | 1,250 | 0,00125 |
| Оксид углерода (IV)(углекислый газ) | 1,980 | 0,00198 | Природный газ | 0,800 | 0,0008 |
| Кислород | 1,430 | 0,00143 | Водяной пар (приt = 100ºC) | 0,590 | 0,00059 |
| Воздух (при 0ºC) | 1,290 | 0,00129 | Гелий | 0,180 | 0,00018 |
| Азот | 1,250 | 0,00125 | Водород | 0,090 | 0,00009 |
Другие заметки по химии
Кислород
Кислород – газ без цвета и запаха, активно поддерживает горение. Плотность газообразного кислорода 1.43 кг/м3 (при температуре 0 градусов по Цельсию и давлении 760 мм рт. ст.), что в 1.11 раз тяжелее воздуха, поэтому газообразный кислород, выпущенный из баллона, скапливается в нижней части помещения, заполняет все приямки и траншеи и надолго там задерживается, образуя закислороженную зону. Максимально допустимое содержание кислорода 23%. По своим химическим свойствам кислород является сильным окислителем. Масло в среде кислорода взрывается, поэтому все детали, работающие в среде кислорода, должны быть чистыми от масла.
Плотность газообразного кислорода 1.43 кг/м3 (при температуре 0 градусов по Цельсию и давлении 760 мм рт. ст.), что в 1.11 раз тяжелее воздуха, поэтому газообразный кислород, выпущенный из баллона, скапливается в нижней части помещения, заполняет все приямки и траншеи и надолго там задерживается, образуя закислороженную зону. Максимально допустимое содержание кислорода 23%. По своим химическим свойствам кислород является сильным окислителем. Масло в среде кислорода взрывается, поэтому все детали, работающие в среде кислорода, должны быть чистыми от масла.
Примечание: во избежание переполнения баллонов, в соответствии с «Правилами устройства и безопасности эксплуатации сосудов, работающих под давлением», допускается заполнять баллон на 1-2 атм. ниже величин, указанных в таблице.
На долю кислорода приходится около 47% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88%, в атмосфере содержание свободного кислорода составляет 20% по объему, либо 23% по массе. Элемент входит в состав более 1500 соединений.
Элемент входит в состав более 1500 соединений.
Газообразный кислород получают путем газификации из жидкого кислорода. Сырье для газификации – жидкий кислород — получают из атмосферного воздуха с помощью устройств для сжижения воздуха – турбодетандеров. Далее жидкий кислород перевозят к месту его применения в криогенных емкостях типа термос-цистерна. Станция по закачке кислорода в баллоны представляет из себя наполнительный пункт, состоящий из резервных и рабочих емкостей, криогенного насоса, испарителя и устройства непосредственного распределения газа по баллонам – наполнительной рампы. Кислород закачивается в баллон под давлением 150 атм при температуре 20 градусов Цельсия. Кислород применяют в промышленности и медицине. Технический кислород ГОСТ 5583-78 используют при автогенной резке и газовой сварке, металлургии, химической промышленности, металлообработке, в качестве компонента топлива в жидкостных ракетных двигателях.
Кислородные баллоны ГОСТ 949-73 принимаются под наполнение объемом 40, 10 и 5л. Баллоны изготавливают из стали методом горячей прокатки. Обычно корпуса баллонов для всех технических газов объемом 40 литров производят двух типов – с рабочим давлением 150 или 125 атм. Баллоны под кислород должны быть выкрашены в голубой цвет и иметь надпись «кислород» черного цвета. Баллоны оснащаются вентилями марки ВК-86 или ВК-94. Не принимаются под наполнение кислородом баллоны с рабочим давлением мене 150 атмосфер, без башмаков, замасленные, заправленные раньше другими газами, со следами механических повреждений или коррозии. Один раз в пять лет проводится аттестация баллона.
Давление в полном кислородном баллоне в зависимости от температуры окружающей среды:
| Температура окр. среды С | -30 | -20 | -10 | 0 | 10 | 20 | 30 |
|
Давление в баллоне не более Р кг/см |
110 | 120 | 130 | 135 | 140 | 145 | 150 |
Эритроцитарные индексы
Эритроцитарные индексы определяют размер эритроцита и содержание в нем гемоглобина и включают в себя средний объем эритроцита (MCV), среднее содержание гемоглобина в эритроците (MCHC), среднюю концентрацию гемоглобина в эритроцитах (MCHC), а также распределение эритроцитов по величине (RDW).
Определение вышеуказанных показателей является неотъемлемой частью общего анализа крови и отдельно не производится.
Синонимы русские
Средний объем эритроцита, среднее содержание гемоглобина в эритроците, средняя концентрация гемоглобина в эритроцитах, распределение эритроцитов по величине, индекс морфологии эритроцитов.
Синонимы английские
Red Cell Indicies, Red Blood Indicies, Red Blood Cell Indices, Blood indicies МСV, MCH, MCHC, Mean cell hemoglobin, Mean Cell Volume, Mean cell hemoglobin concentration, Mean corpuscular volume, Mean corpuscular hemoglobin concentration, Mean corpuscular hemoglobin, RDW, RDW-CS, RDW-SD, Red cell distribution of width.
Общая информация об исследовании
Эритроциты – это красные кровяные клетки, являющиеся основными форменными элементами крови. В их составе есть гемоглобин – белок, который переносит кислород от легких к тканям и органам. Он состоит из белка глобина и гемма-комплекса, содержащего железо, способное связываться с кислородом. У некоторых людей процесс «сборки» гемоглобина может нарушаться, что отражается на внешнем виде и размере эритроцитов.
У некоторых людей процесс «сборки» гемоглобина может нарушаться, что отражается на внешнем виде и размере эритроцитов.
Изменение количества эритроцитов обычно сопряжено с изменениями уровня гемоглобина. Когда количество эритроцитов и уровень гемоглобина снижены – у пациента анемия, когда они повышены – полицитемия.
Эритроцитарные индексы позволяют оценить размер эритроцитов и содержание в них гемоглобина. Они характеризуют сами клетки, а не их количество, вследствие чего являются относительно стабильными параметрами.
Средний объем эритроцита (MCV)
MCV – средний объем одного эритроцита. Он может измеряться анализатором непосредственно путем оценки многих тысяч эритроцитов или вычисляться по формуле как отношение гематокрита к количеству эритроцитов.
Этот показатель измеряется в фемтолитрах (10-15/л). Один фемтолитр равен одному кубическому микрометру (одна миллионная часть метра).
При большом количестве аномальных эритроцитов (например, при серповидно-клеточной анемии) подсчет MCV является недостоверным.
Среднее содержание гемоглобина в эритроците (MCH)
MCH отражает, сколько гемоглобина в среднем содержится в одном эритроците. Измеряется в пикограммах (одна триллионная часть грамма, 10-12) на эритроцит и рассчитывается как отношение гемоглобина к количеству эритроцитов. Он соответствует цветному показателю, который использовался ранее для отражения содержания гемоглобина в эритроцитах. Обычно MCH в эритроците является основой для дифференциальной диагностики анемий.
Средняя концентрация гемоглобина в эритроцитах (MCHC)
MCHC – показатель насыщения эритроцита гемоглобином, в отличие от MCH характеризует не количество гемоглобина в клетке, а «плотность» заполнения клетки гемоглобином. Рассчитывается как отношение общего гемоглобина к гематокриту – объему, который занимают эритроциты в кровяном русле. Он измеряется в граммах на литр и является наиболее чувствительным показателем при нарушениях образования гемоглобина. Кроме того, это один из самых стабильных гематологических показателей, так что MCHC используется как индикатор ошибок анализатора.
Распределение эритроцитов по объему (RDW)
RDW – степень разброса эритроцитов по объему. Существуют разные варианты подсчета этого показателя. RDW-CV измеряется в процентах и показывает, насколько объем эритроцитов отклоняется от среднего. RDW-SD измеряется в фемтолитрах, так же как средний объем эритроцитов (MCV), и показывает разницу между самым маленьким эритроцитом и самым большим.
В целом RDW соответствует анизоцитозу, который определяется на основании микроскопии мазка крови, однако является значительно более точным параметром.
Для чего используется исследование?
Оценка эритроцитарных индексов позволяет получить представление о характеристиках эритроцитов, что очень важно в определении вида анемии. Эритроцитарные индексы зачастую быстро реагируют на лечение анемий и могут использоваться для оценки эффективности терапии.
Когда назначается исследование?
Как правило, эритроцитарные индексы входят в рутинный общий анализ крови, который назначается как планово, так и при различных заболеваниях, перед хирургическими вмешательствами. Повторно этот анализ назначают пациентам, проходящих лечение от анемии.
Повторно этот анализ назначают пациентам, проходящих лечение от анемии.
Что означают результаты?
Средний объем эритроцита (MCV)
|
Пол |
Возраст |
Референсные значения |
|
|
Меньше 1 года |
71 — 112 фл |
|
1-5 лет |
73 — 85 фл |
|
|
5-10 лет |
75 — 87 фл |
|
|
10-12 лет |
76 — 94 фл |
|
|
Женский |
12-15 лет |
73 — 95 фл |
|
15-18 лет |
78 — 98 фл |
|
|
18-45 лет |
81 — 100 фл |
|
|
45-65 лет |
81 — 101 фл |
|
|
Больше 65 лет |
81 — 102 фл |
|
|
Мужской |
12-15 лет |
77 — 94 фл |
|
15-18 лет |
79 — 95 фл |
|
|
18-45 лет |
80 — 99 фл |
|
|
45-65 лет |
81 — 101 фл |
|
|
Больше 65 лет |
81 — 102 фл |
На основании MCV, размера эритроцитов, анемии подразделяются на следующие виды:
- Микроцитарные – при MCV меньше нормы в крови преобладают эритроциты маленького размера.
 Чаще всего причиной микроцитарной анемии является дефицит железа. Он может возникать из-за длительных кровопотерь, нарушения усвоения железа, недостаточного употребления мясных продуктов, а также из-за некоторых нарушений «сборки» гемоглобина, например при талассемии или при различных хронических заболеваниях (длительных инфекциях, онкологиях).
Чаще всего причиной микроцитарной анемии является дефицит железа. Он может возникать из-за длительных кровопотерь, нарушения усвоения железа, недостаточного употребления мясных продуктов, а также из-за некоторых нарушений «сборки» гемоглобина, например при талассемии или при различных хронических заболеваниях (длительных инфекциях, онкологиях). - Нормоцитарные – когда эритроциты нормального размера. Это бывает при угнетении работы костного мозга – при апластической анемии, недавнем кровотечении, хронических заболеваниях печени и почек.
- Макроцитарные, когда в крови преобладают эритроциты крупного размера. Чаще всего это происходит при дефиците витамина B12 или фолиевой кислоты. MCV может повышаться и при нормальном уровне гемоглобина – из-за злоупотребления алкоголем, многолетнего курения, снижения функции щитовидной железы
Средний объём эритроцита в норме в течение жизни меняется: максимален он у новорождённых, а затем постепенно снижается.
Что может влиять на результат?
Большое количество ретикулоцитов, выраженный лейкоцитоз, а также значительное увеличение уровня глюкозы завышают показатель среднего объёма эритроцитов.
При одновременном увеличении в крови количества крупных (макроцитарных) и маленьких (микроцитарных) эритроцитов MCV будет в норме. Выявить нарушения в этом случае позволяет микроскопическое исследование мазка крови.
Среднее содержание гемоглобина в эритроците (MCH)
|
Возраст |
Пол |
Референсные значения |
|
|
30 — 37 пг |
|
|
14 дней — 1 мес. |
|
29 — 36 пг |
|
1 — 2 мес. |
|
27 — 34 пг |
|
2 — 4 мес. |
|
25 — 32 пг |
|
4 — 6 мес. |
|
24 — 30 пг |
|
6 — 9 мес. |
|
25 — 30 пг |
|
9 — 12 мес. |
|
24 — 30 пг |
|
1 — 3 года |
|
22 — 30 пг |
|
3 — 6 лет |
|
25 — 31 пг |
|
6 — 9 лет |
|
25 — 31 пг |
|
9-15 лет |
|
26 — 32 пг |
|
15-18 лет |
|
26 — 34 пг |
|
18-45 лет |
|
27 — 34 пг |
|
45-65 лет |
|
27 — 34 пг |
|
> 65 лет |
женский |
27 — 35 пг |
|
> 65 лет |
мужской |
27 — 34 пг |
По MCH анемии делят на нормохромные (когда среднее содержание гемоглобина в эритроците в пределах референсных назначений), гипохромные (когда MCH снижено) и гиперхромные (если среднее содержание гемоглобина в эритроците повышено).
Нормохромия присуща здоровым людям, но также встречается при гемолитических, апластических анемиях, а также после недавнего кровотечения.
Гипохромия, как правило, связана с уменьшением объёма эритроцитов (микроцитозом), однако может возникать и в эритроцитах нормального объёма.
Таким образом, снижение MCH обычно происходит при микро- и нормоцитарных анемиях. Повышение же отмечается при макроцитарных анемиях и у новорождённых.
Что может влиять на результат?
Повышение уровня липидов крови и значительный лейкоцитоз, миеломная болезнь и введение гепарина завышают результаты MCH.
Средняя концентрация гемоглобина в эритроците (MCHC)
|
Возраст |
Референсные значения |
|
Меньше 1 года |
290 — 370 г/л |
|
1-3 года |
280 — 380 г/л |
|
3-12 лет |
280 — 360 г/л |
|
12-19 лет |
330 — 340 г/л |
|
Больше 19 лет |
300 — 380 г/л |
Повышение MCHC отмечается при унаследованном заболевании, когда эритроциты имеют округлую форму – наследственном сфероцитозе, а также у новорождённых.
Снижение MCHC обычно происходит при микроцитарных анемиях.
Что может влиять на результат?
Повышение уровня липидов крови, миеломная болезнь и насыщение крови гепарином ведут к ложноповышенным результатам по MCHC.
RDW-SD (распределение эритроцитов по объёму, стандартное отклонение): 37 — 54.
RDW-CV (распределение эритроцитов по объёму, коэффициент вариации):
|
Возраст |
RDW-CV, % |
|
14,9 — 18,7 |
|
|
> 6 мес. |
11,6 — 14,8 |
Повышение RDW отмечается при значительном разбросе в размерах эритроцитов, что может быть при железодефицитных анемиях, когда увеличивается количество маленьких эритроцитов (микроцитов), или при дефиците витамина В12 или фолиевой кислоты, когда повышается число увеличенных в размере эритроцитов – мегалобластов.
Повышение RDW является одним из наиболее ранних признаков железодефицитной анемии. Уменьшение среднего объёма эритроцитов при нормальном RDW позволяет заподозрить талассемию.
Если большинство эритроцитов уменьшены или увеличены, результат RDW может оставаться в норме.
Патологические причины сниженного RDW неизвестны.
Что может влиять на результат?
Значительное повышение количества ретикулоцитов или лейкоцитов завышает результат RDW.
Важные замечания
- Полное представление о внешнем виде и размерах эритроцитов можно получить, если подсчёт эритроцитарных индексов проводится совместно с оценкой эритроцитов при микроскопии мазка крови.
Также рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, нефролог, хирург.
(PDF) Content of oxygen in the atmosphere over large cities and respiratory problems
А.С. Гинзбург, А.А. Виноградова, Е.И. Фёдорова, Е.В. Никитич, А.В. Карпов
ГЕОФИЗИЧЕСКИЕ ПРОЦЕССЫ И БИОСФЕРА 2014 Т. 13 № 2
6
бальное изменение климата меняют величину содержания кислорода в воздухе кон-
кретного места.
Изменение климата и загрязнение атмосферы наиболее сильно проявляются в усло-
виях современных быстрорастущих мегаполисов, особенно в развивающихся странах.
Эти процессы могут приводить и уже приводят к уменьшению содержания кислорода в
атмосфере больших городов, где проживает более половины населения Земли.
Широко известно, что недостаток кислорода в воздухе вызывает у человека гипок-
сию – пониженное содержание кислорода в организме [Гипоксия…, 2000]. Население
городских агломераций ощущает также недостаток кислорода, вызванный экологиче-
скими факторами и в первую очередь повышенным содержанием в городском воздухе
угарного газа и взвешенных частиц (аэрозолей), мешающих правильному усвоению ки-
слорода человеческим организмом.
В настоящее время многие интернет-сайты как в России, так и в других странах ин-
формируют широкую общественность о содержании кислорода в воздухе, рассчитывая
его концентрацию по классической формуле (см. ниже). Однако не всегда квалифици-
рованное использование общедоступной информации может привести к весьма проти-
воречивым выводам. Так, летом 2010 г. многие сообщения СМИ о погоде в г. Москве,
мягко говоря, существенно различались. Например, 20.07.2010 г. «РБК Daily» цитирует
руководителя Федеральной службы РФ по гидрометеорологии и мониторингу окру-
жающей среды (Росгидромет) А. Фролова, который предупреждал о том, что в связи со
смогом у москвичей и гостей столицы может развиться гипоксия, поскольку из-за жары
концентрация кислорода снизилась на 15–20 %. Однако его квалифицированное мнение
не показалось СМИ достаточно пугающим и 5 августа интернет-ресурс
«BigpowerNews» сообщил, что в г. Москве «жара вызвала погодную гипоксию, содер-
жание кислорода в воздухе снизилось почти в 2 раза», а 12 августа РИА «Новости»
публикует материал под броским заголовком «Содержание кислорода в московском
воздухе почти в 4 раза ниже нормы». Так сколько же кислорода было в московском
воздухе жарким летом 2010 г. и как это сказывалось на здоровье людей?
Авторы настоящей статьи постарались суммировать и проанализировать имеющиеся
данные о пространственно-временной изменчивости и эпизодах аномального содержа-
ния кислорода в приземном воздухе в контексте их возможного влияния на самочувст-
вие людей. Поскольку происходящие на планете климатические изменения способст-
вуют более частому возникновению различных аномальных ситуаций [Fung et al., 2013],
такое исследование актуально не только для москвичей. В последние несколько лет в ус-
ловиях сильной жары и пожаров на ближайших территориях оказывались жители других
городов России (например, г. Томска и г. Новосибирска в 2012 г.) и Европы.
Содержание кислорода в атмосферном воздухе
Процентное содержание кислорода (О2) в сухом воздухе у поверхности Земли в на-
стоящее время считается практически постоянной величиной, равной 20.95 %. Однако в
истории Земли этот процент бывал и значительно ниже, и заметно выше, да и сейчас
имеет некоторую тенденцию к снижению. Согласно современным данным в стандарт-
ной модели атмосферы предполагается состав сухого воздуха, приведенный в табл. 1
[Атмосфера…, 1991]. Напомним, что объемная доля равна молярной доле только для
идеального газа, а также, что в состав сухой атмосферы не включен водяной пар, кото-
рый в целом занимает в атмосфере ~0.4 %, а в приземном воздухе – от 1 до 4 % объема.
Следовательно, в воздухе, которым дышит человек, доли всех газов несколько меньше
величин, приведенных в табл. 1 (в зависимости от влажности).
Кислород (O 2 ) Кислород — это бесцветный газ без запаха и вкуса. Типичные области применения включают кислородно-ацетиленовую сварку, производство стали и различные химические вещества в качестве компонента топлива в аэрокосмической промышленности для лечения респираторных заболеваний. расстройства. Он также используется во время полетов на большой высоте и во время водолазных работ. ФИЗИЧЕСКИЕ ПОСТОЯННЫЕ (кислород):
СОЕДИНЕНИЯ ЦИЛИНДРОВ (Кислород): Стандартное соединение цилиндра CGA V-1 до 3000 фунтов на кв. Дюйм Резьбовое: CGA 540 |
Как рассчитать плотность газа
Плотность — это масса на единицу объема.Определение плотности газа аналогично определению плотности твердого тела или жидкости. Вы должны знать массу и объем газа. Сложность работы с газами заключается в том, что вам часто задают давление и температуру без упоминания объема. Вы должны выяснить это из другой информации.
Этот пример задачи покажет, как рассчитать плотность газа, учитывая тип газа, давление и температуру.
Вопрос: Какова плотность газообразного кислорода при 5 атм и 27 ° C?
Для начала запишем то, что мы знаем:
Газ — газообразный кислород или O 2 .
Давление 5 атм
Температура 27 ° C
Начнем с формулы закона идеального газа.
PV = nRT
где
P = давление
V = объем
n = количество молей газа
R = газовая постоянная (0,0821 л · атм / моль · K)
T = абсолютная температура
Если мы решим уравнение для объема, мы получим:
V = (nRT) / P
Теперь мы знаем все, что нам нужно, чтобы найти объем, кроме количества молей газа. Чтобы найти это, запомните соотношение между количеством родинок и массой.
п = м / мм
где
n = количество молей газа
m = масса газа
MM = молекулярная масса газа
Это полезно, поскольку нам нужно было найти массу, и мы знаем молекулярную массу газообразного кислорода. Если мы заменим n в первом уравнении, мы получим:
V = (mRT) / (MMP)
Разделите обе части на m:
В / м = (RT) / (ММП)
Но плотность равна m / V, поэтому переверните уравнение, чтобы получить:
m / V = (MMP) / (RT) = плотность газа.
Теперь нам нужно вставить известные нам значения.
MM кислорода или O 2 составляет 16 + 16 = 32 грамма / моль
P = 5 атм
T = 27 ° C, но нам нужна абсолютная температура.
T K = T C + 273
T = 27 + 273 = 300 K
m / V = (32 г / моль · 5 атм) / (0,0821 л · атм / моль · K · 300 K)
m / V = 160 / 24,63 г / л
m / V = 6,5 г / л
Ответ: Плотность газообразного кислорода 6,5 г / л.
РЕШЕНИЙ ДЛЯ ПРИЗНАЧЕНИЯ
РЕШЕНИЙ ДЛЯ НАЗНАЧЕНИЯОБЫЧНЫЕ ВЫПУСКИ
Q1. В выхлопных газах содержится 1,6% объем CO. Какова концентрация CO (в мкг / м 3 ) при 25 o C и 1 атм. давление.
ДАННЫЕ: Температура = 25 C
Давление = 1 атм.
ТРЕБУЕТСЯ: Концентрация CO
РЕШЕНИЕ:
Концентрация = (ppm * молекулярный вес) / (10 6 * Объем @ T, Р)
1.6% по объему = 1,6 * 10 4 частей на миллион
Молекулярная масса CO = 28 г / моль
Объем 1 моля CO при 0 C (T) и 1 атм (P) = 22,4 * 10 -3 м (СТАНДАРТ)
Объем 1 моль CO при 25 C (T) и 1 атм (P) может быть рассчитывается следующим образом
(применить P1V1T2 = P2V2T1)
= 22,4 * (273 + 25) / (273 + 0)
= 24,5 * 10 -3 м
Концентрация = (1,6 * 10 4 * 28) / (10 6 * 24.5 * 10 -3 ) г / м
= 18,3 г / м
= 1,83 * 10 7 г / м
2 квартал. Рассчитайте плотность воздуха при 25 o C и 1 атмосфера.
ДАННЫЕ: Температура = 25 C
Давление = 1 атм.
ТРЕБУЕТСЯ: Плотность воздуха
РЕШЕНИЕ:
Состав воздуха: 78% азота, 21% кислорода, 1% аргона
Плотность при 25 ° C и 1 атм.рассчитывается как
= (Давление * Молекулярный вес) / (R * Температура)
[где R = 0,08206 атм. Л / моль / K]
= (1 * 28) / (0,08206 * 298)
= 1,145 г / л
Плотность кислорода = (1 * 32) / (0,08206 * 298) = 1,309 г / л
Плотность аргона = (1 * 40) / (0,08206 * 298) = 1,638 г / л
Плотность воздуха = (0,78 * 1,145) + (0,21 * 1,309) + (0,01 * 1,638) = 1,184 г / л
Q3. Рассчитайте среднюю молекулярную вес воздуха.Состав сухого воздуха можно рассматривать как 78% азота ( МВ = 28,0), 21% кислорода (МВ = 32,0) и 1% аргона (МВ = 40,0).
ДАННЫЕ: Состав сухого воздуха: 78% азота, 21% кислорода и 1%. Аргон
ТРЕБУЕТСЯ: Молекулярный вес воздуха
РЕШЕНИЕ:
Средняя молекулярная масса воздуха = (0,78 * 28) + (0,21 * 32) + (0,01 * 40) г / моль
= 28.96 г / моль
4 квартал. Средняя скорость отходящего газа 7,92 м / сек измеряется на выходе оксихлорирования завода по производству дихлорэтилена в нормальные условия эксплуатации. Температура отходящего газа составляет 93,33 o ° C и диаметр вентиляционного отверстия — 1 фут. Измеренная средняя концентрация дихлорэтилен 2,2 * 10 -4 кг / м 3 (исправлено на 21,1 o C). Вычислите следующее:
| Объемный расход вентиляционного отверстия газовый поток. | |
| Рассчитать годовой выпуск, если завод работает 8 часов. в день и 241 день в течение год. |
ДАННЫЕ: Средняя скорость газа = 7,92 м / с, Диаметр вентиляционного отверстия = 1 фут,
Концентрация дихлорэтилен = 2,2 * 10 -4 кг / м 3 (при 21,1 ° C ),
Температура = 93,33 С
ТРЕБУЕТСЯ: Объемный расход потока отходящего газа
Годовой выпуск, если завод работает 8 часов в сутки 241 день в году.
РЕШЕНИЕ:
Объемный расход при 93,33 C & 1 атм = скорость * Площадь
= 7,92 м / с * π / 4 * (.305) 2 м
= 0,578 м / сОбъемный расход при 21,1 ° C и 1 атм = 0,578 * (273 + 21,1) / (273 + 93,33) м / с [V1 / T1 = V2 / T2]
= 0,464 м / с
Уровень выбросов = Объемный расход * Концентрация
= 0,464 м / с * 2,2 * 10 -4 кг / м
= 1,02 * 10 -4 кг / с
Годовой выпуск= 1.02 * 10 -4 кг / с * (241 * 8 * 3600) с
= 708,52 кг
Q5. Рассмотрим единичный процесс, использующий химический x для производства продукта. В год 4540 кг. химического x используется для произвести 10896 кг продукта, содержащего 25% химического вещества x по весу. Вход состоит из 3632 кг закупленных химикатов x и 908 кг, собранных из переработка отходов. В результате этого процесса образуется 5 тонн или 4540 кг твердых отходов, содержащих 15% (681 кг) химиката x. Единственный другой единичный процесс — это технологическая вентиляция, которая испускает неизвестное количество химического вещества x в атмосферу.Вычислить вентиляционные потери до воздуха.
ДАННЫЕ:
A I = Исходное количество = 3632 кг / год
A R = Количество вторичного использования = 908 кг / год
A P = Количество продукта = 25% от 10896 кг / год
A Вт = Количество отходов = 681 кг / год
и A A = Потери на выходе из воздуха
ТРЕБУЕТСЯ:
Потери в воздух
РЕШЕНИЕ:
по массовому балансу,
A I + (A R ) = A P + A W + А А + (А R )
Итак, потери на выходе из воздуха (A A ) = 3632 (.25 * 10896) 681 = 227 кг / год
Q6. Кислота плавиковая производится путем реакции плавикового шпата с серной кислотой. Завод производит 55 * 10 6 кг кислоты в год. Оценить выбросы фторидов для следующих кейсы:
| Нет контроля выбросов использовал. | |
| скруббер для отходов используется для
контрольные выбросы фторидов снижены до 0.0908 кг (90,8 г) фторидов
на 1000 кг кислоты. Коэффициент выбросов АП-42 составляет 22,7 кг фтора / 1000 кг. кислоты продукт. |
ДАННЫЕ:
Коэффициент выбросов AP-42 = 22,7 кг фторида / 1000 кг полученной кислоты
Производство кислоты / год = 55 * 10 6 кг / год
ТРЕБУЕТСЯ:
Выбросы фторидадля следующих случаев:
| Контроль за выбросами не используется. | |
| Скруббер для отходов используется для контроля фторида.
выбросы снижены до 0,0908 кг (90,8 г) фторидов на 1000 кг кислоты. |
РЕШЕНИЕ:
Выбросы фторидов без контроля = 55 * 10 6 *
(22,7 / 1000)
= 1,25 * 10 6 кг / год
Коэффициент выбросов для управления скруббером = 0.0908 кг фтора / 1000 кг кислоты произведено
Итак, контролируемый выброс фторида = 55 * 10 6 * (0,0908 / 1000)
= 4994 кг / год
Q7. Выбросы в атмосферу от доменной печи завода по плавке первичного свинца контролируются системой тканевых фильтров. Рассчитайте годовой выброс твердых частиц для годового производства 31,5 * 10 6 кг свинца. Предположим, что эффективность системы тканевых фильтров составляет 97%. Оценка годовых выбросов индивидуальных токсичные соединения с использованием профиля № 29302
ДАННЫЕ:
Коэффициент выбросов = 164 кг / 1000 кг произведенного свинца
Эффективность тканевой фильтровальной системы = 97%
Годовое производство свинца = 31,5 * 10 6 кг
ТРЕБУЕТСЯ:
Годовые выбросы индивидуальных токсичных соединений по профилю № 29302
РЕШЕНИЕ:
Пониженный коэффициент выбросов = (1- эффективность фильтра) * Уровень выбросов
= (1 — 0.97) * 164
= 4,92 кг / 1000 кг свинца
Годовое производство свинца = 31,5 * 10 6 кг
Общий годовой выброс твердых частиц = 31,5 * 10 6 * (4,92 / 1000) кг / год = 154980 кг / год
По профилю № 29302 , годовой выброс индивидуальных токсичных соединений приведена в таблице ниже.
СОЕДИНЕНИЕ | % ЧАСТИЦ | ГОДОВОЙ ВЫБРОС (кг) |
Хром | 0.02 | 31,0 |
Никель | 0,06 | 93,0 |
Медь | 0,35 | 542,4 |
цинк | 15,20 | 23557.0 |
Кадмий | 23,1 | 35800.0 |
Свинец | 30,7 | 47579,0 |
Q8. Технологический сосуд, содержащий 5 мас. % А, 15 мас. % B и 80 мас. % C выбрасывается в атмосферу. Скорость разряда через вентиляционное отверстие было измерено на 0.142 м 3 / мин при 21,11 o C. Технологический резервуар находится в эксплуатации 200 дней в году. При 0 o C, 0,454 кг-моль газа занимает 10,05 м3 3 . Рассчитать годовой выпуск химического вещества A с точки зрения молекулярной массы и давления на выходе.
ДАННЫЕ:
Состав = 5 мас. % А, 15 мас. % B и 80 мас. % C
Объем = 0,142 м 3 / мин, Температура = 21,11 o C
Технологический резервуар находится в эксплуатации 200 дней в году.
При 0 o C 0,454 кг-моль газа занимает 10,05 м3 3
ТРЕБУЕТСЯ:
Ежегодный выброс химического вещества A с точки зрения молекулярной массы и давления вентиляция.
РЕШЕНИЕ:
Доля A в газовой фазе, X AG = (Парциальное давление A / Всего Давление) = P A / P Вентиляционное отверстие
Объем, занимаемый 0,454 кг-моль A при 0C = 10,05 м
Объем, занимаемый 1 кг-моль A @ 21.11С = 10,05 * {(273 + 21,11) / (273)} / 0,454
= 23,85 м
Плотность A = (молекулярная масса / объем, занимаемый 1 кг-моль) кг / м
Годовой выпуск A = P A * Плотность * Скорость выброса * Время разрядка в минутах
= X AG * P Вентиляционное отверстие * (Мол. Масса / 23,85) * 0,142 * (200 * 24 * 60)
= 1714.82 * X AG * P Вентиляционное отверстие * Мол. Вес
Q9. Химический завод использует бензол и имеет шесть трубопроводных клапанов, три клапана с открытым концом, четыре фланца, два насоса, один компрессор и один предохранительный клапан. Завод работает круглосуточно 250 дней / год. Оценить неорганизованные выбросы, используя два метода s. Укажите свой предположения.
Допущение: бензол легкая жидкость
Средний коэффициент выбросов SOCMI:
Неорганизованный источник выбросов | Коэффициент выбросов (фунт / час) | Кол-во шт. |
Трубная арматура | 0.016 | 6 |
Клапаны с открытым концом | 0,0037 | 3 |
Фланцы | 0,0018 | 4 |
Насосы | 0,11 | 2 |
Компрессор (уплотнение) | 0.5 | 1 |
Клапаны сброса давления | 0,23 | 1 |
Общий объем выбросов в год = (Σ (Количество единиц * Выбросы Фактор)) * Время
= 1,064 * (250 * 24)
= 6384 фунтов / год
Q10. Оценить эффективность сбора для фторидного скруббера на установке получения фосфорной кислоты мокрым способом.Завод должен соответствуют норме выбросов 10 г / метрическая тонна P 2 O 5 корма. Неконтролируемые выбросы составляют около 0,12 кг фторидов на метр. тонн корма P 2 O 5 .
ДАННЫЕ:
Выбросы от завода = 0,12 кг / метрическая тонна P 2 O 5
Нормы выбросов = 0,01 кг / метрическая тонна P 2 O 5
ТРЕБУЕТСЯ:
Эффективность сборадля фторидного скруббера
РЕШЕНИЕ:
Эффективность сбора скруббера
= (Неконтролируемая эмиссия — Контролируемая эмиссия) / Неконтролируемая эмиссия
= (0.12 0,01) кг / 0,12 кг
= 0,92
= 92%
Q11. Определите общую эффективность
на основе массы с использованием следующего распределения по размерам и эффективности сбора
данные.
ЭФФЕКТИВНОСТЬ | ||||
<0.50 | 0,25 | 0,1 | 0,1 | 8,1 |
> 0,50 - 1,50 | 1.01 | 0,4 | 0,5 | 30.2 |
> 1,50 - 2,50 | 2,03 | 9,5 | 10,0 | 47,5 |
> 2,50 - 3,50 | 3,01 | 20.0 | 30,0 | 60,4 |
> 3,50 - 4,50 | 4,01 | 20,0 | 50,0 | 68,5 |
> 4,50 - 5.50 | 5,04 | 15,0 | 65,0 | 75,2 |
> 5,50 - 6,50 | 6,02 | 11,0 | 76,0 | 81.1 |
> 6,50–7,50 | 7,01 | 8,0 | 84,0 | 86,1 |
> 7,50 - 8,50 | 8,01 | 5.5 | 89,0 | 89,5 |
> 8,50 - 11,50 | 10,02 | 5,5 | 95,0 | 95,1 |
> 11.50 - 16,50 | 14.01 | 4,0 | 99,0 | 98,1 |
> 16,50–23,50 | 20.01 | 0,8 | 99,8 | 99.1 |
> 23,50 | 0,2 | 100,0 | 99 + |
РЕШЕНИЕ:
Общая эффективность = Σ (% веса * сбор КПД)
= (0.1 * 8,1 + 0,4 * 30,2 + 9,5 * 47,5 + 20 * 60,4 + 20 * 68,5 + 15 * 75,2 + 11 * 81,1 + 8 * 86,1 + 5,5 * 89,5 + 5,5 * 95,1 +
4 * 98,1 + 0,8 * 99,1 + 0,2 * 99) / 100
= 72,58%
Q12. Расчет газофазного переноса коэффициент для лужи диаметром 12 м, образовавшейся при разрыве водорода бак фтора (70%). Средняя скорость ветра составляла 5 м / сек.
ДАННЫЕ: Скорость ветра = 5 м / с
ТРЕБУЕТСЯ: Коэффициент газофазного переноса
РЕШЕНИЕ:
Коэффициент массопередачи, k м (м / с) = 0.00482 * N Sc -0,67 * U 0,78 * d -0,11
Где, N Sc = Номер Шмидта = Кинематическая вязкость / Молекулярная Коэффициент диффузии
U = Скорость ветра (м / с)
d = Диаметр бассейн (м)
2 nd формула : k м (фут / с) = 0,25 * 10 -2 * U 0,78 (фут / с) * (18 / мол. Вес) 1/3
3 rd формула : k м (фут / с) = 0.002 * U 0,78 (фут / с)
По формуле 3 rd , k m = 0,002 * (5 * 3,2808) 0,78
= 0,018 фут / с
Используя формулу 2 nd , k m = 0,25 * 10 -2 * (5 * 3,2808) 0,78 (фут / с) * (18/20) 1/3 {Мол. Вес. = 20}
= 0,021 фут / с
Q13. Рассчитайте скорость испарения фтористый водород из бассейна, образовавшийся ранее.
ДАННЫЕ: k м = 0,0064 м / с
ТРЕБУЕТСЯ: Скорость испарения
РЕШЕНИЕ:
Скорость испарения, E = (k м * P * Мол. Вес) / (R * T a )
Где, E в кг / м / с
k m = коэффициент массопереноса (м / с)
P = Давление паров химического вещества при температуре поверхности (Н / м)
R = Gas Const.(8,314 Дж / моль / К)
T a = Окружающая температура (K)
P @ 25C = 20 КПа = 20000 Н / м
Т а = 298 К
Итак, E = (0,0064 * 20000 * 20) / (8,314 * 298)
= 0,001033 кг / м / с
Криогенные жидкости
КонтейнерыКриогенные жидкости можно транспортировать, хранить и обрабатывать в различных контейнерах в зависимости от количества и желаемого использования.Все три типа контейнеров присутствуют в Принстонском университете.
ДьюарсДьюары - это контейнеры с двойными стенками, не находящиеся под давлением, используемые для хранения криогенных жидкостей. Между стенами находится высокий вакуум для максимальной теплоизоляции. Они имеют неплотно прилегающую изолированную крышку, которая позволяет газам выходить, предотвращая скопление влаги на шее. Во многих случаях они используются в «вспомогательных» контейнерах с криогенной жидкостью в лаборатории.
Сосуды Дьюара - это небольшие криогенные контейнеры с двойными стенками для хранения, которые обычно поддерживают жидкость только в течение нескольких часов.Обычно они имеют металлическую внешнюю стенку и внутреннюю стеклянную стенку с пустым пространством под высоким вакуумом. При обращении следует соблюдать особую осторожность, поскольку эти колбы могут взорваться.
Цилиндры для криогенных жидкостейЦилиндры для криогенных жидкостей, иногда также называемые Дьюарами, представляют собой изолированные сосуды под давлением с вакуумной рубашкой. Они оснащены предохранительными клапанами и разрывными дисками для уменьшения повышения давления. Эти баллоны бывают разных размеров от 80 до 450 литров.Они могут быть оборудованы для подачи газа через внутренний испаритель или подачи жидкости под собственным внутренним давлением пара. Эти баллоны обычно заполняются пользователями на заправочных станциях по всему университетскому городку. При наполнении и разгрузке все пользователи должны носить соответствующие СИЗ. Криогенные цилиндры обычно сбрасывают внутреннее давление, и вы можете наблюдать внезапный шипящий звук и появление тумана. Это совершенно нормально. При использовании криогенных баллонов пользователи должны убедиться, что все клапаны и устройства сброса давления находятся на своих местах и находятся в хорошем состоянии.Если устройства сброса давления выйдут из строя, это может привести к катастрофическому отказу.
Криогенные резервуары для храненияВ нескольких зданиях кампуса есть криогенные резервуары. Они заполняются поставщиками по установленному графику и используются для наполнения крогенных цилиндров и сосудов Дьюара для конечных пользователей.
Молярный объем газа
Молярный объем газа РАСЧЕТЫ ПО ФОРМУЛАМ
7.6 - Молярный объем газа
Когда молярная масса ЛЮБОГО газа делится на
плотность газа на СТП получается значение 22,4.
Вот несколько примеров:
| Газ | Молярная масса (г / моль) | Плотность по стандарту STP (г / л) | Молярная масса / плотность (л / моль) |
|---|---|---|---|
| N 2 , газообразный азот | 28.014 | 1,25 | 22,4 |
| O 2 , газообразный кислород | 31,998 | 1,43 | 22,4 |
| CH 4 , газ метан | 16.043 | 0,714 | 22,4 |
| CO 2 , диоксид углерода | 44,009 | 1,96 | 22,4 |
| H 2 , газообразный водород | 2.015 | 0,090 | 22,4 |
| Ar, газ аргон | 39,948 | 1,78 | 22,4 |
Давайте разберемся, что такое единицы «22.4 "- автор размерный анализ (см. раздел 1.4).
'22,4 ' имеет единицы литр / моль. Эта величина известна как молярный объем газа на СТП. Когда 1 моль газа при 0 ° C и 1 атм (или условиях STP) объем, который занимает газ всегда 22,4 л.
Характеристики твердого, жидкого и газообразного состояний
в разделах 1.3 и 2.5A3, мы отметили, что физические свойства конкретного вещества определяют его состояние при комнатной температуре. Если и его нормальная температура плавления, и его нормальное кипение температура ниже комнатной (20 ° C), при нормальной температуре вещество является газом. условия. Нормальная температура плавления кислорода - 218 ° C; его нормальное кипение точка -189 ° C. Кислород - это газ при комнатной температуре. Если нормальное плавление точка вещества ниже комнатной температуры, вещество является жидкостью при комнатная температура.Бензол плавится при 6 ° C и кипит при 80 ° C; это жидкость при комнатной температуре. Если и нормальная температура плавления, и нормальное кипение точки выше комнатной температуры, вещество твердое. Натрия хлорид плавится при 801 ° C и кипит при 1413 ° C. Хлорид натрия - твердое вещество под нормальные условия. Рисунок 9.1 иллюстрирует взаимосвязь между физическими состояние и нормальные температуры плавления и кипения.
| РИСУНОК 9.1 Физическое состояние относительно нормальных точек плавления и кипения.Обратите внимание, что твердые вещества плавятся и кипят выше комнатной температуры, жидкости плавятся ниже комнатной температуры и кипят выше комнатной температуры, а газы плавятся и кипят ниже комнатной температуры. |
A. Форма и объем
Твердое тело имеет фиксированную форму и объем, которые не меняются вместе с формой его контейнера. Подумайте о камне и о том, что его размер и форма остаются неизменными, независимо от того, куда вы его положите. Жидкость имеет постоянный объем, но ее форма соответствует форме емкости.Рассмотрим образец молока. Его объем остается неизменным, кладете ли вы его в блюдце для кошки или в стакан для себя; ясно, что его форма меняется, чтобы соответствовать форме контейнера. Газ меняет свою форму и объем, чтобы соответствовать форме и объему своего сосуда. Рассмотрим образец воздуха. Он заполнит пустую комнату, воздушный шар, шину или резиновый плот. Его форма и объем соответствуют форме и объему контейнера, в который он помещен. Рисунок 9.2 иллюстрирует эти моменты.
| РИСУНОК 9.2 Постоянство объема, формы и массы в трех состояниях материи: (а) твердое, (б) жидкое, (в) газообразное. |
Б. Плотность
Плотность жидкостей и твердых веществ измеряется в граммах на миллилитр и граммах на кубический сантиметр, соответственно, и очень мало изменяется при изменении температуры образца. Газы имеют гораздо меньшую плотность, настолько низкую, что плотность газа измеряется в граммах на литр, а не в граммах на миллилитр.Плотность газа значительно меняется при изменении температуры газа. В таблице 9.1 показаны плотности трех обычных веществ, по одному в каждом из трех физических состояний, при двух разных температурах.
| Плотность при 20 ° C | Плотность при 100 ° C | |
|---|---|---|
| твердое вещество: хлорид натрия | 2.16 г / см 3 | 2,16 г / см 3 |
| жидкость: вода | 0,998 г / мл | 0,958 г / мл |
| газ: кислород | 1,33 г / л | 1,05 г / л |
C. Сжимаемость
Объем твердого тела или жидкости не очень сильно меняется под давлением.Ты
не может изменить объем кирпича, сжимая его, ни вы не можете сжать один
литр жидкости в бутылку емкостью 0,5 л. Объем газа действительно сильно меняет
справляться с давлением; Вы можете втиснуть баллон объемом 1,0 л в пространство объемом 0,5 л.
D. Выводы о межмолекулярной структуре
Постоянная форма и объем твердого тела позволяют предположить, что его частицы (атомы,
ионы или молекулы) удерживаются вместе довольно жесткими связями. Изменяемая форма
и постоянный объем жидкости предполагают, что между ее
частиц, но эти связи не жесткие и, вероятно, менее прочные, чем
те в твердом.Тот факт, что газ не имеет ни постоянной формы, ни постоянного
объем предполагает, что нет никаких связей и только очень незначительные взаимодействующие силы
между частицами газа. Разнообразие сжимаемости предполагает другие
гипотезы. Если твердые тела и жидкости нельзя сжать, частицы которых
они должны быть составлены очень близко друг к другу. Высокая сжимаемость
газ подразумевает, что частицы газа очень далеко друг от друга и
пространства между ними.Эта последняя гипотеза подтверждается различием между
плотности твердых тел и жидкостей и плотности газов. Один мл
твердое или жидкое вещество всегда имеет массу намного больше, чем один миллилитр газа.
Вязкость и плотность обычных анестезирующих газов: значение для измерения потока | BJA: Британский журнал анестезии
Абстрактные
Хотя вязкость (µ) является решающим фактором при измерении потока с помощью пневмотахографа, а плотность (ρ) также играет роль в присутствии турбулентного потока, эти материальные константы недоступны для летучих анестетиков, обычно применяемых в клинической практике. .Таким образом, мы экспериментально определили μ и ρ чистых летучих анестетиков. Входное сопротивление полиэтиленовой трубки с жесткими стенками ( Z т) было измерено, когда трубка была заполнена различными смесями газов-носителей (воздух, 100% кислород, 50% кислорода + 50% азота), к которым применялись разные концентрации летучих анестетиков. Были добавлены ингаляционные агенты (галотан, изофлуран, севофлуран и десфлуран). µ и ρ были рассчитаны из действительной и мнимой частей Z t, соответственно, с использованием соответствующих физических уравнений.Для оценки µ и ρ чистых летучих веществ применялась множественная линейная регрессия. Значения вязкости чистых летучих веществ были заметно ниже, чем у кислорода или азота. Однако клинически применяемые концентрации не оказали заметного влияния на вязкость газовой смеси (максимальное снижение µ для 2 MAC десфлурана составляет 3,5%). Напротив, все летучие вещества значительно влияют на ρ даже при обычно используемых концентрациях. Наши результаты показывают, что состав газа-носителя имеет большее влияние на вязкость, чем количество и природа летучего анестетика, тогда как на плотность больше влияют концентрации летучих агентов.Таким образом, потребность в поправочном коэффициенте при измерениях потока с помощью пневмотахографа в гораздо большей степени зависит от газа-носителя, чем от концентрации вводимого летучего агента, хотя последний может играть роль в конкретных экспериментальных или клинических условиях.
Br J Anaesth 2001; 87 : 602–7
Принято к публикации: 4 июня 2001 г.
Пневмотахограф - наиболее распространенное устройство, используемое для измерения потока в респираторной механике. Измерение расхода с помощью пневмотахографа основано на принципе определения перепада давления на резистивном элементе внутри устройства.В условиях ламинарного потока перепад давления (также называемый перепадом давления) пропорционален расходу, а также вязкости газа (µ). Таким образом, изменения µ влияют на скорость потока, измеряемую пневмотахографом резистивного типа.12 Плотность газа (ρ) также влияет на измерения потока в условиях турбулентного потока3 или когда поток оценивается с помощью лопастных ротаметров. Кроме того, на измерение давления с помощью датчиков давления, расположенных сбоку, влияет плотность газа через явление Бернулли.4
Хотя вязкости и плотности газов-носителей (воздух, кислород и закись азота) можно извлечь из физических таблиц, 5 и данные о плотности летучих анестетиков могут быть рассчитаны на основе их молекулярной структуры, значения вязкости для Газы-носители, содержащие различные концентрации испаренных летучих анестетиков, недоступны и не могут быть легко выведены из теоретических физических уравнений. Следовательно, неизвестно, как обычно используемые летучие ингаляционные агенты в различных концентрациях влияют на измерения потока с помощью пневмотахографа резистивного типа.Поэтому цель настоящего исследования состояла в том, чтобы экспериментально определить, влияют ли различные концентрации клинически вводимых летучих анестетиков на вязкость и плотность газовых смесей, обычно применяемых при анестезиологическом лечении респираторных заболеваний, и, следовательно, оценить степень, в которой количества различные компоненты влияют на измерения расхода с помощью пневмотахографа.
Методы
Принцип измерения
Чтобы определить вязкость и плотность анестезирующих газов, мы измерили входное сопротивление полиэтиленовой трубки с жесткими стенками ( Z т), когда трубка была заполнена различными газовыми смесями.Поскольку Z t можно рассматривать как последовательно независимые от частоты сопротивление и инертность, действительная часть Z t отражает сопротивление трубки, а мнимая часть (или реактивное сопротивление, X ), которое линейно увеличивается с частоту можно отнести к инерционному действию газа ( X = j ω I , где ω - угловая частота, I - инертность, а j - мнимая единица √ – 1). На низких частотах, для которых все еще действует закон Пуазейля, действительная часть Z t (сопротивление, R ) линейно связана с вязкостью остаточного газа в трубке ( R = 8µ l / r 4 π, где l и r - длина и радиус трубки соответственно).Кроме того, существует линейная зависимость между мнимой частью Z t и плотностью газа в трубке ( X = n ωρ l / A , где ω - угловая частота, и A - это площадь поперечного сечения трубки, а n составляет 4/3 в случае параболического профиля скорости и 1, если профиль скорости тупой) .6 Соответственно, и μ, и ρ любого газа в трубке с известной геометрией можно определить экспериментально, измерив Z t.
Измерительная аппаратура
Мы применили экспериментальный метод Лючена и его коллег для измерения Z t.7 Этот метод позволил нам определить Z t в широком диапазоне частот, чтобы гарантировать справедливость закона Пуазейля, а также позволил нам поменять резидентный газ в трубке. Схема измерительной установки представлена на рисунке 1. Система громкоговорителя в коробке генерирует псевдослучайный форсирующий сигнал малой амплитуды в коробке из оргстекла с жесткими стенками ( V box = 1.6 литров). Колебательный сигнал содержал семь частотных составляющих в диапазоне 0,117–6,04 Гц. Компоненты в форсирующем сигнале были выбраны в соответствии с правилом отсутствия суммы-отсутствия разности8, чтобы минимизировать эффекты нелинейностей и перекрестных помех гармоник. В частности, в сигнал включались 2-я, 5-я, 11-я, 19-я, 31-я, 59-я и 103-я гармоники основной частоты (0,0586 Гц), амплитуда составляющих которых уменьшается с увеличением частоты. Жесткая полиэтиленовая пластиковая трубка ( l = 29 см, r = 1 мм) была пропущена через переднюю панель коробки, и два пластиковых пакета аналогичного размера были прикреплены к внутреннему и внешнему концам трубки.Так как мешки всегда были вялыми, например, давление в мешках было атмосферным, их влиянием на измерение импеданса можно было пренебречь.
Входной поток коробки ( V˙ ) измерялся экранным пневмотахографом, подключенным к датчику дифференциального давления ICS 33NA002D. Давление в коробке ( P b) по отношению к атмосфере определялось идентичным датчиком давления. Сигналы P b и V˙ подвергались фильтрации нижних частот с частотой 25 Гц и дискретизировались при 120 с –1 с 12-битной аналого-цифровой платой IBM-совместимого компьютера.
Процедура
Все измерения были выполнены в одной лаборатории с контролируемым климатом при постоянных атмосферных условиях (970 гПа), стабильной температуре (23 ° C) и влажности. Перед каждым колебательным измерением два мешка опустошали, подвергая их воздействию прямого вакуума до полного разрушения. В начале эксперимента было измерено полное сопротивление системы коробка-трубка ( Z c), когда пластиковые пакеты и трубка были заполнены воздухом.Затем как пластиковые пакеты, так и трубка были заполнены различными концентрациями различных ингаляционных анестетиков по очереди (галотан, изофлуран, севофлуран и десфлуран) в 100% кислороде, в смеси 50% кислорода + 50% азота или в смеси. 21% кислорода + 79% азота (воздух). Концентрация летучих веществ варьировалась от 0,75 до 4% для галотана, от 1,25 до 5,4% для изофлурана, 2 и 9% для севофлурана и от 6 до 18% для десфлурана путем измерения четырех различных концентраций каждого в этих диапазонах для каждого летучего газа. .Максимальные концентрации были ограничены физическими характеристиками испарителей. Газовые смеси были созданы из наркозного аппарата путем пропускания 6 литров газа-носителя через испаритель; на выходе брали пробы в количестве 200 мл мин. –1 с помощью монитора Datex AS3, пока не было достигнуто установившееся измерение. После этого и пластиковые пакеты, и трубка были заполнены полученной смесью через трехходовой кран. Перед колебательными измерениями концентрацию каждого компонента в газовой смеси в мешках анализировали с помощью монитора Datex AS3, который калибровали перед каждым использованием.Для каждой газовой смеси было выполнено четыре серии измерений, четыре полученные кривые были усреднены и использованы для дальнейших анализов (см. Ниже). После серии измерений с каждой газовой смесью внешний конец трубки закупоривали и определяли импеданс закрытого ящика ( Z b).
Анализ данных и статистика
Быстрое преобразование Фурье использовалось для вычисления Z c ( P b / V˙ с открытой трубкой) и Z b ( P b / V˙ с закрытой трубкой) от 30 Длительные записи с использованием 17-секундного временного окна и 95% перекрытия.Поскольку Z c состоит из Z b и Z t, включенных параллельно, Z t было вычислено путем параллельного удаления Z b из Z c: Z t = Z b Z c / ( Z b - Z c).
Наш анализ данных предполагает, что плотность и вязкость газовой смеси изменяются линейно со значениями плотности и вязкости чистых составляющих газов. Линейность плотности обязательно относится к смесям идеальных газов, и можно предположить, что отклонения от линейности не играют существенной роли при оценке вязкости.Поэтому для оценки значений вязкости и плотности чистых составляющих газов использовался множественный линейный регрессионный анализ, рассматривая значения вязкости или плотности газовых смесей как зависимые, а количество составляющих газов как независимые переменные. Неопределенности в оценках параметров выражались в виде значений se.
Результаты
Типичные данные входного импеданса
Реальная и мнимая части импеданса трубки, определенные экспериментально при заполнении системы воздухом или 100% кислородом, представлены на рисунке 2.Измеренные действительные части для обоих газов не зависели от частоты в применяемом диапазоне, тогда как реактивные сопротивления линейно увеличивались с увеличением частоты.
Вязкость и плотность чистых составляющих газов
Значения вязкости и плотности чистых компонентов анестезирующих газов показаны в таблицах 1 и 2, соответственно. Значения вязкости чистых летучих агентов обычно ниже, чем у газов-носителей. Напротив, для летучих веществ были получены значительно более высокие значения плотности, чем для газов-носителей.
Вязкость и плотность обычно используемых газовых смесей
Значения вязкости и плотности газовых смесей, обычно используемых в анестезиологической практике, приведены в таблицах 3 и 4 соответственно. Клинически применяемые концентрации летучих веществ имеют относительно небольшое, хотя и систематическое, влияние на значения вязкости газовых смесей с максимальным снижением вязкости на 3,3–3,5% при 2 ПДК десфлурана. Однако на значения плотности обычных смесей анестезирующих газов заметно повлияли летучие агенты с максимальным увеличением плотности 47.5% при 2 ПДК десфлурана в воздухе. Значительные изменения с десфлураном возникают из-за высоких концентраций 1 и 2 ПДК для этого агента, а не из-за необычно отклоняющихся значений вязкости и плотности.
Обсуждение
В настоящем исследовании были определены вязкость и плотность газов, обычно используемых в анестезиологической практике. Мы продемонстрировали, что значения вязкости обычных летучих веществ заметно ниже, чем у газов-носителей, обычно применяемых при анестезиологическом лечении.Поскольку в клинической практике летучие агенты вводятся в очень низких концентрациях, их суммарное влияние на вязкость и, следовательно, на измерение потока с помощью пневмотахографа не превышает 4% для обычно используемых смесей анестезирующих газов. На плотность обычных смесей анестезирующих газов заметно влияло присутствие летучих веществ даже в клинически применяемых концентрациях с возможным увеличением плотности почти на 50%.
Методические вопросы
Прежде чем обсуждать значение настоящих результатов, касающихся измерения механики дыхания, необходимо рассмотреть некоторые методологические вопросы.Во-первых, оценки параметров предполагают, что измерения проводились при наличии ламинарного потока в трубе.6 Чтобы проверить это предположение, мы вычислили число Рейнольдса ( Re = rv ρ / µ) из наших экспериментов, вычислив осевая скорость ( v ) из измерений потока на входе в пластиковый бокс. Этот расчет показал, что числа Рейнольдса были ниже (130–140), чем критическое значение (1160). Таким образом, можно сделать вывод, что в трубке возник ламинарный поток, и, таким образом, использование уравнения Пуазейля для оценки вязкости было целесообразным.
Во-вторых, исходя из физических принципов, R для жесткой трубки увеличивается с увеличением частоты колебаний.10 Таким образом, если это явление оказывает значительное влияние, мы должны переоценивать вязкость, так как закон Пуазейля справедлив для низких частот. . В этом исследовании действительная часть всегда почти полностью не зависела от частоты (например, рис. 2). Следовательно, усреднение значений R по исследованному диапазону частот, по-видимому, не внесло какой-либо систематической ошибки в оценку вязкости.Кроме того, I жесткой трубки немного уменьшается с увеличением частоты колебаний.10 В этом исследовании мы наблюдали почти идеальное линейное увеличение X в исследованном диапазоне частот. Таким образом, в наших измерениях инертность также может считаться частотно-независимой и может использоваться для оценки плотности остаточной газовой смеси в трубке.
Действительность и точность
Поскольку анализ, примененный в настоящем исследовании, дает значения вязкости и плотности для газов-носителей (чистый кислород и азот), сравнивая наши значения со значениями в справочных таблицах9 (последние скорректированы на температуру 23 ° C и атмосферное давление 970 гПа) дает информацию о надежности техники, использованной в настоящем исследовании.Значения вязкости для кислорода и азота, определенные экспериментально в настоящем исследовании, очень близки к их эталонным значениям (разница составляет 1,7 и 0,9% соответственно), что позволяет предположить, что значения вязкости других чистых составляющих газов также могут быть надежными. Однако значения плотности как для азота, так и для кислорода немного занижены (6,7 и 1,5% соответственно). Эта небольшая недооценка, скорее всего, из-за небольшого искажения параболического профиля скорости, особенно на входе и выходе из трубы, что снижает коэффициент n с 4/3 до 1 в уравнении, связывающем инертность с плотность6 (см. выше).Соответственно, можно ожидать занижения на 1–7% всех значений плотности, представленных в настоящем исследовании.
Точность оценок кислорода и азота в данном эксперименте превосходна со стандартными ошибками менее 2%. Тем не менее, наши оценки вязкости и плотности летучих ингаляционных агентов показывают более низкую точность. В настоящем исследовании концентрация доставляемых летучих веществ ограничивалась физической емкостью испарителей. Таким образом, экстраполяция физических параметров для чистых летучих газов была основана на измерениях, когда эти агенты присутствовали только в очень низких концентрациях.Действительно, точность нашей оценки заметно увеличивалась с увеличением концентрации летучих агентов в газе-носителе, с самой низкой точностью для галотана (максимальная концентрация 4%) и самой высокой для десфлурана (максимальная концентрация 18%).
Последствия
Измерение расхода чувствительно к вязкости газа, так как падение давления на резистивном элементе пневмотахографа (экран или Флейш) линейно связано с этим параметром.3 Таким образом, уменьшение вязкости газа занижает реальный расход и завышает оценку сопротивление и эластичность, и наоборот.Соответственно, без применения поправочного коэффициента это явление искажает результаты исследований по механике дыхания. В недавних публикациях после изменения природы вдыхаемого газа к измерениям потока не применялся поправочный коэффициент, что могло в некоторой степени смещать их результаты1112
В настоящем исследовании, как и ожидалось, вязкость носителя газ значительно увеличился, когда содержание кислорода увеличилось. Следовательно, калибровка пневмотахографа воздухом и использованием другого газа-носителя с высоким содержанием кислорода приведет к недооценке механических параметров органов дыхания.Однако для данного газа-носителя присутствие летучего агента в низкой концентрации вряд ли существенно повлияет на результирующую вязкость. Таким образом, наши результаты предполагают, что эффект изменения вязкости в результате введения летучего агента может не быть физиологически значимым (приблизительно 4% максимум), когда однократное считывание респираторного механического параметра производится в данной клинической обстановке. Однако, когда повторные измерения выполняются в исследованиях на животных или в клинических условиях для сравнения различных агентов или популяций, может быть важно учитывать изменения вязкости в различных газовых смесях при оценке механики дыхания в различных экспериментальных условиях.13 Учитывая, что мы определили значения вязкости чистых летучих веществ, можно оценить влияние измененной вязкости на измерение потока, и в будущих исследованиях важность применения поправочного коэффициента будет зависеть от конкретных условий эксперимента.
На плотность газовой смеси влияло количество как кислорода, так и летучих веществ (Таблица 4). Хотя плотность газа в легких не играет очень существенной роли в большинстве экспериментальных условий, этот физический параметр может влиять на измеряемые механические параметры через эффект Бернулли при измерениях бокового давления4 и / или в случае турбулентного потока.614 Можно отметить, что, поскольку измерение расхода с помощью пневмотахографа основано на обнаружении перепада давления между двумя портами, влияние плотности через эффект Бернулли нивелируется при таких измерениях перепада давления. измерение давления в отверстии дыхательных путей с большей вероятностью зависит от эффекта Бернулли и, следовательно, от плотности. Кроме того, плотность влияет на измерения расхода в условиях турбулентности, когда число Рейнольдса превышает критическое значение.14 В связи с этим Бейтс и его коллеги4 предложили экспериментальный метод определения поправочного коэффициента, который будет применяться при высоких числах Рейнольдса. Наши измерения указывают на необходимость такой коррекции, если содержание кислорода или концентрация летучих веществ внутригрудного газа изменяется во время экспериментальной процедуры.
В заключение мы применили методику измерения7 для определения физических свойств летучих агентов, обычно применяемых при анестезиологическом лечении.Измерения были подтверждены сравнением значений вязкости и плотности кислорода и азота с их эталонными значениями.9 Мы пришли к выводу, что летучие вещества в обычно используемых клинических концентрациях незначительно влияют на вязкость газовой смеси. Однако содержание кислорода в газе-носителе и природа летучего анестетика существенно влияют на плотность газовой смеси. Таким образом, наши результаты предполагают, что следует уделять внимание составам обычно используемых ингаляционных анестезирующих газов во время респираторных механических измерений; Применение газозависимого поправочного коэффициента может быть необходимо для точных измерений расхода с помощью пневмотахографа резистивного типа.
Благодарности
Эта работа была выполнена в отделении детской анестезии Женевской детской больницы, Женева, Швейцария. Работа поддержана грантом Швейцарского национального научного фонда 3200‐056717.99 / 1 и Венгерским грантом на научные исследования OTKA T30670.
Рис. 1 Измерительная установка. П б, коробка напорная; ПТГ, пневмотахограф; V˙ коробчатый поток.
Рис. 1 Измерительная установка. П б, коробка напорная; ПТГ, пневмотахограф; V˙ коробчатый поток.
Рис. 2 Значения сопротивления ( R ) и реактивного сопротивления ( X ) для воздуха и кислорода (пунктирные линии указывают рассчитанные значения сопротивления и реактивного сопротивления, а непрерывные линии представляют значения сопротивления и реактивного сопротивления, измеренные с помощью данного набора -вверх). Планки погрешностей представляют SD.
Рис. 2 Значения сопротивления ( R ) и реактивного сопротивления ( X ) для воздуха и кислорода (пунктирные линии указывают рассчитанные значения сопротивления и реактивного сопротивления, а непрерывные линии представляют значения сопротивления и реактивного сопротивления, измеренные в настоящее время. настраивать).Планки погрешностей представляют SD.
Таблица 1Вязкость обычно используемых анестезирующих газов. Цифры в скобках: справочные значения (9). Все значения приведены при температуре 23 ° C и атмосферном давлении 970 гПа
| Среднее (Па с × 10 –5 ) | se оценки | ||||
| Азот | 1.812 (1,781) | 0,0082 | |||
| Кислород | 1,999 (2,018) | 0,0073 | |||
| Галотан | 1,249 | 0,3529 | |||
| Изофлуран | 0,89214 | 0,25 Изофлуран | 0,89214 | 0,25 1,276 | 0,1688 |
| Десфлуран | 1,452 | 0,0706 |
| Среднее значение (Па с × 10 –5 3 сметы | |||||
| Азот | 1.812 (1,781) | 0,0082 | |||
| Кислород | 1,999 (2,018) | 0,0073 | |||
| Галотан | 1,249 | 0,3529 | |||
| Изофлуран | 0,89214 | 0,25 Изофлуран | 0,89214 | 0,25 1,276 | 0,1688 |
| Десфлуран | 1,452 | 0,0706 |
Вязкость обычно используемых анестезирующих газов.Цифры в скобках: справочные значения (9). Все значения приведены при температуре 23 ° C и атмосферном давлении 970 гПа
| Среднее значение (Па с × 10 –5 ) | se оценки | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азот | 1,812 (1,781) | 0,0082 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кислород | 1,999 (2,018) | 0,0073 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Галотан | 1.249 | 0,3529 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изофлуран | 0,892 | 0,2439 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Севофлуран | 1,276 | 0,1688 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Десфлуран | 1,452 | 03 0,07061,452 | 03 0,0706 1,452
Плотность обычно используемых анестезирующих газов при температуре 23 ° C и атмосферном давлении 970 гПа.Цифры в скобках: контрольные значения (ρ , ref ) преобразованы в 23 ° C и 970 гПа (ρ ref = ρ 0 P м T 0 / P 0 T м , где P м = 970 гПа, T 0 = 273 K, P 0 = 1010 гПа, T м = 300 K и ρ = 1,429 кг / м 3 для кислорода и ρ 0 = 1,25055 кг / м 3 для азота) (9)
Плотность обычно используемых анестезирующих газов при температуре 23 ° C и атмосферном давлении 970 гПа.Цифры в скобках: контрольные значения (ρ , ref ) преобразованы в 23 ° C и 970 гПа (ρ ref = ρ 0 P м T 0 / P 0 T м , где P м = 970 гПа, T 0 = 273 K, P 0 = 1010 гПа, T м = 300 K и ρ = 1,429 кг / м 3 для кислорода и ρ 0 = 1,25055 кг / м 3 для азота) (9)
Значения вязкости (Па · с × 10 –5 ) обычных смесей анестезирующих газов.Цифры в скобках: относительное изменение вязкости из-за введения летучих веществ. Значения ПДК для галотана, изофлурана, севофлурана и десфлурана составляют 0,75, 1,15, 2 и 7,25% соответственно
|

 Чаще всего причиной микроцитарной анемии является дефицит железа. Он может возникать из-за длительных кровопотерь, нарушения усвоения железа, недостаточного употребления мясных продуктов, а также из-за некоторых нарушений «сборки» гемоглобина, например при талассемии или при различных хронических заболеваниях (длительных инфекциях, онкологиях).
Чаще всего причиной микроцитарной анемии является дефицит железа. Он может возникать из-за длительных кровопотерь, нарушения усвоения железа, недостаточного употребления мясных продуктов, а также из-за некоторых нарушений «сборки» гемоглобина, например при талассемии или при различных хронических заболеваниях (длительных инфекциях, онкологиях).