Формула концентрации раствора в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Главная Справочник Формулы по химии Формула концентрации раствора
Определение и формула концентрации раствора
Наиболее распространены следующие способы выражения концентрации раствора.
Массовая доля – отношение (обычно – процентное) массы растворенного вещества к массе раствора:
w = msolute / msolution× 100%.
Например, 15: (масс.) водный раствор хлорида натрия – это такой раствор, в 100 единицах массы которого содержится 15 единиц массы NaCl и 85 единиц массы воды.
Молярная доля – это отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом молярная доля растворенного вещества (N2) равна:
N2 = n2 / (n1 + n2),
а молярная доля растворителя (N1):
N1 = n1 / (n1 + n2),
где n1иn2 – соответственно количество вещества растворителя и растворенного вещества.
Молярная концентрация, или молярность – отношение количества растворенного вещества к объему раствора:
СМ = n / V.
Обычно молярность обозначается СМили (после численного значения молярности) М. Так, 2М H2SO4 означает раствор, в каждом литре которого содержится 2 моля серной кислоты, т.е. СМ = 2 моль/л.
Моляльная концентрация, или моляльность – это отношение количества растворенного вещества к массе растворителя:
m = nsolute / msolvent.
Обычно моляльность обозначается буквой m. Так, для раствора серной кислоты запись m = 2 моль/кг (воды) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится 2 моля серной кислоты. Моляльность раствора в отличие от его молярности не изменяется при изменении температуры.
Нормальность раствора (нормальная концентрация, молярная концентрация эквивалента) СН(Х) – это отношение количества вещества эквивалента, содержащегося в растворе, к объему этого раствора [моль / м3]. На практике нормальность раствора по аналогии с молярной концентрацией выражают в моль/л. Так, например, с(H2SO4) = 1 моль/л, с(KOH) = 0,01 моль/л. При с(В) = 1 моль/л раствор называют нормальным, при с(В) = 0,01 моль/л – сантимолярным и т. д. Приняты и такие обозначения: 1 н. раствор H2SO4; 0,01 н. раствор KOH.
д. Приняты и такие обозначения: 1 н. раствор H2SO4; 0,01 н. раствор KOH.
Эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Моль вещества эквивалента содержит 6,02×1023 эквивалентов.
Титр раствора – это масса вещества, содержащаяся в одном кубическом сантиметре (одном миллилитре) раствора [г/мл]. Обычно обозначается буквой Т. Например, T(HCl) = 0,02 г/мл означает, что в 1 мл раствора содержится 0,02 г соляной кислоты.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.
* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
(I)
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации.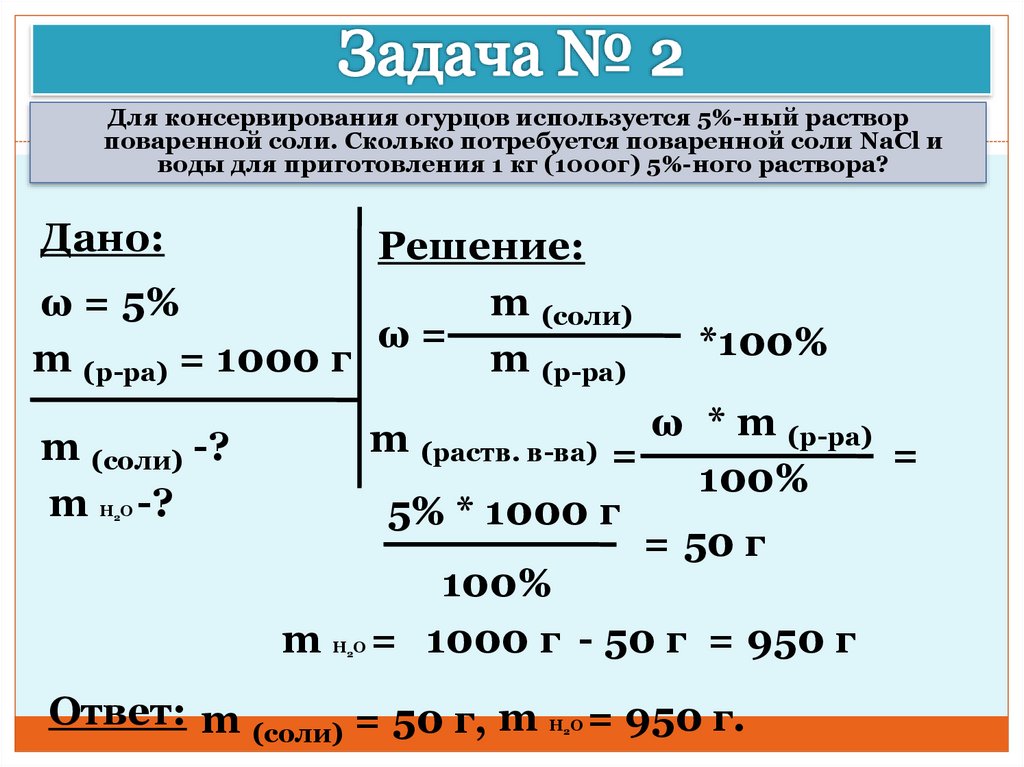 Поскольку А = Vp, формула (1) будет иметь вид:
Поскольку А = Vp, формула (1) будет иметь вид:
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4)
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(8)
(9)
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
(11)
Объем воды (в мл) для разбавления: b = V2 — V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:
Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
К оглавлению
см. также
- Формулы для пересчета концентраций растворов
- Общие правила приготовления растворов
Объяснение урока: Концентрация в процентах | Nagwa
В этом объяснителе мы узнаем, как выразить и рассчитать процентную концентрацию раствора по его объемному или массовому соотношению.
Замечали ли вы когда-нибудь, что на этикетке тюбика с мазью, флакона с лекарством или дезинфицирующего средства для рук после ингредиентов следуют обозначения %, % (об./об.) или % (масс./масс.)? Ингредиенты отбеливателя также перечислены таким образом.
Это обозначение описывает процентную концентрацию ингредиентов и часто используется для растворов. Возможно, вам знаком термин «концентрация». Концентрация – это мера количества растворенного вещества, растворенного в данном количестве раствора.
Определение: Концентрация
Концентрация является мерой того, сколько растворенного вещества растворено в данном количестве раствора.
Мы можем выразить концентрацию, используя общее уравнение концентрация раствора количество растворенного вещества количество раствора =.
Концентрация раствора может быть описана качественно. Когда имеется большое количество растворенного вещества по отношению к количеству растворителя, мы говорим, что раствор концентрированный, а когда имеется небольшое количество растворенного вещества по отношению к количеству растворителя, мы говорим, что раствор разбавлен.
Мы также можем количественно измерить концентрацию раствора, используя различные единицы измерения. Количество растворенного вещества и раствора может быть выражено в граммах, миллилитрах, литрах, кубических дециметрах или молях:
Концентрацияраствораколичество растворенного веществагмLormolsamountofsolutiongmLLordm=(,),.
Количество растворенного вещества и раствора может быть выражено в граммах, миллилитрах, литрах, кубических дециметрах или молях:
Концентрацияраствораколичество растворенного веществагмLormolsamountofsolutiongmLLordm=(,),.
Концентрация в процентах является более конкретной. Это мера количества растворенного вещества в каждых 100 единицах раствора.
Определение: Концентрация в процентах
Концентрация в процентах является мерой количества растворенного вещества, растворенного в каждых 100 единицах раствора.
Общее уравнение для процентной концентрации: процентная концентрацияраствораколичество растворенного веществаgmLorLaколичествораствораgmLLordm=(,),×100%.
Мы можем рассматривать два типа процентной концентрации, а именно, концентрацию в процентах по массе и концентрацию в процентах по объему.
Когда количество растворенного вещества и количество раствора выражены в граммах, мы можем использовать массовую концентрацию (m/m), которая также известна как массовая концентрация. Масса раствора равна сумме массы растворенного вещества и массы растворителя.
Масса раствора равна сумме массы растворенного вещества и массы растворителя.
Не используйте массу растворителя вместо массы раствора!
Например, если масса растворенного вещества в 50 г раствора составляет 2,5 г, массовая концентрация (м/м) равна ммконцентрациямасса растворенного веществаgмасса растворенного веществаgмасса растворителяgмассарастворенного веществаgмассараствораg/=()()+()=()().
Подстановка масс в наши значения дает нам =2,550=0,05/.gggg
Это означает, что в 1 г раствора содержится 0,05 г растворенного вещества.
Часто удобнее выражать массовую концентрацию в процентах. Мы можем преобразовать ответ в проценты, умножив значение m/m на 100%. Взяв тот же пример, массапроцентконцентрациямммасса растворенного веществаgмассараствораgggg(%/)=()()×100%=2,550×100%=5/%=5%.
Мы можем отказаться от граммов, чтобы получить окончательный ответ 5%. Это значение говорит нам о том, что в каждых 100 г раствора содержится 5 г растворенного вещества.
Пример 1: Расчет процента по массовой концентрации
Раствор сахара готовили путем смешивания 12 г глюкозы со 100 г воды. Какова процентная концентрация по массе глюкозы в растворе? Дайте ответ с точностью до одного десятичного знака.
- 12,0 % (массовая доля)
- 8,3 % (массовая доля)
- 13,6 % (массовая доля)
- 10,7% (массовая доля)
- 11,4% (массовая доля)
Ответ
В этом вопросе нам предлагается рассчитать концентрацию раствора глюкозы в воде в процентах по массе.
Чтобы вычислить массовый процент раствора, нам нужны два значения массы: масса растворенного вещества и масса раствора. В этом примере нам дана масса растворенного вещества (12 г глюкозы), но не дана масса раствора. Однако, поскольку нам дана масса растворителя в вопросе (100 г воды), мы можем вычислить массу раствора.
Чтобы рассчитать концентрацию в процентах по массе, мы можем использовать следующее уравнение:
массапроцентконцентрациямммасса растворенного веществаgмассарастворенного веществаgмассарастворителяg(%/)=()()+()×100%.
Подставим значения массы растворенного вещества и массы растворителя: массовая процентная концентрацияgggg=1212+100×100%=12112×100%=10,714…%.
Помните, что мы можем сокращать две единицы грамма друг с другом. Также не забудьте выразить ответ до одного десятичного знака. Окончательный ответ 10,7%.
Когда смешиваются два или более растворов с различной массовой концентрацией в процентах, мы можем рассчитать концентрацию нового комбинированного раствора.
Например, если 13 г раствора NaCl (концентрация 19 % масс.) добавить к 20 г другого раствора NaCl (концентрация 22 % масс.), мы можем определить общую концентрацию нового раствора .
Для расчета общей новой массовой концентрации в процентах воспользуемся формулой массапроцентконцентрацияmmмасса растворенного веществаgмассараствораg(%/)=()()×100%.
Мы можем легко вычислить новую общую массу раствора, сложив массы обоих растворов: общаямассарастворамассарастворамассараствораgg=1+2=13+20=33.
Мы не знаем общую массу растворенного вещества. Мы можем рассчитать общую массу растворенного вещества, сначала вычислив массу растворенного вещества в каждом растворе, а затем суммируя эти значения. Итак, для этого начнем с вычисления массы растворенного вещества в растворе 1:
%/=11×100%mmmassofsolutemassofsolution
Мы можем рассчитать общую массу растворенного вещества, сначала вычислив массу растворенного вещества в каждом растворе, а затем суммируя эти значения. Итак, для этого начнем с вычисления массы растворенного вещества в растворе 1:
%/=11×100%mmmassofsolutemassofsolution
Теперь мы можем подставить наши значения, 19%=113×100%, масса растворенного вещества а затем переформулируйте уравнение, чтобы найти массу растворенного вещества в растворе 1: масса растворенного веществаgмассарастворенного веществаg1=19%×13100%1=2,47.
Далее вычисляем массу растворенного вещества в растворе 2: %/=22×100%.mmmassofsolutemassofsolution
Теперь мы можем подставить наши значения, 22%=220×100%, масса растворенного вещества а затем переформулируйте уравнение, чтобы найти массу растворенного вещества в растворе 2: масса растворенного веществаgмассарастворенного веществаg2=22%×20100%2=4,40.
Затем мы можем сложить массу растворенного вещества 1 и массу растворенного вещества 2, чтобы получить общую массу растворенного вещества:
общая масса растворенного веществамасса растворенного веществамасса растворенного веществаgg=1+2=2,47+4,40=6,87.
Теперь мы можем рассчитать концентрацию нового комбинированного раствора: массапроцентконцентрациямммасса растворенного веществаgмассараствораggg(до одного десятичного знака)(%/)=()()×100%=6,8733×100%=20,818%≈20,8%.
Пример 2. Расчет нового процентного содержания по массе при смешивании двух различных процентных растворов
50 г 26%-го (м/м) раствора смешивали со 130 г 17%-го (м/м) раствора. Какова процентная концентрация по массе нового раствора?
- 19,5% (м/м)
- 15% (м/м)
- 5% (м/м)
- 43% (м/м)
- 35% (м/м)
Ответ
Чтобы решить эту задачу, нам нужно знать общую массу растворенного вещества и общую массу раствора. Мы можем начать с вычисления общей массы раствора, сложив вместе две массы раствора следующим образом: общаямассарастворамассарастворамассараствораgg=1+2=50+130=180.
Вычисление общей массы растворенного вещества требует немного больше работы. Во-первых, нам нужно определить массу растворенного вещества в каждом растворе.
В растворе 1 массу растворенного вещества можно рассчитать, подставив данные, которые мы имеем для раствора 1, в уравнение массовых процентов: %/=11×100%26%=150×100%.mmmassofsolutemassofsolutionmassofsoluteg
Затем мы можем изменить уравнение, чтобы найти массу растворенного вещества: масса растворенного веществаgмассарастворенного веществаg1=26%×50100%1=13.
Мы можем сделать то же самое для решения 2, используя данные, которые у нас есть для него: %/=22×100%17%=2130×100%.mmmassofsolutemassofsolutionmasssofsoluteg
Затем мы можем изменить уравнение и найти массу растворенного вещества в растворе 2: масса растворенного веществаgмассарастворенного веществаg2=17%×130100%2=22,1.
Затем мы можем сложить массу растворенного вещества 1 и массу растворенного вещества 2, чтобы получить общую массу растворенного вещества: общая масса растворенного веществамасса растворенного веществамасса растворенного веществаgg=1+2=13+22,1=35,1.
Теперь мы можем рассчитать новую концентрацию объединенного раствора:
массапроцентконцентрациямммасса растворенного веществаgмассараствораggg(%/)=()()×100%=35,1180×100%=19,5%.
Еще один способ выразить концентрацию раствора — это объем растворенного вещества (для жидкого растворенного вещества) и объем раствора. Мы называем это объемной концентрацией (об./об.) или объемной концентрацией. Значения объема обычно выражаются в одних и тех же единицах, таких как мл/мл или л/л. Обычно используется мл/мл.
Например, если к воде было добавлено 24 мл этанола (CHOh35) и объем конечного раствора составил 120 мл, мы можем рассчитать объемную концентрацию (об./об.) следующим образом: vvconcentrationvolumeofsolutemLvolumeofsolutionmL/=()().
Мы можем заменить 24 мл этанола на объем растворенного вещества и 120 мл на объем раствора: vvконцентрацияmLmLmLmL/=24120=0,2/.
Это значение означает, что в каждом 1 мл раствора содержится 0,2 мл этанола.
В этом примере нам не сказали объем растворителя, воды, но нам сказали объем раствора. Иногда растворенное вещество может влиять на объем растворителя из-за взаимодействия частиц. Как правило, мы можем приготовить раствор, взяв известный объем растворенного вещества и разбавив его до конечного желаемого объема раствора.
Мы также можем выразить объемную концентрацию в процентах, используя это уравнение: объемная процентная концентрацияvvобъем растворенного веществаобъем раствора (%/)=×100%.
Используя тот же пример, который мы только что использовали, мы можем определить объемную процентную концентрацию: %/=24120×100%=20%.vvmLmL
Это значение говорит нам о том, что в каждых 100 мл раствора содержится 20 мл этанола.
Пример 3. Расчет объема растворенного вещества по процентной относительной концентрации
Бутылка уксуса объемом 0,75 л содержит 4% (об./об.) этановой кислоты. Какой объем этановой кислоты содержится в бутылке с уксусом?
Ответ
В вопросе нам предлагается рассчитать объем этановой кислоты в 0,75 л раствора уксуса с концентрацией 4% (об./об.). Нам нужно определить, что этановая кислота является растворенным веществом. Чтобы определить объем растворенного вещества, нам нужно использовать уравнение процентной концентрации (v/v):
объемная процентная концентрацияvvобъем растворенного веществаобъем раствора (%/)=×100%.
Нам сообщают объемную процентную концентрацию (4%) и объем раствора (0,75 л). Мы можем подставить эти значения в уравнение: 4%=0,75×100%.volumeofsoluteL
Теперь мы можем изменить уравнение для определения объема растворенного вещества: объем растворенного вещества LL=4%×0,75·100%=0,03.
Обратите внимание: если бы мы сначала преобразовали объем раствора в миллилитры, окончательный ответ также был бы в миллилитрах.
Пример 4. Расчет объема воды, добавляемой для разбавления раствора до желаемой концентрации
Какой объем воды нужно добавить к 125 мл раствора этанола, чтобы изменить его объемное процентное содержание с 40% (об./об.) до 35% (об./об.)? Дайте ответ до ближайшего целого числа.
- 18 мл
- 143 мл
- 50 мл
- 44 мл
- 107 мл
Ответ
в). Затем этот раствор разбавляют добавлением воды до новой концентрации 35% (об./об.). Нам нужно рассчитать, сколько воды нужно добавить к начальному объему, чтобы уменьшить концентрацию с 40% (об.
 /об.) до 35% (об./об.).
/об.) до 35% (об./об.).Итак, объем и концентрация исходного раствора и разбавленного раствора различаются. Однако объем растворенного этанола в обоих растворах одинаков; это не меняется.
Мы можем начать с подсчета количества этанола в исходном растворе, и это будет также количество этанола в разбавленном растворе. Для его расчета воспользуемся уравнением объемная процентная концентрацияvvобъем растворенного веществаобъем раствора (%/)=×100%.
Тогда мы можем подставить объем и концентрацию исходного раствора, 40%=125×100%, объем растворенного вещества, л и найдем объем растворенного этанола в исходном растворе: объем растворенного вещества л мл = 40 % × 125 100 % = 50.
Это значение 50 мл также является объемом этанола в разбавленном растворе. Итак, мы можем рассчитать объем разбавленного раствора, подставив объем этанола (50 мл) и концентрацию разбавленного раствора (35%) в уравнение объемных процентов:
объемпроцентная концентрацияvvобъемрастворенного веществаобъемрастворамлобъемраствора(%/)=×100%35%=50×100%.
Тогда мы можем найти объем разбавленного раствора: объем раствора млмл=50×100%35%=142,86.
Наконец, мы можем вычесть объем исходного раствора из объема разбавленного раствора, чтобы определить, сколько воды было добавлено к исходному раствору при разбавлении: объем добавленной воды, объем разбавленного раствора, объем исходного раствора=−.
Подставляем объемы исходного и разбавленного растворов и вычитаем: =142,86−125=17,86≈18,mLmLmLmL
Мы должны не забыть округлить ответ до ближайшего целого числа. Таким образом, к исходному раствору необходимо добавить 18 мл воды, чтобы разбавить его до новой желаемой концентрации 35% (об./об.).
Третий способ выражения концентрации раствора – массовые объемные проценты (% масс./об.). Это масса растворенного вещества (обычно в граммах) в заданном объеме раствора (обычно 100 мл).
Определение: Концентрация в процентах по объему (% масс./об.)
Единица концентрации для массы растворенного вещества (в граммах) в 100 единицах объема (обычно миллилитрах) раствора.
Уравнение масса-на-объем-процент-концентрацияmvмассарастворенного веществаgобъемраствораmL(%/)=()()×100%.
Единицы г и мл не сокращаются друг с другом. Несмотря на это, массовые проценты по объему обычно используются в лекарствах. Возможно, вы заметили, что эта единица написана на тюбиках с мазями или на бутылочках с сиропом от кашля.
Пример 5: Расчет концентрации раствора в процентах по массе
Солевой раствор готовили путем растворения 9 г NaCl в воде с получением раствора общим объемом 1 000 мл. Какова массовая/объемная процентная концентрация, %(m/v) физиологического раствора?
Ответ
Мы можем использовать следующее уравнение для массовой/объемной концентрации в процентах: масса-на-объем-процент-концентрацияmvмассарастворенного веществаgобъемраствораmL(%/)=()()×100%.
Чтобы решить эту задачу, нам нужно знать массу растворенного вещества, которое составляет 9 г NaCl. И нам нужно знать объем раствора, который составляет 1 000 мл. Мы можем подставить эти значения в уравнение:
%/=()()×100%=91000×100%=0,9%.
Мы можем подставить эти значения в уравнение:
%/=()()×100%=91000×100%=0,9%.
Калькулятор растворов в процентах (%) — PhysiologyWeb
Калькулятор растворов в процентах (%)
Предназначенный для использования как в учебной, так и в исследовательской лаборатории, этот калькулятор (см.0227 процентов (%) растворов при запуске с твердым или жидким материалом. Очень часто концентрацию растворов выражают в процентах. Процент означает на 100 частей, где для растворов часть относится к единице измерения массы (мкг, мг, г, кг и т. д.) или объема (мкл, мл, л и т. д.). В процентных растворах количество (масса или объем) растворенного вещества выражается в процентах от общей массы или объема раствора. Процентные растворы могут принимать форму вес/объем % (вес/объем % или вес/объем %), вес/вес % (вес/вес % или вес/вес %), или объем/объем % (об/об % или об/об %). В каждом случае процентная концентрация рассчитывается как доля веса или объема растворенного вещества по отношению к общему весу или объему раствора.
д.) или объема (мкл, мл, л и т. д.). В процентных растворах количество (масса или объем) растворенного вещества выражается в процентах от общей массы или объема раствора. Процентные растворы могут принимать форму вес/объем % (вес/объем % или вес/объем %), вес/вес % (вес/вес % или вес/вес %), или объем/объем % (об/об % или об/об %). В каждом случае процентная концентрация рассчитывается как доля веса или объема растворенного вещества по отношению к общему весу или объему раствора.
Поскольку процентные растворы могут быть выражены тремя различными способами, необходимо явно указать тип процентного раствора. Если эта информация не предоставлена, конечному пользователю остается «угадать», использовалось ли % вес/об, % вес/вес или % объем/объем. Каждый процентный раствор подходит для ряда различных приложений. Например, коммерческие водные реагенты, такие как концентрированные кислоты и основания, обычно выражают в виде растворов в процентах по массе. Например, коммерчески доступная концентрированная соляная кислота (HCl) составляет 37% по весу (мас. /мас.%). С другой стороны, многие разбавленные растворы, используемые для биологических исследований, выражаются в % массы/объема (например, 1% додецилсульфат натрия, SDS). Объемные/объемные % растворенных веществ также распространены и используются, когда используются чистые растворенные вещества в жидкой форме. Например, 70 % (об./об.) раствор этанола можно приготовить путем растворения 70 мл 100 % (т. е. пробы 200) этанола в общем объеме раствора 100 мл.
/мас.%). С другой стороны, многие разбавленные растворы, используемые для биологических исследований, выражаются в % массы/объема (например, 1% додецилсульфат натрия, SDS). Объемные/объемные % растворенных веществ также распространены и используются, когда используются чистые растворенные вещества в жидкой форме. Например, 70 % (об./об.) раствор этанола можно приготовить путем растворения 70 мл 100 % (т. е. пробы 200) этанола в общем объеме раствора 100 мл.
При выборе типа процентного раствора для приготовления могут иметь значение и другие факторы. Например, если рассматриваемый процентный раствор должен использоваться при самых разных температурах, то лучше приготовить раствор в виде раствора в процентах по массе, поскольку его концентрация не зависит от изменений температуры окружающей среды.
Важное примечание. Здесь мы использовали «вес» вместо «масса» просто для того, чтобы соответствовать традиции и популярному использованию. Таким образом, 9Растворы 0227 мас. /об.% должны правильно называться мас./об.% . Аналогично, растворы мас./мас.% следует обозначать как мас./мас.% или просто мас.% .
/об.% должны правильно называться мас./об.% . Аналогично, растворы мас./мас.% следует обозначать как мас./мас.% или просто мас.% .
Если вы хотите выполнить расчеты разведения для растворов с молярностью или процентной концентрацией, используйте наш Калькулятор разбавления — молярность, проценты.
Если вы хотите выполнить фактор разбавления или кратное разведение для расчетов растворов с молярностью или процентной концентрацией используйте наш Калькулятор коэффициента разбавления — молярность, проценты.
Уравнения с процентным решением
| (уравнение 1) | |
| (уравнение 2) | |
| (уравнение 3) |
Как отмечалось выше, вес относится к массе (т. е. измеренной на весах). При изучении уравнения для каждого из приведенных выше процентных растворов очень важно отметить, что во всех случаях знаменатель относится к массе или объему раствора , а не только к массе или объему растворителя. Таким образом, масса раствора представляет собой объединенную массу растворенного вещества и растворителя, а объем раствора представляет собой объединенный объем растворенного вещества и растворителя.
е. измеренной на весах). При изучении уравнения для каждого из приведенных выше процентных растворов очень важно отметить, что во всех случаях знаменатель относится к массе или объему раствора , а не только к массе или объему растворителя. Таким образом, масса раствора представляет собой объединенную массу растворенного вещества и растворителя, а объем раствора представляет собой объединенный объем растворенного вещества и растворителя.
Последнее примечание необходимо при рассмотрении объемных/объемных % растворов. Когда разные объемы идентичного раствора добавляются вместе, конечный объем всегда будет в точности равен сумме добавленных отдельных порций. Например, добавление 50 мл воды к 50 мл воды даст общий объем 100 мл, а добавление 75 мл 100% этанола к 75 мл 100% этанола даст общий объем 150 мл. Однако при смешивании смешивающихся жидкостей (например, воды и этанола) конечный объем раствора не совсем равен сумме отдельных объемов. Например, при добавлении 50 мл этанола к 50 мл воды общий объем будет меньше 100 мл.
