Классификация химических реакций » Дистанционные олимпиады Inter Olymp
Правильный вариант ответа отмечен знаком +
1. Какому типу химических реакций соответствует взаимодействие BaCl2 с Rb2SO4?
— распада
+ обмена
— соединения
— замещения
2. Необратимой является реакция:
— дегидратации C3H7OH
— соединения SO2 с O2
+ разложения Al(OH)3
— гидрирования C2h5
3. Выберите реакцию, которой свойственно в стандартных условиях протекать с наибольшей скоростью:
4. При каком условии происходит смещение химического равнове-сия реакции CO2+C ↔ 2CO-Q в сторону продуктов реакции?
— при снижении температуры
+ при увеличении температуры
— при уменьшении давления
— при повышении давления
5. Как изменится скорость химической реакции Н2 (г) + I2 (г) → 2HI(г) при повышении давления в 2 раза?
+ возрастёт в 4 раза
— уменьшится в 3 раза
— увеличится в 2 раза
— никак не изменится
6. Скорость взаимодействия раствора HCl будет максимальной с ку-сочком:
— Fe
+ Mg
— Zn
— Cu
7. Взаимодействие Zn с HCl относится к реакциям:
Взаимодействие Zn с HCl относится к реакциям:
— разложения
— соединения
— обмена
+ замещения
8. Химическая реакция BaCl2+h3SO4=BaSO4+2HCl относится к реак-циям:
+ обмена
— распада
— замещения
— соединения
9. Какая из реакций относится к каталитическим?
— взаимодействия HCl с Na2CO3
+ синтеза Nh4
— хлорирования Ch5
— бромирования анилина (C₆H₅NH₂)
10. Какого цвета будет осадок в результате обмена между FeCl2 и NaOH?
— коричневый
— малиновый
+ зелёный
— фиолетовый
11. Гетерогенной обменной реакцией является реакция:
— NaOH + HCl = NaCl + Н2О
+ CuS + h3SO4 = CuSO4 + h3S
— Fe + CuSO4 = Cu + FeSO4
— СаО + СO2 = СаСО3
12. С каким соединением вступает в реакцию оксид углерода (IV)?
— h3O
— CaO
— C
+ Ca(OH)2
13. К экзотермическим относится реакция:
— электролиза воды
— дегидрирования этана
— разложения KMnO₄
+ нейтрализации h3SO4 гидроксидом калия
14. Гидролизу подвергается:
— BaSO₄
+ сахароза
— KBr
— глюкоза
15. Увеличение скорости реакции происходит с увеличением:
Увеличение скорости реакции происходит с увеличением:
+ концентрации реагентов
— объёма продуктов реакции
— концентрации продуктов реакции
— объёма реагентов
16. Процесс разложения какого соединения является окислительно-восстановительной реакцией?
— NaHCO3
— малахита Cu₂(CO₃)(OH)₂
+ Zn(NO₃)₂
— (NH₄)₂CO₃
17. Какая реакция может служить примером реакции соединения?
+ S + O2 = SO2
— Al2O3 + 6HCl = 2AlCl3 + 3h3O
— Na + HCl = NaCl + h3
— BaCl2 + Na2SO4 = BaSO4 + NaCl
18. Какой металл не может вступать в реакцию замещения с серной кислотой?
— Cu
— Na
+ Mg
— Pb
19. Какая из реакций является окислительно-восстановительной и экзотермической?
+ 2Mg + O2 = 2MgO + Q
— N2 + O2 = 2NO – Q
— CaCO3 = CaO + CO2 – Q
— HCl + NaOH = NaCl + h3O + Q
20. Как изменится скорость химического взаимодействия А + 2В = С, если температура повысится на 10 градусов (температурный коэф-фициент равен 2)?
+ увеличится 2 раза
— снизится в 4 раза
— увеличится в 3 раза
— снизится в 2 раза
21. Укажите тип химической реакции, изображённой на рисунке:
Укажите тип химической реакции, изображённой на рисунке:
— обмена
— нейтрализации
— распада
+ соединения
22. В каком случае при понижении давления скорость реакции Fe (тв.) + h3SO4 (р-р) = FeSO4 (р-р) + Н2 (г) + Q повысится?
— при уменьшении температуры
+ при измельчении железа
— при разбавлении раствора кислоты
— при понижении концентрации серной кислоты
23. При нагревании Cu(OH)2 происходит реакция:
— соединения
— замещения
+ разложения
— обмена
24. К реакциям гидролиза не относится:
— K2SiO3 + h3O →
— Ch4COOCh4 + NaOH(р-р) →
+ Na2O + h3O →
— Al4C3 + h3O →
25. Какой признак реакции между NaCl и AgNO3?
— выделение кислорода
+ выпадение осадка
— выделение газа
— образование воды
26. Взаимодействие CaCO3 + CO2 + h3O = Ca(HCO3)2 относится к ре-акциям:
— обмена
— замещения
— распада
+ соединения
27. Насколько достоверны представленные ниже суждения?
А. Скорость химического взаимодействия – это изменение концен-трации реагентов за единицу времени.
Б. Концентрация компонента в смеси – это отношение массы ком-понента к объёму смеси.
+ достоверно лишь утверждение А
— достоверно лишь утверждение Б
— достоверны оба суждения
— оба суждения недостоверны
28. Уравнение 2КMnO4 = K2MnO4 + MnO2 + O2 описывает реакцию:
— обмена
— замещения
+ распада
— соединения
29. Какой металл не реагирует с Cr2O3?
— медь
+ алюминий
— натрий
— все ответы верные
Написать комментарий
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Электролитическая диссоциация. Ионные реакции — презентация онлайн
Похожие презентации:
Растворы. Теория электролитической диссоциации
Электролитическая диссоциация. Реакции ионного обмена
Ионные уравнения реакции
Теория электролитической диссоциации. Протолитическая теория кислот и оснований
Ионные уравнения реакций
Электролитическая диссоциация
Реакции ионного обмена
Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация
Электролитическая диссоциация
Электролитическая диссоциация веществ
1. Электролитическая диссоциация
ИОННЫЕ РЕАКЦИИ2. Что мы должны знать
1. Электролиты и неэлектролиты.Особенности свойств растворов
электролитов.
2. Определение электролитической
диссоциации.
3. Основные положения.
4. Механизм растворения веществ
– с ионной связью
– с молекулярной связью.
5. Диссоциация кислот, оснований,
солей.
6. Общие понятия о кислотах и
основаниях как электролитах.
7. Ионнообменные реакции.
3. Вопросы для контроля
• 1. Чем обусловлена электропроводность растворовэлектролитов?
• 2. Что называется процессом «электролитической
диссоциации»?
• 3. Какую роль при электролитической диссоциации
играет растворитель?
• 4. Каковы основные положения теории
электролитической диссоциации?
• 5. Что значит сильный или слабый электролит?
• 6. Что такое : а) катионы? , б) анионы?
• 7.
 Как называются ионы, движущиеся при
Как называются ионы, движущиеся приэлектролизе: а) к катоду, б) к аноду?
• 8. Как заряжен катод и анод?
4. Вопросы для контроля
1. Дать определение кислот,оснований, солей. Привести
примеры.
2. Привести несколько примеров
оксида, соответствующей
кислоты и любой соли
образованной этой кислотой.
Дать названия
5. Механизм диссоциации
6. Диссоциация кислот
• Кислоты — это электролиты, которыедиссоциируют на водород и кислотный остаток.
• Кислотные остатки для различных кислот
различны, но общим для всех кислот является
наличие в растворах иона водорода.
• Наличие в растворах кислот иона водорода,
точнее, гидратированного иона, обусловливает
общие свойства кислот (кислый вкус, действие
на индикаторы, взаимодействие с металлами с
выделением водорода и др.).
7. Модельная схема диссоциации кислоты
+—
2
+
h3SO4 =
2H + +
2SO4
8. Проверим на практике
1.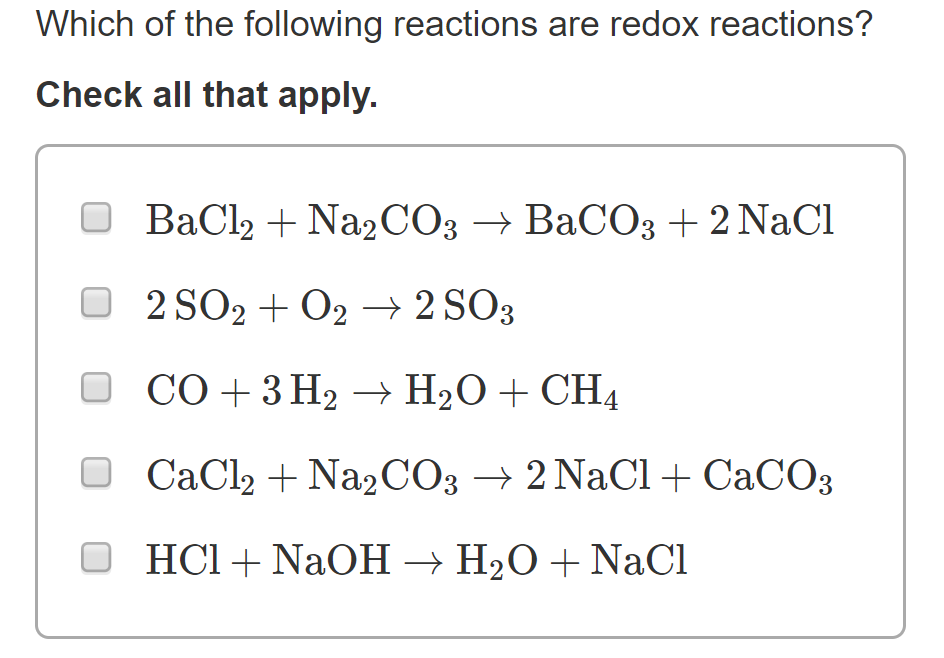 Общие свойства.
Общие свойства.• Добавить метилоранж и индикаторную бумагу к
растворам серной и соляной кислот. Что
наблюдаем? С каким ионом взаимодействует
метилоранж: катионом или анионом?
• Добавить несколько кусочков цинка к раствору
серной и соляной кислоты. Что наблюдаем?
Цинк замещает…(указать ион). Написать
уравнения реакций.
Соли – это продукт реакции…. (указать тип
реакции, и ион, который замещается и ион,
который замещает).
9. Проверим на практике
2. Различие в свойствах. Добавим хлоридбария к растворам серной и соляной
кислот. Что наблюдаем? С чем
реагирует хлорид бария: с катионом или
анионом? С каким?
Закончите предложение. Общие свойства
кислот обусловлены …, различные
свойства …
10. Модельная схема диссоциации щёлочи
—+
+
+
+
+
+
Na
NaOH
=
Na+ + OH
_
OH
—
11. Диссоциация оснований
• Основания – это электролиты, которыедиссоциируют на катион металла и
гидроксид-анион.

Лабораторный опыт: добавьте к растворам
NаОН и Са(ОН)2 фенолфталеин и
индикаторную бумагу. Что наблюдаем?
• Общие свойства оснований обусловлены…..,
различие в свойствах — …. (указать ионы)
12. Понятие об индикаторах
ИНДИКАТОРЫ – это вещества,которые… (указать один из
признаков химической реакции)
при взаимодействии с
…….(указать названия ионов, с
которыми взаимодействуют
индикаторы).
13. Диссоциация солей
• Соли — это электролиты,которые диссоциируют на
катион металла и анион
кислотного остатка.
14. Модельная схема диссоциации соли
—+
—
+
+
+
NaCl
=
—
Na
+
+
Cl
—
Модельная схема диссоциации соли
+
—
—
+
+
—
—
+
—
—
+
+
+
—
—
—
+
KNO3 ↔ К+ + NO3-
16. Самоконтроль
Среди веществ, формулы которыхприведены:
BaCl2,h3SO4, Ca(OH)2, HNO3,
Al2(SO4)3,
выбрать кислоты, соли, основания,
дать им названия, написать
уравнения диссоциации.

17. Проверь себя
Кислоты: h3SO4 ↔ 2H+ + SO42-HNO3 ↔ H+ + NO3Основания: Са(ОН)2 ↔ Са2+ + 2ОНСоли: BaCl2 ↔ Ba2+ + 2ClAl2(SO4)3 ↔ 2Al3+ + 3SO42-
Химические свойства
растворов электролитов
определяются
свойствами тех ионов,
которые они образуют
при диссоциации.
19. Самоконтроль
В растворе находятся следующие ионы:РО43-, К+, СО32-, Н+, ОН-.
Какие вещества были растворены. Дать
им названия.
Ответ: К3РО4, К2СО3, Н3РО4, Н2СО3, КОН
20. Ионные реакции – это
реакции между ионами вводных растворах
электролитов
21. Модельная схема ионообменной реакции
—+
—
—
+
+
+
—
+
—
— +
—
— +
+
Na
—
—
AgNO3
+
NO3
+
Ag +
+
+
— +
NaCl
+
Cl
—
AgCl
=
AgCl ↓
AgNO3 + NaCl = AgCl ↓ + NaNO3
—
22. Правила составления ионных уравнений
1.Простые вещества, оксиды, а также нерастворимыекислоты, основания и соли не диссоциируют.

2.Для реакции берут растворы веществ, поэтому даже
малорастворимые вещества находятся в растворах в
виде ионов.
3.Если малорастворимое вещество образуется в
результате реакции, то при записи ионного уравнения
его считают нерастворимым.
4.Сумма электрических зарядов ионов в левой части
уравнения должна быть равна сумме электрических
зарядов ионов в правой части.
Записывая молекулярное уравнение ионного обмена,
помним: обмениваются ионы одинакового заряда
23. Проверь себя
• Составить уравнениемежду гидроксидом
натрия и хлоридом
железа(III) в
молекулярном и ионном
виде
24. Алгоритм составления ионных уравнений
1.Записать молекулярное уравнение реакции
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
2.
3.
4.
С помощью таблицы растворимости определить
растворимость каждого вещества.
р
р
н
р
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
Составляем полное ионное уравнение. Сильные электролиты
записывают в виде ионов, а слабые электролиты,
малорастворимые вещества и газообразные вещества
записывают в виде молекул.

3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 + 3Na+ + 3ClНайти одинаковые ионы (они не приняли участия в реакции в
левой и правой частях уравнения реакции) и сократить их
слева и справа.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 ↓ + 3Na+ + 3ClСоставить сокращенное ионное уравнение (выпишите знаки,
формулы ионов или веществ, которые приняли участие в
реакции).
Fe3+ + 3OH- = Fe(OH)3 ↓
25. Реакции нейтрализации
Реагирующиевещества
Кислота +
основание
Кислотный
оксид +
основание
Основной оксид
+ кислота
Продукты
Условия
Протекают во
всех случаях
Соль + вода
26. Реакция нейтрализации
__
+
_
+
+
_
+
_
_
+
+
_
+
_
+
+
+
+
_
+
+
_
_
_
_
+
_
_
+
+
_
NaOH + HCl = NaCl + h3O
Na + +
H
+
+
OH
H
+
Na +
_
OH
_
_
+
+
Cl
+ OH
_
=
_
=
Na + + Cl
_
+ h3O
h3O
+ H +
_
Cl
_
Почему Cu(OH)2 не раскладываем на ионы ?
+
_
_
+
+
+
_
+
+
_
+
_
_
+
_
+
+
+
+
+
_
+
+
_
_
_
+
+
+
_
+
Cu 2+
+
+
+
OH
_
+
+
_
+
+
_
+
Cu(OH)2 + 2HCl = CuCl
2 + 2h3O
Cu(OH)2 + 2H += Cu 2++ 2h3O
_
H
+
Cl
_
28.
 Попробуй сам1. Налить в пробирку раствор NаОН, добавить
Попробуй сам1. Налить в пробирку раствор NаОН, добавитьфенолфталеин, затем раствор соляной кислоты.
Записать уравнение реакции в молекулярном и
ионном виде.
2. В пробирку с оксидом меди добавить раствор
серной кислоты, подогреть. Записать уравнение
реакции в молекулярном и ионном виде.
3. Взять 2 пробирки. В первую налить раствор
Са(ОН)2,, во вторую добавить мрамор и соляную
кислоту, заткнуть вторую пробирку пробкой с
газоотводной трубкой. Конец газоотводной
трубки опустить в раствор Са(ОН)2. Что
наблюдаем? Какой газ выделяется? Записать
уравнение реакции между СО2 и Са(ОН)2 в
молекулярном и ионном виде.
29. Проверь себя
1. NaOH + HCl = NaCl + h3ONa+ + OH- + H+ + Cl- = Na+ + Cl- + h3O
OH- + H+ = h3O
2. CuO + h3SO4 = CuSO4 + h3O
CuO + 2H+ + SO42- = Cu2+ + SO42- + h3O
CuO + 2H+ = Cu2+ + h3O
3. CO2 + Ca(OH)2 = CaCO3↓ + h3O
CO2 + Ca2+ + 2OH- = CaCO3↓ + h3O
30. Свойства кислот, солей, оснований как электролитов
Реагирующиевещества
Продукты
Условия
Кислота1 + соль1
Кислота2 +
соль2
Соль1 + щелочь1
Соль2 +
основание2
Более сильная кислота
вытесняет более слабую из
ее соли
Реагирующие вещества
растворимы, хотя бы один
из продуктов нерастворим
Реагирующие вещества
растворимы, хотя бы один
из продуктов нерастворим
Соль1 + соль2
Соль3 + соль4
31.
 Попробуй самВыберите из предложенных
Попробуй самВыберите из предложенныхреактивов те, с которыми можно
провести реакции между солью и
щелочью, солью и солью.
Проведите реакции. Запишите
уравнения реакций в
молекулярном и ионном виде.
32. Проверь себя
Соль + ЩелочьCuSO4 + 2Na OH = Cu(OH)2↓ + Na2SO4
Cu2+ + SO42- + 2Na+ + 2OH- = SO42- + 2Na+
+ Cu(OH)2 ↓
Cu2+ + 2OH- = Cu(OH)2 ↓
Соль + соль
Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4 ↓
2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 2Al3+ + 6Cl- +
3BaSO4 ↓
Ba2+ + SO42- = BaSO4 ↓
33. Попробуй сам
1. Подобрать молекулярные уравнения к каждомукраткому ионному:
а) СО32- + Са2+ = СаСО3
б) 3Mg2+ + 2PO43- = Mg3(PO4)2
2. При помощи молекулярных и ионных уравнений
ответьте на вопросы:
а) растворы каких солей, присутствующих у вас на столе,
надо смешать для получения в осадке йодида свинца?
б) каким способом из NaCl можно получить нитрат
натрия?
34. Основные понятия
1. Кислоты, основания, соли какэлектролиты.

2. Индикаторы.
3. Ионнообменные реакции
4. Составление ионных уравнений
6. Свойства кислот, солей, оснований как
электролитов.
English Русский Правила
Сбалансируйте уравнение — BaCl2 + h3SO4 → BaSO4 + HCl
Последнее обновление: 2 июля 2021 г., Teachoo
Сбалансируйте следующие химические уравнения.
(г) BaCl
2 + Н 2 SO4 → BaSO 4 + HClОтвечать
(г) BaCl 2 + Н 2 ТАК 4 → БаСО 4 + HCl
Имя элемента | Количество атомов в реагентах | Количество атомов в продуктах |
Барий | 1 | 1 |
хлор | 2 | 1 |
Водород | 2 | 1 |
Сера | 1 | 1 |
Кислород | 4 | 4 |
Чтобы сбалансировать водород и хлор,
Умножить HCl на 2
BaCl 2 + Н 2 ТАК 4 → БаСО 4 + 2 HCl
Имя элемента | Количество атомов в реагентах | Количество атомов в продуктах |
Барий | 1 | 1 |
хлор | 2 | 2 |
Водород | 2 | 2 |
Сера | 1 | 1 |
Кислород | 4 | 4 |
Теперь все элементы уравновешены, и сбалансированное уравнение
BaCl 2 + Н 2 ТАК 4 → БаСО 4 + 2 HCl
BaCl 2 + Н 2 ТАК 4 → БаСО 4 + 2 HCl
Реакция \[BaC{l_2}\, + \,{H_2}S{O_4}\, \to \,BaS{O_4}\, + \,2HCl\]: A.
 Комбинированная реакция Б. Реакция разложения C. Реакция смещения D. Реакция двойного смещения
Комбинированная реакция Б. Реакция разложения C. Реакция смещения D. Реакция двойного смещенияПодсказка: В этой реакции, когда хлорид бария взаимодействует с серной кислотой, мы можем наблюдать, что как положительно заряженные частицы или катионные соединения, так и отрицательно заряженные частицы или анионные соединения вытесняются, и они переключаются с образованием нового соединения, названного сульфат бария и соляная кислота.
Полный пошаговый ответ: В этой реакции мы можем наблюдать, что один моль хлорида бария реагирует с одним молем серной кислоты с образованием одного моля сульфата бария и побочного продукта из двух молей соляной кислоты. 9{2 — }\] вытесняются с образованием нового соединения сульфата бария и соляной кислоты.
Таким образом, мы можем наблюдать двойную реакцию смещения.
В реакции двойного замещения два ионных соединения, т. е. катионное и анионное соединения, заменяются с образованием двух новых соединений.
\[AB\, + \,CD\, \to \,AD\, + \,CB\]
Итак, правильный вариант D. Реакция двойного смещения.
Дополнительная информация: В сочетании реакций два или более элементов/соединений объединяются в одно соединение. Проще говоря, сочетание двух или более реагентов с образованием одного продукта называется реакцией сочетания. Так как в этой реакции происходит соединение реагентов. Это можно представить следующим образом:
\[A\, + \,B\, \to \,C\]
Или же,
\[CaO\, + \,{H_2}O\, \to \,Ca{(OH)_2}\ ]
Например,
\[CaO\, + \,{H_2}O\, \to \,Ca{(OH)_2}\]
В реакции разложения соединения распадаются на более простые вещества. Проще говоря, соединения разлагаются на два или более соединений. Это можно представить следующим образом:
В реакции замещения один из элементов или набор элементов замещается другой молекулой. Это можно представить следующим образом:
\[AB\, + \,C\, \to \,AC\, + \,B\]
Примечание: Реакции двойного замещения подразделяются на реакции нейтрализации, осаждения и газообразования:
Реакции нейтрализации: Эта реакция представляет собой особый тип реакции двойного замещения.
