15 фактов о HCl + CaCO3: реакция нескольких элементов
Карбонат кальция (CaCO3) является основным и легко реагирует с сильной кислотой HCl. Давайте подробно объясним различные важные факты реакции.
Реакция между HCl и CaCO3 является примером кислотно-щелочной реакции или реакции нейтрализации. Для этой реакции больше не требуется тепла или внешнего давления. Это экзотермическая реакция, которая указывает на то, что продукты более стабильны и обладают меньшей энергией, чем реагенты.
Поговорим о типе реакции, продуктах, межмолекулярных силах, энтальпии, методе уравновешивания и сопряженных парах этой реакции.
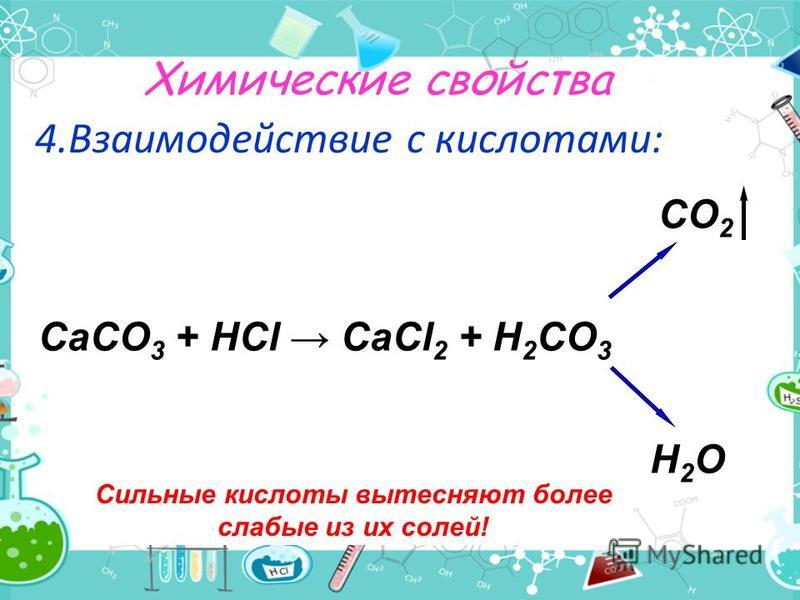
Что является продуктом HCl и CaCO3?Карбонат металла, CaCO3 реагирует с сильной кислотой HCl с образованием хлорида кальция (CaCl2), диоксид углерода (CO2) и вода ( H2О). Углекислый газ всегда выделяется через раствор, когда карбонат металла реагирует с кислотой.
СаСО3 (водн.) + 2HCl (водн.) = CaCl2 (водн.) + CO2 (г) + Н2О (л)
Какой тип реакции HCl + CaCO?3?Реакция между HCl + CaCO3 является примером кислотно-щелочной реакции или реакция нейтрализации. В этой реакции кислота HCl полностью нейтрализуется основным веществом CaCO.3 с образованием соли и воды.
Как сбалансировать HCl + CaCO3?Чтобы сбалансировать химическую реакцию, необходимо выполнить следующие шаги:
- Сначала напишите неуравновешенное химическое уравнение со стрелкой вправо. СаСО3 (водн.) + HCl (водн.) → CaCl2 (водн.) + CO2 (г) + Н2О (л)
- Подсчитайте количество молей, присутствующих для каждого элемента в стороне реагента и продукта.
| элементы | Количество родинок в сторона реагента | Количество родинок в сторона продукта |
| Ca | 1 | 1 |
| C | 1 | 1 |
| O | 3 | 3 |
| H | 1 | 2 |
| Cl | 1 | 2 |
- Чтобы сбалансировать обе стороны (реагент и продукт), мы должны умножить 2 на HCl, чтобы сбалансировать количество молей водорода и хлора.

- Следовательно, сбалансированное уравнение будет – СаСО3 (водн.) + 2HCl (водн.) = CaCl2 (водн.) + CO2 (г) + Н2О (л).
В этой реакции требуется обратное титрование HCl + CaCO.3 потому что карбонат кальция не растворяется в воде.
АппаратыСтакан на 250 мл, мерная колба на 250 мл, коническая колба, бюретка, пипетка (25 мл).
Индикаторныефенолфталеин известен как кислотно-щелочной индикатор.
Процедура- Твердый СаСО3 берут в химический стакан и добавляют к нему HCl. После тщательного перемешивания всю смесь переносят в мерную колбу вместимостью 250 мл и доводят до метки дистиллированной водой.
- Пипеткой отбирают 25 мл раствора из мерной колбы и помещают в коническую колбу.
 В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора.
В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора. - Титруют раствор 0.1 М раствором гидроксида натрия (NaOH), взятого в бюретку, до появления бледно-розовой окраски.
- Для точности повторите титрование не менее трех раз и возьмите среднее значение титра.
- По формуле «В1S1 V =2S2», чистота внутри CaCO3 определяется точно.
Суммарное ионное уравнение химической реакции HCl + CaCO3 является-
СаСО3 (с) + 2H+ (водн.) + 2Cl– (водн.) = Ca2+ (водн.) + 2Cl– (водн.) + CO2 (г) + Н2О (л).
HCl + СаСО3 Сопряженные парыСопряженные пары (пара соединений отличаются одним протоном) уравнение HCl + CaCO3 является-
HCl + СаСО3 = Кл– + HCaСО3+.
Компания межмолекулярные силы действуют на HCl и CaCO3 находятся-
- Электростатическая сила притяжения действует на CaCO3 потому что это ионное соединение. CA2+ и СО32- ионы присоединяются благодаря этой сильной силе притяжения.
- Будучи ковалентным соединением, диполь-дипольное взаимодействие и Лондонские дисперсионные силы работают с молекулами HCl.
Компания энтальпия изменение реакции HCl + CaCO3 составляет -15.2 кДж/моль и получается из математического расчета написано ниже.
- Энтальпия стороны реагента составляет -1206.9 кДж/моль (для CaCO3) и 167.16 кДж/моль (для HCl). Значения энтальпии для стороны продукта составляют -877.
 1 (CaCl2), -285.83 (Н2О) и -393.51 (СО2) кДж/моль.
1 (CaCl2), -285.83 (Н2О) и -393.51 (СО2) кДж/моль. - Изменение энтальпии = {Энтальпия (продуктов) – Энтальпия (реагентов)} = [-877.1 – 285.83 – 393.51 – {-1206.9 + 2×(-167.16)}] кДж/моль. = -15.22 кДж/моль.
HCl + СаСО3 не буферный раствор потому что это не смесь ни слабой кислоты и сопряженного с ней основания, ни слабого основания и сопряженной с ним кислоты. В этой смеси HCl является сильной кислотой, а CaCO3 представляет собой карбонат металла, который действует как основание.
HCl + CaCO3 полная реакция?HCl + СаСО3 не может быть полной реакцией, потому что здесь написаны только реагенты. Если продукты также написаны с реагентами, то это будет считаться полной реакцией.
HCl + CaCO3 экзотермическая или эндотермическая реакция?HCl + СаСО3 является примером экзотермическая реакция потому что изменение энтальпии в этой реакции отрицательно и составляет -15. 22 кДж/моль.
22 кДж/моль.
HCl+СаСО3 не является окислительно-восстановительной реакцией, поскольку в этой реакции не происходит переноса электрона. Это реакция нейтрализации, происходящая между кислотой и основанием.
HCl + CaCO3 реакция осаждения?HCl+СаСО3 не является реакцией осаждения, поскольку продукты не образуются в виде осадка. Хлорид кальция (CaCl2) полностью растворим в воде и CO2 выходит в виде газа из реакционной среды.
HCl + CaCO3 обратимая или необратимая реакция?HCl+СаСО3 не обратимая реакция потому что газообразный продукт (CO2) получается со стороны продукта, а молекулы газа обладают большой энтропией. По этой причине сторона продукта более стабильна, чем сторона реагента, и равновесие реакции смещается в прямом направлении.
HCl+СаСО3 является реакцией двойного замещения, потому что в этой реакции связи в двух реагирующих химических веществах разрываются, и эти два химических вещества реагируют путем обмена ионами.
Двойная реакция смещенияКак сбалансировать CaCO3 + NaOH + HCl → NaHCO3 + CaCl2 + H2O?- Сначала напишите несбалансированное химическое уравнение. СаСО3 + NaOH + HCl → NaHCO3 + CaCl2 + H2O.
- Количество молей каждого элемента в реагенте и стороне продукта должно быть подтверждено.
| элементы | Количество родинок в сторона реагента | Количество родинок в сторона продукта |
| Ca | 1 | 1 |
| C | 1 | 1 |
| O | 4 | 4 |
| H | 2 | 3 |
| Cl | 1 | 2 |
| Na | 1 | 1 |
- Чтобы сбалансировать обе стороны, мы должны умножить 2 перед HCl, чтобы сбалансировать количество молей водорода и хлора.
 Остальные элементы присутствуют с одинаковыми молярными числами как в реагенте, так и в продукте.
Остальные элементы присутствуют с одинаковыми молярными числами как в реагенте, так и в продукте. - Следовательно, сбалансированное уравнение будет – СаСО3 (водн.) + NaOH (водн.) + 2HCl (водн.) = CaCl2 (водн.) + NaHCO3 (вод) + H2О (л).
Заключение
Мы можем рассчитать процент чистоты с помощью этой реакции, потому что примеси в CaCO3 не может реагировать с HCl. Мы также можем производить углекислый газ посредством этой реакции.
Задачи Крюкова / Кинетика 4
За ходом химической реакции взаимодействия CaCO3 (т) с разбавленной соляной кислотой:
CaCO3 (т) + 2HCl(aq) = CaCl2 (aq) + CO2 (г) + h3O(ж)
следили по изменению объема выделенного газа CO2 за равные промежутки времени. Были получены следующие данные:
t, с | 0 | 15 | 30 | 45 | 50 | 100 | ∞ |
VCO2, см3 | 0 | 27 | 47 | 57 | 69 | 75 | 80 |
Рассчитайте константу скорости данной
реакции, считая ее реакцией первого
порядка по HCl и нулевого порядка по CaCO3
(т).
Решение
Реакция нулевого порядка по CaCO3 (т), по нему неудобно измерять уменьшение вещества за равные промежутки времени, поэтому решаем по HCl.
В реакции CaCO3 (т) + 2HCl(aq) = CaCl2 (aq) + CO2 (г) + h3O(ж)
в начальный момент времени концентрации:
соляной кислоты – C0(HCl) моль/л;
углекислого газа – 0 моль/л.
После начала реакции концентрации будут равны:
соляной кислоты – C0(HCl) — 2x (так как в реакции 2HCl) моль/л;
углекислого газа – x моль/л.
Реакция первого порядка по HCl, не нужно пересчитывать объем, так как для таких реакций объем пропорционален концентрации.
Рассчитаем константу скорости реакции:
Для данной реакции:
,
где — максимальный объем CO2
при времени t = ∞,
который будет пропорционален начальной
концентрации HCl.
Вычислим константы:
Среднее значение константы скорости реакции равно 0,0304 с-1
Ответ: k = 0,0304 с-1
Вещество А смешано с В и С в равных концентрациях (С0 = 0,2 моль/дм3). Через 20 мин осталось 50 % вещества А. Сколько вещества А останется через 40 мин, если реакция имеет нулевой, первый, второй, третий порядок?
Решение
вещество | A | B | |
моль/л | 0,2 | 0,2 | 0,2 |
Для реакции нулевого порядка константа скорости равна:
Тогда
Для реакции первого порядка константа скорости равна:
Тогда
;
;
Для реакции второго порядка константа скорости равна:
Тогда
;
;
Для реакции третьего порядка константа скорости равна:
Тогда
Ответ: если
реакция имеет нулевой порядок, то через
40 минут вещества А не останется; если
реакция имеет первый порядок, то через
40 минут останется 0,0493 моль/л вещества
А; если реакция имеет второй порядок,
то через 40 минут останется 0,8 моль/л
вещества А; если реакция имеет третий
порядок, то через 40 минут останется
0,0756 моль/л вещества А.
Монохлоруксусная кислота при 298 К взаимодействует с водой (вода взята в большом избытке):
Сh3ClCOOH + h3O = Ch3(OH)COOH + HCl
Кинетика этой реакции изучалась путем титрования проб одинакового объема раствором щелочи. Результаты титрования приведены ниже:
Время, мин | 0 | 600 | 780 | 2070 |
Количество щелочи, мл | 12,9 | 15,8 | 16,4 | 20,5 |
Вычислить
константу скорости и рассчитать, сколько
времени после начала реакции необходимо,
чтобы все три кислоты присутствовали
в эквивалентных количествах.
Решение
В начальный момент времени титруется только монохлоруксусная кислота, но с течением реакции образуются соляная и гликолевая кислоты, которые также титруются. Вода взята в большом избытке, поэтому мы не можем определить общий порядок реакции, а только по монохлоруксусной кислоте. Попробуем подобрать порядок реакции методом подстановки.
Константа скорости для реакции первого порядка равна
Реакция первого порядка, не нужно пересчитывать объем, так как для таких реакций объем пропорционален концентрации.
В начальный момент времени концентрации:
монохлоруксусной кислоты –
гликолевой кислоты – 0 моль/л
соляной кислоты – 0 моль/л
После начала реакции концентрации будут равны:
монохлоруксусной кислоты –
гликолевой кислоты – моль/л
соляной кислоты – моль/л
Щелочь титрует все три кислоты, значит считаем концентрацию
В формулу подставим объемы пропорциональные каждой концентрации и получим:
Константы скорости первого порядка:
Константы примерно равны, данная реакция – реакция первого порядка, среднее значение равно 4,199 ∙ 10-4 мин-1,
Монохлоруксусная, гликолевая и соляная кислоты будут в эквивалентных количествах, когда останется 50% монохлоруксусной кислоты, то есть нужно найти время ее полураспада по формуле:
Ответ: k
= 4,199 ∙ 10-4 мин-1, t1/2 = 1650,7 мин или 27,5 часов.
Карбонат кальция, соляная кислота и их взаимодействие
Похоже, вы зашли на наш сайт из Германия . Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Как CaCO₃ реагирует с HCl
[Депозитные фотографии]Давайте немного поговорим о взаимодействии между соляной кислотой и карбонатом кальция и природе самих этих соединений.
Карбонат кальция
Объемная модель части кристаллической структуры карбоната кальция CaCO₃ [Викимедиа] CaCO₃ — широко распространенное соединение, содержащееся в меле, извести, мраморе и т.
Карбонат кальция представляет собой твердое белое вещество, которое не растворяется в нем полностью: вода становится мутной, появляется белый осадок. Но если реакция с водой происходит в присутствии углекислого газа, то получается гидрокарбонат кальция, растворимая кислая соль:
CaCO₃ + CO₂ + H₂O → Ca(HCO₃)₂
Посмотрим, как получается карбонат кальция
Большинство карбоната кальция получают из природных источников. Чистый источник, обычно мрамор, обычно используется для получения карбоната кальция, используемого в пищевых красителях.
Мраморная статуя «Давид», Микеланджело ди Лодовико Буонарроти [Депозитные фотографии] Вода смешивается с оксидом кальция с получением гидроксида кальция. Затем через предварительно приготовленный раствор пропускают углекислый газ. Карбонат кальция выпадает в осадок:
Вода смешивается с оксидом кальция с получением гидроксида кальция. Затем через предварительно приготовленный раствор пропускают углекислый газ. Карбонат кальция выпадает в осадок:CaO + H₂O = Ca(OH)₂
Ca(OH)₂ + CO₂ = CaCO₃↓ + H₂O
Оксид кальция, также известный как негашеная или негашеная известь, обычно используется в строительстве. В промышленности оксид кальция, необходимый для вышеуказанного процесса, получают прокаливанием. Кальцинирование — это общее название химического изменения веществ путем обжига или нагревания до высоких температур. Если известняк или мрамор нагреть до температуры 900-1000°C, в результате химических процессов образуется углекислый газ и желаемый оксид кальция CaO:
СаСO₃ = СаО+СО₂↑
Но если температура еще выше (1500°C) и присутствует источник углерода, то в результате реакции образуются карбид кальция и оксид углерода:
СаСО₃ + 4C = СаC₂ + 3СО↑
Соляная кислота
Молекула соляной кислоты [Викимедиа] Соляная кислота является сильной одноосновной кислотой и получается путем растворения хлористого водорода HCl в воде.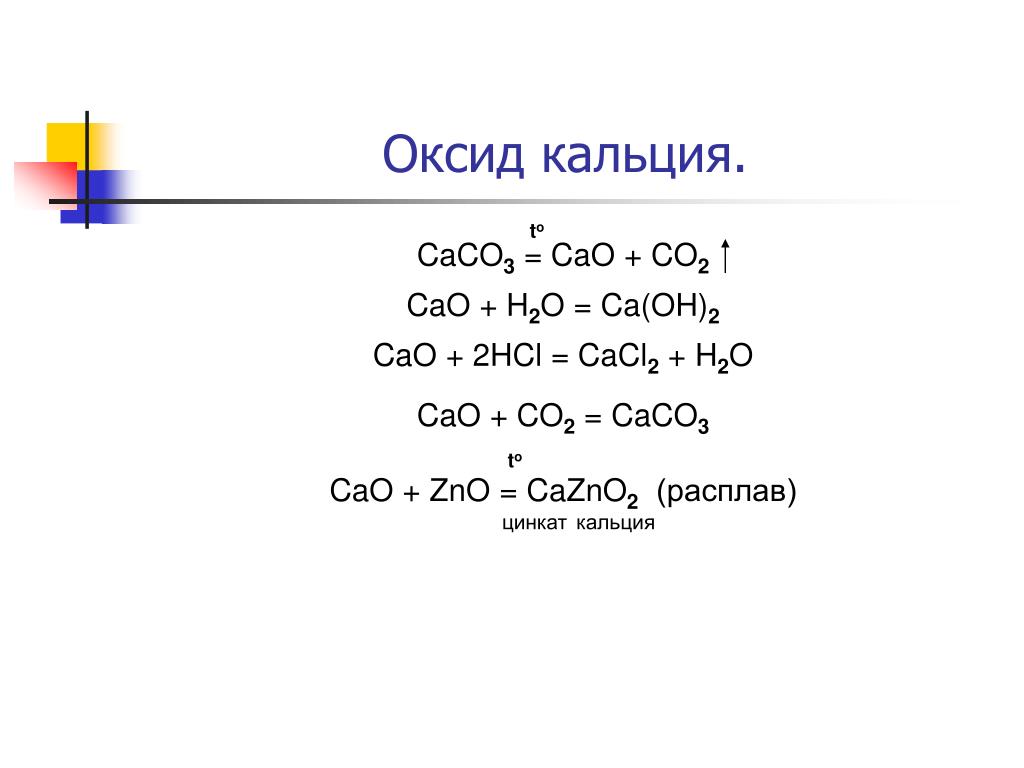 Это бесцветная жидкость, хотя техническая кислота может иметь желтый оттенок, часто из-за примеси железа. Свойства этого раствора напрямую зависят от концентрации хлороводорода. Соли соляной кислоты называются хлоридами.
Это бесцветная жидкость, хотя техническая кислота может иметь желтый оттенок, часто из-за примеси железа. Свойства этого раствора напрямую зависят от концентрации хлороводорода. Соли соляной кислоты называются хлоридами.
Это вещество очень едкое и требует осторожного обращения: даже небольшая капля на кожу вызовет сильный химический ожог. При работе с сильными кислотами всегда нужно иметь под рукой нейтрализаторы – слабые щелочные растворы, бикарбонат натрия (пищевая сода) и т. д. Следует помнить, что при открытии емкости с концентрированной кислотой выделяются пары HCl, способные нанести вред глазам и органам дыхания. При проведении химических опытов рекомендуется использовать респиратор и защитные очки.
Получение соляной кислоты
Газообразный хлористый водород растворяется в воде. Сам хлористый водород получают путем сжигания водорода в хлоре с получением синтетической кислоты. Соляную кислоту также можно получить из вторичных газов, выделяющихся в ряде химических процессов, например, при хлорировании углеводородов. Кислота, полученная этим методом, является технической или технической.
Кислота, полученная этим методом, является технической или технической.
Соляная кислота используется в медицине, промышленности и химических реакциях.
Бесцветная кислота с резким запахом хлористого водорода хорошо реагирует с металлами; атомы металла восстанавливают катионы водорода в окислительно-восстановительной реакции.
Химические реакции с металлами в основном сопровождаются выделением водорода, интенсивность которого зависит от активности металла. Например, щелочной металл литий реагирует бурно, а алюминий реагирует слабо из-за его прочной оксидной пленки.
Hydrochloric acid and zinc:
2HCl + Zn = ZnCl₂ + H₂↑
Hydrochloric acid and iron:
2HCl + Fe = FeCl₂ + H₂↑
Hydrochloric acid and magnesium:
2HCl + Mg = MgCl₂ + H₂ ↑
Хлорид магния, используемый для удаления льда на улицах [Викимедиа]Реакция кислоты с оксидами металлов приводит к образованию соли и воды:
CuO + 2HCl = CuCl₂ + H₂O
Реакция соляной кислоты и карбоната кальция
Вам потребуется:
Внимание! Не пытайтесь проводить этот эксперимент без профессионального наблюдения!
Посмотрите здесь безопасные химические эксперименты, которые вы можете провести дома
Выполняйте этот эксперимент в хорошо проветриваемом помещении. Соблюдайте осторожность при работе с соляной кислотой.
Соблюдайте осторожность при работе с соляной кислотой.
Добавьте в сосуд несколько кусочков мрамора и капните на него соляной кислотой с помощью пипетки. Произойдет мгновенная реакция с образованием пузырьков (выделение углекислого газа). Это реакция обмена, в результате которой образуется слабое и нестабильное соединение, угольная кислота, которая распадается на углекислый газ и воду. Уравнение реакции растворения карбоната кальция в соляной кислоте выглядит следующим образом:
CaCO₃ + 2HCl (разбавленный) → CaCl₂ + CO₂↑ + H₂O
У нас есть для вас еще статьи по химии:
- Как заставить пальцы дымиться Трюк с дымящимися пальцами
- клетка Траубе Как выращивать химические водоросли
Вы можете провести десятки химических опытов дома!
Волшебная жидкость
Учить больше
Попробуй
Реакция нескольких элементов – Lambda Geeks
Карбонат кальция (CaCO 3 ) является основным и легко реагирует с сильной кислотой HCl. Давайте подробно объясним различные важные факты реакции.
Давайте подробно объясним различные важные факты реакции.
Реакция между HCl и CaCO 3 является примером кислотно-щелочной реакции или реакции нейтрализации. Для этой реакции больше не требуется тепла или внешнего давления. Это экзотермическая реакция, которая указывает на то, что продукты более стабильны и обладают меньшей энергией, чем реагенты.
Поговорим о типе реакции, продуктах, межмолекулярных силах, энтальпии, способе уравновешивания и сопряженных парах этой реакции.
Что является продуктом HCl и CaCO 3 ?Карбонат металла CaCO 3 реагирует с сильной кислотой HCl с образованием хлорида кальция (CaCl 2 ), диоксида углерода (CO 2 ) и воды (H 2 O) . Углекислый газ всегда выделяется через раствор, когда карбонат металла реагирует с кислотой.
CaCO 3 (водн.) + 2HCl (водн.) = CaCl 2 (водн. 5 90 HCl + CaCO 3 ?  ) + CO 2 (г) + H 2 O (л) 12
) + CO 2 (г) + H 2 O (л) 12
Реакция между HCl + CaCO 3 является примером кислотно-основной реакции или реакции нейтрализации. В этой реакции кислота HCl полностью нейтрализуется основным веществом CaCO 3 с образованием соли и воды.
Как сбалансировать HCl + CaCO 3 ?Чтобы сбалансировать химическую реакцию, необходимо выполнить следующие шаги:
- Сначала напишите несбалансированное химическое уравнение со стрелкой вправо. CaCO 3 (водн.) + HCl (водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O (л)
- Подсчет присутствующих молей каждый элемент со стороны реагента и продукта.
| Elements | No of moles in reactant side | No of moles in product side | |||
| Ca | 1 | 1 | |||
| C | 1 | 1 | |||
| O | 3 | 3 | |||
| H | 1 | 2 | |||
| 1 | 2 | ||||
| 2 | 201010120101010102A | 2012010101010101010101010101010102A | 12010101010102A | 0204 |
- Чтобы сбалансировать обе стороны (реагент и продукт), мы должны умножить 2 на HCl, чтобы сбалансировать количество молей водорода и хлора.

- Таким образом, сбалансированное уравнение будет таким: ).
В этой реакции требуется обратное титрование HCl + CaCO 3 , поскольку карбонат кальция не растворяется в воде.
ПриборСтакан на 250 мл, мерная колба на 250 мл, коническая колба, бюретка, пипетка (25 мл).
ИндикаторФенолфталеин известен как кислотно-щелочной индикатор.
Процедура- Твердый CaCO 3 помещают в химический стакан и добавляют к нему HCl. После тщательного перемешивания всю смесь переносят в мерную колбу вместимостью 250 мл и доводят до метки дистиллированной водой.
- Пипеткой отберите 25 мл раствора из мерной колбы и поместите в коническую колбу.
 В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора.
В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора. - Титруйте раствор 0,1 М раствором гидроксида натрия (NaOH), взятого в бюретку, до появления бледно-розового окрашивания.
- Для точности повторите титрование не менее трех раз и возьмите среднее значение титра.
- Используя формулу «V 1 S 1 = V 2 S 2 », можно точно определить чистоту CaCO 3 .
Суммарное ионное уравнение химической реакции HCl + CaCO 3 is-
CaCO 3 (тв) + 2H + (водн.) + 2Cl – (водн.) = Ca 2+ (водн.) + 2Cl – 9037 5 2 (9037 водный раствор) г) + Н 2 О (л).
HCL + CaCO 3 Conjugate PairsThe conjugate pairs (pair of compounds differ by one proton) equation of HCl + CaCO 3 is-
HCl + CaCO 3 = Cl – + HCaCO 3 + .
Закон о межмолекулярных силах на HCL и Caco 3 IS-
- 3 IS-ATTRACTION
- 91919175. 3 IS ATATER
- 75 7. ATTRACTIALITATIC 7. 9007. . 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. 9007. . ионное соединение. Ионы Ca 2+ и CO 3 2- присоединяются благодаря этой сильной силе притяжения.
- Будучи ковалентным соединением, диполь-дипольное взаимодействие и дисперсионные силы Лондона действуют на молекулы HCl.
Энтрипийная изменение реакции HCL + CACO 3 —15,2 KJ/моль, и это получено из математического расчета 75676767676.
 75676. 9007 600 75 года.
75676. 9007 600 75 года. - Энтальпия стороны реагента составляет -1206,9 кДж/моль (для CaCO 3 ) и 167,16 кДж/моль (для HCl). Значения энтальпии для продукта составляют -877,1 (CaCl 2 ), -285,83 (H 2 O) и -393,51 (CO 2 ) кДж/моль.
- Изменение энтальпии = {Энтальпия (продуктов) – Энтальпия (реагентов)} = [-877,1 – 285,83 – 393,51 – {-1206,9 + 2×(-167,16)}] кДж/моль. = -15,22 кДж/моль.
HCl + CaCO 3 не является буферным раствором, поскольку он не является смесью ни слабой кислоты и сопряженного с ней основания, ни слабого основания и сопряженной с ней кислоты. В этой смеси HCl является сильной кислотой, а CaCO 3 представляет собой карбонат металла, который действует как основание.
Является ли HCl + CaCO 3 полной реакцией?HCl + CaCO 3 не может быть полной реакцией, потому что здесь указаны только реагенты.
Является ли реакция HCl + CaCO 3 экзотермической или эндотермической? Если продукты также написаны с реагентами, то это будет считаться полной реакцией.
Если продукты также написаны с реагентами, то это будет считаться полной реакцией. HCl + CaCO 3 является примером экзотермической реакции, поскольку изменение энтальпии в этой реакции отрицательно и составляет -15,22 кДж/моль.
Является ли HCl + CaCO 3 окислительно-восстановительной реакцией?HCl +CaCO 3 не является окислительно-восстановительной реакцией, поскольку в этой реакции не происходит переноса электрона. Это реакция нейтрализации, происходящая между кислотой и основанием.
Является HCl + CaCO 3 реакция осаждения?HCl +CaCO 3 не является реакцией осаждения, поскольку продукты не образуются в виде осадка. Хлористый кальций (CaCl 2 ) полностью растворим в воде, и CO 2 выходит в виде газа из реакционной среды.
Является ли реакция HCl + CaCO 3 обратимой или необратимой?
HCl +CaCO 3 не является обратимой реакцией, поскольку газообразный продукт (CO 2 ) получается на стороне продукта, а молекулы газа обладают большой энтропией. По этой причине сторона продукта более стабильна, чем сторона реагента, и равновесие реакции смещается в прямом направлении.
Является ли HCl + CaCO 3 реакцией замещения?HCl +CaCO 3 является реакцией двойного замещения, поскольку в этой реакции связи в двух реагирующих химических веществах разрываются, и эти два химических вещества реагируют путем обмена ионами.
Реакция двойного замещения Как сбалансировать CaCO 3 + NaOH + HCl → NaHCO 3 + CaCl 2 + H 2 O?- Сначала напишите несбалансированное химическое уравнение.
 CaCO 3 + NaOH + HCl → NaHCO 3 + CaCl 2 + H 2 O.
CaCO 3 + NaOH + HCl → NaHCO 3 + CaCl 2 + H 2 O. - Количество молей каждого элемента в реагенте и продукте должно быть указано .
Количество молей элементов в реагенте и продуктеElements No of moles in reactant side No of moles in product side Ca 1 1 C 1 1 O 4 4 H 2 3 Cl 1 2 Na 1 1 - Чтобы сбалансировать обе стороны, мы должны умножить количество молей хлора и водорода HCl на 2 перед HCl, чтобы сбалансировать количество молей водорода и хлора на 2 перед HCl.



 В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора.
В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора. 1 (CaCl2), -285.83 (Н2О) и -393.51 (СО2) кДж/моль.
1 (CaCl2), -285.83 (Н2О) и -393.51 (СО2) кДж/моль.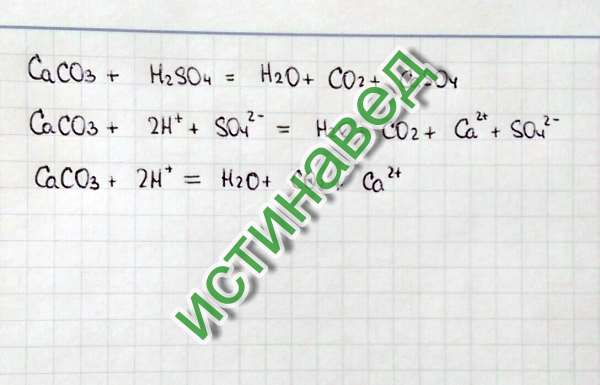 Остальные элементы присутствуют с одинаковыми молярными числами как в реагенте, так и в продукте.
Остальные элементы присутствуют с одинаковыми молярными числами как в реагенте, так и в продукте.
 В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора.
В коническую колбу добавляют фенолфталеин в качестве кислотно-щелочного индикатора. 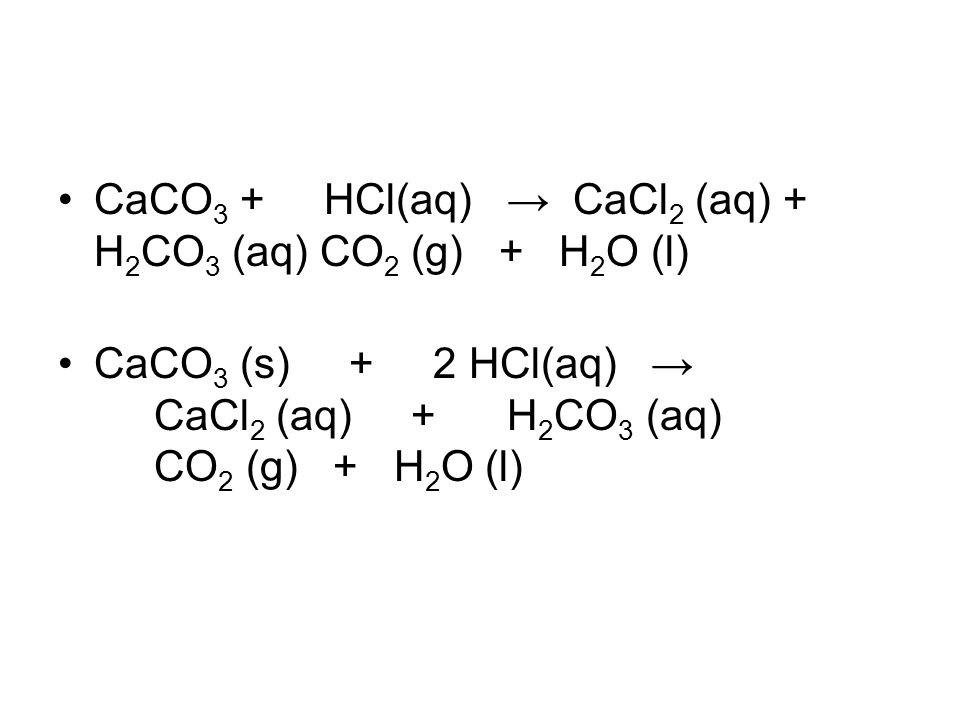 75676. 9007 600 75 года.
75676. 9007 600 75 года.  Если продукты также написаны с реагентами, то это будет считаться полной реакцией.
Если продукты также написаны с реагентами, то это будет считаться полной реакцией. 
 CaCO 3 + NaOH + HCl → NaHCO 3 + CaCl 2 + H 2 O.
CaCO 3 + NaOH + HCl → NaHCO 3 + CaCl 2 + H 2 O.