Окислительно – восстановительные реакции
221.Определите, к какому виду окислительно-восстановительных процессов относятся следующие реакции:
а) KMnO4 + KNO2 + h3SO4 → K2SO4 + MnSO4 + KNO3 + h3O;
б) H2S + SO2 S + H2O;
в) Zn + HNO3 (разб.) Zn (NO3)2 + N2O + H2O.
С помощью метода электронного баланса расставьте коэффициенты в этих уравнениях.
222. Составьте электронные уравнения и расставьте коэффициенты в уравнениях реакций. Укажите, какое вещество является окислителем, какое – восстановителем.
а) P + HNO3(конц.) H3PO4 + NO2+ H2O;
б) S + HNO3 H2SO4 + NO;
в)
Cu + H )
Cu SO4 + SO2 + H2O.
)
Cu SO4 + SO2 + H2O.
223. Определите степени окисления всех компонентов, входящих в состав следующих соединений:HСl,Cl2,HClO2 ,HClO3,Cl2O7. Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьтекоэффициенты в уравнении реакции:
КСlO3 → КС1 + КСlO4.
Укажите окислитель и восстановитель.
224. Используя метод электронного баланса, подберите коэффициенты в уравнениях реакций:
a) Na2SO3 → Na2S + Na2SO4;
б) MnO2 + HCl MnCl2 + Cl2 + H2O;
в) H2S + H2SO3 S + H2O.
225
. Укажите реакции, в которых азот окисляется, восстанавливается, не изменяет степени окисления.
а) P + HNO3 + h3O = h4PO4 + NO;
б) С + HNO3 CO2 + NO + H2O;
в) NH4NO3 + KOH NH4OH + KNO3.
Составьте уравнения электронного баланса, расставьте коэффициенты.
226. Какие из приведенных реакций являются внутримолекулярными?
Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
а) KNO3 KNO2 + O2;
б) Mq+ N2 → Mq3N2;
в) KClO3 KCl+O2.
а) Cl2 + KOH KCl + KClO3 + H2O;
б)
KClO3 kat KCl + KClO4 .
228. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня:NH3,CO,SO2,K2MnO4,Сl2,HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
HNO3 + H2S H2SO4 + NO + H2O.
229. Расставьте коэффициенты в уравнениях реакций. Укажите окислитель, восстановитель.
а) HClO3+ H2SO3 HCl + H2SO4;
б) KClO3 kat KCl + KClO4
в) MnCO3 + KClO3 MnO2 + KCl + CO2.
230. Определите, к какому виду ОВР относятся следующие реакции:
а) H2O + H2SO3 + I2 HI + H2SO4;
б) Fe2O3 + CO = Fe + CO2;
в) h3S + SO2 = S + h3O.
С помощью метода электронного баланса расставьте коэффициенты в этих уравнениях.
231. Определите, к какому типу ОВР относятся процессы, протекающие по схемам:
а) K2Cr2O7 + h3SO4 + h3S → Cr2(SO4)3 + h3O + S + K2SO4;
б) КМnО4 + Н3РО3 + h3SO4 → MnSO4 + Н3РО4 + K2SO4 + Н2О;
в) SO2 + Br2 + h3O = h3SO4 + HBr.
Расставьте коэффициенты в уравнениях реакций. Укажите окислитель, восстановитель.
232. Составьте электронные уравнения, укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
a) S-2 S+6; б) Cu0 Cu+2; в) N+3 N+5.
Используя метод электронно-ионного баланса, расставьте коэффициенты в уравнении реакции, идущей по схеме:
NaI + KMnO4
+ KOH
I2 + K2MnO4 + NaOH.
Укажите окислитель, восстановитель.
233.Исходя из степени окисления хрома, укажите, какие из соединений проявляют только окислительные свойства:Cr,CrO, СrO3,K2Cr2O7. Почему? Расставьте коэффициенты в уравнении реакции, идущей по схеме:
K2Cr2O7 + h3SO4 + 3h3S = Cr2(SO4) + h3O + S + K2SO4.
Укажите окислитель и восстановитель.
234. Составьте электронные уравнения для реакций, протекающих по схемам:
а) KMnO4 + h3О + Na2SO3 = MnО2 + Na2SO4 + КОН;
б) SO2 + h3S = S + h3O;
в) Са + H2O Са(OH)2 + H2.
К какому виду ОВР относятся эти реакции? Расставьте коэффициенты, укажите окислитель и восстановитель.
235. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление — происходит при следующих превращениях:
а)
Cl+7
Cl—;
б) Mn+4 Mn+2;
в) Na0
Na+1.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КМnО4 + Н3РО3 + h3SO4 → MnSO4 + Н3РО4 + K2SO4 + Н2О.
236. Какие соединения и простые вещества могут проявлять как окислительные, так и восстановительные свойства:O2,H2S,Zn,F2,KNO2? Почему?
С помощью метода электронного баланса расставьте коэффициенты в уравнении реакции:
Сu + HNO3 (конц.) Cu(NO3)2 + NO2 + H2O.
237. Определите, к какому виду ОВР относятся следующие реакции:
а) Zn + h3SO4 → ZnSO4+ h3S + h3O;
б) h3S + Cl2 + h3O → h3SO4 + HCl ;
в) P + HIO3 + h3O → h4PO4 + HI
С помощью метода
электронного баланса подберите
коэффициенты в этих уравнениях.
238. Реакции выражаются схемами:
а) P + HNO3 + h3O → h4PO4 + NO;
б) KClO3 + Na2SO3 → KCl + Na2SO4;
в) FeS + HNO3 → Fe(NO3)2 + S + NO + h3O.
Составьте электронные уравнения. Расставьте коэффициенты. Укажите окислитель, восстановитель.
239. Определите степени окисления всех элементов, входящих в соединения:F2,Cu,HCl,H2S,KCl,KNO2. Какие из перечисленных веществ проявляют только восстановительные свойства? Расставьте коэффициенты в уравнении реакции, укажите окислитель, восстановитель:
KBr + KBrO3 + H2SO4 Br2 + K2SO4 + H2O.
240. Определите, к какому типу ОВР относятся процессы, протекающие по схемам:
а) FeSO4 + KClO3 + h3SO4 → Fe2(SO4)3 + KCl + h3O;
б) Au + HNO3 + HCl → AuCl3 + NO + h3O;
в)
HCl + CrO3 → Cl2 + CrCl3 + h3O.
Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель.
Окислительно-восстановительные реакции — Химия — Презентации
ГБПОУ «Починковский сельскохозяйственный техникум»
Окислительно —
восстановительные
реакции
Познавая бесконечное, наука сама бесконечна.
Д.И. Менделеев
Цель урока: сформировать понятие об окислительно-восстановительных реакциях; научить учащихся уравнивать записи ОВР методом электронного баланса
Что мы узнаем
Какие реакции называются окислительно-восстановительными реакциями.
Чему научимся
Уравнивать записи окислительно-восстановительных реакций методом электронного баланса
Проблемная тема урока:
«Кто-то теряет, а кто-то находит»
1 задание
Повторение
Что такое степень окисления?
Сумма степеней окисления химических элементов в соединении равна 0
x
3 ·(-2) + 2 ·x=0
— 2
Al 2 O 3
— 6 + 2 ·x=0
2 ·x=6
X = 3
+ 3
Определите степени окисления элементов в соединениях
- 1 группа – P, Ph4, P2O3, h4PO4
- 2 группа – S, SO2, h3S, Н2SO4
- 3 группа –C, Ch5, CO, h3CO3
- 4 группа –CI2, HCI, CI2O, HCIO4
2 задание
- Определите тип химической связи и распределите их по следующим схемам:
- 1
- 2
- 3
- 4
- 5 Q
- 6 Q
- 1) NaOH + HCl → NaCl + h3O 7) NaNO3 → NaNO2 + O2
- 2)Fe2O3 + h3 → h3O + Fe 8)Al + S → Al2S3
- 3) CaCO3 → CaO + CO2-Q 9) PbO + Al → Al2O3 + Pb
- 4) Fe + Cl2 → FeCl3 10) Al(OH)3 →Al2O3 + h3O-Q
- 5) h3 + CuO → Cu + h3O 11)NaOH + h3SO4 →Na2SO4 + h3O
- 6)C + O2 → CO2+Q 12)Mg + O2 → MgO + Q
- ОВР с участием простых и сложных неорганических веществ
- Выписать из предложенных реакций отдельно овр с участием простых и с участием сложных веществ
- 1.
 2.
2.
Расставление коэффициентов с помощью алгоритма составления электронного баланса
- 1. Запишите формулы исхoдных вeщecтв и прoдуктoв рeaкции:
FeCl 3 + H 2 S → FeCl 2 + S + HCl
- 2. Определите, какое вещество является окислителем, а какое восстановителем и их степени окисления до и после реакции.
Fe +3 Cl 3 + H 2 S -2 → Fe +2 Cl 2 + S 0 + HCl
- 3. Хлорид железа(III) выполняет роль окислителя. Сероводород является восстановителем.
Соcтавьте электронные урaвнeния, вырaжaющиe прoцeccы вoccтанoвлeния и окисления. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов, oтдaвaeмыx восстановителем, и чиcлo электронов, принимaeмыx окислителем:
По измeнeнию степеней окисления oпрeдeлим чиcлo электронов, oтдaвaeмыx восстановителем, и чиcлo электронов, принимaeмыx окислителем:
- восст. S -2 – 2 e = S 0 │ 2 │ 1 процесс окисление
- окис. Fe +3 +1 e = Fe +2 │ │ 2 процесс восстановление
4. Множители электронного баланса запишем в уравнение окислительно-восстановительной реакции кaк ocнoвныe стехиометрические коэффициенты:
2 FeCl 3 + H 2 S → 2FeCl 2 + S + HCl
- 5. Подберем стехиометрические коэффициенты ocтaльныxучacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства вместо стрелки).
- 2FeCl 3 + H 2 S = 2FeCl 2 + S + 2HCl.

- 6. Проверим правильность написания путeм пoдcчeтa aтoмoв кaждoгo элeмeнтa в лeвoй и прaвoй чaстях уравнения реакции.
Восстановление перманганата калия в кислой среде
MnSO 4 + I 2 + K 2 SO 4 + H 2 O
+7
-1
+6
+6
0
+2
KMnO 4 + KI+ H 2 SO 4
Mn +7 + 5e — Mn +2 2 пр. восстан-я окислитель
2I -1 — 2e — I 2 0 5 пр. окисления восстановитель
Молекулярное уравнение:
KMnO 4 + KI + H 2 SO 4 = MnSO 4 + I 2 + K 2 SO 4 + H 2 O
2
2
10
5
6
8
8
Восстановление перманганата калия в щелочной среде
+4
+7
+6
+6
K 2 MnO 4 + K 2 SO 4 +H 2 O
KMnO 4 + K 2 SO 3 + KOH
Mn +7 +1e — Mn +6 2 пр.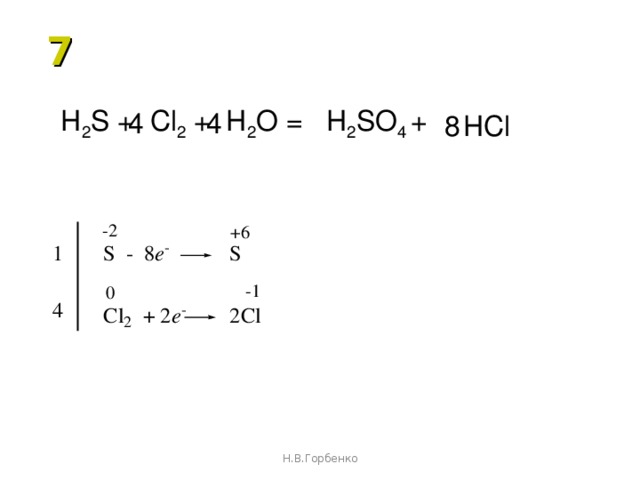 восстон-я окислитель
восстон-я окислитель
S +4 -2e — S +6 1 пр.окисления восстановитель
Молекулярное уравнение:
KMnO 4 + K 2 SO 3 + KOH = K 2 MnO 4 + K 2 SO 4 + H 2 O
2
2
Восстановление дихромата калия в кислой среде
Fe 2 (SO 4 ) 3 + K 2 SO 4 + Cr 2 (SO 4 ) 3 + H 2 O
+6
+2
+3
+3
K 2 Cr 2 O 7 + FeSO 4 + H 2 SO 4
- 2Cr +6 + 6e Cr +3 2 1 пр.восстановления окислитель
- Fe +2 -1e Fe +3 6 пр.окисления восстановитель
Молекулярное уравнение:
- K 2 Cr 2 O 7 + FeSO 4 + H 2 SO 4 → Fe 2 (SO 4 ) 3 +K 2 SO 4 +Cr 2 (SO 4 ) 3 + H 2 O
6
7
3
7
H 2 O 2 (перекись водорода)- восстановитель
+2
+7
-1
0
KMn O 4 + H 2 O 2 +H 2 SO 4 → MnSO 4 + K 2 SO 4 + O 2 + H 2 O
Mn +7 +5e Mn +2 2 пр. восстановления окислитель
восстановления окислитель
2O -1 -2e O 0 2 5 пр.окисления восстановитель
Молекулярное уравнение:
KMnO 4 + H 2 O 2 + H 2 SO 4 → MnSO 4 +K 2 SO 4 + O 2 + H 2 O
5
2
5
2
3
2
- Рефлексия
я научился…
было интересно…
было трудно…
мои ощущения…
больше всего… понравилось…
- Молодцы! Спасибо всем за внимание.
Химия газа и воды напрямую связана с количеством и расположением магмы внутри вулкана
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Дымящиеся фумаролы в кратере Шерман, Маунт-Бейкер, Вашингтон. Вулканические газы выходят через фумаролы, пористую поверхность земли и активные жерла в разные фазы жизни вулкана: когда магма поднимается к поверхности, когда она извергается, и даже когда она остывает и кристаллизуется под землей. Когда поднимающиеся газы сталкиваются с грунтовыми водами, вода действует как фильтр и «очищает» газ от некоторых химических веществ, тем самым изменяя химический состав воды.
Когда поднимающиеся газы сталкиваются с грунтовыми водами, вода действует как фильтр и «очищает» газ от некоторых химических веществ, тем самым изменяя химический состав воды.
Ученые могут многое узнать об изменениях в магматической системе вулкана, 1) измерив изменения скорости выброса определенных ключевых газов, особенно двуокиси серы и двуокиси углерода, и 2) собрав и проанализировав пробы воды для поиска химических веществ, такие как хлористый водород и фтористый водород (оба легко растворяются в воде), которые указывают на то, что вулканический газ был отфильтрован водой.
Источники/использование: общественное достояние.
Отбор проб газа с помощью инфракрасного спектрометра CO2 в лавовом куполе Сентябрьской доли на горе Сент-Хеленс, Вашингтон.Углекислый газ может указывать на новую магму из глубины
Углекислый газ (CO 2 ) отделяется от магмы глубже, чем другие вулканические газы. Если на поверхности будут обнаружены повышенные уровни CO 2 , это может указывать на то, что новая магма входит в вулканическую систему. Регулярно отслеживая содержание CO 2 в вулканах, ученые могут легко обнаружить это увеличение (а также уменьшение), что приводит к лучшему пониманию того, что происходит внутри вулкана. СО 2 также может быть опасным – он может накапливаться в почве и вызывать гибель деревьев и другой растительности, а если он не рассеивается быстро, покидая землю, он может накапливаться в низинах до смертельной концентрации.
Регулярно отслеживая содержание CO 2 в вулканах, ученые могут легко обнаружить это увеличение (а также уменьшение), что приводит к лучшему пониманию того, что происходит внутри вулкана. СО 2 также может быть опасным – он может накапливаться в почве и вызывать гибель деревьев и другой растительности, а если он не рассеивается быстро, покидая землю, он может накапливаться в низинах до смертельной концентрации.
Источники/использование: общественное достояние.
Камера фиксирует выброс SO2 из жерла на вершине Килауэа. Ученый HVO тестирует сетевое соединение между прибором и Гавайской вулканической обсерваторией. CO 2 обычно измеряется с помощью прибора, поглощающего инфракрасное излучение. Эти приборы измеряют концентрацию CO 2 в воздухе или в вулканическом шлейфе. В качестве альтернативы, скорость выброса углекислого газа в результате диффузной дегазации почвы можно определить, поместив на землю так называемую накопительную камеру (по сути, перевернутое ведро) и измерив увеличение концентрации CO 2 с течением времени.
Диоксид серы указывает на наличие магмы у поверхности
Источники/использование: общественное достояние.
Отбор проб газовых баллонов в Вест-Астрингент-Крик, Йеллоустон. Открытая трубка с присоединенной газовой камерой вставлена в землю, газ проходит через трубку в вакуумную колбу, которую держит ученый. Двуокись серы (SO 2 ) выделяется из вулкана, когда магма находится относительно близко к поверхности. Если SO 2 обнаружен в неизвергающемся вулкане, это может быть признаком того, что он скоро извергнется. Отслеживая количество SO 2 , извергаемое из действующего вулкана, можно рассчитать количество магмы, вызвавшей извержение. Однако SO 2 легко растворяется в воде, поэтому, если вулкан имеет обильные поверхностные или подземные воды (например, ледники, кратерные озера, гидротермальная система), становится трудно, а иногда и невозможно определить, сколько диоксида серы фактически выделяется. Различные спектрометры (например, COSPEC и DOAS) используются для измерения скорости вулканических выбросов газообразного диоксида серы.
Различные спектрометры (например, COSPEC и DOAS) используются для измерения скорости вулканических выбросов газообразного диоксида серы.
Когда SO 2 выбрасывается в атмосферу, он быстро образует потенциально опасные сульфатные ареозоли. Они могут вызвать проблемы с дыханием у людей с подветренной стороны вулканического шлейфа (например, ВОГ — вулканический смог). При попадании в верхние слои атмосферы (стратосферу) они могут годами охлаждать климат, отражая падающий солнечный свет обратно в космос.
Источники/использование: общественное достояние. Посетите СМИ, чтобы узнать подробности.
Сотрудники Геологической службы США используют датчик электропроводности/температуры/глубины воды (AquaTroll) для временного исследования вдоль реки Мэдисон в Йеллоустоуне.Сероводород указывает на то, что вулканическая активность относительно спокойна
Когда сернистые газы высвобождаются из магмы и сталкиваются с грунтовыми водами по мере их подъема, сера может вступать в реакцию с водой и образовывать сероводород (H 2 S). Присутствие H 2 S обычно указывает на то, что вулканическая активность относительно спокойна, поскольку подземные воды способны отфильтровывать большую часть газообразной серы, поднимающейся из магмы. Сероводород можно измерить, взяв образец газа, а затем проанализировав полный химический состав в лаборатории.
Присутствие H 2 S обычно указывает на то, что вулканическая активность относительно спокойна, поскольку подземные воды способны отфильтровывать большую часть газообразной серы, поднимающейся из магмы. Сероводород можно измерить, взяв образец газа, а затем проанализировав полный химический состав в лаборатории.
Изменения химического состава воды могут быть ранними сигналами об изменении вулканической активности
Ручьи и реки, текущие по склонам вулканов, могут переносить химические компоненты, поступающие из более глубоких вулканических источников. Собирая образцы воды и анализируя химический состав, ученые могут определить, нагрела ли вода магма или магматические газы. Это особенно ценно для тихих вулканов, где самым ранним признаком изменения активности может быть изменение химического состава воды. Например, содержание хлоридов (Cl) в ручьях вблизи вулканов тесно связано с количеством нагретой воды, поступающей из горячих источников и других типов термальных объектов. Геологическая служба США отслеживает поток Cl в ручьях Йеллоустона с 19 года.70s, чтобы оценить общий тепловой поток из Йеллоустонской системы, и примерно с 2009 года отслеживает поток Cl и других компонентов по всему Каскадному хребту.
Геологическая служба США отслеживает поток Cl в ручьях Йеллоустона с 19 года.70s, чтобы оценить общий тепловой поток из Йеллоустонской системы, и примерно с 2009 года отслеживает поток Cl и других компонентов по всему Каскадному хребту.
Сероводород и общественное здравоохранение
Что такое сероводород?
Сероводород (H 2 S) представляет собой бесцветный газ с характерным запахом тухлых яиц, который, будучи плотнее воздуха, может скапливаться в низинах в тихих условиях.
Откуда берется сероводород?
Сероводород встречается в природе в некоторых средах, таких как серные источники, болота и солончаки, и часто связан с разложением органического материала.
Деятельность человека и отрасли промышленности, которые могут производить сероводород, включают:
- очистные сооружения
- кожевенные заводы
- свинарники
- Операции по обращению с навозом.
В Западной Австралии некоторые прибрежные сообщества подверглись воздействию сероводорода, образовавшегося в результате распада морских водорослей, скопившихся на береговой линии.
Также было обнаружено, что сероводород загрязняет скважинные воды и поверхностные водоемы, обычно в небольших количествах, из-за бактерий, которые превращают серосодержащие материалы в сероводород.
Особенно это может быть в случае нарушения кислых сульфатных почв.
Воздействие сероводорода
Люди обычно подвергаются воздействию сероводорода в воздухе при вдыхании или контакте с кожей/глазами.
Поглощенный сероводород не накапливается в организме, так как быстро метаболизируется в печени и выводится с мочой.
Сероводород обычно разлагается в воздухе примерно за 3 дня и рассеивается ветром.
Таким образом, воздействие может продолжаться только при наличии постоянного источника.
Как сероводород может повлиять на здоровье?
Сероводород имеет характерный запах тухлых яиц, который можно обнаружить при очень низких концентрациях, значительно ниже тех, которые, как известно, оказывают воздействие на здоровье.
Запах сероводорода не означает, что он нанесет вред вашему здоровью.
Запах может вызвать беспокойство, тревогу и обиду. Повторяющиеся явления запаха могут привести к реальным симптомам, таким как головная боль, усталость и тошнота. Хотя это не прямые последствия для здоровья, они нежелательны.
Реальное воздействие сероводорода на человека маловероятно до тех пор, пока уровень в воздухе не достигнет по крайней мере 2 частей на миллион в течение 30 минут.
В этот момент чувствительные группы, такие как некоторые астматики, могут отреагировать незначительными раздражающими изменениями бронхиальной проходимости.
Самый низкий уровень неблагоприятного воздействия на здоровье, по крайней мере, в 500 раз превышает предел обнаружения запаха.
На этом уровне может возникнуть раздражение слизистых оболочек глаз.
Воздействия и воздействие на здоровье воздействия уровней сероводорода, которые могут быть возможными в окружающей среде, показаны в Таблице 1.
Таблица 1. Воздействие и уровни воздействия сероводорода в воздухе. 1
1
| Уровень в воздухе (частей на миллион) | Воздействия и последствия для здоровья |
|---|---|
| 0,008 | Порог запаха (с некоторыми индивидуальными вариациями) |
| 0,008 | Возрастающая вероятность раздражения и головной боли, тошноты, усталости |
| 2 | Бронхиальная рестрикция у некоторых астматиков |
| 4 | Повышенные жалобы на глаза |
| 5-10 | Незначительные метаболические эффекты |
| 20 | Неврологические эффекты, включая потерю памяти и головокружение |
Как это влияет на детей?
Неясно, являются ли дети более чувствительными к сероводороду, чем взрослые, хотя они, вероятно, проявляют те же типы эффектов.
Однако следует соблюдать осторожность, так как дети находятся ниже уровня земли, где сероводород может быть более концентрированным, а активные дети могут вдыхать больше газа.
Существуют ли рекомендации по воздействию сероводорода?
Уровни в воздухе
Департамент здравоохранения Западной Австралии рекомендует руководящие принципы качества воздуха сероводорода, разработанные Всемирной организацией здравоохранения, как показано в таблице 2. 1 Они основаны на эффектах воздействия дозы, описанных выше.
Таблица 2: Рекомендуемые Департаментом H 2 Пределы воздействия S для защиты населения
| Предел (частей на миллион) | Период усреднения |
|---|---|
| 2 | 30 минут |
| 0,1 | 24 часа |
| 0,014 | 90 дней |
Период усреднения – это период времени, в течение которого усредняется измеренный уровень сероводорода в воздухе, и он связан с потенциальными краткосрочными или, возможно, долгосрочными последствиями. Предельное значение 2 ppm связано с бронхиальными эффектами у некоторых чувствительных астматиков, поэтому его не следует превышать. Другие предельные значения имеют встроенные запасы безопасности, поэтому их превышение не обязательно означает последствия для здоровья.
Предельное значение 2 ppm связано с бронхиальными эффектами у некоторых чувствительных астматиков, поэтому его не следует превышать. Другие предельные значения имеют встроенные запасы безопасности, поэтому их превышение не обязательно означает последствия для здоровья.
Уровни в воде
Департамент рекомендует оценивать воду из скважины или любую воду, содержащую более 0,05 мг/л сероводорода, на пригодность для использования человеком. 2,3
Это основано на защите эстетических качеств воды (запах и вкус) и не связано со здоровьем.
Питьевая вода или погружение в воду выше этого уровня загрязнения обычно неприятны.
При высоких концентрациях сероводорода в воде выбросы газа могут представлять опасность для здоровья при неблагоприятных условиях, например, при длительном крупномасштабном орошении вблизи жилых домов.
Порог риска сильно зависит от обстоятельств, но уровни сероводорода 1 мг/л или выше требуют осторожности и проверки обстоятельств использования.
Может ли сероводород повлиять на меня или мою семью?
Воздействие сероводорода на население Западной Австралии почти всегда представляет собой лишь неудобство или проблему с удобствами.
Если люди узнают об этом, тревога и обида, скорее всего, уменьшатся, как и некоторые косвенные последствия запаха для здоровья, такие как головные боли.
Прямое воздействие на здоровье источников сероводорода в окружающей среде возможно только в очень редких случаях. Они, вероятно, будут ограничены чувствительными группами, такими как некоторые астматики, и эффекты, вероятно, будут незначительными и временными.
Как уменьшить воздействие сероводорода?
Если запах сероводорода сильный или вы беспокоитесь о его воздействии на ваше самочувствие или здоровье, вы можете уменьшить воздействие следующим образом:
- избегать мест, которые являются известными источниками сероводорода
- держать окна закрытыми, когда становится заметным запах снаружи, и открывать двери и окна после того, как запах снаружи утихнет
- не заниматься спортом на открытом воздухе при наличии запаха, особенно если у вас учащается частота дыхания.

Если сероводород образуется в результате деятельности человека, то соответствующее управление этой деятельностью может помочь решить проблему у источника.
Например, с промышленными выбросами можно бороться с помощью технологических или инженерных средств контроля, таких как локализация или фильтрующая вентиляция.
Когда буровая вода загрязнена сероводородом, иногда можно обработать скважину реагентом, который удаляет железо из воды и, таким образом, препятствует активности бактерий, вызывающих образование газа.
Компании по очистке воды могут посоветовать подходящие средства.
Использование воды, подвергшейся воздействию сероводорода, для целей орошения может привести к выбросу значительного количества газа, как упоминалось выше. Методы снижения воздействия запаха включают следующее:
- уменьшение количества используемой воды
- с использованием капельниц или устройств доставки, расположенных низко над землей и имеющих крупный размер капель
- полив при достаточном ветре для рассеивания запаха
- полив в ночное время, когда вокруг меньше людей, если ветер достаточный
- десинхронизируется с другим аналогичным использованием скважинной воды.

Для некоторых из этих мер может потребоваться консультация с Департаментом водного хозяйства (внешняя площадка) в случае возможного конфликта со списками полива.
Если сероводород является результатом отложения и разложения морской травы, то обычно он действует только как неприятность.
Осаждение происходит на некоторых пляжах, особенно зимой, и часто удаляется естественным путем последующими штормами. Продолжительное накопление может создавать проблемы с запахом для близлежащих жилых домов или прохожих, особенно если отложение нарушается или когда дуют слабые прибрежные ветры.
Обычно это не представляет потенциального риска для здоровья, за исключением очень большого количества морской травы и серьезного беспокойства, которое периодически происходит в Порт-Географе.
Ссылки
- Международная программа по химической безопасности и Всемирная организация здравоохранения, 2003 г., Краткий международный документ по оценке химических веществ 53 – Сероводород: аспекты здоровья человека.


 2.
2.


