8. Гидролиз солей уровень a
Какие из перечисленных солей подвергаются гидролизу: nh5no2, Na2co3, Al2(so4)3, NaNo3?
Ответ: любую соль можно представить как продукт взаимодействия кислоты и основания:
NH4NO2 Na2CO3
NH4OH + HNO2 NaOH + H2CO3
слаб. слаб. сильн. слаб.
Al2(SO4)3 NaNO3
Al(OH)3 + H2SO
слаб. сильн.
сильн. сильн.
сильн.
сильн. сильн.
Гидролизу подвергаются соли, которые образованы при взаимодействии слабой кислоты и слабого основания; слабой кислоты и сильного основания; сильной кислоты и слабого основания; это соли NH4NO2, Na2CO3, Al2(SO4)3. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются (NaNO3).
Указать реакцию среды водных растворов солей k2so3, ZnCl2, Cr(no3)3, kno3.
Ответ:
K2SO3
KOH + H2SO3
сильн. слаб.
слаб.
Реакция среды определяется сильным электролитом, участвующим в образовании соли. Сульфит калия образован слабой кислотой и сильным основанием, поэтому реакция среды щелочная, рН > 7.
ZnCl2 Cr(NO3)3
Zn(OH)2 + HCl Cr(OH)3 + HNO3
слаб. сильн. слаб. сильн.
Хлорид цинка и нитрат хрома (III) образованы сильной кислотой и слабым основанием,
КNO3
КOH + HNO3
сильн.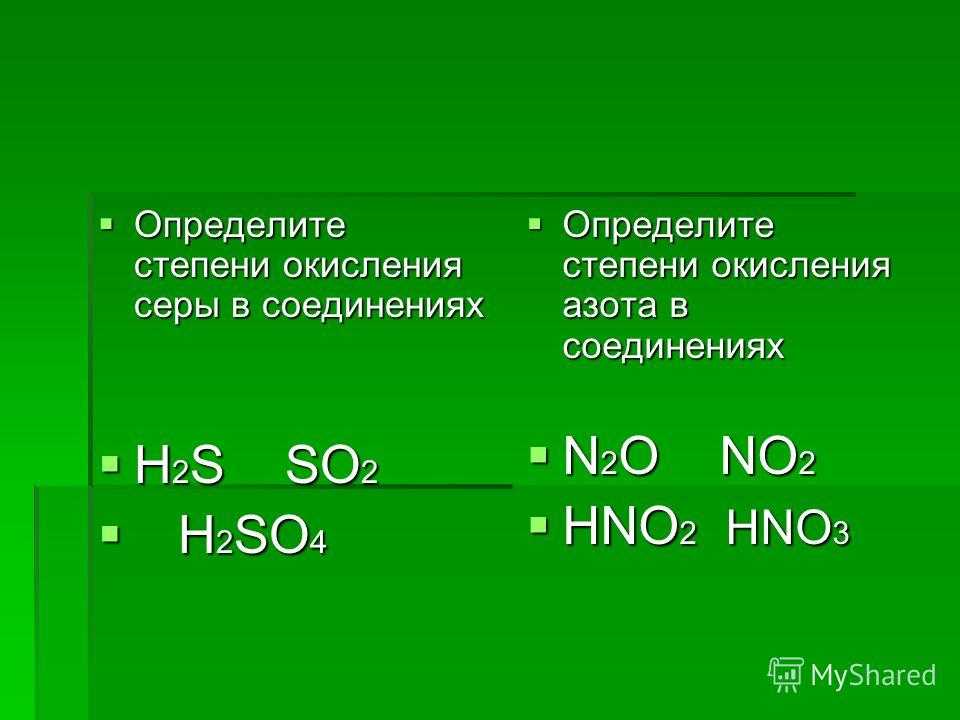 сильн
сильн
Нитрат калия образован сильным основанием и сильной кислотой, гидролизу не подвергается, поэтому реакция среды – нейтральная, рН = 7.
3. Написать полное молекулярное уравнение по данному сокращенному ионно-молекулярному уравнению:
Ca2+ + CО → CaCО3↓.
Ответ: для написания молекулярного уравнения ионы Ca2+ и CО берем из растворимых солей (см. таблицу растворимости). Вторая образующаяся в результате реакции соль в молекулярном уравнении должна быть растворима.
СaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
растворимая растворимая осадок растворима
соль соль соль
9.
 Окислительно-восстановительные реакции уровень а
Окислительно-восстановительные реакции уровень аРасположить перечисленные вещества в порядке уменьшения степени окисления хрома:
Cr2O3 – CrCl2 – K2Cr2O7.
Ответ: алгебраическая сумма степеней окисления отдельных атомов, образующих молекулу, с учетом стехиометрических индексов равна нулю.
Cr Х Сl Сr O
Х + (–1) ∙ 2 = 0 Х ∙ 2 + (–2) ∙ 3 = 0
Х = +2 Х = +3
K Cr O
(+1) ∙ 2 + Х ∙ 2 + (–2) · 7 = 0
Х = +6
K2Cr
O7 – Cr
O3 –
Cr+2Cl2.
2. Составить уравнения для следующих процессов и назвать их:
а) Ni0 → Ni+2
б) 2I— → I 2
в) Cu+2 → Cu0
Ответ:
а) Ni0 – 2е = Ni+2 – процесс окисления;
б) 2I– 2е = I20 – процесс окисления;
в) Cu+2 + 2е = Cu0 – процесс восстановления.
3. Какие свойства (окислительные или восстановительные) проявляют PbO2 ; H2S; KMnO4 ?
Ответ: окислители
– атомы, молекулы или ионы, присоединяющие
электроны, а восстановители – отдающие
электроны. Поэтому чем выше степень
степень окисления иона, тем сильнее он
проявляет окислительные свойства, а
чем ниже степень окисления иона – тем
сильнее его восстановительные свойства.
Поэтому чем выше степень
степень окисления иона, тем сильнее он
проявляет окислительные свойства, а
чем ниже степень окисления иона – тем
сильнее его восстановительные свойства.
Pb+4O2 – окислитель H2S-2 – восстановитель
KMn+7 O4 – окислитель
Химические свойства хрома и его соединений
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Химические свойства
хрома и его соединений.
Место хрома в Периодической системе
химических элементов Д.И. Менделеева.
• Хром расположен в 6 группе Периодической системы химических
элементов Д.И. Менделеева.
• Хром – d-элемент. Валентные электроны атома хрома имеют
электронную конфигурацию 3d44s2, однако вследствие устойчивости d5состояния энергетическим более выгодным оказывается переход
одного s-электрона на 3d-подуровень, поэтому валентные электроны
хрома имеют следующую конфигурацию: 3d54s1. В соединениях хром
проявляет степени окисления +2, +3, +4, +5, +6. Характерная степень
окисления +3, в меньшей мере +6. Соединения хрома (II) проявляют
преимущественно основные свойства, хрома (III) – амфотерные,
соединения хрома (VI) – кислотные.
Распространенность в природе.
• Хром относится к распространенным элементам, его содержание в
земной коре составляет 3,5·10-2 мас. %. В природе встречается только в
Основными минералами являются: хромит (хромистый железняк) FeCr2O4,
крокоит PbCrO4, волконскоит Cr2Si4O10(OH)2 · nh3O, уваровит
Ca3Cr2(SiO4)3 и др.
 В метеоритах обнаружены сульфидные минералы
В метеоритах обнаружены сульфидные минералыхрома. Хром также содержится в океанической воде.
Физические свойства хрома.
• Хром
–
голубовато-белый
металл,
кристаллизуется в объемоцентрированной
кубической решетке с металлическим
типом химической связи. Температура
плавления 1890°С, температура кипения
2680 °C, плотность 7,19 г/см3. Технический
хром – хрупкий металл, при температурах
выше
200–250
°С
приобретает
пластичность, чистый хром пластичен при
обычных условиях. Очень твердый.
• На воздухе
оксида.
покрыт
прочной
пленкой
Химические свойства хрома.
• Хром при обычных условиях – инертный металл, при нагревании становится
довольно активным.
1. Взаимодействие с неметаллами
При нагревании выше 600°С хром сгорает в кислороде:
4Cr + 3O2 = 2Cr2O3
С фтором реагирует при 350°С, с хлором – при 300°С, с бромом – при температуре
красного каления, образуя галогениды хрома (III):
2Cr + 3Cl2 = 2CrCl3
С азотом реагирует при температуре выше 1000°С с образованием нитридов:
2Cr + N2 = 2CrN или 4Cr + N2 = 2Cr2N
Сера при температуре выше 300°С образует сульфиды от CrS до Cr5S8, например:
2Cr + 3S = Cr2S3
Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и
силицидов:
Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4)
2Cr + 3C = Cr2C3 (возможно образование Cr23C6, Cr7B3)
Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi)
С водородом непосредственно не взаимодействует.

В тонкоизмельченном раскаленном состоянии хром реагирует с водой, образуя
оксид хрома (III) и водород:
2Cr + 3h3O = Cr2O3 + 3h3
3. Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов хром находится до
водорода, он вытесняет водород из растворов неокисляющих кислот:
Cr + 2HCl = CrCl2 + h3
Cr + h3SO4 = CrSO4 + h3
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
Концентрированная азотная и серная кислоты пассивируют хром. Хром
может растворяться в них лишь при сильном нагревании, образуются
соли хрома (III) и продукты восстановления кислоты:
2Cr + 6h3SO4 = Cr2(SO4)3 + 3SO2 + 6h3O
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3h3O
4. Взаимодействие с щелочными реагентами
В водных растворах щелочей хром не растворяется, медленно реагирует
с расплавами щелочей с образованием хромитов и выделением
водорода:
2Cr + 6KOH = 2KCrO2 + 2K2O + 3h3
Реагирует с щелочными расплавами окислителей, например хлоратом
калия, при этом хром переходит в хромат калия:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + h3O
5.
 Восстановление металлов из оксидов и солей
Восстановление металлов из оксидов и солейХром – активный металл, способен вытеснять металлы из растворов их
солей:
2Cr + 3CuCl2 = 2CrCl3 + 3Cu
Способы получения хрома.
Хром обычно получают в виде сплава с железом (феррохром). Для этого хромит восстанавливают углем:
FeCr2O4 + 4C = Fe + 2Cr + 4CO
Относительно чистый хром получают методом алюмотермии:
2Al + Cr2O3 = 2Cr + Al2O3
Необходимый для получения металлического хрома оксид выделяют из хромита. Вначале проводят
обжиг исходного хромсодержащего сырья в смеси с карбонатом натрия и доломитом при 1100–1200 °С:
4 FeCr2O4 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2
образующийся при этом хромат натрия выщелачивают водой и после дополнительной обработки
выделяют в щелочной раствор. Затем восстанавливают серой в процессе кипячения до оксида хрома
(III).
Более чистый хром получают электролизом оксида хрома (VI) или хромкалиевых квасцов. Особо чистый
хром образуется при термическом разложении органических хромсодержащих комплексных
соединений.

Соединения хрома (II).
• Оксид хрома (II) CrO
– кристаллическое вещество красного или черного цвета, при
обычной температуре устойчив на воздухе, выше 100°С окисляется:
4CrO + O2 = 2Cr2O3
Сильный восстановитель, реагирует с соляной кислотой с выделением водорода:
2CrO + 6HCl = 2CrCl3 + h3 + 2h3O
С разбавленной серной и азотной кислотой и щелочами не взаимодействует.
Образуется при окислении амальгамы хрома кислородом воздуха:
2Cr/Hg + O2 = 2CrO + 2Hg
или при термическом разложении карбонила:
Cr(CO)6 = CrO + 5CO + C
• Гидроксид хрома (II) Cr(OH)2
– вещество коричневого
или желтого цвета, плохо растворяется в воде, проявляет основные
свойства, медленно реагирует только с концентрированными
кислотами, образуя соли хрома (II) синего цвета:
Cr(OH)2 + h3SO4 = CrSO4 + 2h3O
С разбавленными кислотами и щелочами не взаимодействует.
Хороший восстановитель, легко окисляется кислородом воздуха:
4Cr(OH)2 + O2 + 2h3O = 4Cr(OH)3
Получается при взаимодействии солей хрома (II) со щелочами в
отсутствии кислорода :
CrCl2 + 2NaOH = Cr(OH)2 + 2NaCl
• Соли хрома (II).

Известны галогениды хрома (II), сульфат и
перхлорат, растворы солей окрашены в синий цвет.
Все соли хрома (II) – сильные восстановители, в растворах окисляются
кислородом воздуха:
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2h3O
при отсутствии окислителя восстанавливают даже воду, разлагая её с
выделением водорода:
2CrCl2 + 2h3O = 2CrOHCl2 + H.
Получаются при восстановлении солей хрома (III) водородом в момент
выделения:
2CrCl3 + 3Zn + 4HCl = 2CrCl2 + 3ZnCl2 + 2h3
Галогениды образуются при взаимодействии простых веществ.
Соединения хрома (III).
У хрома степень окисления +3 является наиболее устойчивой.
• Оксид
хрома
– темно-зеленый порошок, в
кристаллическом состоянии – черное с металлическим блеском вещество.
Температура плавления 1990°С, плотность 5,21 г/см3. Химически
инертен. В воде, кислотах и щелочах не растворяется. С трудом
растворяется в сильных кислотах при длительном нагревании.
(III)
Cr2O3
Проявляет амфотерные свойства.
 При сплавлении с оксидами,
При сплавлении с оксидами,гидроксидами и карбонатами щелочных металлов образует хромиты,
проявляя кислотные свойства:
Cr2O3 + 2KOH = 2KCrO2 + h3O
Cr2O3 + Na2CO3 = 2NaCrO2 + CO2
При сплавлении с кислотным реагентом – дисульфатом калия –
образует сульфат хрома (III), проявляя основные свойства:
3K2S2O7 = 3K2SO4 + 3SO3
Cr2O3 + 3SO3 = Cr2(SO4)3
Cr2O3 + 3K2S2O7 = Cr2(SO4)3 + 3K2SO4
Оксид хрома (III) получается при термическом разложении
дихромата аммония:
(Nh5)2Cr2O7 = Cr2O3 + N2 + 4h3O
или при восстановлении дихромата калия коксом или серой:
2K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S = Cr2O3 + K2SO4
• Гидроксид хрома (III) Cr(OH)3 – аморфное или кристаллическое вещество,
цвет зависит от условий осаждения и изменяется от голубого и зеленого до
черно-фиолетового, разлагается при температуре около 150°С:
2Cr(OH)3 = Cr2O3 + 3h3O
Проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
2Cr(OH)3 + 6HCl = 2CrCl3 + 3h3O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Образуется при действии щелочей или водного раствора аммиака на растворы
солей хрома:
CrCl3 + 3Nh4 + 3h3O = Cr(OH)3 + 3Nh5Cl
или при пропускании углекислого
гексагидроксохромата (III) натрия:
Na3[Cr(OH)6] + 3СО2 = Cr(OH)3 + 3NaHCO3
газа
через
щелочной
раствор
• Соли хрома (III).
 Хром в степени окисления +3 образует два типа
Хром в степени окисления +3 образует два типасолей, в которые входит в состав катиона и аниона.
• Хромиты устойчивы в щелочной среде, в кислой разрушаются:
NaCrO2 + HCl + h3O = Cr(OH)3 + NaCl
в избытке кислоты:
NaCrO2 + 4HCl = CrCl3 + NaCl + 2h3O
Соли Cr3+ проявляют все свойства солей, большинство из них хорошо
растворимы в воде и гидролизуют.
Соединения хрома (III) проявляют окислительные и восстановительные
свойства:
2CrCl3 + 3h3O2 + 10 KOH = 2K2CrO4 + 6KCl + 8h3O (Cr3+ – восстановитель)
2CrCl3 + 3Zn + 4HCl = 2CrCl2 + 3ZnCl2 + 2h3 (Cr3+ – окислитель)
Спасибо за внимание!
English Русский Правила
Сбалансируйте следующее уравнение методом степени окисления. Cr((s))+Pb(NO(3))(2(aq))toCr(NO(3))(3(aq))+Pb((s))
Вопрос
Обновлено:26/ 04/2023
ПУБЛИКАЦИЯ ВИКРАМ (ПУБЛИКАЦИЯ АНДХРА)-СТЕХИОМЕТРИЯ-ОЧЕНЬ КРАТКАЯ Ответьте на вопросы
13 видеоРЕКЛАМА
Текстовое решение
Проверено экспертами
Таким образом, сбалансированное уравнение равно 2 Cr + 3Pb(NO3)2→2Cr(NO3 )3+3Pb
Был ли этот ответ полезен?
498 9(3)(водн. ) (xiii) S+HNO_(3) в SO_(2)+NO_(2)+H_(2)O
) (xiii) S+HNO_(3) в SO_(2)+NO_(2)+H_(2)O
148973432
Сбалансируйте следующие химические уравнения.
i) Zn(s)+AgNO3(aq)→Zn(NO3)2(aq)+Ag(s)
161346116
Сбалансируйте следующее уравнение методом степени окисления.
Cr(s)+Pb(NO3)2(aq)→Cr(NO3)3(aq)+Pb(s)
260027040
Среди реакций указаны окислитель и восстановитель в каждом случае: (NH_(4 ))_(2)S(водн.)+Cu(NO_(3))_(2)(водн.) к CuS(s)+2NH_(4)NO_(3)(водн.)
37629(-)
6373
Сбалансируйте следующие уравнения методом степени окисления.
Zn+HNO3→Zn(NO3)2+h3O+Nh5NO3
643652572
Напишите сбалансированное ионное полууравнение (окисление и восстановление) для каждой из следующих реакций:
(а) Mn3+(водн.)→MnO2(s)+ Mn2+(водн.)
(б) Mn(т)+NOӨ3(водн.)→Mn2+(водн.)+NO2(г)
(в) h3O2(водн.)+Fe2+(водн.)→Fe3+(водн.)+h3O(ж)
(г) Te(т)+NOӨ3(водн.)→TeO2(т)+NO(г)
644116405
Степени окисления переходных металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 650
Степень окисления элемента связана с количеством электронов, которые атом теряет, приобретает или, по-видимому, использует при соединении с другим атомом в соединениях. Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько экспериментально наблюдаемых степеней окисления.
Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько экспериментально наблюдаемых степеней окисления.
Введение
Для заполнения атомных орбиталей требуется определенное количество электронов. S-блок состоит из элементов I и II групп, щелочных и щелочноземельных металлов (к этому блоку относятся натрий и кальций). Группы с XIII по XVIII включают p-блок, который содержит неметаллы, галогены и инертные газы (обычными членами являются углерод, азот, кислород, фтор и хлор). Переходные металлы находятся в d-блоке между группами III и XII. Если следующая таблица покажется вам странной или ориентация неясна, просмотрите раздел, посвященный атомным орбиталям.
| с Орбитальный | p Орбиты | d Орбиты |
|---|---|---|
| 1 орбиталь, 2 электрона | 3 орбитали: p x , p y , p z ; 6 электронов | 5 орбиталей: d x 2 -y 2 , d z 2 , d xy , d yz , д хз ; 10 электронов |
| Орбиталь с наивысшей энергией для данного квантового числа n | Вырожденный с s-орбиталью квантового числа n+1 |
Главное, что нужно помнить об электронной конфигурации, это то, что наиболее стабильная конфигурация благородного газа идеальна для любого атома. Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Электронные конфигурации нейтрального атома
Счет в периодической таблице — это простой способ определить, какие электроны находятся на каких орбиталях. Как упоминалось ранее, подсчитав протоны (атомный номер), вы можете определить количество электронов в нейтральном атоме. Организация по блокам ускоряет этот процесс. Например, если бы нас интересовало определение электронной организации ванадия (атомный номер 23), мы бы начали с водорода и продвигались вниз по Периодической таблице).
1s (H, He), 2s (Li, Be), 2p (B, C, N, O, F, Ne), 3s (Na, Mg), 3p (Al, Si, P, S, Cl, Ar), 4s (K, Ca), 3d (Sc, Ti, V).
Если вы не уверены в этой системе счета и в том, как заполняются электронные орбитали, см. раздел о конфигурации электронов.
раздел о конфигурации электронов.
Ссылка на приведенную ниже периодическую таблицу подтверждает эту организацию. У нас есть три элемента на 3d-орбитали. Поэтому пишем в порядке заполнения орбиталей.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3
или
[Ar] 4s 2 3d 3 .
Конфигурации нейтральных атомов переходных металлов четвертого периода приведены в таблице \(\PageIndex{2}\).
| Sc | Ти | В | Кр | Мн | Фе | Ко | Ni | Медь | Цинк |
|---|---|---|---|---|---|---|---|---|---|
| [Ar] 4s 2 3d 1 | [Ar] 4s 2 3d 2 | [Ar] 4s 2 3d 3 | [Ar] 4s 2 3d 4 | [Ar] 4s 2 3d 5 | [Ar] 4s 2 3d 6 | [Ar] 4s 2 3d 7 | [Ar] 4s 2 3d 8 | [Ar] 4s 2 3d 9 | [Ar] 4s 2 3d 10 |
| [Ar] 4s 1 3d 5 | [Ar] 4s 1 3d 10 |
Хром и медь выглядят аномально. Взгляните на место элемента Хром (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Взгляните на место элемента Хром (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Степени окисления ионов переходных металлов
При рассмотрении ионов мы добавляем или вычитаем отрицательные заряды атома. Учет атомных орбиталей при присвоении степеней окисления помогает понять, что переходные металлы представляют собой особый случай, но не исключение из этого удобного метода. Атому, который принимает электрон для достижения более стабильной конфигурации, присваивается степень окисления -1. Пожертвование электрона тогда +1. Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Пример \(\PageIndex{1}\)
Запишите электронные конфигурации:
- нейтральное железо,
- ион железа (II) и
- ион железа(III).
- Ответить
Атомный номер железа равен 26, поэтому в этом веществе 26 протонов.
- Fe: [Ar] 4s 2 3d 6
- Fe 2 + : [Ar] 3d 6
- Fe 3 + : [Ar] 3d 5
Обратите внимание, что s-орбитальные электроны теряются сначала , затем d-орбитальные электроны.
Пример \(\PageIndex{2}\)
Определите более стабильную конфигурацию между следующей парой:
- [Kr] 5s 2 4d 6 по сравнению с [Kr] 5s 1 4д 7
- Ag 1 + против Ag 2 +
- Ответить
- Это описывает рутений.
 Имеется только один 5s электрон.
Имеется только один 5s электрон. - Однократно окисленное серебро ([Kr] 4d 10 ) более стабильно, чем дважды- ([Kr] 4d 9 ).
- Это описывает рутений.
Множественные степени окисления
Большинство переходных металлов имеют несколько степеней окисления, поскольку переходные металлы относительно легко теряют электрон(ы) по сравнению со щелочными металлами и щелочноземельными металлами. Щелочные металлы имеют один электрон на валентной s-орбитали, а их ионы почти всегда имеют степень окисления +1 (из-за потери одного электрона). Точно так же щелочноземельные металлы имеют два электрона на своих валентных s-орбиталях, что приводит к образованию ионов со степенью окисления +2 (из-за потери обоих). Однако переходные металлы более сложны и демонстрируют ряд наблюдаемых степеней окисления, в первую очередь из-за удаления d-орбитальных электронов. В следующей таблице описаны наиболее распространенные степени окисления элементов периода 3.
Скандий — один из двух элементов первого периода переходного металла, который имеет только одну степень окисления (другой — цинк со степенью окисления +2). Все остальные элементы имеют как минимум две различные степени окисления. Марганец, находящийся в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку у него пять неспаренных электронов (см. таблицу ниже).
Чтобы помочь запомнить стабильность более высоких степеней окисления для переходных металлов, важно знать тенденцию: стабильность более высоких степеней окисления постепенно увеличивается вниз по группе. Например, в группе 6 (хром) Cr наиболее стабилен при степени окисления +3, а это означает, что вы не найдете много стабильных форм Cr в степени окисления +4 и +5. Напротив, существует много стабильных форм молибдена (Mo) и вольфрама (W) в степенях окисления +4 и +5.
Пример \(\PageIndex{3}\)
Что делает цинк стабильным в виде Zn 2 + ? Что делает скандий стабильным в виде Sc 3 + ?
- Ответить
Цинк имеет нейтральную конфигурацию [Ar]4s 2 3d 10 .
 Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Пример \(\PageIndex{4}\)
Почему железо почти всегда Fe 2 + или Fe 3 + ?
- Ответить
Железо записывается как [Ar]4s 2 3d 6 . Потеря 2 электронов с s-орбитали (3d 6 ) или 2 s- и 1 d-орбитали (3d 5 ) электрона являются довольно стабильными состояниями окисления.
Пример \(\PageIndex{5}\)
Запишите оксиды марганца в нескольких различных степенях окисления. Какие из них возможны и/или разумны?
- Ответить
Хотя Mn +2 является наиболее стабильным ионом марганца, d-орбиталь может удалять от 0 до 7 электронов.
 Таким образом, соединения марганца варьируются от Mn(0) как Mn (s) , Mn(II) как MnO, Mn(II,III) как Mn 3 O 4 , Mn(IV) как MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Таким образом, соединения марганца варьируются от Mn(0) как Mn (s) , Mn(II) как MnO, Mn(II,III) как Mn 3 O 4 , Mn(IV) как MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Степень окисления переходных металлов в соединениях
При наличии ионного соединения, такого как \(\ce{AgCl}\), можно легко определить степень окисления переходного металла. В этом случае вас попросят определить степень окисления серебра (Ag). Поскольку мы знаем, что хлор (Cl) находится в группе галогенов периодической таблицы, мы знаем, что он имеет заряд -1, или просто Cl — . Кроме того, видя, что для \(\ce{AgCl}\) нет общего заряда (что определяется, глядя на верхний правый угол соединения, т.е. AgCl # , где # представляет собой общий заряд соединения), мы можем заключить, что серебро (\(\ce{Ag}\)) имеет степень окисления +1. Это дает нам Ag + и Cl — , в которых положительный и отрицательный заряд компенсируют друг друга, в результате чего получается общий нейтральный заряд; поэтому +1 подтверждается как степень окисления серебра (Ag).
Пример \(\PageIndex{6}\)
Определите степень окисления кобальта в \(\ce{CoBr2}\).
- 9{-}}\)). Так как есть два брома, каждый с зарядом -1. Кроме того, мы знаем, что \(\ce{CoBr2}\) имеет общий нейтральный заряд, поэтому мы можем сделать вывод, что катион (кобальт), \(\ce{Co}\) должен иметь степень окисления от +2 до нейтрализовать заряд -2 от двух анионов брома.
Пример \(\PageIndex{7}\)
Какова степень окисления цинка в \(\ce{ZnCO3}\). (Примечание: анион \(\ce{CO3}\) имеет зарядовое состояние -2)
- Ответ 9{-}}\).
Этот пример также показывает, что атомы марганца могут иметь степень окисления +7, которая является наивысшей возможной степенью окисления для переходных металлов четвертого периода.
Марганец: тематическое исследование
Марганец широко изучается, поскольку он является важным восстановителем в химическом анализе, а также изучается в биохимии для катализа и в металлургии для обогащения сплавов.
Рисунок \(\PageIndex{2}\): (слева) Грубый фрагмент блестящего серебристого металла (CC BY-SA 3.0; Tomihahndorf через Википедию) (справа) В некоторых наскальных рисунках Ласко используются пигменты на основе марганца. (Общественное достояние; Prof saxx через Википедию) В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.Электронные конфигурации неспаренных электронов называются парамагнитными и реагируют на близость магнитов. Полностью спаренные электроны диамагнитны и не чувствуют этого влияния. Марганец, в частности, имеет парамагнитную и диамагнитную ориентацию в зависимости от его степени окисления. 9{0}\nonumber\]
Поскольку все 3p-орбитали спарены, этот комплекс является диамагнитным.

Резюме
Степени окисления переходных металлов подчиняются общим правилам для большинства других ионов, за исключением того факта, что d-орбиталь вырождается с s-орбиталью с более высоким квантовым числом. Переходные металлы достигают стабильности за счет соответствующего расположения своих электронов и окисляются или теряют электроны на другие атомы и ионы. Эти образующиеся катионы участвуют в образовании координационных комплексов или синтезе других соединений.
Вопросы
Определите степени окисления переходных металлов, обнаруженных в этих нейтральных соединениях. Примечание. В следующих соединениях переходный металл подчеркнут.
(A) Медь(I) Хлорид: Cu Cl (B) Медь(II) Нитрат: Cu (NO 3 ) 2 (C) Золото(V) Фтор: Au F 5 (D) Железо(II) Оксид: Fe O (E) Железо(III) Оксид: Fe 2 O 3 (F) Свинец(II) Хлор: Pb Cl 2 (G) Свинец(II) Нитрат: Pb (NO 3 ) 2 (H) Марганец(II) Хлорид: Mn Cl 2 (I) Молибден триоксид: Mo O 3 (J) Никель(II) Гидроксид: Ni (OH) 2 (K) Платина(IV) Хлорид: Pt Cl 4 (L) Серебро Сульфид: Ag 2 S (M) Вольфрам(VI) Фтор: W F 6 (N) Ванадий(III) Нитрид: V N (O) Цирконий Гидроксид: Zr (OH) 4 - Определите степень окисления переходного металла для общего ненейтрального соединения: Манганат ( Mn O 4 2 — )
- Почему переходные металлы имеют большее число степеней окисления, чем металлы основной группы (т.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)? - Какой переходный металл имеет наибольшее количество степеней окисления?
- Почему число степеней окисления переходных металлов увеличивается в середине группы?
- Какие два переходных металла имеют только одну степень окисления?
Ссылки
- Окстоби Д., Гиллис Х.П., Кэмпион, А. Принципы современной химии, 6 -е -е изд. Томсон Брукс/Коул, Белмонт. 2008 г.; 313-318.
- Audi A, Шервуд, стр. Рентгено-фотоэлектронные спектроскопические исследования валентной зоны марганца и его оксидов, интерпретированные расчетами кластерной и зонной структуры ; Серф. Интерфейс Анал.; 2002 г.; 33; 274-282.
- Reaney S, Kwik-Uribe C, Smith D. Состояние окисления марганца и его последствия для токсичности. Хим. Рез. Токсикол.; 2002 г.; 15; 1119-1126.
- CRC Handbook, 88 th ed. св. 1, пр. 1 Электронная конфигурация и энергия ионизации нейтральных атомов в основном состоянии ; 13-14.


 Имеется только один 5s электрон.
Имеется только один 5s электрон. Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 . Таким образом, соединения марганца варьируются от Mn(0) как Mn (s) , Mn(II) как MnO, Mn(II,III) как Mn 3 O 4 , Mn(IV) как MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Таким образом, соединения марганца варьируются от Mn(0) как Mn (s) , Mn(II) как MnO, Mn(II,III) как Mn 3 O 4 , Mn(IV) как MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее. В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)?