25 полных кратких фактов —
Эта статья содержит только структуру Льюиса HClO2 и ее 31st важные факты подробно. Начнем статью с рисования структуры Льюиса HClO2.
Хлористая кислота или структура Льюиса HClO2 состоит из оксокислоты галогена Cl. Центральный атом Cl представляет собой sp3 гибридизуется в этой кислоте. есть один дπ-pπ связь, присутствующая между Cl и O. Он менее кислый, чем HClO3, из-за нехватки одного атома O. Это бинарное соединение. Степень окисления центрального Cl в структуре Льюиса HClO2 равна +3.
Из-за умеренной степени окисления HClO2 может действовать как окислитель или восстановитель, но действует как окислитель во многих окислительно-восстановительных реакциях. Молекулярная геометрия является тетраэдрической вокруг центрального Cl из-за наличия двух пар неподеленных пар и трех пар связей, одна из которых представляет собой π-связь.
Некоторые факты о HClO2Сопряженным основанием HClO2 является ClO2. –, название которого хлорит, а суффикс оканчивается на «ous» вместо «ite». На основе сопряженного основания кислота получила свое название. исходя из стабильности сопряженного основания, кислота также определяется ее кислотностью и силой. Степень окисления cl в этой кислоте является промежуточной, поэтому она склонна к реакции диспропорционирования и диспропорционирует до хлорноватистой (+1) и хлорноватистой кислоты (+5).
–, название которого хлорит, а суффикс оканчивается на «ous» вместо «ite». На основе сопряженного основания кислота получила свое название. исходя из стабильности сопряженного основания, кислота также определяется ее кислотностью и силой. Степень окисления cl в этой кислоте является промежуточной, поэтому она склонна к реакции диспропорционирования и диспропорционирует до хлорноватистой (+1) и хлорноватистой кислоты (+5).
2 HClO2 → HClO + HClO3
III I IV
Молярная масса HClO2 составляет 68.46 г/моль. Значение pka хлорноватистой кислоты составляет 1.96, поэтому она менее кислая, чем HClO3.
Способ получения HClO2 заключается в реакции хлорита бария или свинца с разбавленной серной кислотой.
Ba (ClO2)2 + H2SO4 → БаСО4 + 2 HClO2
Pb (ClO2)2 + H2SO4 → PbSO4 + 2 HClO2
Только Cl является галогеном, который может образовывать формулу выделяемой кислоты, такой как HXO2, ни бромистая кислота, ни йодистая кислота никогда не могут быть выделены.
Для каждой ковалентной молекулы очень важно нарисовать ее структура Льюиса. Итак, пытаемся нарисовать структуру Льюиса HClO2 следуя некоторым протоколам. Эта структура Льюиса HClO2 помогает нам находить различные ковалентные характеристики.
Структура Льюиса HClO2В процессе рисования структуры Льюиса HClO2 мы должны найти валентные электроны для всей молекулы. Мы рассчитываем валентные электроны для отдельных атомов, присутствующих в структуре Льюиса HClO2, по отдельности и суммируем их. Cl является элементом группы VIIA, поэтому он имеет семь валентных электронов на своей валентной орбитали, O является элементом VIA, поэтому он имеет шесть электронов.s и H имеет только один электрон.
Таким образом, общее количество валентных электронов для структуры Льюиса HClO2 составляет: 7+(6*2)+1 =20 electrons.
Теперь нам нужно выбрать центральный атом для структуры Льюиса HClO2. Cl больше среди всех молекул в HClO2 структура льюиса, поэтому мы выбираем Cl в качестве центрального атома для структуры Льюиса HClO2. Два О и Н присоединены к центральному атому подходящим количеством связей.
Cl больше среди всех молекул в HClO2 структура льюиса, поэтому мы выбираем Cl в качестве центрального атома для структуры Льюиса HClO2. Два О и Н присоединены к центральному атому подходящим количеством связей.
В структуре Льюиса HClO2 все атомы должны следовать правилу октета. Таким образом, согласно правилу октета, электроны, необходимые для каждого атома, равны 2+(3*8) = 26 электронов. Но валентные электроны, рассчитанные ранее для структуры Льюиса HClO2, составляют 20 электронов. Итак, нехватка электронов составляет 26-20 = 6 электронов.
Эта нехватка шести электронов будет аккумулируется 6/2 = 3 связями. Итак, в структуре Льюиса HClO2 будет необходимый минимум 3 связи. Мы добавили все атомы с центральным атомом по необходимому количеству связей.
Два атома O присоединяются к Cl двумя одинарными связями, а h будет присоединен к одному O через одинарную связь. Молекула кислоты HClO2 должен содержать одну группу -OH, поэтому атомы H присоединены к позиции O, а не Cl.
После добавления подходящего количества одинарных связей мы добавили несколько связей, если это необходимо. Чтобы оправдать валентность Cl и O, мы добавили еще одну связь между Cl и O, которая является двойной связью и является dπ-pπ обратная связь Также.
Теперь добавьте неподеленные пары над соответствующими атомами. Два O содержат по две пары неподеленных пар каждый, а Cl также содержит две пары неподеленных пар, которые участвуют в гибридизации.
2. Форма структуры Льюиса HClO2Форма структуры Льюиса HClO2 отвечает за неподеленные пары над центральными атомами Cl, а также за окружающие два атома O. Из-за отталкивания пар неподеленных пар форма несколько отличается от фактической тетраэдрической формы.
HClO2 ФормаГеометрия HClO2 структура Льюиса тетраэдрическая с двумя неподеленными парами над центральным атомом Cl. Но электронная геометрия молекулы угловая. Действительно, без неподеленных пар над атомами Cl форма структура Льюиса HClO2 изогнутая или угловатая.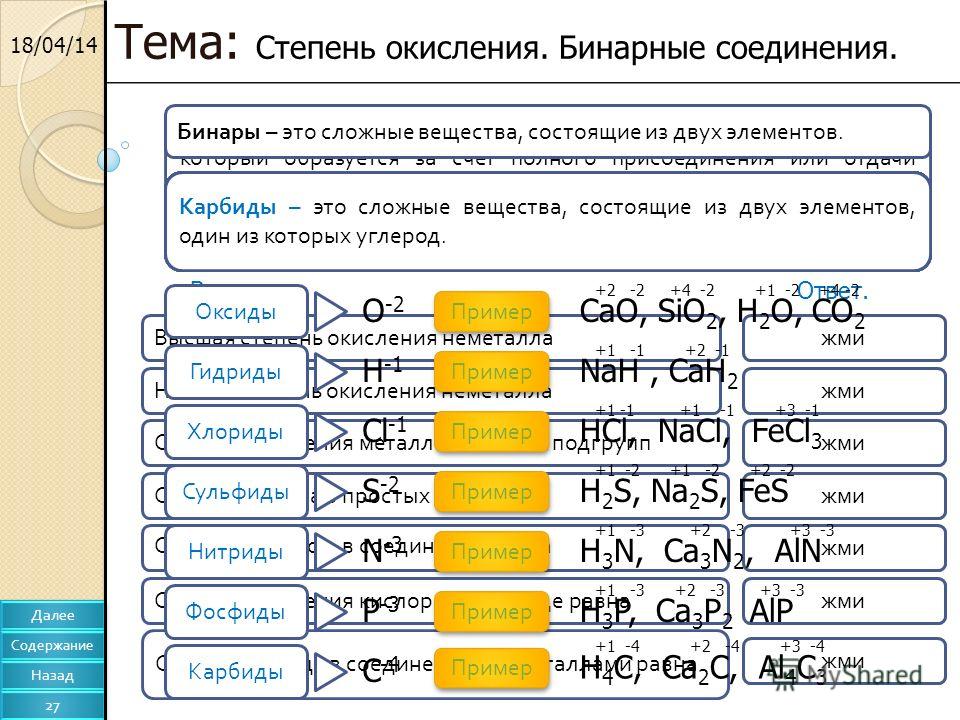
Молекула типа AX2 будет иметь линейную форму в соответствии с теорией VSEPR (электронная пара валентной оболочки). Но если над центральным атомом присутствуют неподеленные пары, то его геометрия или форма будут изменены и отклонятся от идеальной геометрии.
Опять же, из количества электронов для внешней орбитали для окружающих атомов, а также для центрального атома и равно 8, то его форма будет четырехгранной.. Так, если рассматривать неподеленные пары над центральным атомом Cl в HClO2 структура льюиса тогда количество электронов равно 8, и он принимает тетраэдрическую геометрию вместе с двумя парами неподеленных пар.
Но без одиночных пар форма не может быть линейной для структуры Льюиса HClO2 за счет отталкивания электронной плотности атомов O и Cl.
3. Валентные электроны HClO2Общее количество валентных электронов для структуры Льюиса HClO2 представляет собой сумму индивидуальных валентных электронов для каждого атома, присутствующего в молекуле. Мы индивидуально рассчитываем валентные электроны для каждого атома, а затем суммируем их для структуры Льюиса HClO2.
Мы индивидуально рассчитываем валентные электроны для каждого атома, а затем суммируем их для структуры Льюиса HClO2.
Центральным атомом в структуре Льюиса HClO2 является Cl, группа 17th элемент в периодической таблице, поэтому у него семь валентных электронов на валентной орбитали. Эти семь электронов участвуют в образовании связи или неподеленных пар, поэтому мы считаем семь электронов для Cl его валентными электронами.
2nd важным атомом в структуре Льюиса HClO2 является O, это 16 группаth элемент в таблице Менделеева и также принадлежит к группе VIA. Итак, у него есть шесть валентных электронов. Эти шесть электронов участвуют в образовании связи и неподеленных пар в структуре Льюиса HClO2, поэтому мы рассматриваем шесть электронов для O как его валентные электроны.
Оставшийся атом H имеет один валентный электрон на своей орбитали.
Таким образом, общее количество валентных электронов в структуре Льюиса HClO2 равно 7+(6*2)+1 = 20 электронов.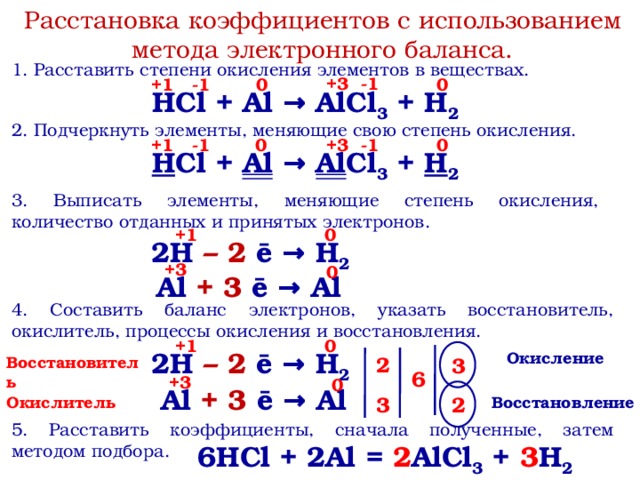
Неподеленные пары доступны для тех атомов, которые имеют много электронов от пары связи на валентной оболочке или орбитали. Только атомы O и Cl имеют неподеленные пары в структуре Льюиса HClO2.
В структуре Льюиса HClO2 CL имеет семь валентных электронов на своей валентной оболочке, но не все электроны участвуют в образовании или донорстве связи, поэтому остальные электроны, не участвующие в образовании связи, существуют в виде неподеленных пар.
Cl использовал только три электрона для образования связи с двумя атомами O, двумя одинарными связями и одной двойной связью. Таким образом, остальные четыре электрона, присутствующие на валентной оболочке Cl в структуре Льюиса HClO2, существуют как две пары неподеленных пар над атомом Cl.
Теперь перейдем к атомам O, O имеет шесть валентных электронов, поскольку он является элементом VIA, и оба O образуют две связи в структуре Льюиса HClO2.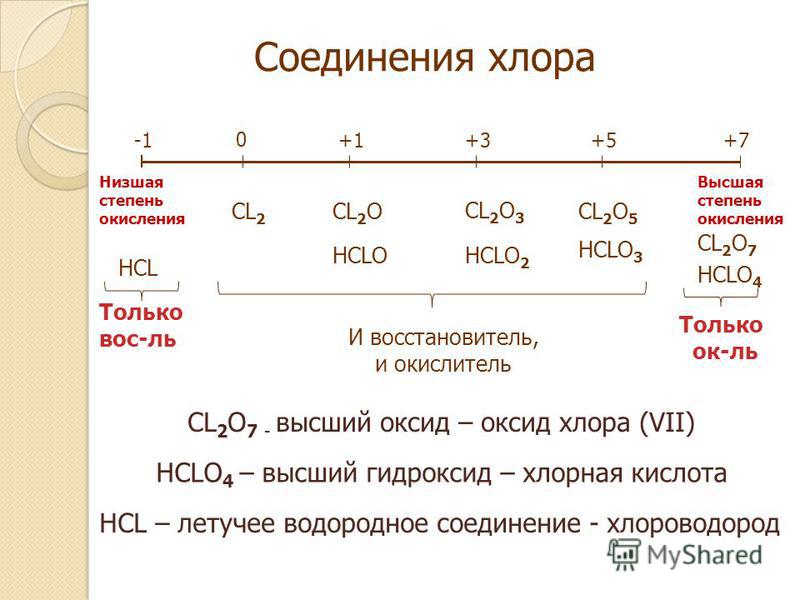 Один атом О составляет одна сигма и одна π связь с Cl, а другой O образует одну одинарную связь с Cl и одну сигма-связь с атомом H.
Один атом О составляет одна сигма и одна π связь с Cl, а другой O образует одну одинарную связь с Cl и одну сигма-связь с атомом H.
Таким образом, в основном два атома O использовали два валентных электрона при образовании связи, а остальные четыре электрона, которые не участвуют в образовании связи, но вносят свой вклад в октет, существуют как две пары неподеленных пар над каждым O атом в структуре Льюиса HClO2.
H не имеет такой возможности, так что это отсутствие одинокой пары.
5. Правило октета структуры Льюиса HClO2Все атомы в периодической таблице после образования связи пытаются завершить свой октет и пытаются получить ближайшую конфигурацию благородного газа для стабильного состояния, особенно блочные элементы s и p всегда следуют правилу октета, а в структуре Льюиса HClO2 все атомы из блоков s и p, поэтому они должны следовать правилу октетов.
Электронная конфигурация Cl представляет собой [Ne]3s23p4, это группа 17th элемент. Cl принадлежит к семейству галогенов и группе VIIA. Из электронной конфигурации центрального атома Cl мы можем сказать, что он имеет семь валентных электронов, которые присутствуют на 3s- и 3p-орбиталях соответственно. Согласно правилу октета, блочный элемент p должен заполнить валентную оболочку восемью электронами, поэтому для завершения октета ему нужен еще один электрон.
Cl принадлежит к семейству галогенов и группе VIIA. Из электронной конфигурации центрального атома Cl мы можем сказать, что он имеет семь валентных электронов, которые присутствуют на 3s- и 3p-орбиталях соответственно. Согласно правилу октета, блочный элемент p должен заполнить валентную оболочку восемью электронами, поэтому для завершения октета ему нужен еще один электрон.
На 3p-орбитали атома Cl пять электронов, а максимальное количество электронов, накопленных p-орбиталью, равно шести, теперь она образует две одинарные связи с двумя атомами O, общими с двумя электронами. Теперь у него есть шесть электронов на его 3p-орбитали, подвергающейся гибридизации. Итак, Cl выполняет свой октет, образуя связи с О, подвергающимся гибридизации.
Теперь для O электронная конфигурация: [He] 2s22p4. О группа 16th элемент и элемент VIA. Итак, у него шесть валентных электронов, из которых два электрона находятся на 2s-орбитали и четыре электрона на 2p-орбитали. O также является ар-блочным элементом, поэтому он должен следовать правилу октетов, завершая свою 2p-орбиталь шестью электронами.
O также является ар-блочным элементом, поэтому он должен следовать правилу октетов, завершая свою 2p-орбиталь шестью электронами.
Теперь O образует две связи, одну с Cl и одну с H, или двойную связь с атомами Cl. В этих двух связях O имеет два общих электрона, а два других электрона приходятся на сайт Cl или H. Таким образом, после участия в формировании связи O завершает свой октет, выполняя свою 2p-орбиталь шестью электронами и два электрона уже находятся на 2s-орбитали.
H является блочным элементом, имеющим один электрон на своей орбитали. Чтобы s-блочный элемент выполнял правило октета, ему нужно два электрона на s-орбитали, потому что s-орбиталь может накапливать максимум два электрона, поскольку она имеет одну подоболочку. Таким образом, H образует связь с O, чтобы разделить один из своих электронов, а другой — с сайта O, чтобы завершить свой октет.
6. Формальный заряд структуры Льюиса HClO2Степень окисления Cl в структуре Льюиса HClO2 равна +3, но мы не можем предсказать, является ли молекула заряженной или нейтральной. Итак, мы должны рассчитать формальный заряд молекулы, учитывая одинаковую электроотрицательность для каждого заместителя.
Итак, мы должны рассчитать формальный заряд молекулы, учитывая одинаковую электроотрицательность для каждого заместителя.
Формула, которую мы можем использовать для расчета формального заряда, ФК = Нv — NЛ.П. -1/2 Нбп
Где Nv — количество электронов на валентной оболочке или на самой внешней орбитали, Nлп — количество электронов в неподеленной паре, а Nбп это общее число электронов, которые участвуют только в образовании связи.
В структуре Льюиса HClO2 присутствуют три разных заместителя, поэтому нам необходимо рассчитать формальный заряд для отдельного атома.
Формальный заряд Cl: 7-4-(6/2) = 0
Формальный заряд O равен 6-4-(4/2) = 0.
Формальный заряд H: 1-0-(2/2) = 0
Так, из расчета формального заряда структуры Льюиса HClO2 видно, что молекула нейтральна и заряд на ней не появляется или заряд нейтрализуется полностью.
Из-за отталкивания пар неподеленных пар валентный угол уменьшается по сравнению с ожидаемым значением в структуре Льюиса HClO2. Если присутствует какой-либо фактор отклонения, то валентный угол всегда отклоняется для правильной ориентации атомов в молекуле.
Угол связи HClO2Геометрия вокруг центрального Cl в структуре Льюиса HClO2 является тетраэдрической вместе с двумя парами неподеленных пар. Итак, ожидаемый валентный угол должен быть 109.50по теории ВСЕПР. Но здесь, если валентный угол O-Cl-O принимает значение 1090 тогда должно быть сильное отталкивание между двойной связью и неподеленными парами.
Мы знаем, что для неподеленных пар и двойных связей требуется больше места. Итак, молекула больше не будет существовать в своей стабильной форме. Таким образом, избегая такого типа отталкивания, валентный угол O-Cl-O уменьшается по сравнению с его первоначальным значением, и это должен около 1040. На самом деле он принимает форму изогнутого типа, поэтому валентный угол уменьшается для правильной ориентации пар связей, а также одиночных пар.
На самом деле он принимает форму изогнутого типа, поэтому валентный угол уменьшается для правильной ориентации пар связей, а также одиночных пар.
Опять же, другой валентный угол Cl-OH также наблюдается в структуре Льюиса HClO2. Этот валентный угол почти 1040 потому что структура похожа на молекулу воды V-образной формы. На самом деле геометрия вокруг буквы O тетраэдрическая с двумя неподеленными парами, но здесь отталкивание меньше, чем в предыдущем случае, потому что ее Одинарная связь Cl-O присутствует, и длина связи одинарной связи всегда больше, чем двойной связи.
Так, здесь отталкивание неподеленных пар меньше, а валентный угол почти 1040 как молекула воды, так как он принимает ту же форму, что и вода.
8. Резонанс структуры Льюиса в HClO2Сопряженное основание структуры Льюиса HClO2 более резонансно стабилизировано, чем молекула кислоты. В ионе хлора (ClO2–) из-за отрицательного заряда электронные облака могут быть делокализованы между различными формами скелета посредством резонанса.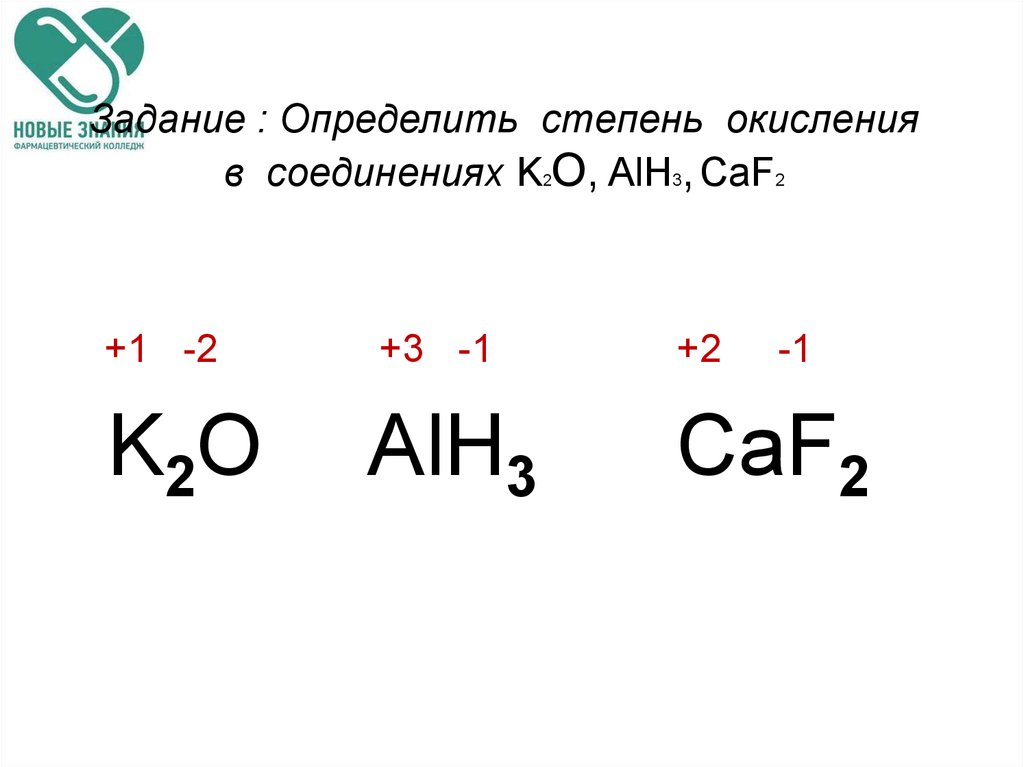
Все три структуры представляют собой различные резонирующие формы сопряженной основы структуры Льюиса HClO2. Среди трех структур III вносит больший вклад в резонанс, поскольку она более стабильна. из-за более ковалентной связиs и отрицательный заряд присутствует над электроотрицательным атомом Cl.
После этой структуры следует структура II, так как она содержит меньшее количество ковалентных связей, чем структура I, но больше, чем структура I. Структура I вносит меньший вклад или менее стабильна, поскольку содержит меньшее количество ковалентных связей и положительный заряд поверх электроотрицательный атом Cl, который является дестабилизирующим фактором.
Общая стабильность сопряженного основания структуры Льюиса HClO2 равна III>II>I.
9. Гибридизация HClO2Энергия орбиталей Cl и O различна, и образовать ковалентную связь непросто, поэтому они подвергаются гибридизации путем смешивания орбиталей с образованием гибридной орбитали эквивалентной орбитали и образованием стабильной ковалентной связи. Центральный Cl — это sp3 гибридизировался здесь.
Центральный Cl — это sp3 гибридизировался здесь.
Мы использовали формулу для предсказания гибридизации структуры Льюиса HClO2:
H = 0.5(V+M-C+A), где H = значение гибридизации, V — количество валентных электронов в центральном атоме, M = одновалентные атомы в окружении, C = нет. катиона, А=нет. аниона.
В структуре Льюиса HClO2 центральным атомом Cl является ½(6+2) = 4 (сп3)
| Структура | Значение гибридизации | Состояние гибридизации центрального атома | Бондовый угол |
| Линейные приводы | 2 | сп/сд/пд | 1800 |
| Планировщик тригональный | 3 | sp2 | 1200 |
| четырехгранный | 4 | sd3/сп3 | 109.50 |
| Тригональный бипирамидальный | 5 | sp3д/дсп3 | 900 (осевой), 1200(экваториальный) |
| восьмигранный | 6 | sp3d2/ д2sp3 | 900 |
| Пятиугольная бипирамидальная | 7 | sp3d3/d3sp3 | 900, 720 |
Из таблицы гибридизации мы можем сказать, что если значение гибридизации для любого центрального атома равно 4 тогда должно быть сп3 гибридизированный.
Рассмотрим гибридизацию центрального Cl в структуре Льюиса HClO2.
HClO2 ГибридизацияИз блочной диаграммы HClO2 структура льюиса, можно сказать, что две пары неподеленных пар над Cl также представляют собой гибридную орбиталь, и мы не можем учитывать π-связь при гибридизации. Здесь задействованы одна s- и три p-орбитали.
10. Растворимость HClO2растворим в HClO2,
- воды
- Бензол
- Четыреххлористый углерод
HClO2 частично ионный и полярный, поэтому он растворим в воде.
12. Является ли HClO2 электролитом?Да, HClO2 является электролитом в водном растворе.
13. Является ли HClO2 сильным электролитом?Да, при электролизе образуются сильные ионы H+, так что это сильный электролит.
14. Является ли HClO2 кислой или основной?Из-за присутствия кислого протона HClO2 является кислой.
HClO2 является сильной кислотой из-за присутствия сильных электроотрицательных атомов Cl и O.
16. Является ли HClO2 полиосновной кислотой?Нет, HClO2 — моноосновная кислота.
17. Является ли HClO2 кислотой Льюиса?Нет, в HClO2 вакантных мест нет.
18. Является ли HClO2 кислотой Аррениуса?HClO2 высвобождает H+ ион в водной среде, поэтому это кислота Аррениуса.
19. Является ли HClO2 полярным или неполярным?Да, HClO2 является полярной молекулой из-за ее асимметричной структуры и результирующего дипольного момента.
20. Линейна ли HClO2?Нет, HClO2 имеет изогнутую форму.
21. Является ли HClO2 парамагнитным или диамагнитным?Из-за отсутствия неспаренных электронов HClO2 диамагнетичен.
22. Температура кипения HClO2Температура кипения HClO2 высокая из-за разрыва двойной связи.
HClO2 является ковалентной молекулой.
24. Является ли HClO2 водородной связью?Нет, в HClO2 нет Н-связи.
25. Является ли HClO2 бинарной или оксокислотой?Да, HClO2 — это бинарная оксокислота галогена.
ЗаключениеHClO2 является сильной кислотой, так как сопряженное с ней основание более стабильно. Кислота менее сильна, чем HClO3, из-за меньшего количества атомов O.
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | ||
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Какова степень окисления хлора?
Химия
Наука
- Анатомия и физиология
- астрономия
- Астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- Физика
Математика
- Алгебра
- Исчисление
- Геометрия
- Преалгебра
- Предварительный расчет
- Статистика
- Тригонометрия
Гуманитарные науки
- Английская грамматика
- История США
- Всемирная история
- Сократическая мета
- Избранные ответы
.
 .. и не только
.. и не толькоТемы
Не исправлено, может быть +1, +3, +5 и +7
Ссылка ответа
Влияние этого вопроса
3396 просмотров по всему миру
Вы можете повторно использовать этот ответ
Лицензия Creative Commons
25 Complete Quick Facts —
Эта статья содержит только структуру Льюиса HClO2 и ее 31 st важных фактов в деталях. Начнем статью с рисования структуры Льюиса HClO2.
Хлористая кислота или HClO2 структура Льюиса состоит из оксокислоты галогена Cl. Центральный атом Cl имеет sp 3 гибридизуются в этой кислоте. Между Cl и O имеется одна связь d π -p π . Она менее кислая, чем HClO3, из-за нехватки одного атома O. Это бинарное соединение. Степень окисления центрального Cl в структуре Льюиса HClO2 равна +3.
Центральный атом Cl имеет sp 3 гибридизуются в этой кислоте. Между Cl и O имеется одна связь d π -p π . Она менее кислая, чем HClO3, из-за нехватки одного атома O. Это бинарное соединение. Степень окисления центрального Cl в структуре Льюиса HClO2 равна +3.
Из-за умеренной степени окисления HClO2 может действовать как окислитель или восстановитель, но во многих окислительно-восстановительных реакциях действует как окислитель. Молекулярная геометрия является тетраэдрической вокруг центрального Cl из-за наличия двух пар неподеленных пар и трех пар связей, одна из которых представляет собой π-связь.
Некоторые факты о HClO2 Сопряженным основанием HClO2 является ClO2 – , название которого – хлорит, а суффикс оканчивается на «ous» вместо «ite». На основе сопряженного основания кислота получила свое название. исходя из стабильности сопряженного основания, кислота также определяется ее кислотностью и силой. Степень окисления cl в этой кислоте является промежуточной, поэтому она подвержена реакции диспропорционирования и диспропорционируется до хлорноватистой (+1) и хлорноватистой кислоты (+5).
Степень окисления cl в этой кислоте является промежуточной, поэтому она подвержена реакции диспропорционирования и диспропорционируется до хлорноватистой (+1) и хлорноватистой кислоты (+5).
2 HClO 2 → HClO + HClO 3
III I I IV
Молярная масса HCl8. Значение pka хлорноватистой кислоты составляет 1,96, поэтому она менее кислая, чем HClO3.
Метод получения HClO2 заключается в реакции хлорита бария или свинца с разбавленной серной кислотой.
Ba(ClO 2 ) 2 + H 2 SO 4 → BaSO 4 + 2 HClO 2
PB (CLO 2 ) 2 + H 2 SO 4 → PBSO 4 + 2 HCLO 2
только Cl — халян, который может формировать Isolable Acidula, как HXO2, как HXO2, как и HXO2, как и HXO2. ни бромистая кислота, ни йодистая кислота никогда не могут быть выделены.
Для каждой ковалентной молекулы очень важно изобразить ее структуру Льюиса. Итак, мы пытаемся нарисовать структуру Льюиса HClO2, следуя некоторым протоколам. Эта структура Льюиса HClO2 помогает нам находить различные ковалентные характеристики.
Структура Льюиса HClO2В процессе рисования структуры Льюиса HClO2 мы должны найти валентные электроны для всей молекулы. Мы рассчитываем валентные электроны для отдельных атомов, присутствующих в структуре Льюиса HClO2, по отдельности и суммируем их. Cl является элементом группы VIIA, поэтому он имеет семь валентных электронов на своей валентной орбитали, O является элементом VIA, поэтому он имеет шесть электронов s, а H имеет только один электрон.
Таким образом, общее количество валентных электронов для структуры Льюиса HClO2 составляет 7+(6*2)+1 =20 электронов.
Теперь нам нужно выбрать центральный атом для структуры Льюиса HClO2. Cl больше всех молекул в структуре Льюиса HClO2, поэтому мы выбрали Cl в качестве центрального атома для структуры Льюиса HClO2. Два О и Н присоединены к центральному атому подходящим количеством связей.
Cl больше всех молекул в структуре Льюиса HClO2, поэтому мы выбрали Cl в качестве центрального атома для структуры Льюиса HClO2. Два О и Н присоединены к центральному атому подходящим количеством связей.
В структуре Льюиса HClO2 все атомы должны подчиняться правилу октетов. Таким образом, согласно правилу октета, электроны, необходимые для каждого атома, составляют 2+(3*8) = 26 электронов . Но валентные электроны, рассчитанные ранее для структуры Льюиса HClO2, составляют 20 электронов. Итак, нехватка электронов составляет 26-20 = 6 электронов.
Эта нехватка шести электронов будет равна накопленным связям 6/2 = 3. Итак, в структуре Льюиса HClO2 будет необходимый минимум 3 связи. Мы добавили все атомы с центральным атомом по необходимому количеству связей.
Два атома O присоединяются к Cl двумя одинарными связями, а h будет присоединен к одному O через одинарную связь. Молекула кислоты HClO2 должен содержать одну группу -OH , поэтому атомы H присоединяются к позиции O, а не Cl.
После добавления подходящего количества одинарных связей мы добавили несколько связей, если это необходимо. Чтобы оправдать валентность Cl и O, мы добавили еще одну связь между Cl и O, которая является двойной связью и представляет собой обратную связь d π -p π .
Теперь добавьте неподеленные пары над соответствующими атомами. Два O содержат по две пары неподеленных пар каждый, а Cl также содержит две пары неподеленных пар, которые участвуют в гибридизации.
2. Форма структуры Льюиса HClO2Форма структуры Льюиса HClO2 отвечает за неподеленные пары над центральными атомами Cl, а также вокруг двух атомов O. Из-за отталкивания пар неподеленных пар форма несколько отличается от фактической тетраэдрической формы.
Форма HClO2 Геометрия структуры Льюиса HClO2 является тетраэдрической с двумя неподеленными парами над центральным атомом Cl. Но электронная геометрия молекулы угловая. На самом деле, без неподеленных пар над атомами Cl форма Структура Льюиса HClO2 изогнутая или угловатая .
Но электронная геометрия молекулы угловая. На самом деле, без неподеленных пар над атомами Cl форма Структура Льюиса HClO2 изогнутая или угловатая .
Молекула типа AX 2 будет иметь линейную форму в соответствии с теорией VSEPR (электронная пара валентной оболочки). Но если над центральным атомом присутствуют неподеленные пары, то его геометрия или форма будут изменены и отклонятся от идеальной геометрии.
Опять же, из количества электронов для внешней орбиты для окружающих атомов, а также для центрального атома и равно 8 , тогда его форма будет тетраэдрической . Итак, если мы рассмотрим неподеленные пары над центральным атомом Cl в структуре Льюиса HClO2, то количество электронов равно 8, и она принимает тетраэдрическую геометрию вместе с двумя парами неподеленных пар.
Но без неподеленных пар форма не может быть линейной для структуры Льюиса HClO2 из-за отталкивания электронной плотности для атомов O и Cl.
Общее количество валентных электронов для структуры Льюиса HClO2 представляет собой сумму отдельных валентных электронов для каждого атома, присутствующего в молекуле. Мы индивидуально рассчитываем валентные электроны для каждого атома, а затем суммируем их для структуры Льюиса HClO2.
Центральным атомом в структуре Льюиса HClO2 является Cl, который является 17-й группой -го -го элемента в периодической таблице, поэтому он имеет семь валентных электронов на валентной орбитали. Эти семь электронов участвуют в образовании связи или неподеленных пар, поэтому мы считаем семь электронов для Cl его валентными электронами.
2 nd важным атомом в структуре Льюиса HClO2 является O, который является элементом группы 16 th в периодической таблице и также принадлежит к группе VIA. Итак, у него шесть валентных электронов . Эти шесть электронов участвуют в образовании связи и неподеленных пар в структуре Льюиса HClO2, поэтому мы рассматриваем шесть электронов для O как его валентные электроны.
Эти шесть электронов участвуют в образовании связи и неподеленных пар в структуре Льюиса HClO2, поэтому мы рассматриваем шесть электронов для O как его валентные электроны.
Оставшийся атом H имеет один валентный электрон на своей орбитали.
Итак, общее количество валентных электронов в структуре Льюиса HClO2 составляет 7+(6*2)+1 = 20 электронов.
4. Неподеленные пары со структурой Льюиса HClO2Неподеленные пары доступны для тех атомов, которые имеют много электронов от пары связи на валентной оболочке или орбитали. Только атомы O и Cl имеют неподеленные пары в структуре Льюиса HClO2.
В структуре Льюиса HClO2 CL имеет семь валентных электронов на своей валентной оболочке, но не все электроны участвуют в образовании или донорстве связи, поэтому остальные электроны, не участвующие в образовании связи, существуют в виде неподеленных пар.
Cl использовал только три электрона для образования связи с двумя атомами O, двумя одинарными связями и одной двойной связью. Таким образом, остальные четыре электрона, присутствующие на валентной оболочке Cl в структуре Льюиса HClO2, существуют как две пары неподеленных пар над атомом Cl .
Таким образом, остальные четыре электрона, присутствующие на валентной оболочке Cl в структуре Льюиса HClO2, существуют как две пары неподеленных пар над атомом Cl .
Теперь перейдем к атомам O, у O шесть валентных электронов, поскольку он является элементом VIA, и оба O образуют две связи в структуре Льюиса HClO2. Один атом O образует одну сигма- и одну π-связь с Cl, а другой O образует одну одинарную связь с Cl и одну сигма-связь с атомом H.
Таким образом, два атома О использовали два валентных электрона для образования связи, а остальные четыре электрона, которые не участвуют в образовании связи, но вносят свой вклад в октет, существуют как две пары неподеленных пар над каждым атомом O в структуре Льюиса HClO2.
H не имеет такой возможности, значит не хватает одиночной пары.
5. Правило октета структуры Льюиса HClO2 Все атомы в периодической таблице после образования связи пытаются завершить свой октет и попытаться получить ближайшую конфигурацию благородного газа для стабильного состояния, особенно s- и p-блочные элементы всегда следуют правило октета, а в структуре Льюиса HClO2 все атомы происходят из блоков s и p, поэтому они должны следовать правилу октета.
Электронная конфигурация Cl: [Ne]3s 2 3p 4 , это группа 17 й элемент . Cl принадлежит к семейству галогенов и группе VIIA. Из электронной конфигурации центрального атома Cl мы можем сказать, что он имеет семь валентных электронов, которые присутствуют на 3s- и 3p-орбиталях соответственно. Согласно правилу октета, блочный элемент p должен заполнять валентную оболочку восемью электронами, поэтому для завершения октета ему нужен еще один электрон.
На 3p-орбитали атома Cl пять электронов, а максимальное количество электронов, накопленных p-орбиталью, равно шести, теперь она образует две одинарные связи с двумя атомами O, общими с двумя электронами. Теперь у него есть шесть электронов на его 3p-орбитали, подвергающейся гибридизации. Итак, Cl выполняет свой октет, образуя связи с О, подвергающимся гибридизации.
Теперь для O электронная конфигурация: [He]2s 2 2p 4 . О группа 16 й элемент и элемент VIA. Итак, у него шесть валентных электронов, из которых два электрона находятся на 2s-орбитали и четыре электрона на 2p-орбитали. O также является элементом p-блока, поэтому он должен следовать правилу октета, завершая свою 2p-орбиталь шестью электронами.
Итак, у него шесть валентных электронов, из которых два электрона находятся на 2s-орбитали и четыре электрона на 2p-орбитали. O также является элементом p-блока, поэтому он должен следовать правилу октета, завершая свою 2p-орбиталь шестью электронами.
Теперь O образует две связи, одну с Cl и одну с H, или двойную связь с атомами Cl. В этих двух связях O имеет два общих электрона, а два других электрона приходятся на сайт Cl или H. Таким образом, после участия в формировании связи O завершает свой октет, выполняя свои 2p-орбиталь шестью электронами и два электрона уже находятся на 2s-орбитали.
H – блочный элемент, имеющий один электрон на орбите. Чтобы s-блочный элемент выполнял правило октета, ему нужно два электрона на s-орбитали, потому что s-орбиталь может накапливать максимум два электрона только потому, что она имеет одну подоболочку. Таким образом, H образует связь с O, чтобы разделить один из своих электронов, а другой — с сайта O, чтобы завершить свой октет.
Степень окисления Cl в структуре Льюиса HClO2 равна +3, но мы не можем предсказать, является ли молекула заряженной или нейтральной. Итак, мы должны рассчитать формальный заряд молекулы, учитывая одинаковую электроотрицательность для каждого заместителя.
Формула, которую мы можем использовать для расчета формальных сборов, F.C. = N v – N л.п. -1/2 Н п.н.
Где N v — число электронов на валентной оболочке или на самой внешней орбитали, N l.p — количество электронов в неподеленной паре, а N b.p — общее количество электронов, которые участвуют только в образовании связи.
В структуре Льюиса HClO2 присутствуют три различных заместителя, поэтому нам необходимо рассчитать формальный заряд для отдельного атома.
Формальный заряд Cl: 7-4-(6/2) = 0
Формальный заряд O: 6-4-(4/2) = 0 , 1-0-(2/2) = 0
Итак, из расчета формального заряда структуры Льюиса HClO2 видно, что молекула нейтральна и заряд на ней не появляется или заряд нейтрализуется полностью.
Из-за отталкивания пар неподеленных пар угол связи уменьшается по сравнению с ожидаемым значением в структуре Льюиса HClO2. Если присутствует какой-либо фактор отклонения, то валентный угол всегда отклоняется для правильной ориентации атомов в молекуле.
Угол связи HClO2Геометрия вокруг центрального Cl в структуре Льюиса HClO2 является тетраэдрической с двумя парами неподеленных пар. Таким образом, ожидаемый валентный угол должен быть 109,5 0 согласно теории VSEPR. Но здесь, если валентный угол O-Cl-O принимает значение 109 0 , тогда должно быть сильное отталкивание между двойной связью и неподеленными парами.
Мы знаем, что для одиночных пар и двойных связей требуется больше места. Таким образом, молекула больше не будет существовать в стабильной форме. Таким образом, избегая такого типа отталкивания, валентный угол O-Cl-O уменьшается по сравнению с его первоначальным значением, и он должен быть рядом 104 0 . На самом деле он принимает форму изогнутого типа, поэтому валентный угол уменьшается для правильной ориентации пар связей, а также одиночных пар.
На самом деле он принимает форму изогнутого типа, поэтому валентный угол уменьшается для правильной ориентации пар связей, а также одиночных пар.
Опять же, другой валентный угол Cl-O-H также наблюдается в структуре Льюиса HClO2. Этот валентный угол составляет почти 104 0 , потому что структура похожа на V-образную молекулу воды. На самом деле геометрия вокруг буквы О тетраэдрическая с двумя неподеленными парами, но здесь отталкивание меньше, чем в предыдущем случае, потому что ее Присутствует одинарная связь Cl-O , и расстояние связи одинарной связи всегда больше, чем у двойной связи.
Таким образом, здесь отталкивание неподеленных пар меньше, а валентный угол почти равен 104 0 , как у молекулы воды , поскольку она принимает ту же форму, что и вода.
8. Резонанс структуры Льюиса HClO2 Сопряженное основание структуры Льюиса HClO2 более резонансно стабилизировано, чем молекула кислоты. В ионе хлора (ClO2 – ) из-за отрицательного заряда электронные облака могут быть делокализованы между различными формами скелета посредством резонанса.
В ионе хлора (ClO2 – ) из-за отрицательного заряда электронные облака могут быть делокализованы между различными формами скелета посредством резонанса.
Все три структуры представляют собой различные резонирующие формы сопряженной основы структуры Льюиса HClO2. Среди трех структур III вносит больший вклад в резонанс, так как она более стабильна из-за большего количества ковалентной связи s, а отрицательный заряд присутствует над электроотрицательным атомом Cl.
После этой структуры следует структура II, так как она содержит меньше ковалентных связей, чем структура I, но больше, чем структура I. Структура I вносит меньший вклад или менее стабильна, поскольку содержит меньше ковалентных связей и положительный заряд поверх нее. электроотрицательный атом Cl, который является фактором дестабилизации.
Общая стабильность сопряженного основания структуры Льюиса HClO2 составляет III>II>I.
Энергии орбиталей Cl и O различны, и образовать ковалентную связь непросто, поэтому они подвергаются гибридизации путем смешивания орбиталей с образованием гибридной орбитали эквивалентной орбитали и образованием стабильной ковалентной связи. Центральный Cl представляет собой sp 3 , гибридизованный здесь.
Мы использовали формулу для предсказания гибридизации структуры Льюиса HClO2: центральный атом, M = одновалентные атомы в окружении, C = нет. катиона, А=нет. аниона.
In the HClO2 lewis structure, the central Cl atom is, ½(6+2) = 4 (sp 3 )
| Structure | Hybridization value | State of hybridization of central atom | Bond Угол |
| Linear | 2 | SP / SD / PD | 180 0 |
| Planner Trigonal | 3 | ||
| 120 0 | |||
| Tetrahedral | 4 | sd 3 / sp 3 | 109.5 0 |
| Trigonal bipyramidal | 5 | sp 3 d/dsp 3 | 90 0 (axial), 120 0 (equatorial) |
| Octahedral | 6 | sp 3 d 2 / d 2 sp 3 | 90 0 |
| Pentagonal bipyramidal | 7 | sp 3 d 3 /d 3 sp 3 | 90 0 ,72 0 |
Из таблицы гибридизации мы можем сказать, что если значение гибридизации для любого центрального атома равно 4, то он должен гибридизоваться sp 3 .
Рассмотрим гибридизацию центрального Cl в структуре Льюиса HClO2.
Гибридизация HClO2Из диаграммы структуры Льюиса HClO2 мы можем сказать, что две пары неподеленных пар над Cl также представляют собой гибридную орбиталь, и мы не можем учитывать π-связь в гибридизации. Здесь задействованы одна s- и три p-орбитали.
10. Растворимость HClO2HClO2 растворим в,
- Вода
- Бензол
- Четыреххлористый углерод
HClO2 частично ионный и полярный, поэтому растворим в воде.
12. Является ли HClO2 электролитом?Да, HClO2 является электролитом в водном растворе.
13. Является ли HClO2 сильным электролитом? Да, при электролизе образуются сильные ионы H+, поэтому это сильный электролит.
Из-за присутствия кислого протона HClO2 является кислой.
15. Является ли HClO2 сильной кислотой?HClO2 является сильной кислотой из-за присутствия сильных электроотрицательных атомов Cl и O.
16. Является ли HClO2 полипротонной кислотой?Нет, HClO2 — моноосновная кислота.
17. Является ли HClO2 кислотой Льюиса?Нет, в HClO2 нет свободных позиций.
18. Является ли HClO2 кислотой Аррениуса?HClO2 выделяет ион H + в водной среде, поэтому это кислота Аррениуса.
19. Является ли HClO2 полярным или неполярным?Да, HClO2 является полярной молекулой из-за ее асимметричной структуры и результирующего дипольного момента.
20. Линейна ли HClO2?Нет, HClO2 имеет изогнутую форму.
21.

 0079
0079