Элементы которые проявляют только положительную степень окисления. Понятие о степени окисления
При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи : NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:
В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:
Такие условные заряды называются степенью окисления . При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
— это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород , второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
I группы во всех соединениях степень окисления равна +1,
II группы равна +2. III группы — +3, например:
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2
(+14):2 = +7.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Названия бинарных соединений состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.
Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
При определении этого понятия условно полагают, что связующие (валентные) электроны переходят к более электроотрицательным атомам (см. Электроотрицательность), а потому соединения состоят как бы из положительно и отрицательно заряженных ионов . Степень окисления может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху.
Нулевое значение степени окисления приписывается атомам элементов, находящихся в свободном состоянии, например: Cu, H 2 , N 2 , P 4 , S 6 .
Алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе — заряду иона. С помощью этого правила вычислим, например, степень окисления фосфора в ортофосфорной кислоте H 3 PO 4 .
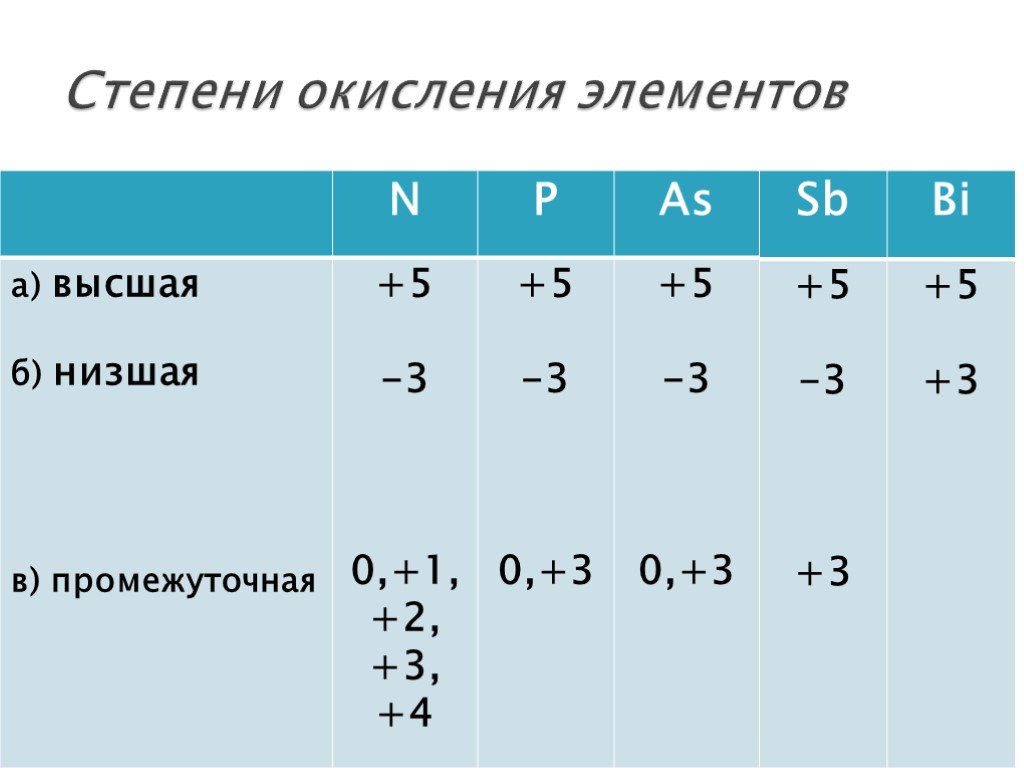
Высшая степень окисления — это наибольшее положительное ее значение. Для большинства элементов она равна номеру группы в периодической системе и является важной количественной характеристикой элемента в его соединениях. Наименьшее значение степени окисления элемента, которое встречается в его соединениях, принято называть низшей степенью окисления; все остальные — промежуточными. Так, для серы высшая степень окисления равна +6, низшая −2, промежуточная +4.
Изменение степеней окисления элементов по группам периодической системы отражает периодичность изменения их химических свойств с ростом порядкового номера.
Понятие степени окисления элементов используется при классификации веществ, описании их свойств, составлении формул соединений и их международных названий. Но особенно широко оно применяется при изучении окислительно-восстановительных реакций . Понятие «степень окисления» часто используют в неорганической химии вместо понятия «валентность» (см.
Задача по определению степени окисления может оказаться как простой формальностью, так и сложной головоломкой. В первую очередь, это будет зависеть от формулы химического соединения, а также наличия элементарных знаний по химии и математике.
Понятие степени окисления
Чтобы научиться определять степень окисления, для начала необходимо разобраться, что это понятие означает?
- Степень окисления применяют при записи в окислительно-восстановительных реакциях, когда происходит передача электронов от атома к атому.
- Степень окисления фиксирует количество перенесенных электронов, обозначая условный заряд атома.
- Степень окисления и валентность зачастую тождественны.
Данное обозначение пишется сверху химического элемента, в его правом углу, и представляет собой целое число со знаком «+» или «-». Нулевое значение степени окисления знака не несет.
Правила определения степени окисления
Рассмотрим основные каноны определения степени окисления:
- Простые элементарные вещества, то есть те, которые состоят из одного вида атомов, всегда будут иметь нулевую степень окисления. Например, Na0, H02, P04
- Существует ряд атомов, имеющих всегда одну, постоянную, степень окисления.
 Приведенные в таблице значения лучше запомнить.
Приведенные в таблице значения лучше запомнить.
- Как видно, исключение бывает лишь у водорода в соединении с металлами, где он приобретает не свойственную ему степень окисления «-1».
- Кислород также принимает степень окисления «+2» в химическом соединении с фтором и «-1» в составах перекисей, надперекисей или озонидов, где атомы кислорода соединены друг с другом.
- Ионы металлов имеют несколько значений степени окисления (причем только положительные), поэтому ее определяют по соседним элементам в соединении. Например, в FeCl3, хлор имеет степень окисления «-1», у него 3 атома, значит умножаем -1 на 3, получаем «-3». Чтобы в сумме степеней окисления соединения получась «0», железо должно иметь степень окисления «+3». В формуле FeCl2, железо, соответственно, изменит свою степень на «+2».
- Математически суммируя степени окисления всех атомов в формуле (с учетом знаков), всегда должно получаться нулевое значение. Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте h3+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0).

- Степень окисления одноатомного иона будет равна его заряду. Например: Na+, Ca+2.
- Наивысшая степень окисления, как правило, соотносится с номером группы в периодической системе Д.И.Менделеева.
Алгоритм действий определения степени окисления
Порядок нахождения степени окисления не сложен, но требует внимания и выполнения определенных действий.
Задача: расставить степени окисления в соединении KMnO4
- Первый элемент – калий, имеет постоянную степень окисления «+1».
Для проверки можно посмотреть в периодическую систему, где калий находится в 1 группе элементов. - Из оставшихся двух элементов, кислород, как правило, принимает степень окисления «-2».
- Получаем следующую формулу: К+1MnхO4-2. Остается определить степень окисления марганца.
Итак, х – неизвестная нам степень окисления марганца. Теперь важно обратить внимание на количество атомов в соединении.
Количество атомов калия – 1, марганца – 1, кислорода – 4.
С учетом электронейтральности молекулы, когда общий (суммарный) заряд равен нулю,
1*(+1) + 1*(х) + 4(-2) = 0,
+1+1х+(-8) = 0,
-7+1х = 0,
(при переносе меняем знак)
1х = +7, х = +7
Таким образом, степень окисления марганца в соединении равна «+7».
Задача: расставить степени окисления в соединении Fe2O3.
- Кислород, как известно, имеет степень окисления «-2» и выступает окислителем. С учетом количества атомов (3), в сумме у кислорода получается значение «-6» (-2*3= -6), т.е. умножаем степень окисления на количество атомов.
- Чтобы уравновесить формулу и привести к нулю, 2 атома железа будут иметь степень окисления «+3» (2*+3=+6).
- В сумме получаем ноль (-6 и +6 = 0).
Задача: расставить степени окисления в соединении Al(NO3)3.
- Атом алюминия – один и имеет постоянную степень окисления «+3».
- Атомов кислорода в молекуле – 9 (3*3), степень окисления кислорода, как известно «-2», значит, умножая эти значения, получаем «-18».

- Осталось уровнять отрицательные и положительные значения, определив таким образом степень окисления азота. -18 и +3, не хватает + 15. А учитывая, что имеется 3 атома азота, легко определить его степень окисления: 15 делим на 3 и получаем 5.
- Степень окисления азота «+5», а формула будет иметь вид: Al+3(N+5O-23)3
- Если сложно таким способом определять искомое значение, можно составлять и решать уравнения:
1*(+3) + 3х + 9*(-2) = 0.
+3+3х-18=0
3х=15
х=5
Итак, степень окисления – достаточно важное понятие в химии, символизирующее состояние атомов в молекуле.
Без знания определенных положений или основ, позволяющих правильно определять степень окисления, невозможно справиться с выполнением этой задачи. Следовательно, вывод один: досконально ознакомиться и изучить правила нахождения степени окисления, четко и лаконично представленные в статье, и смело двигаться дальше по нелегкой стезе химических премудростей.
Степень окисления. Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Степень окисления элемента — это условный заряд атома в веществе, исчисленный с предположением, что она состоит из ионов. Для определения степени окисления элементов необходимо запомнить определенные правила:
1. Степень окисления может быть положительным, отрицательным или равным нулю. Он обозначается арабской цифрой со знаком «плюс» или «минус» над символом элемента.
2. При определении степеней окисления исходят из электроотрицательности вещества: сумма степеней окисления всех атомов в соединении равна нулю.
3. Если соединение образована атомами одного элемента (в простой веществе), то степень окисления этих атомов равен нулю.
4. Атомам некоторых химических элементов обычно приписывают стали степени окисления. Например, степень окисления фтора в соединениях всегда равна -1; лития, натрия, калия, рубидия и цезия +1; магния, кальция, стронция, бария и цинка +2, алюминия +3.
5. Степень окисления водорода в большинстве соединений +1, и только в соединениях с некоторыми металлами он равен -1 (KH, Bah3).
6. Степень окисления кислорода в большинстве соединений -2, и лишь в некоторых соединениях ему приписывают степень окисления -1 (h3O2, Na2O2 или +2 (OF2).
7. Атомы многих химических элементов оказывают переменные степени окисления.
8. Степень окисления атома металла в соединениях положительный и численно равна его валентности.
9. Максимальный положительный степень окисления элемента, как правило, равна номеру группы в периодической системе, в которой находится элемент.
10. Минимальная степень окисления для металлов равна нулю. Для неметаллов в большинстве случаев ниже отрицательный степень окисления равна разнице между номером группы и цифрой восемь.
11. Степень окисления атома образует простой ион (состоит из одного атома), равна заряду этого иона.
Пользуясь приведенным правилам, определим степени окисления химических элементов в составе h3SO4. Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Определим неизвестный степень окисления серы. Пусть степень окисления серы в этой соединении равно х.
Составим уравнения, умножив для каждого элемента его индекс в степень окисления и добытую сумму приравняем к нулю: 2 · (+1) + x + 4 · (-2) = 0
2 + X — 8 = 0
x = +8 — 2 = +6
Следовательно, степень окисления серы равна плюс шесть.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов. Составим формулу феррум (III) оксида. Слово «оксид» означает, что справа от символа железа надо записать символ кислорода: FeO.
Отметим степени окисления химических элементов над их символами. Степень окисления железа указана в названии в скобках (III), следовательно, равна +3, степень окисления кислорода в оксидах -2.
Найдем наименьшее общее кратное для чисел 3 и 2, это 6. Разделим число 6 на 3, получим число 2 — это индекс для железа. Разделим число 6 на 2, получим число 3 — это индекс для кислорода.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов и зарядами ионов. Составим формулу кальций ортофосфата. Слово «ортофосфат» означает, что справа от символа Кальция надо записать кислотный остаток ортофосфатнои кислоты: CaPO4.
Отметим степень окисления кальция (правило номер четыре) и заряд кислотного остатка (по таблице растворимости).
Найдем наименьшее общее кратное для чисел 2 и 3, это 6. Разделим число 6 на 2, получим число 3 — это индекс для кальция. Разделим число 6 на 3, получим число 2 — это индекс для кислотного остатка.
Умение находить степень окисления химических элементов является необходимым условием для успешного решения химический уравнений, описывающих окислительно-восстановительные реакции. Без него вы не сможете составить точную формулу вещества, получившегося в результате реакции между различными химическими элементами. В результате решение химических задач, построенных на подобных уравнениях, будет либо невозможным, либо ошибочным.
Без него вы не сможете составить точную формулу вещества, получившегося в результате реакции между различными химическими элементами. В результате решение химических задач, построенных на подобных уравнениях, будет либо невозможным, либо ошибочным.
Понятие степени окисления химического элемента
Степень окисления – это условная величина, с помощью которой принято описывать окислительно-восстановительные реакции. Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
В окислительно-восcтановительных реакциях понятие степень окисления используется для определения химических формул соединений элементов, получающихся в результате взаимодействия нескольких веществ.
На первый взгляд может показаться, что степень окисления эквивалентна понятию валентности химического элемента, но это не так. Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Как определить степень окисления конкретного химического элемента
Определение степени окисления для конкретного химического элемента подчиняется следующим правилам:
- Степень окисления простых веществ всегда равна нулю.

- Щелочные металлы, которые находятся в первой группе периодической таблицы, имеют степень окисления +1.
- Щелочноземельные металлы, занимающие в периодической таблице вторую группу, имеют степень окисления +2.
- Водород в соединениях с различными неметаллами всегда проявляет степень окисления +1, а в соединениях с металлами +1.
- Степень окисления молекулярного кислорода во всех соединениях, рассматриваемых в школьном курсе неорганической химии, равна -2. Фтора -1.
- При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
- Алюминий во всех соединениях проявляет степень окисления равную +3.
Дальше, как правило, начинаются сложности, так как остальные химические элементы демонстрируют и проявляют переменную степень окисления в зависимости от типов атомов других веществ, участвующих в соединении.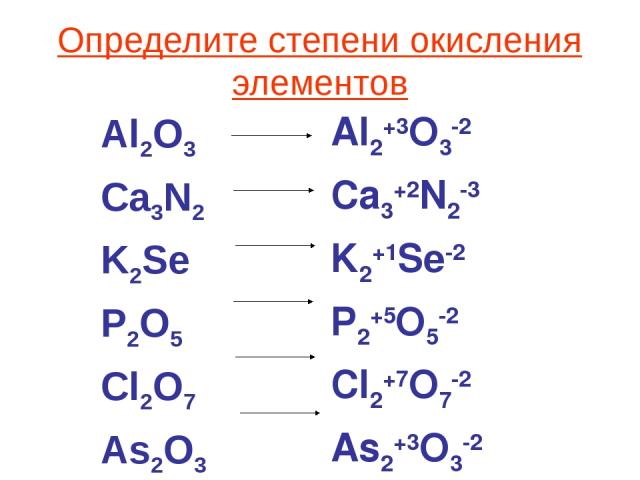
Различают высшую, низшую и промежуточную степени окисления. Высшая степень окисления, как и валентность, соответствует номеру группы химического элемента в периодической таблице, но имеет при этом положительное значение. Низшая степень окисления численно равна разности между числом 8 группой элемента. Промежуточной степенью окисления будет любой число в диапазоне от низшей степени окисления до высшей.
Чтобы помочь вам сориентироваться в многообразии степеней окисления химических элементов предлагаем вашему вниманию следующую вспомогательную таблицу. Выберите в ней интересующий вас элемент и вы получите значения его возможных степеней окисления. В скобках будут указаны редко встречающиеся значения.
Репетитор по химии — Белов Н.В
|
|
|
|
| Таблица 20 | |
|
| Типы кристаллических решеток твердых веществ |
| |||
|
|
|
|
|
| |
| Тип кристаллической | Молекулярная | Ионная | Атомная | Металлическая | |
| решетки |
|
|
|
| |
|
|
|
|
|
| |
| Частицы, нахо- | Молекулы | Положительно и от- | Атомы | Атомы и положительно | |
| дящиеся в узлах |
| рицательно заряжен- |
| заряженные ионы | |
| решетки |
| ные ионы (катионы |
| металлов | |
|
|
| и анионы) |
|
| |
| Характер связи | Силы межмолеку- | Электростатические | Ковалентные | Металлическая связь | |
| между частицами | лярного взаимо- | ионные связи | связи | между ионами метал- | |
| кристалла | действия (в т. |
|
| лов и свободными | |
140 |
| водородные связи) |
|
| электронами | |
|
|
|
|
| ||
Прочность связи | Слабая | Прочная | Очень прочная | Разной прочности | ||
| ||||||
| Отличительные | Легкоплавкие, | Тугоплавкие, твердые, | Очень тугоплавкие, | Разнообразны по свой- | |
| физические | небольшой твер- | многие растворимы | очень твердые, | ствам; имеют металли- | |
| свойства | дости, многие рас- | в воде. | практически | ческий блеск; обла- | |
| веществ | творимы в воде | и расплавы проводят | нерастворимы | дают электропровод- | |
|
|
| электрический ток | в воде | ностью (проводники | |
|
|
| (проводники II рода) |
| I рода) и теплопровод- | |
|
|
|
|
| ностью | |
| Примеры веществ | Йод I2, лед Н2О, | Хлорид натрия NaCl, | Алмаз С, | Медь Cu, калий К, | |
|
| «сухой лед» | гидроксид калия | кремний Si | цинк Zn | |
|
| (твердый СO2) | КОН, нитрат бария |
|
| |
|
|
| Ва(NО3)2 |
|
| |
7. Что называется ионной связью? Между атомами каких элементов она образуется?
Что называется ионной связью? Между атомами каких элементов она образуется?
8.Какой заряд имеют ионы металлов? Как они называются?
9.В какие ионы превращаются атомы неметаллов при присоединении электронов?
10.Чем обусловлены ненаправленность и ненасыщаемость ионной связи?
11.Что находится в узлах кристаллической решетки металлов и что — между узлами?
12.Что называется металлической связью?
13.С атомами каких элементов атом водорода обычно образует водородные связи?
14.Какие виды взаимодействия обусловливают образование водородной связи?
15.В каких пределах варьируется энергия водородной связи?
16.Как называются силы, которые обусловливают притяжение между молекулами любого вещества в жидком и твердом агрегатных состояниях?
17.Назовите известные вам виды межмолекулярного взаимодействия.
18.Какие типы кристаллических решеток представлены в табл. 20?
19.Какие частицы находятся в узлах молекулярной, ионной, атомной и металлической кристаллических решеток?
20. Каков характер связи между частицами кристаллов в молекулярной, ионной, атомной и металлической кристаллических решетках?
Каков характер связи между частицами кристаллов в молекулярной, ионной, атомной и металлической кристаллических решетках?
21.Какова прочность связи между частицами кристаллов в молекулярной, ионной, атомной и металлической кристаллических решетках?
22.Охарактеризуйте отличительные физические свойства веществ, которые имеют: а) молекулярную кристаллическую решетку; б) ионную кристаллическую решетку; в) атомную кристаллическую решетку; г) металлическую кристаллическую решетку.
23.Приведите примеры веществ, которые в твердом состоянии имеют молекулярную, ионную, атомную и металлическую кристаллические решетки.
Задания для самостоятельной работы
1.Напишите электронные формулы атомов следующих элементов: 3Li, 38Sr, 35Br, 31Ga. Какие элементарные ионы могут образовать атомы этих элементов? Напишите уравнения процессов образования этих
ионов.
2.Допишите уравнения следующих процессов образования ионов:
141
а) Са0 – 2e = …; | б) S0 … = S2–; |
в) Fe0 – 3e# = …; | г) Fe0 … = Fe2+. |
3.Определите заряды ионов в следующих соединениях: AlF3, CsCl, Rb2O, СаBr2.
4.Какие из следующих веществ являются ионными соединениями: Н2,
КСl, N2, KH, CaF2, Ch5? Почему? Напишите схемы образования этих соединений.
5, Какой атом является донором и какой — акцептором электронов при взаимодействии молекул Nh4 и BF3 с образованием молекулярного соединения BF3 · Nh4? Чему равны валентности бора и азота в образующемся соединении?
§ 3.10. Степени окисления элементов
Степень окисления является важной характеристикой состояния атома в молекуле.
Степень окисления элемента в данном соединении — это реальный или условный заряд, который имеет атом этого эле-
мента в этом соединении.
В соединениях с ионной связью степени окисления элементов равны зарядам ионов. Например:
+1 –1 |
|
NaCl | Степень окисления натрия = +1 |
| Степень окисления хлора = –1 |
+2 –1 |
|
CaF2 | Степень окисления кальция = +2 |
| Степень окисления фтора = –1 |
+2 –2 |
|
MgO | Степень окисления магния = +2 |
| Степень окисления кислорода = –2 |
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степени окисления элементов равны нулю.
Например: h30, Сl20, О20, F20 …
Степень окисления элементов равна нулю во всех простых
соединениях: S0, С0, P0, Na0, Al0, Fe0 и др.
В соединениях с ковалентной полярной связью степень окисления элемента — это условный заряд его атома в молекуле, если считать, что молекула состоит из ионов, т. е. рассматривать ковалентные полярные связи как ионные связи.
142
При этом считают, что общие электронные пары полностью переходят к атомам элементов с бо@льшей ЭО.
Например, в молекуле хлороводорода НСl ковалентная полярная связь Н : Сl. Если общая электронная пара полностью перейдет к атому хлора (ЭОСl > ЭОН), то связь станет ионной. На атоме Н появится заряд +1, на атоме хлора будет заряд –1. Следовательно, степени окисления атомов в моле-
+1 –1
куле равны: НСl. (Степени окисления записывают над сим-
волами элементов.)
Любая молекула является электронейтральной, поэтому
алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Некоторые элементы во всех сложных веществах имеют
постоянную степень окисления:
Элементы с постоянной степенью окисления | Степень | |
| окисления | |
а) Щелочные металлы (Li, Na, К, Rb, Cs, Fr) | +1 | |
|
| |
б) Элементы II группы (кроме Hg): Be, Mg, Са, Sr, | +2 | |
Ba, Ra, Zn, Cd | ||
| ||
|
| |
в) Алюминий Аl | +3 | |
г) Фтор F | –1 | |
|
|
Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления, но есть исключения:
Элемент | Степень окисления |
|
|
|
| в большинстве | Исключения | ||
| соединений |
|
|
|
|
|
| ||
|
| Гидриды активных металлов: | ||
Н | +1 | +1–1 +1–1 +2–1 | ||
|
| NaH, KH, СаН2 и др. | ||
|
| Пероксиды водорода и металлов: | ||
|
| +1–1 | +1 –1 | +2–1 |
О | –2 | Н2O2, Na2O2, CaO2 | ||
|
| Фторид кислорода: +2–1 | ||
|
|
|
| OF2 |
Все другие элементы в различных соединениях имеют раз-
ные степени окисления, т. е. являются элементами с пере-
менной степенью окисления.
143
Например, определим степени окисления углерода в различных соединениях. Одновременно напишем графические формулы этих соединений, чтобы показать валентность углерода.
х +1 |
|
| х = –4 | ||
СН | 4 |
| х + 4(+1) = 0; | ||
|
|
|
|
| |
х +1 |
|
| х = –3 | ||
С | Н | 6 | 2х + 6(+1) = 0; | ||
2 |
|
|
|
| |
х +1 |
|
| х = –2 | ||
С | Н | 4 | 2х + 4(+1) = 0; | ||
2 |
|
|
|
| |
+1 х –2+1
Н С О Н х + 2(+1) + (–2) = 0; х = 0
+1 х –2–2 +1
Н С О О Н х + 2(+1) + 2(–2) = 0; х = +2
х –2 | х + 2(–2) = 0; |
|
| |
СО | 2 | х = +4 | О=С=О | |
|
|
|
| |
Вы видите, что степень окисления углерода изменяется от –4 до +4, а валентность углерода во всех соединениях равна IV.
Степени окисления могут иметь и дробные значения. Например:
х +1 |
|
| +1х |
|
|
С3Н8 |
|
| КO2 |
|
|
3х + 8(+1) | = 0; | 8 | 2х + 1 | = 0; | 1 |
х = –— | х = –— | ||||
|
| 3 |
|
| 2 |
Необходимо знать, что:
1.Атомы металлов во всех сложных соединениях имеют
только положительные степени окисления.
2.Атомы неметаллов могут иметь и положительные, и отрицательные степени окисления. В соединениях с металла-
144
ми и водородом степени окисления неметаллов всегда отрицательные.
3.Высшая (максимальная) степень окисления элемента, как правило, равна номеру группы, в которой находится эле-
мент в периодической системе.
4.Низшая (минимальная) степень окисления металлов равна нулю. Низшая степень окисления неметаллов обычно равна: – (8 — номер группы, в которой находится элемент).
5.Значения степеней окисления элемента между высшей
и низшей степенями окисления называются промежуточ-
ными.
Например, элемент-неметалл азот (V группа) может иметь следующие степени окисления:
–3 | –2 | –1 | 0 | +1 | +2 | +3 | +4 | +5 |
Низшая |
|
|
|
|
|
|
| Высшая |
степень |
| Промежуточные степени окисления |
| степень | ||||
окис- |
|
| окис- | |||||
|
|
|
|
|
|
| ||
ления |
|
|
|
|
|
|
| ления |
|
|
|
|
|
|
|
|
|
–3 | –2 | –1 | 0 | +1 | +2 | +3 | +4 | +5 |
Nh4 | N2h5 | Nh3OH | N2 | N2O | NO | N2O3 | NO2 | N2O5 |
Примеры соединений
Знание степеней окисления элементов позволяет делать выводы о химических свойствах веществ, в состав которых входят эти элементы.
Вопросы для контроля
1.Чему равны степени окисления элементов в соединениях с ионной связью?
2.Чему равны степени окисления элементов в соединениях с неполярной ковалентной связью (в молекулах простых веществ)?
3.Что такое степень окисления элемента в соединениях с полярной ковалентной связью?
4.Чему равна алгебраическая сумма степеней окисления всех атомов в молекуле? Почему?
5.Какие элементы имеют постоянную степень окисления во всех сложных веществах?
6.Какие степени окисления имеют водород и кислород в большинстве сложных веществ? Какие вы знаете исключения?
7.Какие степени окисления (положительные или отрицательные) имеют атомы металлов и неметаллов в сложных веществах?
145
8.Чему равны высшие и низшие степени окисления элементов?
9.Какие степени окисления называются промежуточными?
Упражнения для самостоятельной работы
1.Определите степени окисления и валентности:
а) фосфора в: РН3, Р2О3, Н3РО4, Mg3P2; б) брома в: NaBr, HBrO, КBrО3, Br2О5;
в) хрома в: Cr2О3, К2CrО4, Н2Cr2О7, Cr(ОН)3; г) марганца в: MnО, КMnО4, MnСl2, Н2MnО4; д) серы в: CaS, SO3, h3SO3, BaSO4;
е) хлора в: НСlО, HClO2, BaCl2, Cl2O7;
ж) железа в: Fe2O3, Fe2S3, FeSO4, h3FeO4;
Модель выполнения задания 1
Соединения | Степень | Графические формулы | Валентность |
| окисления |
| азота |
| азота |
|
|
|
|
|
|
+1 –2 |
| Н—О—N=О |
|
HNO2 | +3 | III | |
+1 –2 |
|
|
|
Nh4 | –3 | Н | III |
|
|
|
|
|
| H—N—H |
|
N0 | 0 | N N | III |
2 |
|
|
|
+2 |
| Са=N—Са—N=Са |
|
Ca3N2 | –3 | III |
2. Чему равны высшие и низшие степени окисления следующих эле-
Чему равны высшие и низшие степени окисления следующих эле-
ментов: а) хлор 17Cl; б) марганец 25Mn; в) сера 16S; г) кремний 14Si;
д) хром 24Cr; е) фосфор 15Р; ж) свинец 82Рb; з) бром 35Br?
Модель выполнения задания 2
Элемент | № группы | Металл или | Низшая степень | Высшая степень |
|
| неметалл | окисления | окисления |
6C | IV | неметалл | –4 | +4 |
23V | V | металл | 0 | +5 |
Тест № 4 по теме: «Химическая связь.
Степени окисления элементов»
(Число правильных ответов — 9)
Вариант I
1.В каких молекулах существует неполярная ковалентная связь?
. | 2 | . | 2 . | 3 | . 2 | . | 2 |
А I |
| Б CO | В NH |
| Г H | O Д O |
|
146
2. Как изменяется полярность связей в ряду молекул:
. | Н2О h3S h3Se h3Te? | |
не изменяется | . | |
А | Б увеличивается | |
. | уменьшается |
|
В |
| |
3.Чему равна валентность кремния 14Si (…3s23p2) в основном
ив возбужденном состояниях?
.А I .Б II .В III .Г IV .Д V 4. Чему равна низшая степень окисления серы 16S?
.А –6 .Б –4 .В –2 . Г 0 .Д +6 5. Чему равна степень окисления фосфора в соединении
Г 0 .Д +6 5. Чему равна степень окисления фосфора в соединении
Mg3P2?
.А +3 .Б +2 .В 0 .Г –2 .Д –3
6.Какие элементы имеют постоянную степень окисления +1?
.А 1Н .Б 3Li .В 29Cu .Г 37Rb .Д 47Ag
Вариант II
1.В каких молекулах существуют полярные ковалентные связи?
.А КBr .Б НBr .В Br2 .Г РBr3 .Д CsBr 2. Как изменяется полярность связей в ряду молекул:
Ph4 h3S HCl?
. | не изменяется | . |
А | Б увеличивается | |
. | уменьшается |
|
В |
|
3.Чему равна валентность фосфора 15P (…3s23p3) в основном
ив возбужденном состояниях?
.А I .Б II .В III .Г IV .Д V
4. Чему равна высшая степень окисления марганца 25Mn?
.А –1 .Б 0 .В +7 .Г +4 .Д +2 5. Чему равна степень окисления хлора в соединении
Са(СlО)2?
. А +1 .Б +1 .В 0 .Г –1 .Д –2 6. Какие элементы могут иметь степень окисления —1?
А +1 .Б +1 .В 0 .Г –1 .Д –2 6. Какие элементы могут иметь степень окисления —1?
.А 1Н .Б 12Mg .В 35Br .Г 26Fe .Д 19K
147
Раздел 4
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ И ЗАКОНОМЕРНОСТИ ИХ ПРОТЕКАНИЯ
Главным предметом изучения в химии является химическая реакция. Глубокое знание сущности и закономерностей протекания химических реакций дает возможность управлять ими и использовать для синтеза новых веществ. Усвоение общих закономерностей протекания химических реакций необходимо для последующего изучения свойств неорганических
иорганических веществ.
Вданном разделе рассматриваются классификация химических реакций, сущность окислительно-восстанови- тельных реакций, тепловые эффекты реакций, их скорости, состояние химического равновесия для обратимых реакций и условия его смещения, а также показаны правила составления различных типов уравнений химических реакций.
§4.1. Окислительно-восстановительные реакции. Важнейшие окислители
ивосстановители
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов
в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции.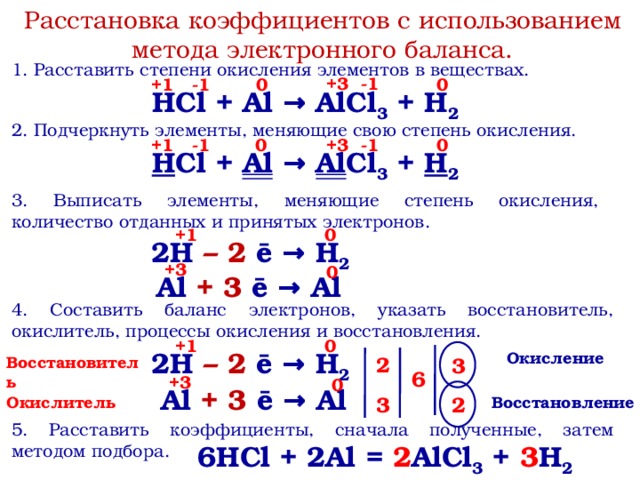 Например:
Например:
+1–1 | +1–2+1 | +1 –1 | +1–2 |
|
НСl + NaOH = NaCl + h3O | (4.1.1) | |||
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны
148
степеням окисления этих элементов в молекулах продуктов реакции. Например:
|
| 0 | 0 | +2 –2 |
|
|
| 2Mg + O2 = 2MgO | (4.1.2) | ||
+7 | –1 | +2 |
| 0 |
|
2КMnО4 + 16НСl = 2MnСl2 + 5Сl2 + 2КСl + 8Н2О | (4. | ||||
Реакции второго типа называются окислительно-вос- становительными.
• Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов од-
ного элемента к атомам другого элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg0 = Mg+2 + 2e# (или: Mg0 – 2e# = Mg+2) | (4.1.4) |
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
О2 + 4e# = 2О–2 | (4.1.5) |
В реакции 4.1.3 атомы хлора, которые в молекулах НСl имеют степень окисления –1, отдают по одному электрону и превращаются в нейтральные атомы хлора, которые соеди-
няются попарно и образуют молекулы хлора Сl2: |
| ||
Сl–1 = Сl0 + e#; | Сl0 + Сl0 = Сl2 |
| |
или суммарно: | 2Сl–1 = Сl2 + 2e# | (4. | |
Атом марганца, который в исходном веществе (КMnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта
реакции MnCl2): |
|
Mn+7+5e# = Mn+2 | (4.1.7) |
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электро-
нов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса
электронов.
149
Соседние файлы в папке Справочники
- #
16.03.202317.79 Mб0Глосарій термінів з хімії. Укладачі Й.Опейда, О.Швайка.pdf
- #
19.03.202313.1 Mб2Кузьменко Н.Е., Еремин В.В. Химия. Ответы на вопросы. Теория и примеры решения задач.pdf
- #
16.
 02.202314.22 Mб7Репетитор по химии — Белов Н.В..pdf
02.202314.22 Mб7Репетитор по химии — Белов Н.В..pdf
MCAT Physical Help
Учащиеся, нуждающиеся в физической помощи MCAT, получат большую пользу от нашей интерактивной программы. Мы разбираем все ключевые элементы, чтобы вы могли получить адекватную физическую помощь MCAT. Имея под рукой обязательные концепции обучения и соответствующие практические вопросы, вы мгновенно получите много физической помощи MCAT. Получите помощь сегодня с нашей обширной коллекцией важной физической информации MCAT.
MCAT Физические науки
Биохимия, органическая химия и другие понятия
Ферменты
Классификация ферментов
Ингибирование и ингибиторы
Макромолекулы
Углеводы
Дисахариды, полисахариды и гликозидные связи
Липиды
Структурные липиды
Белки
Аминокислоты и классификация
Физическая химия
Электрохимия
Батареи
Электролизеры
Полуреакции и восстановительный потенциал
Другие электрохимические принципы
Окисление-восстановление в электрохимии
Гальванические/гальванические элементы
Фазовые изменения
Фазовые диаграммы
Состояние вещества
Термодинамика фазовых переходов
Кинетика реакции
Катализаторы, переходные состояния и энергия активации
Факторы, влияющие на скорость реакции
Скорость реакции и законы скорости
Термохимия и энергетика
Эндергонические и экзергонические реакции
Эндотермические и экзотермические реакции
Энергетика биологических реакций и АТФ
Энтальпия
Энтропия
Свободная энергия Гиббса
Законы термодинамики
Другие принципы термодинамики
Термодинамические системы и калориметрия
Методы очистки
Перегонка
Электрофорез
Тонкослойная хроматография
Спектроскопия
Инфракрасная (ИК) спектроскопия
Общая химия
Кислотно-основная химия
Кислоты и основания
Буферы
Определение/классификация кислот и оснований
рН
Реакции и титрования
Кислотно-щелочное равновесие
Кислотно-основные реакции
Уравнение Хендерсона-Хассельбальха
Кривые титрования
Методика титрования и индикаторы
Атомы, элементы и периодическая таблица
Ионы и изотопы
Группы периодической таблицы
Периодические тренды
Субатомные частицы и свойства элементов
Соединения, молекулы и связи
Ковалентные связи
Межмолекулярные силы
Ионные связи
Точечные структуры Льюиса
ВСЕПР Геометрия
Равновесие
Константа равновесия и коэффициент реакции
Принцип Ле Шателье и общий ионный эффект
Ядерная химия и электроны
Атомное ядро
Электронная конфигурация
Орбиты и гибридизация
Другие принципы, управляющие электронами
Квантовые числа
Радиоактивный распад
Окислительно-восстановительный
Общие принципы окисления-восстановления
Полуреакции и уравнения баланса
Номер окисления
Потенциалы восстановления
Химический раствор
Коллигативные свойства
Точка кипения
Точка замерзания
Давление паров
Растворимость и ионы
Концентрация, разбавление и единицы измерения
Ионы в растворе
Растворимость и равновесие в растворе
Правила растворимости
Стехиометрия и аналитическая химия
Молекулярная масса, молекулярная формула и количество молей
Расчеты реакции и ограничивающий реагент
Единицы и преобразование единиц измерения
Физика
Электричество и магнетизм
Схемы
Конденсаторы и диэлектрики
Текущий
Закон Ома
Удельное сопротивление
Резисторы и сопротивление
Напряжение, энергия и мощность
Электростатика и электрические поля
Заряд и электрическая сила
Электрические поля
Электрическая потенциальная энергия
Электростатика
Другие принципы электротехники
Магнетизм и электромагнетизм
Индукция
Магнитные поля
Магнитные силы и энергия
Правила правой руки
Жидкости и газы
Поток
Уравнение Бернулли
Уравнение непрерывности
Другие принципы потока
Течение Пуазейля и турбулентность
Вязкость
Газы
Газовые законы
Кинетическая молекулярная теория
Принципы работы с другими газами
Парциальное давление
Реальные газы и идеальные газы
Использование молярного объема
Погружение
Плавучесть и водоизмещение
Плотность
Прочие жидкие принципы
Давление
Ньютоновская механика и движение
Сил
Силовое равновесие
Трение и нормальная сила
Гравитация и вес
Второй закон Ньютона
Другие силы
Универсальная гравитация
Общие принципы
Перемещение, скорость и ускорение
Законы Ньютона
Скалярные и векторные величины
Вращательное, круговое и гармоническое движение
Центростремительная сила и ускорение
Другие принципы гармонического движения
Другие принципы вращательного движения
Маятники
Период, длина волны и частота
Пружины и гармоники
Крутящий момент
Поступательное движение
Импульс
Движение в одном измерении
Движение в двух измерениях
Работа, энергия и мощность
Сохранение энергии
Кинетическая энергия
Потенциальная энергия (гравитационная и пружинная)
Мощность
Работа
Оптика
Общие принципы и свойства
Отражение и преломление
Закон Снелла
Полное внутреннее отражение
Скорость и показатель преломления
Зеркала и линзы
Комбинированные линзы
Фокусное расстояние
Увеличение
Принципы других линз и зеркал
Уравнение тонкой линзы
Типы изображений
Волны
Общие принципы и свойства
Продольные и поперечные волны
Другие свойства волны
Скорость и Волны
Длина волны, частота и период
Легкий
Электромагнитный спектр
Интерференция и дифракция
Другие принципы света
Фотоны и фотонная энергия
Поляризация
Звук
Эффект Доплера
Гармоники
Интенсивность и децибелы
Другие принципы рационального использования
Вы планируете поступать в медицинскую школу? Вы, наверное, уже знаете, что для большинства программ требуется сдать вступительный экзамен в медицинский колледж или MCAT. Этот экзамен разделен на три раздела: физические науки, вербальные рассуждения и биологические науки. Многие студенты считают сдачу MCAT одной из самых напряженных задач в студенческие годы, но не волнуйтесь! Имея немного информации, вы сможете справиться с этим тестом без колебаний. Начнем с первого раздела, который будет проводиться в день экзамена: физические науки. Нужны ли вам лучшие преподаватели MCAT в Нью-Йорке, преподаватели MCAT в Чикаго или лучшие преподаватели MCAT в Лос-Анджелесе, работа с профессионалом может вывести ваше обучение на новый уровень.
Этот экзамен разделен на три раздела: физические науки, вербальные рассуждения и биологические науки. Многие студенты считают сдачу MCAT одной из самых напряженных задач в студенческие годы, но не волнуйтесь! Имея немного информации, вы сможете справиться с этим тестом без колебаний. Начнем с первого раздела, который будет проводиться в день экзамена: физические науки. Нужны ли вам лучшие преподаватели MCAT в Нью-Йорке, преподаватели MCAT в Чикаго или лучшие преподаватели MCAT в Лос-Анджелесе, работа с профессионалом может вывести ваше обучение на новый уровень.
Как и остальная часть экзамена, часть MCAT, посвященная физическим наукам, в основном состоит из отрывков, а это означает, что большинство вопросов относятся к короткому пояснительному отрывку. Из 52 общих вопросов теста 39 связаны с одним из семи полных отрывков; обычно получается 5 или 6 вопросов за отрывок. Остальные 13 вопросов являются дискретными или «автономными». Поскольку они не связаны с каким-либо данным материалом, вам придется полагаться на информацию в основе вопроса и на ваши внешние знания. Возможно, вы слышали, что раздел «Физические науки» включает в себя как физику, так и общую химию. Около половины вопросов проверяют ваше понимание физики. Концепции для рассмотрения включают кинематику, силы, поведение волн, жидкости и потоки, а также контуры; хотя от вас требуется знать несколько уравнений наизусть, они, как правило, просты, например, закон Кулона и V = IR. Остальная часть экзамена охватывает общую химию. Убедитесь, что вы понимаете периодические тренды, гальванические и электролитические элементы, поведение идеального газа и кислотно-щелочные проблемы. От вас могут потребовать выполнить некоторые базовые вычисления, но вам не разрешат пользоваться калькулятором (не волнуйтесь, он вам не понадобится). Администраторы теста также предоставят вам несколько листов черновой бумаги.
Возможно, вы слышали, что раздел «Физические науки» включает в себя как физику, так и общую химию. Около половины вопросов проверяют ваше понимание физики. Концепции для рассмотрения включают кинематику, силы, поведение волн, жидкости и потоки, а также контуры; хотя от вас требуется знать несколько уравнений наизусть, они, как правило, просты, например, закон Кулона и V = IR. Остальная часть экзамена охватывает общую химию. Убедитесь, что вы понимаете периодические тренды, гальванические и электролитические элементы, поведение идеального газа и кислотно-щелочные проблемы. От вас могут потребовать выполнить некоторые базовые вычисления, но вам не разрешат пользоваться калькулятором (не волнуйтесь, он вам не понадобится). Администраторы теста также предоставят вам несколько листов черновой бумаги.
Вам будет дано 70 минут на выполнение этой части экзамена. Если вы подойдете к тесту с уверенностью и твердой стратегией, этого времени должно хватить. Итак, как лучше всего атаковать вопросы? Многие учащиеся предпочитают сначала отвечать на отдельные вопросы, поскольку их можно закончить без дополнительных затрат времени на чтение нескольких абзацев. Когда вы как можно лучше ответите на отдельные вопросы, переходите к отрывкам. Хотя вы не должны тратить больше минуты или двух на выбор того, какой отрывок начать первым, важно начать с областей, которые вы считаете менее сложными. Это повысит ваши баллы и повысит вашу уверенность в себе до конца экзамена. Как вы оцениваете отрывок всего за несколько секунд? Здесь, как и в других ситуациях тестирования, лучший совет — познать себя. У вас большой опыт работы в лаборатории? Многие отрывки из раздела «Физические науки» представляют собой описания экспериментов с проверенными гипотезами и сделанными выводами. Вас смущают лабораторные работы, но вы предпочитаете фактическую информацию? Найдите отрывок, в котором содержится справочная информация по определенной теме. Играйте в свои сильные стороны! Varsity Tutors предлагает такие ресурсы, как бесплатные практические тесты MCAT по физическим наукам, которые помогут вам в самостоятельном обучении, или вы можете подумать о преподавателе MCAT по физическим наукам.
Когда вы как можно лучше ответите на отдельные вопросы, переходите к отрывкам. Хотя вы не должны тратить больше минуты или двух на выбор того, какой отрывок начать первым, важно начать с областей, которые вы считаете менее сложными. Это повысит ваши баллы и повысит вашу уверенность в себе до конца экзамена. Как вы оцениваете отрывок всего за несколько секунд? Здесь, как и в других ситуациях тестирования, лучший совет — познать себя. У вас большой опыт работы в лаборатории? Многие отрывки из раздела «Физические науки» представляют собой описания экспериментов с проверенными гипотезами и сделанными выводами. Вас смущают лабораторные работы, но вы предпочитаете фактическую информацию? Найдите отрывок, в котором содержится справочная информация по определенной теме. Играйте в свои сильные стороны! Varsity Tutors предлагает такие ресурсы, как бесплатные практические тесты MCAT по физическим наукам, которые помогут вам в самостоятельном обучении, или вы можете подумать о преподавателе MCAT по физическим наукам.
Наконец, один из аспектов научных разделов MCAT, который многие студенты находят пугающим, — это наличие графиков и таблиц в большинстве отрывков. Пусть это вас не пугает! Хороший совет: сначала прочтите отрывок, запишите несколько слов, чтобы обобщить любые графики или таблицы, а затем переходите к вопросам. Это может занять лишнюю минуту или около того, но вы получите преимущество более полного понимания отрывка. В дополнение к справочному разделу MCAT Physical Sciences и репетиторству MCAT по физическим наукам вы также можете рассмотреть возможность использования некоторых наших карточек MCAT Physical Sciences.
Как всегда, потренируйтесь как можно больше с настоящими пассажами! Вы можете использовать ресурсы Varsity Tutors MCAT Physical Sciences, чтобы помочь вам попрактиковаться в чтении отрывков MCAT Physical Science и ответить на вопросы MCAT Physical Science. Бесплатные диагностические тесты MCAT по физике от Varsity Tutors помогут вам определить свои сильные и слабые стороны, а после этого вы сможете попрактиковаться в ответах на бесплатные вопросы MCAT по физике, основанные на темах, которые вы понимаете наименее хорошо.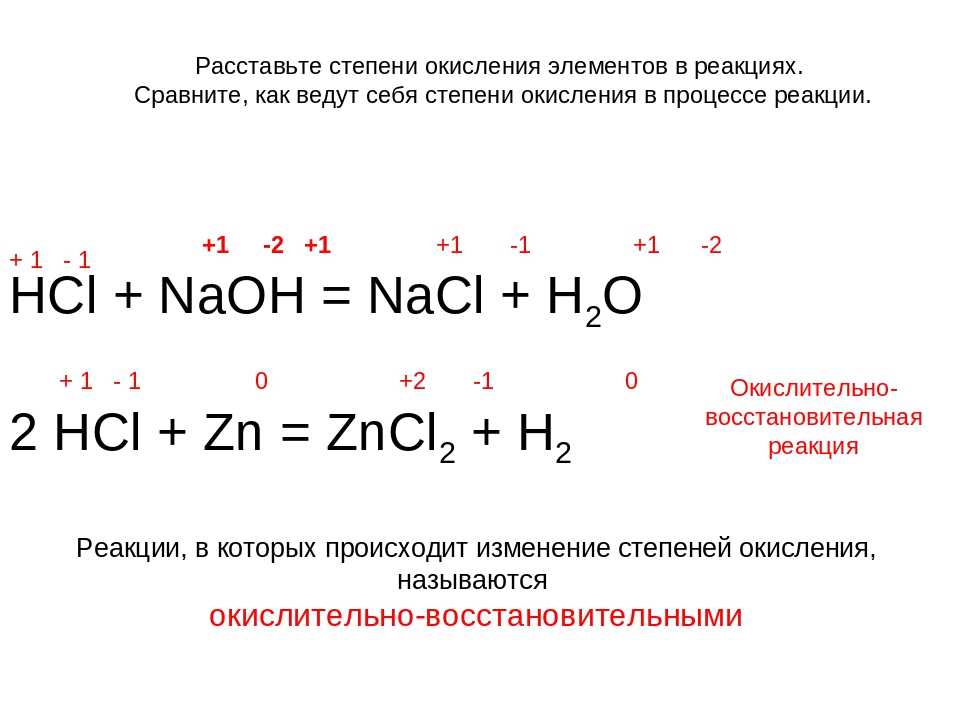 Это поможет вам улучшить понимание материала MCAT Physical Science и способа его форматирования. Вы быстро изучите шаблоны, которые вам очень помогут. Удачи!
Это поможет вам улучшить понимание материала MCAT Physical Science и способа его форматирования. Вы быстро изучите шаблоны, которые вам очень помогут. Удачи!
Номер окисления: правила и примеры
Номер окисления: правила и примеры | StudySmarterВыберите язык
Предлагаемые языки для вас:
Немецкий (DE)
Дойч (Великобритания)
Европа
- английский (DE)
- английский (Великобритания)
StudySmarter — универсальное учебное приложение.
4.8 • Рейтинг +11k
Более 3 миллионов загрузок
Бесплатно
Степень окисления
СОДЕРЖАНИЕ :
ОГЛАВЛЕНИЕ
Lerne mit deinen Freunden und bleibe auf dem richtigen Kurs mit deinen persönlichen Lernstatistiken
Jetzt kostenlos anmelden
Nie wieder prokastinieren mit unseren Lernerinnerungen.
Jetzt kostenlos anmelden
Электроны могут быть потеряны или получены, когда одни атомы взаимодействуют с другими атомами и связываются или реагируют с ними. Почему степеней окисления важны в этом контексте?
Числа окисления используются химиками для определения и отслеживания количества электронов, переданных или разделенных во время химических реакций. Числа окисления также полезны для химиков, когда дело доходит до наименования неорганических соединений.
Числа окисления также полезны для химиков, когда дело доходит до наименования неорганических соединений.
Во-первых, мы определим термин степень окисления .
Затем мы рассмотрим правила степени окисления , а также их исключения.
После этого мы рассмотрим, как степени окисления связаны с , назвав соединения .
Наконец, мы приступим к расчету степени окисления для различных соединений и ионов.
Что такое степени окисления?
В «Окислительно-восстановительном потенциале» вы узнали, что многие реакции связаны с движением электронов. Один вид теряет электроны и окисляется , в то время как другой получает электроны и восстанавливается . В целом мы называем эти процессы окислительно-восстановительными реакциями. Числа окисления помогают нам отслеживать, какие соединения окисляются, а какие восстанавливаются в такой реакции.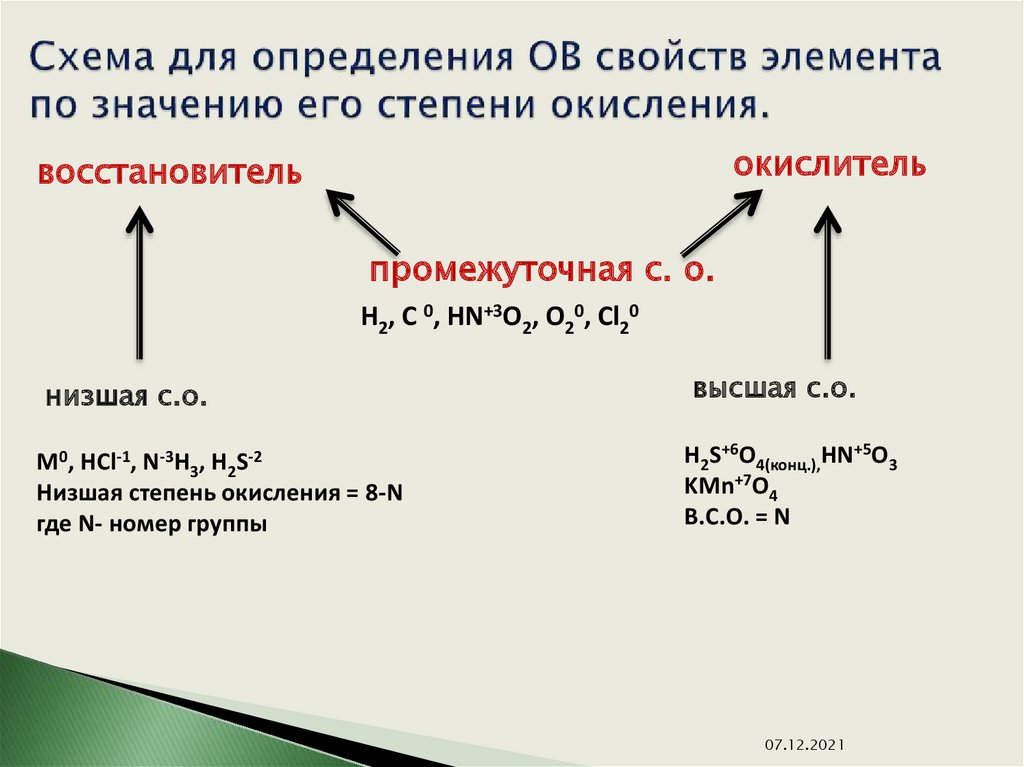
Числа окисления — это числа, присвоенные ионам, которые показывают, сколько электронов потерял или приобрел ион по сравнению с элементом в несвязанном состоянии. Положительная степень окисления показывает, что элемент потерял электроны, а отрицательная степень окисления показывает, что он приобрел электроны. Их также можно обозначить как степеней окисления .
Правила для степеней окисления
Есть несколько правил, которые могут помочь и упростить способ определения степеней окисления.
- Степень окисления всех несвязанных элементов 0 . Причина этого в том, что элемент не потерял электронов и не приобрел их, а потому является нейтральным.
- напр. Zn, H и Cl.
- Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна 0.
- напр. В NaCl степень окисления Na равна +1, а степень окисления Cl равна -1.
 В сумме они составляют 0.
В сумме они составляют 0.
- напр. В NaCl степень окисления Na равна +1, а степень окисления Cl равна -1.
- Сумма степеней окисления иона равна заряду иона . Это относится как к одноатомным ионам, так и к комплексным ионам.
- напр. Степень окисления одноатомного иона F — это -1.
- напр. В ионе CO 3 2- C имеет степень окисления +4, а каждый из трех O имеет степень окисления -2. 4 + 3(-2) = -2, то есть заряд иона.
- В ион или соединение более электроотрицательный элемент обычно имеет более отрицательную степень окисления . Помните, что электроотрицательность уменьшается вниз по группе и увеличивается по периоду.
- напр. В Ф 2 O, F более электроотрицателен, чем кислород, и поэтому имеет более отрицательную степень окисления. Здесь F имеет степень окисления -1, а O имеет степень окисления +2.
Проверьте электроотрицательность для получения дополнительной информации.
Многие элементы имеют одинаковую степень окисления во всех своих соединениях:
- Все элементы группы 1 имеют степень окисления +1.

- Все элементы группы 2 имеют степень окисления +2.
- Алюминий всегда имеет степень окисления +3.
- Фтор всегда имеет степень окисления -1.
- Водород обычно имеет степень окисления +1, за исключением гидридов металлов.
- Кислород обычно имеет степень окисления -2, за исключением пероксидов и соединений с фтором.
- Хлор обычно имеет степень окисления -1, за исключением соединений с кислородом и фтором.
Периодическая таблица со степенями окисления
Чтобы помочь в определении степеней окисления различных соединений, вот изображение периодической таблицы с общими степенями окисления для каждой группы.
Периодическая таблица со степенями окисления элементов в пределах их групп — StudySmarter Originals
Однако вы всегда должны помнить об исключениях из правил степеней окисления. Далее мы рассмотрим их более подробно.
Исключения для степеней окисления
Как мы узнали, есть несколько исключений для степеней окисления элементов в соединениях.
Исключения по степени окисления: Водород
Водород обычно имеет степень окисления +1. Но в гидридах металлов, таких как NaH или KH, он имеет степень окисления -1. Это потому, что мы знаем, что сумма степеней окисления в нейтральном соединении всегда равна 0, а металлы группы 1 всегда имеют степень окисления +1. Это означает, что в гидриде металла водород должен иметь степень окисления -1, так как 1 + (-1) = 0. Например, в NaH Na имеет степень окисления +1, а H имеет степень окисления — 1.
Исключения по степени окисления: Кислород
Кислород обычно имеет степень окисления -2. Но в пероксидах, таких как H 2 O 2 , он имеет степень окисления -1. Опять же, это нейтральное соединение, поэтому сумма степеней окисления должна быть равна нулю. Например, в случае H 2 O 2 каждый атом водорода имеет степень окисления +1, поэтому каждый атом кислорода должен иметь степень окисления -1.
Кислород также отклоняется от своей обычной степени окисления в соединениях с фтором. Это потому, что мы знаем, что более электроотрицательный элемент имеет более отрицательную степень окисления, а фтор более электроотрицательный, чем кислород. Например, в F 2 O, более электроотрицательным элементом является фтор, поэтому он получает отрицательную степень окисления -1. У нас есть два атома фтора на каждый кислород, поэтому степень окисления кислорода равна +2.
Это потому, что мы знаем, что более электроотрицательный элемент имеет более отрицательную степень окисления, а фтор более электроотрицательный, чем кислород. Например, в F 2 O, более электроотрицательным элементом является фтор, поэтому он получает отрицательную степень окисления -1. У нас есть два атома фтора на каждый кислород, поэтому степень окисления кислорода равна +2.
Исключения по степени окисления: Хлор
Аналогичным образом, хлор принимает различные кислородные числа в соединениях с кислородом или фтором. Опять же, это потому, что кислород и фтор более электроотрицательны, чем хлор. Например, в HClO O является наиболее электроотрицательным элементом и поэтому имеет самую отрицательную степень окисления. Здесь он имеет степень окисления -2. H не находится в гидриде металла и поэтому имеет степень окисления +1. Это означает, что Cl также должен иметь степень окисления +1, так как 1 + 1 + (-2) = 0,9.0003
Степени окисления и названия соединений
Хотя мы только что узнали некоторые правила присвоения степеней окисления, они не охватывают все элементы. На самом деле многие элементы могут принимать множество возможных степеней окисления, что может вызвать путаницу во многих соединениях. Вот несколько советов, которые помогут вам.
На самом деле многие элементы могут принимать множество возможных степеней окисления, что может вызвать путаницу во многих соединениях. Вот несколько советов, которые помогут вам.
Степени окисления и названия соединений: римские цифры
Если есть риск двусмысленности, конкретная степень окисления элемента в данном соединении указывается с помощью римские цифры . Однако это относится только к положительным степеням окисления . Например, сульфат железа (II) (FeSO 4 ) содержит ионы железа со степенью окисления +2, а сульфат железа (III) (Fe 2 (SO 4 ) 3 ) содержит ионы железа со степенью окисления +2. степень окисления +3.
Числа окисления и названия соединений: префиксы и суффиксы
Мы также можем использовать префиксы и суффиксы , чтобы дать информацию о формуле соединения, которая помогает нам определить степень окисления каждого элемента:
- Соединения, содержащие кислород, оканчиваются на -ate или -ite .
 Между ними есть разница: в соединении -ate всегда на один атом кислорода больше, чем в соединении -ite . Если мы встречаем соединение с одним кислородом больше, чем соединение -ate , мы добавляем префикс per-. Если мы встречаем соединение с одним кислородом меньше, чем соединение -ite , мы добавляем префикс гипо-.
Между ними есть разница: в соединении -ate всегда на один атом кислорода больше, чем в соединении -ite . Если мы встречаем соединение с одним кислородом больше, чем соединение -ate , мы добавляем префикс per-. Если мы встречаем соединение с одним кислородом меньше, чем соединение -ite , мы добавляем префикс гипо-.- напр. Ион перхлората (HClO 4 − ) имеет 4 атома кислорода, хлорат-ион (ClO 3 − ) имеет три, хлорит-ион (ClO 2 − ) имеет два и гипохлорит-ион (2ClO 92 0 9 ) имеет только один.
- Неорганические кислоты, содержащие кислород, заканчивающиеся на -ic .
- напр. Серная кислота (H 2 SO 4 ).
Примеры расчета степеней окисления
Сумма всех степеней окисления в нейтральном соединении должна быть равна нулю, а сумма всех степеней окисления в комплексном ионе должна равняться заряду иона — мы знаем это из наших правил присвоения степеней окисления.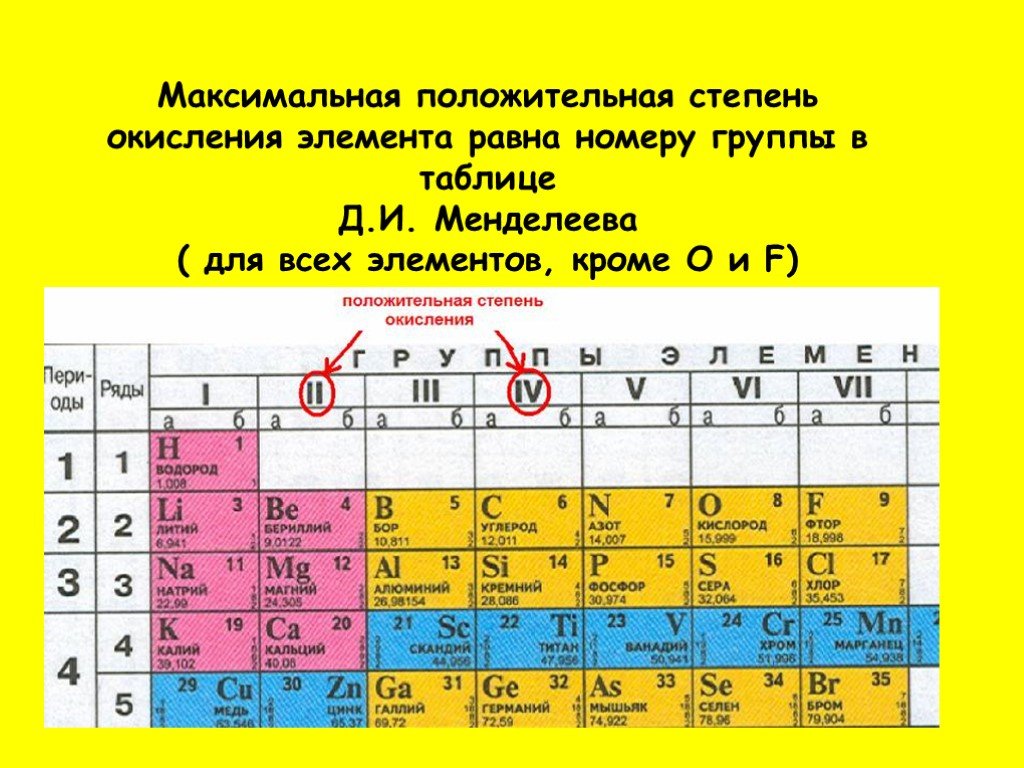 Но как определить степени окисления отдельных элементов в составе соединения или иона? Для этого мы можем применить наши знания о фиксированных степенях окисления и вычислить неизвестные степени окисления путем дедукции.
Но как определить степени окисления отдельных элементов в составе соединения или иона? Для этого мы можем применить наши знания о фиксированных степенях окисления и вычислить неизвестные степени окисления путем дедукции.
Может помочь следующий процесс:
Посмотрите на заряд иона или соединения, если он есть. Это поможет вам понять, к чему вы стремитесь.
Определите любые атомы с фиксированными степенями окисления.
Определите степени окисления остальных атомов, убедившись, что сумма всех степеней окисления равна заряду иона или соединения.
Теперь ваша очередь: попробуйте вычислить степени окисления некоторых элементов, используя правила, которые мы рассмотрели выше. Если вы застряли, мы будем работать над решениями вместе.
Каковы степени окисления серы в следующих соединениях и ионах?
- S 8
- H 2 S
- SO 3 2 —
- H 2 SO 4
a. Поскольку это несвязанный элемент, степень окисления серы в S 8 равна 0,
b. H 2 S является нейтральным соединением, поэтому общая сумма всех степеней окисления равна нулю. Каждый ион водорода имеет степень окисления +1. Следовательно, сера должна иметь степень окисления -2, так как 2(1) + (-2) = 0,9.0003
в. Общий заряд иона SO 3 2 — равен -2. Следовательно, сумма степеней окисления должна быть равна -2. Каждый кислород имеет степень окисления -2, поэтому их общая сумма равна 3 (-2) = -6. Это означает, что степень окисления серы должна быть +4, так как (-6) + 4 = -2
d. Опять же, H 2 SO 4 является нейтральным соединением, поэтому сумма всех степеней окисления должна быть равна нулю. Существует четыре атома кислорода, каждый со степенью окисления -2, поэтому их общая сумма равна 4 (-2) = -8. Есть два атома водорода, каждый со степенью окисления +1, поэтому их общая сумма равна 2(1) = 2. Следовательно, степень окисления серы должна быть +6, так как (-8) + 2 + (+6 ) = 0,
Существует четыре атома кислорода, каждый со степенью окисления -2, поэтому их общая сумма равна 4 (-2) = -8. Есть два атома водорода, каждый со степенью окисления +1, поэтому их общая сумма равна 2(1) = 2. Следовательно, степень окисления серы должна быть +6, так как (-8) + 2 + (+6 ) = 0,
Число окисления — ключевые выводы
- Номера окисления — это числа, присвоенные ионам, которые показывают сколько электронов ион потерял или приобрел по сравнению с элементом в его несвязанном состоянии.
- Существуют определенные правила, которым необходимо следовать при присвоении степеней окисления:
- Степень окисления всех несвязанных элементов равна нулю.
- Сумма степеней окисления иона равна заряду иона.
- Степень окисления нейтрального соединения равна нулю.
- В ионе или соединении более электроотрицательный элемент имеет более отрицательную степень окисления.
- Некоторые элементы всегда принимают определенные степени окисления, хотя есть исключения из общих правил.

- Римские цифры и составные префиксы и суффиксы дают нам подсказки о степени окисления участвующих элементов.
- Мы можем вычислить степени окисления, используя химические формулы и правила, перечисленные выше.
Часто задаваемые вопросы о числе окисления
Число, присвоенное элементу в химическом соединении, которое представляет собой количество электронов, потерянных или приобретенных атомом этого элемента в соединении.
Числа окисления показывают общее количество электронов, которые были удалены из элемента или присоединены к элементу, чтобы получить его нынешнее состояние.
В ионе или соединении более электроотрицательному элементу присваивается более отрицательная степень окисления. Чем меньше электроотрицательный элемент, тем больше положительная степень окисления.
Вы можете рассчитать степени окисления, используя химическую формулу вида и определенные правила:
- Степень окисления всех несвязанных элементов равна нулю.

- Степень окисления нейтрального соединения равна нулю.
- Сумма степеней окисления в ионе равна заряду иона
- Чем больше электроотрицательный элемент в ионе или соединении, тем больше отрицательная степень окисления.
Некоторые элементы всегда принимают определенные степени окисления, но есть исключения из общих правил. Мы рассмотрим их более подробно в оставшейся части этой статьи.
В газообразном хлоре (Cl 2 ) степень окисления хлора равна 0.
Окончательный тест на число окисления
Тест на число окисления — Teste dein Wissen
Вопрос
Что такое окисление?
Показать ответ
Ответ
Окисление – это процесс, сопровождающийся потерей электронов.
Показать вопрос
Вопрос
Какова степень окисления несвязанных элементов, таких как Cl?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова сумма степеней окисления нейтрального соединения?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова степень окисления одноатомного иона?
Показать ответ
Ответ
Степень окисления одноатомных ионов равна заряду иона.
Показать вопрос
Вопрос
Какова сумма всех степеней окисления многоатомного иона?
Показать ответ
Ответ
Сумма степеней окисления многоатомных ионов равна заряду иона.
Показать вопрос
Вопрос
Какова степень окисления элементов группы 1 в соединении?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова степень окисления элементов 2 группы в соединении?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова степень окисления алюминия во всех соединениях?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова степень окисления фтора во всех соединениях?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова степень окисления водорода в гидридах металлов?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова степень окисления кислорода в пероксидах, таких как H 2 O 2 ?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какова степень окисления кислорода в F 2 O?
Показать ответ
Ответ
В F 2 O более электроотрицательным элементом является фтор, поэтому он получает отрицательную степень окисления -1. Есть два атома фтора, поэтому их сумма равна 2 (-1) = -2. Следовательно, степень окисления кислорода равна +2, так как (-2) + 2 = 0,9.0003
Есть два атома фтора, поэтому их сумма равна 2 (-1) = -2. Следовательно, степень окисления кислорода равна +2, так как (-2) + 2 = 0,9.0003
Показать вопрос
Вопрос
Какой элемент в ионе или соединении имеет отрицательную степень окисления?
Показать ответ
Ответ
Элемент с большей электроотрицательностью.
Показать вопрос
Вопрос
Как представлена степень окисления элемента?
Показать ответ
Ответ
Степень окисления элемента указывается римскими цифрами, если он имеет более одной возможной степени окисления, и это указывается в названиях соединений.
Показать вопрос
Вопрос
Какова степень окисления серы в H 2 SO 4 ?
Показать ответ
Ответ
В этом соединении четыре атома кислорода, каждый со степенью окисления -2, поэтому в сумме они имеют 4(-2) = -8.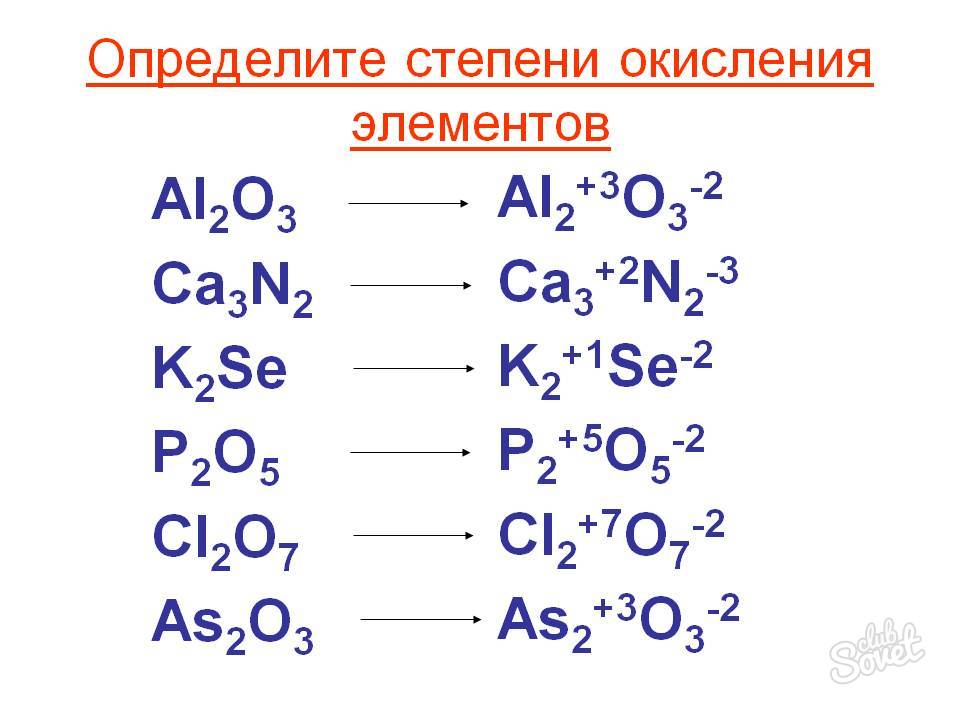 Есть два атома водорода, каждый со степенью окисления +1, поэтому в сумме они имеют 2(1) = 2. Общий заряд соединения равен нулю. Это означает, что степень окисления серы должна быть +6, так как (-8) + 2 + 6 = 0,9.0003
Есть два атома водорода, каждый со степенью окисления +1, поэтому в сумме они имеют 2(1) = 2. Общий заряд соединения равен нулю. Это означает, что степень окисления серы должна быть +6, так как (-8) + 2 + 6 = 0,9.0003
Показать вопрос
Подробнее о числе окисления
Откройте для себя подходящий контент для ваших тем
Не нужно обманывать, если у вас есть все необходимое для успеха! Упаковано в одно приложение!
Учебный план
Будьте идеально подготовлены вовремя с индивидуальным планом.

 Приведенные в таблице значения лучше запомнить.
Приведенные в таблице значения лучше запомнить.



 ч.
ч. Растворы
Растворы


 1.3)
1.3) 1.6)
1.6)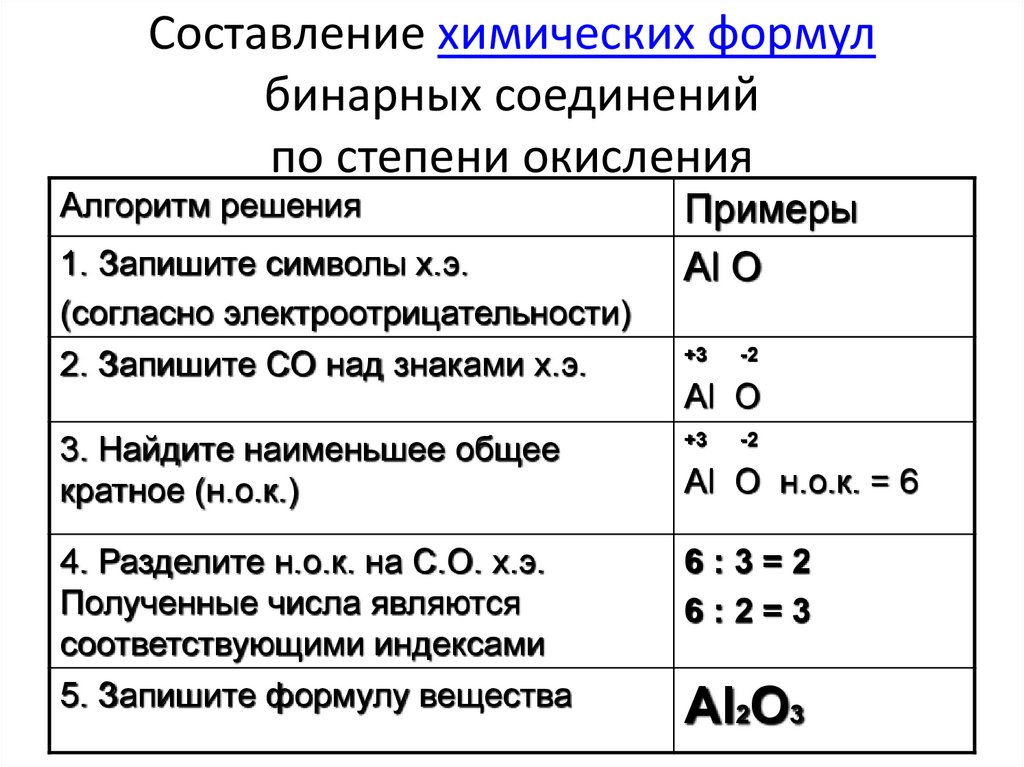 02.202314.22 Mб7Репетитор по химии — Белов Н.В..pdf
02.202314.22 Mб7Репетитор по химии — Белов Н.В..pdf В сумме они составляют 0.
В сумме они составляют 0.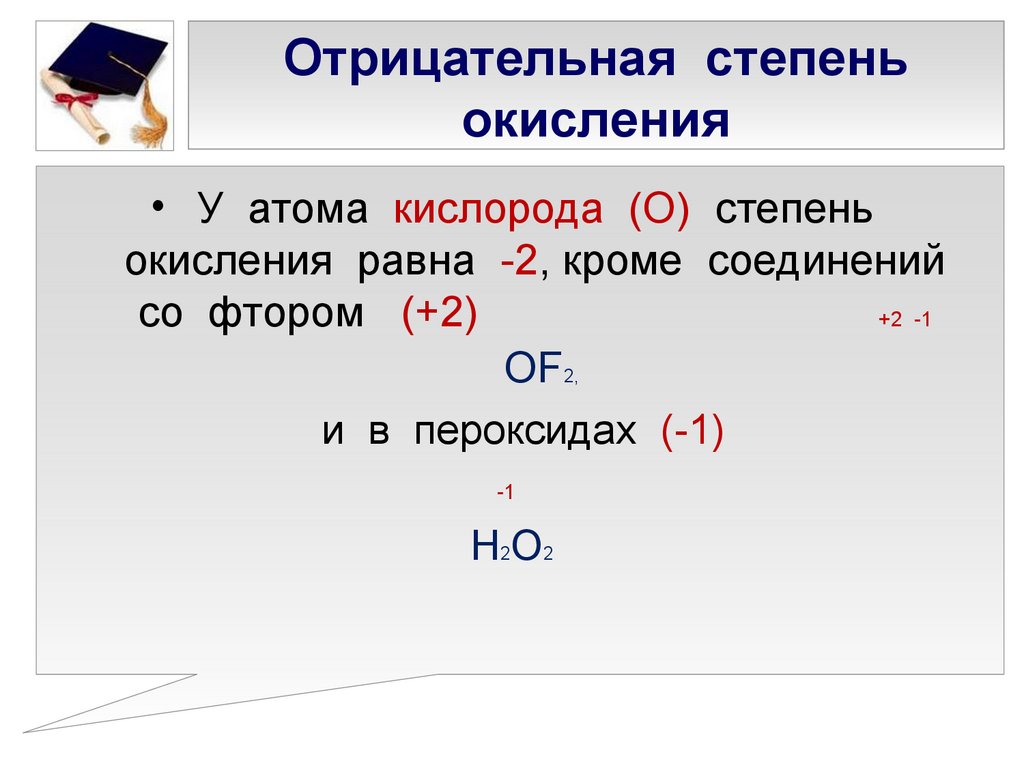
 Между ними есть разница: в соединении -ate всегда на один атом кислорода больше, чем в соединении -ite . Если мы встречаем соединение с одним кислородом больше, чем соединение -ate , мы добавляем префикс per-. Если мы встречаем соединение с одним кислородом меньше, чем соединение -ite , мы добавляем префикс гипо-.
Между ними есть разница: в соединении -ate всегда на один атом кислорода больше, чем в соединении -ite . Если мы встречаем соединение с одним кислородом больше, чем соединение -ate , мы добавляем префикс per-. Если мы встречаем соединение с одним кислородом меньше, чем соединение -ite , мы добавляем префикс гипо-.
