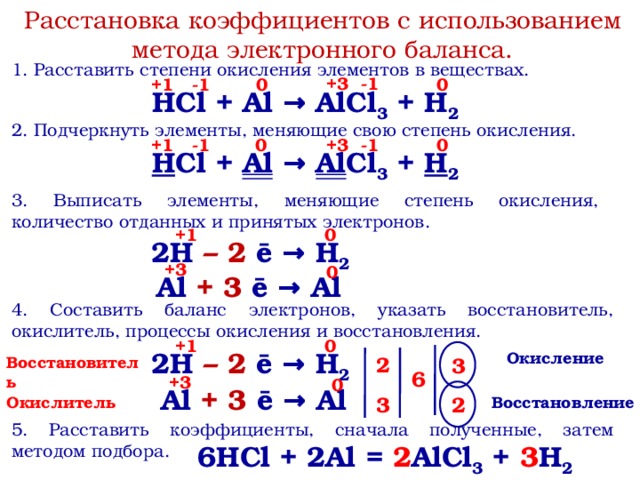
Окислительно-восстановительные реакции
Окислительно-восстановительные
реакции (ОВР) — это реакции, сопровождающиеся
изменением степени окисления элементов
вследствие смещения или полного перехода
электронов от одних атомов или ионов к
другим. Окисление
– процесс отдачи электронов атомом,
молекулой или ионом; восстановление —
процесс присоединения электронов
атомом, молекулой или ионом. Окисление
и восстановление — это взаимосвязанные
процессы, протекающие одновременно.
Окислителями могут быть атомы и молекулы
некоторых неметаллов; сложные ионы и
молекулы, содержащие атомы элементов
в высшей или в одной из высших степеней
окисления MnO4—, NO3—, SO42-, Cr2O72-, ClO3—,  ; положительно заряженные ионы
металлов (Fe3+, Au3+, Ag+, Sn4+, Hg2+ и др.). Типичными восстановителями
являются почти все металлы и некоторые
неметаллы (С, Н2 и др.) в свободном состоянии; отрицательно
заряженные ионы неметаллов (S2-, I— и др.), катионы, степень окисления которых
может возрасти (Sn2+, Fe2+, Cu+ и др.). Если вещество содержит элемент
в промежуточной степени окисления, то
в зависимости от условий проведения
реакции оно может быть и окислителем и
восстановителем. Например, нитрит калия
в присутствии сильного окислителя
проявляет восстановительные свойства,
окисляясь при этом до нитрата
; положительно заряженные ионы
металлов (Fe3+, Au3+, Ag+, Sn4+, Hg2+ и др.). Типичными восстановителями
являются почти все металлы и некоторые
неметаллы (С, Н2 и др.) в свободном состоянии; отрицательно
заряженные ионы неметаллов (S2-, I— и др.), катионы, степень окисления которых
может возрасти (Sn2+, Fe2+, Cu+ и др.). Если вещество содержит элемент
в промежуточной степени окисления, то
в зависимости от условий проведения
реакции оно может быть и окислителем и
восстановителем. Например, нитрит калия
в присутствии сильного окислителя
проявляет восстановительные свойства,
окисляясь при этом до нитрата
3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
При взаимодействии с восстановителем, наоборот проявляет окислительные свойства
2KNO2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2H2O
Такая
окислительно-восстановительная
двойственность характерна также для
Н2О2, H2SO3 (и ее солей) и т.
Составление уравнений ОВР.
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. В основе его лежит правило, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.
Рассмотрим данный метод на реакции взаимодействия сероводорода с перманганатом калия в кислой среде.
H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Затем определяем изменение степеней окисления атомов
H2S-2 + KMn+7O4 + H
2SO4 = S0 + Mn+2SO4 + K2SO4 + H2OОтсюда видно, что степень окисления изменяется у серы и марганца
Далее
составляем электронные уравнения, т. е.
изображаем процессы отдачи и присоединения
электронов:
е.
изображаем процессы отдачи и присоединения
электронов:
S-2 – 2e = S5
Mn+7 + 5e = Mn+2 2
Находим
коэффициенты при окислителе и
восстановителе, а затем при других
реагирующих веществах. Из электронных
уравнений видно, что надо взять 5 молекул H2S и 2 молекулы KMnO
Окончательное уравнение реакции будет иметь вид:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
Правильность
написания уравнения проверяется путем
подсчета атомов каждого элемента в
левой и правой частях уравнения.
Лабораторная работа. Окислительно-восстановительные реакции Опыт 1. Окислительные свойства kMnO4 в различных средах.
В три конические колбы поместить по 3 капли раствора KMnO4. Затем в первую добавить 2 капли раствора 2 н. H2SO4, во вторую — 2 капли дистиллированной воды, в третью -2 капли раствора NaOH, после чего добавлять по каплям в каждую пробирку раствор Na2SO3 до изменения цвета раствора. Как ведет себя KMnO4 в кислой, нейтральной и щелочной среде ?
KMnO4 + Na2SO3 + H2SO4 MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na2SO3 + H2O MnO
KMnO4 + Na2SO3 + NaOH Na2MnO4 + К2SO4 + H2O
Определить
степень окисления для всех элементов,
расставить коэффициенты в уравнениях
реакций.
Опыт 2. Окислительные свойства дихромата калия.
Налейте в две пробирки по 3-4 капли раствора K2Cr2O7, добавьте в одну из пробирок 3-4 капли 2 н. раствора H2SO4, в другую — 3-4 капли 2 н. раствора щелочи. Обратите внимание на изменение цвета раствора во второй пробирке. Добавьте во все пробирки сульфита натрия. Дайте объяснения наблюдаемым явлениям.
К2Cr2O7+ H2SO4 + Na2SO3Cr2 (SO4) 3 + К2SO4+ Na2SO4+ H2O
Определите
степень окисления для всех элементов,
расставьте коэффициенты в уравнениях
реакций.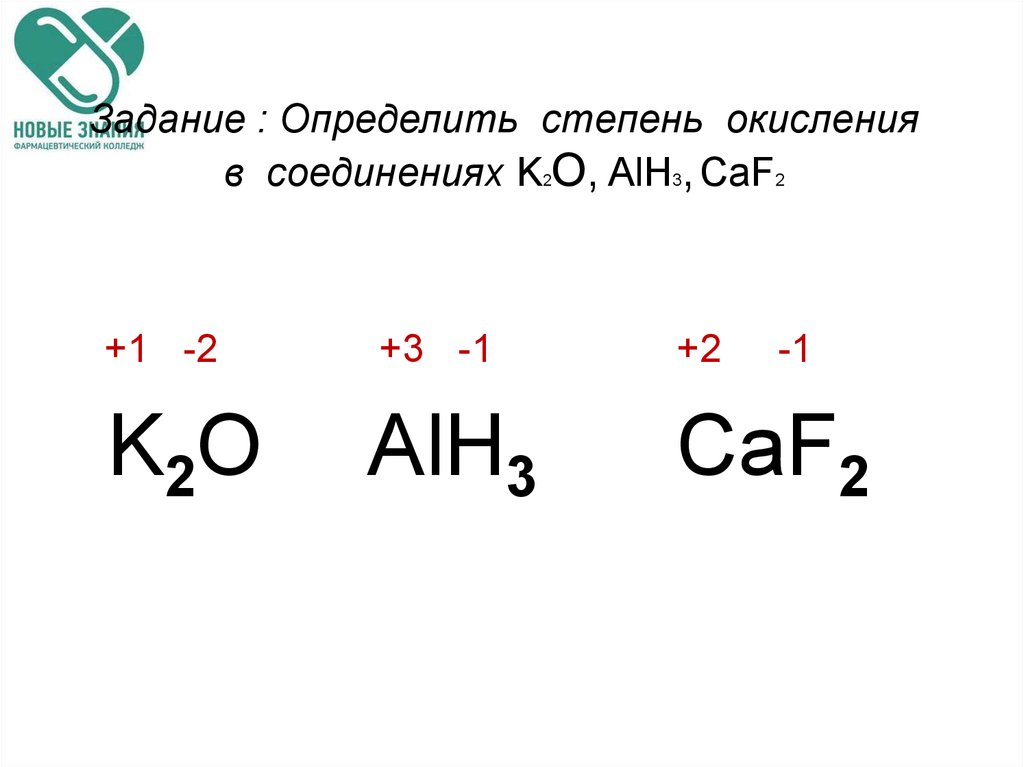
Опыт
3.Восстановление дихромата калия
В пробирку налить 5-6 капель раствора дихромата калия, добавить 2-3капли серной кислоты и внести несколько кристалликов сульфида калия. Встряхнуть содержимое пробирки. Наблюдать изменение окраски.
Опыт 4. Окислительно–восстановительные свойства соединений железа (III)
В пробирку налить 4-5 капель раствора KMnO4 и 1-2 капли H2SO4 по каплям добавить раствор сульфата железа (II) до обесцвечивания раствора.
В
пробирку налить 4-5 капель раствора
хлорида железа и 1-2 капли раствора иодида
калия. Отметить изменение окраски
раствора. В пробирку с 7-8 каплями крахмала
внести 1-2 капли полученного раствора.
Определить степень окисления для всех
элементов, расставить коэффициенты в
уравнениях реакций.
KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2 (SO4 ) 3 + K2SO4 + H2O
FeCl3 +KI FeCl2+KCl+I2
Опыт 5. Самоокисление и самовосстановление (диспропорционирование) сульфита натрия.
В
две цилиндрические пробирки поместить
по 2-3 кристаллика Na2SO3.
Одну пробирку оставить в качестве
контрольной. Вторую закрепить в штативе
и нагревать в течение 5-6 мин. Дать пробирке
остыть. В обе пробирки внести по 2-3 мл
дистиллированной воды, размешать
стеклянными палочками до растворения
солей, находящихся в пробирках.
Na2SO3 + H2O +CuSO4 H2SO4+ Cu2O + NaOH
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 6. Окислительные свойства пероксида водорода.
В
пробирку с 5-6 каплями раствора KI прибавить 3-4 капли 2 н H2SO4 и затем по каплям прибавлять раствор H2O2 до появления желтой окраски. Для
обнаружения в растворе йода внести в
пробирку несколько капель хлороформа
или бензола. Составьте уравнение реакции.
Для
обнаружения в растворе йода внести в
пробирку несколько капель хлороформа
или бензола. Составьте уравнение реакции.
KI + H2O2 + H2SO4I2 + H2O + K2SO4
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 7. Восстановительные свойства пероксида водорода.
В
пробирку с 5-6 каплями KMnO4 прибавить 3-4 капли 2 н H2SO4,
5-6 капель пероксида водорода и подогреть.
Что происходит? Составить уравнение
реакции, учитывая, что пероксид водорода
окисляется до кислорода.
KMnO4 + H2O2 + H2SO4 MnSO4 + O2 + K2SO4 + H2O
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 8. Окисление меди азотной кислотой.
В пробирку поместить кусочек медной проволоки и прибавить 5-6 капель 0,2 н HNO3. Отметить выделение газа, растворение меди и изменение цвета раствора. Составить электронные уравнения реакции, указав окислитель и восстановитель. Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Cu + HNO3 Cu(NO3)2 + NO + H2O
Контрольные вопросы
1. Какие из
следующих реакций являются
окислительно-восстановительными:
Какие из
следующих реакций являются
окислительно-восстановительными:
a) Na2CO3 + SiO2 = Na2SiO3 + CO2 б) Fe2O3 + CO = 2FeO + CO2
в) K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
2. Определить окислитель и восстановитель и подобрать коэффициенты в следующих реакциях окисления-восстановления:
a) Na2SO3 + I2 + H2O = Na2SO4 + HI б) S + HNO3 = H2SO4 + NO
3. Степень
окисления +2 в соединениях имеют металлы:
Cu,
Al, Zn,
Sn,
Pb,
Cr, Fe,
Mn
Степень
окисления +2 в соединениях имеют металлы:
Cu,
Al, Zn,
Sn,
Pb,
Cr, Fe,
Mn
4.Степень окисления +3 в соединениях имеют металлы: Cu, Al, Zn, Sn, Pb, Cr, Fe, Mn
5.Степень окисления +1 в соединениях имеют металлы: Cu, Al, Zn, Sn, Pb, Cr, Fe, Mn, Na, Ca, Ag
1 двустадийный способ получения
1 двустадийный способ полученияI. этап: подготовка руды
Для производства используют окисные руды сорта пиролюзит с содержанием MnO2 не менее 80 % (возможно использование MnO2 48-62%) Руда сушится и измельчается до размеров частиц 200мкм и меньше в шаровых мельницах. Мокрого (50% KOH)и сухого помолов.II этап: получение манганата калия
Твердофазный способ
1) Производят спекание тонкоизмельченного пиролюзита с KOH при 400-800*С
2n KOH+m MnO2 ——} n K2O mMnO2 + h3O В результате взаимодействия руды и гидроокиси калия образуется соединения переменного состава в зависимости от типа руды и температуры.

2) Производят окисление спёкшейся массы кислородом воздуха во вращающихся барабанных печах. (диаметром 2м и длиной 20м )
Для этого пульпа тонкоизмельчённого пиролюзита вдувается в факел горелки расположенной в головке первой печи, при этом удаляется влага и гранулируется реакционная масса. Температура в головке печи 800-850 *С, На выходе она понижается до 380-420 *С. На данном этапе 70% Mn содержится в виде K3MnO4, а 30% находится в виде MnO2 . Далее плав измельчают в шаровых мельницах и направляют во 2-ю печь, где температура колеблется в пределах 180-230 *С (за счёт тепла отходящих газов или наружным обогревом барабана дымовыми газами) На данном этапе происходят все 3 процесса (в основном образование манганата калия, 80-90% Mn находится в виде KMnO4) Суммарное время составляет 32-40 часов , удельная производительность 4-5 кг/ч м3 Выбор температурных режимов и времени проведения процесса , осуществляется в зависимости от типа руды.
 Для повышения эффективности процесса руду можно гранулировать более мелко, а также понизить коэффициент заполнености печи.
Возможно проведение окисления ,предварительно увлажненного и гранулированного до размеров 0,6Х0,6Х1 см пиролюзита, в псевдоожиженном слое при температуре 230-240С , в течение 60-90 мин, или окисление в печи шахтного типа.
В Германии использовали метод, заключающийся в кратковременном спекании пиролюзита со щёлочью в соотношении 1:3 в присутствии кислорода воздуха и температуре 300С
Далее проводили тонкое измельчение и окисление в барабанной печи при t=140-250C в присутствии кислорода, в концентрации 8-30% и водяных паров, в концентрации 10-35% при постоянном обновлении поверхности реарента.
При этом за 4 часа процесса 87% MnO2 переходило в K2MnO4,
Пиролюзит необходимо гидратировать и гранулировать.
Гидрат закиси марганца получают обогащением пиролюзита илидоменного ферромарганца азотнокислым способом.
В настоящее время, данный способ не применяется, из за высокой сложности технологического процесса.
Для повышения эффективности процесса руду можно гранулировать более мелко, а также понизить коэффициент заполнености печи.
Возможно проведение окисления ,предварительно увлажненного и гранулированного до размеров 0,6Х0,6Х1 см пиролюзита, в псевдоожиженном слое при температуре 230-240С , в течение 60-90 мин, или окисление в печи шахтного типа.
В Германии использовали метод, заключающийся в кратковременном спекании пиролюзита со щёлочью в соотношении 1:3 в присутствии кислорода воздуха и температуре 300С
Далее проводили тонкое измельчение и окисление в барабанной печи при t=140-250C в присутствии кислорода, в концентрации 8-30% и водяных паров, в концентрации 10-35% при постоянном обновлении поверхности реарента.
При этом за 4 часа процесса 87% MnO2 переходило в K2MnO4,
Пиролюзит необходимо гидратировать и гранулировать.
Гидрат закиси марганца получают обогащением пиролюзита илидоменного ферромарганца азотнокислым способом.
В настоящее время, данный способ не применяется, из за высокой сложности технологического процесса.
Жидкофазный способ
1 вариант:
Производят окисление пиролюзита и других окислов Mn, в избытке концентрированной KOH, кислородом или кислородосодержащим газом при температуре 140-280 С и интенсивном перемешивании смеси.2 вариант:
Бергиус и Саккур окисляли пиролюзит в 40% KOH при t=150-160С и давлении 100атм.3 вариант:
Кислород пропускают в раствор, содержащий окисные соединения марганца и воду при t=160-220С. Выход перманганата калия составляет 70-85%.4 вариант (двухступенчатый способ):
Сначала производят взаимодействие пиролюзита с 90% KOH в соотношении 30:60; Далее барботируют полученную реакционную смесь K3MnO4 кислородом, и очищают манганат калия (VII) от избытка KOH (промыванием и фильтрацией)5 вариант (разработан в СССР):
Производят окисление пиролюзита , и 70-80% KOH в соотношении 1:5, кислородом при 220-230С и интенсивном перемешивании. В результате выход манганата (VII) калия состаляет 87-93% за 2-6 часов.
Удельная производительность реакторов 40-50 кг/ч м3
При использовании данного метода руда не набухает, масса не густеет, тепло из вне не подводится возможно использовать любой теплоноситель вместо водорода. Также обеспечивается цикловое использование KOH и соответственно низкий расход щёлочи. К тому же образуется кристаллический продукт, что необходимо для широкого применения KMnO4.
В результате выход манганата (VII) калия состаляет 87-93% за 2-6 часов.
Удельная производительность реакторов 40-50 кг/ч м3
При использовании данного метода руда не набухает, масса не густеет, тепло из вне не подводится возможно использовать любой теплоноситель вместо водорода. Также обеспечивается цикловое использование KOH и соответственно низкий расход щёлочи. К тому же образуется кристаллический продукт, что необходимо для широкого применения KMnO4.
III этап: получение перманганата калия методом анодного окисления
Процесс перехода манганата в перманганат происходит даже при простом кипячении водного раствора по реакции:3K2MnO4+2h3O=2KMnO4+MnO2+4KOH Процесс заметно ускоряется при обработке раствора диоксидом углерода:
3K2MnO4+3CO2=2KMnO4+MnO2+2K2CO3 Однако, образующийся в процессе карбонат калия требуется подвергать каустификации известью для регенерации гидроксида калия:
K2CO3+CaO+h3O=2KOH+CaCO3 Получение перманганата этим способом оказывается невыгодным и тем, что значительная доля исходного манганата превращается в диоксид марганца.
 Окисление манганата хлором по реакции:
Окисление манганата хлором по реакции:
2K2MnO4+Cl2=2KMnO4+2KCl Также экономически невыгодно, поскольку регенерация гидроксида калия из его хлорида, например электролизом, является дорогим процессом. В настоящее время перевод манганата в перманганат осуществляется обычно электрохимическим окислением.
1) Подготовка электролита
Манганат (VII) калия растворяют в KOH концентрацией 70-150г/л в течение 1-1,5 часа ,при 70С и очищают от примесей. Для электролиза используют скоростные растворители непрерывного действия с мешальными устройствами и непрерывной подачей раствора на электролиз. Отстоявшийся раствор направляется на электролиз, а шлам поступает на барабанные вакуум-фильтры, где отделяется от раствора и возвращается на процесс получения манганатного плава. При необходимости проводят упарку дополнительно введённой воды. Шлам содержит 35-50% MnO2 (не прореагировавшего при получении манганата) и другие примеси, перешедшие из исходного пиролюзита. По мере значительного накопления вышедших из пиролюзита примесей, шлам вывозится в шламонакопитель.
По мере значительного накопления вышедших из пиролюзита примесей, шлам вывозится в шламонакопитель.
2) Электрохимическое окисление
Проводится в ваннах, представляющих собой стальной цилиндрический резервуар с коническим днищем, по которому уложен змеевик, с помощью которого регулируют температуру в ванне, впуская в него греющий пар или охлаждённую воду. Температуру можно регулировать и электрическим путём. Ванна снабжена мешальным устройством и спускным краном. Железные аноды расположены внутри ванны в виде нескольких концентрических цилиндров на расстоянии 100мм друг от друга. Применяют также никелевые аноды. Между анодами находятся катоды -железные стержни диаметром 20-25мм. Общая поверхность катодов приблизительно в 10 раз меньше поверхности катодов, что уменьшает потери от катодного восстановления. Плотность тока на аноде 60-150 а/м2, на катоде 600-1500а/м2 . Анодные и катодные пластины опираются на стеклянные или фарфоровые изоляторы. Диаметр ванны 1,3-1,4м , высота цилиндрической части -0,7-0,8м, конической части -0,5м. В ванну вмещается 900 1000 литров раствора электролита. Процесс электролиза проводится при 60С.
Напряжение на ванну в начале электролиза составляет ~2,7В, нагрузка 1400-1600 а.В конце процесса электролиза напряжение возрастает до 3В, а сила тока несколько падает. Ванны работают сериями по нескольку штук. Число ванн в серии определяется характеристикой генератора постоянного тока. Расход энергии на 1т KMnO4 составляет 700 кВт.ч.
Процесс электролиза обычно без диафрагмы, поскольку она засоряется диоксилом марганца, незначительное количество которого образуется в процессе. Поэтому выход по току зависит главным образом от степени обратного восстановления перманганата на катоде. Большая щёлочность электролита препятствует использованию добавок для образования на катоде защитной плёнки. Уменьшению выхода по току способствует также выделения на аноде кислорода и обратный переход KMnO4 в K2MnO4 по причине высокой концентрации гидроксида калия:
4KMnO4+4KOH=4K2MnO4+2h3O+O2
Реакция каталитически ускоряется присутствующим в электролите диоксидом марганца.
Диаметр ванны 1,3-1,4м , высота цилиндрической части -0,7-0,8м, конической части -0,5м. В ванну вмещается 900 1000 литров раствора электролита. Процесс электролиза проводится при 60С.
Напряжение на ванну в начале электролиза составляет ~2,7В, нагрузка 1400-1600 а.В конце процесса электролиза напряжение возрастает до 3В, а сила тока несколько падает. Ванны работают сериями по нескольку штук. Число ванн в серии определяется характеристикой генератора постоянного тока. Расход энергии на 1т KMnO4 составляет 700 кВт.ч.
Процесс электролиза обычно без диафрагмы, поскольку она засоряется диоксилом марганца, незначительное количество которого образуется в процессе. Поэтому выход по току зависит главным образом от степени обратного восстановления перманганата на катоде. Большая щёлочность электролита препятствует использованию добавок для образования на катоде защитной плёнки. Уменьшению выхода по току способствует также выделения на аноде кислорода и обратный переход KMnO4 в K2MnO4 по причине высокой концентрации гидроксида калия:
4KMnO4+4KOH=4K2MnO4+2h3O+O2
Реакция каталитически ускоряется присутствующим в электролите диоксидом марганца. Увеличению выхода по току способствует низкая анодная плотность тока и искусственное перемешивание электролита, уменьшающее концентрационную поляризацию на аноде, при перемешивании в прианодном слое создаётся более высокая концентрация манганата, понижается анодный потенциал, в результате чего уменьшается выделение кислорода.
Выход по току и степень окисления увеличиваются при электролизе насыщенного раствора K2MnO4 в присутствии кристаллов. Такой раствор содержит примерно 180 г/л манганата,
30-40 г/л перманганата, 150 г/л калийной щёлочи и 50 г/л карбоната калия. Процесс электролиза продолжается до снижения концентрации манганата до 15-30 г/л.
Предусмотрен электролиз манганата в двух сериях ванн, во вторую серию поступают растворы с малым содержанием манганата-5-25 г/л, при понижении концентрации манганата рекомендуется снижать и плотность анодного тока.
Изучено, что присутствие в растворе ионов Cl-, SO42-, AlO42-, на выход перманганата не влияет, однако он значительно падает в присутствие SiO32-.
Увеличению выхода по току способствует низкая анодная плотность тока и искусственное перемешивание электролита, уменьшающее концентрационную поляризацию на аноде, при перемешивании в прианодном слое создаётся более высокая концентрация манганата, понижается анодный потенциал, в результате чего уменьшается выделение кислорода.
Выход по току и степень окисления увеличиваются при электролизе насыщенного раствора K2MnO4 в присутствии кристаллов. Такой раствор содержит примерно 180 г/л манганата,
30-40 г/л перманганата, 150 г/л калийной щёлочи и 50 г/л карбоната калия. Процесс электролиза продолжается до снижения концентрации манганата до 15-30 г/л.
Предусмотрен электролиз манганата в двух сериях ванн, во вторую серию поступают растворы с малым содержанием манганата-5-25 г/л, при понижении концентрации манганата рекомендуется снижать и плотность анодного тока.
Изучено, что присутствие в растворе ионов Cl-, SO42-, AlO42-, на выход перманганата не влияет, однако он значительно падает в присутствие SiO32-. Изучена возможность использования металлургических сортов марганцевых руд , методом автоклавного окисления.
Новый метод автоклавного получения манганата позволяет использовать более дешёвые сорта марганцевых руд ,взамен дефицитного пиролюзита, существенно сокращает время проведения процесса и удельный расход щёлочи.
Процесс электрохимического окисления манганата в растворах, может быть существенно интенсифицирован за счёт применения диафрагмы из стеклоткани, пропитанной лаком ХСЛ.
Диафрагма в виде чехла укрепляется на катоде и существенно снижает потери продукта от восстановления.
Показатель Электролизёр без диафрагмы Электролизёр с катодным чехлом
Нагрузка, кА 5 5
Плотность тока
Анодного а/мм
Катодного а/мм
Объёмная а/мм
80
800
1,14
80
90
2,1
Напряжение на электролизёре, В 2,-2,7 1,9-2,0
Выход по току % 60-70 84
Объём электролизёра ,м3 4,4 2,4
Содержание K2MnO4, г/л
В исходном электролите
В отработанном электролите
200-220
35-40
115-125
15-18
В электролизёрах с диафрагмой удаётся осуществить интенсивное перемешивание, которое снижает выход по току перманганата в электролизёре без диафрагмы из-за усиления катодного восстановления.
Изучена возможность использования металлургических сортов марганцевых руд , методом автоклавного окисления.
Новый метод автоклавного получения манганата позволяет использовать более дешёвые сорта марганцевых руд ,взамен дефицитного пиролюзита, существенно сокращает время проведения процесса и удельный расход щёлочи.
Процесс электрохимического окисления манганата в растворах, может быть существенно интенсифицирован за счёт применения диафрагмы из стеклоткани, пропитанной лаком ХСЛ.
Диафрагма в виде чехла укрепляется на катоде и существенно снижает потери продукта от восстановления.
Показатель Электролизёр без диафрагмы Электролизёр с катодным чехлом
Нагрузка, кА 5 5
Плотность тока
Анодного а/мм
Катодного а/мм
Объёмная а/мм
80
800
1,14
80
90
2,1
Напряжение на электролизёре, В 2,-2,7 1,9-2,0
Выход по току % 60-70 84
Объём электролизёра ,м3 4,4 2,4
Содержание K2MnO4, г/л
В исходном электролите
В отработанном электролите
200-220
35-40
115-125
15-18
В электролизёрах с диафрагмой удаётся осуществить интенсивное перемешивание, которое снижает выход по току перманганата в электролизёре без диафрагмы из-за усиления катодного восстановления. Процесс электрохимического окисления манганата калия интенсифицируется также при наложении ультразвукового поля-
Электросинтез интенсифицируется в 10 раз с одновременным повышением выхода по току на 20-30% и степени окисления на 30%, по сравнению с используемыми методами.
Оптимальные условия электролиза достигаются при концентрациях (в г/л) K2MnO4-150-230; KMnO4-15; KOH-50-90; MnO2-6;температура 35-40С; плотность анодного тока 0,8-2,4 кА/м2, т.е в 10-15 раз больше, чем существующие. Оптимальная интенсивность ультразвука 0,3-0,5 Вт/см3 при направлении его параллельно поверхности электродов и преимущественном “озвучивании анода” эффект влияния ультразвука объясняется снижением концентрационной поляризации на аноде (на 0,3-0,35 В) и перенапряжении водорода.(на 0,04В), а также диспергирующим и дегазирующим действием. Выход по току перманганата калия и степень окисления манганата в ультразвуковом поле составляет 90%. Описана конструкция ультразвукового электролизёра на 5кА ёмкостью 800 л.
Процесс электрохимического окисления манганата калия интенсифицируется также при наложении ультразвукового поля-
Электросинтез интенсифицируется в 10 раз с одновременным повышением выхода по току на 20-30% и степени окисления на 30%, по сравнению с используемыми методами.
Оптимальные условия электролиза достигаются при концентрациях (в г/л) K2MnO4-150-230; KMnO4-15; KOH-50-90; MnO2-6;температура 35-40С; плотность анодного тока 0,8-2,4 кА/м2, т.е в 10-15 раз больше, чем существующие. Оптимальная интенсивность ультразвука 0,3-0,5 Вт/см3 при направлении его параллельно поверхности электродов и преимущественном “озвучивании анода” эффект влияния ультразвука объясняется снижением концентрационной поляризации на аноде (на 0,3-0,35 В) и перенапряжении водорода.(на 0,04В), а также диспергирующим и дегазирующим действием. Выход по току перманганата калия и степень окисления манганата в ультразвуковом поле составляет 90%. Описана конструкция ультразвукового электролизёра на 5кА ёмкостью 800 л. К корпусу электролизёра примыкает сборник кристаллов. Электролизёр имеет крышку, снабжённую патрубком для отвода газов. В дне ванны, имеющим угол 5-100 в сторону кристаллизатора, помещено 8 магнитострикционных преобразователей типа ПМС-6 . Аноды из никеля или нержавеющей стали изготовлены в виде пластин толщиной 0,15-0,2мм, проходящих вдоль электролизёра. Стальные катоды изготовлены в виде прутков толщиной 6-8мм.Раствор, содержащий частицы манганата поступает в электролизёр через штуцер. Кристаллы перманганата калия отводят через штуцер сборника.[2],[10],[15],[16]
К корпусу электролизёра примыкает сборник кристаллов. Электролизёр имеет крышку, снабжённую патрубком для отвода газов. В дне ванны, имеющим угол 5-100 в сторону кристаллизатора, помещено 8 магнитострикционных преобразователей типа ПМС-6 . Аноды из никеля или нержавеющей стали изготовлены в виде пластин толщиной 0,15-0,2мм, проходящих вдоль электролизёра. Стальные катоды изготовлены в виде прутков толщиной 6-8мм.Раствор, содержащий частицы манганата поступает в электролизёр через штуцер. Кристаллы перманганата калия отводят через штуцер сборника.[2],[10],[15],[16]
IV Этап: кристаллизация
Образующийся перманганат плохо растворим, поэтому частично выделяется в осадок в виде кристаллов. По окончании процесса раствор электролита вместе с кристаллами перманганата калия поступает в стальные, охлаждаемые с помощью водяных рубашек холодильники с мешальными устройствами. Для кристаллизации используются : 1. Емкостные аапарата объёмом 12-25м3 с рубашками и рамнвми мешалками (производство Россия) 2. Ёмкостные аппараты с трубками Фильда, с перемешиванием
3. конвекцией (производство Германия)
4. Вращающиеся барабаны с наружным оросительным охлаждением и подачей воздуха внутрь барабанаобъёмом 18 м3 (производство Чехия)
5. Вакуум-кристаллизаторы барабанные –непрерывного действия и ёмкостные периодического действия.
Из кристаллизаторов пульпа направляется в сгустители-отстойники, отжимается на горизонтальной фильтрующей центрифуге центрифуге и промывается водой. Маточные растворы и промывочные воды после центрифуги направляются на выщелачивание манганатного плава.
Маточные растворы содержат 23 г/л KMnO4, 16г/л K2MnO4 210 г/л KOH и 60 г/л K2CO3.
После промывки на центрифуге и высушивания получается загрязнённый технический перманганат калия , содержащий 80-95% KMnO4 и примеси диоксида марганца, манганата калия, сульфатов, карбоната и гидроксида калия.
С целью получения качественного целевого продукта, образующиеся кристаллы растворяют в чистой воде при 85С, фильтруют на фильтр-прессах или методом отстоя, а из полученных растворов путём их охлаждения -чистые кристаллы,
Которые направляются на сушку в барабанные или пневмогазовые ленточные сушилки, подогретые воздухом.
Ёмкостные аппараты с трубками Фильда, с перемешиванием
3. конвекцией (производство Германия)
4. Вращающиеся барабаны с наружным оросительным охлаждением и подачей воздуха внутрь барабанаобъёмом 18 м3 (производство Чехия)
5. Вакуум-кристаллизаторы барабанные –непрерывного действия и ёмкостные периодического действия.
Из кристаллизаторов пульпа направляется в сгустители-отстойники, отжимается на горизонтальной фильтрующей центрифуге центрифуге и промывается водой. Маточные растворы и промывочные воды после центрифуги направляются на выщелачивание манганатного плава.
Маточные растворы содержат 23 г/л KMnO4, 16г/л K2MnO4 210 г/л KOH и 60 г/л K2CO3.
После промывки на центрифуге и высушивания получается загрязнённый технический перманганат калия , содержащий 80-95% KMnO4 и примеси диоксида марганца, манганата калия, сульфатов, карбоната и гидроксида калия.
С целью получения качественного целевого продукта, образующиеся кристаллы растворяют в чистой воде при 85С, фильтруют на фильтр-прессах или методом отстоя, а из полученных растворов путём их охлаждения -чистые кристаллы,
Которые направляются на сушку в барабанные или пневмогазовые ленточные сушилки, подогретые воздухом. Часть маточных растворов после кристаллизации перманганата калия, содержащих кроме перманганата и щелочей, алюминаты, ванадаты, и другие примеси, подвергают каустификации известью (CaO или Ca(OH)2)-с целью регенерации KOH и отфильтровав растворы напрвляют на процесс выщелачивания манганата.
Также можно очищать щёлоче-поташный маточный раствор методом дробной упарки и последовательного разделения K2MnO4, K2CO3 и KOH основанном на различной растворимости K2MnO4 и K2CO3 в концентрированных растворах щёлочи.Выделившийся кристаллический манганат используют для приготовления электролита, а маточный раствор перерабатывают на поташ после карбонизации или обрабатывают известью с целью регенерации щёлочи.
Разработан также способ утилизации маточного раствора восстановив KMnO4 и K2MnO4 раствором формалина до диоксида марганца. Оставшийся после отделения диоксида марганца раствор диоксида и карбоната калия нейтрализуют азотной кислотой и получают нитрат калия.[2],[10],[20]
Часть маточных растворов после кристаллизации перманганата калия, содержащих кроме перманганата и щелочей, алюминаты, ванадаты, и другие примеси, подвергают каустификации известью (CaO или Ca(OH)2)-с целью регенерации KOH и отфильтровав растворы напрвляют на процесс выщелачивания манганата.
Также можно очищать щёлоче-поташный маточный раствор методом дробной упарки и последовательного разделения K2MnO4, K2CO3 и KOH основанном на различной растворимости K2MnO4 и K2CO3 в концентрированных растворах щёлочи.Выделившийся кристаллический манганат используют для приготовления электролита, а маточный раствор перерабатывают на поташ после карбонизации или обрабатывают известью с целью регенерации щёлочи.
Разработан также способ утилизации маточного раствора восстановив KMnO4 и K2MnO4 раствором формалина до диоксида марганца. Оставшийся после отделения диоксида марганца раствор диоксида и карбоната калия нейтрализуют азотной кислотой и получают нитрат калия.[2],[10],[20]
главная страница
Степени окисления марганца — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 131419
Необходимое обучение | Необходимые СИЗ |
|---|---|
Основы безопасности лаборатории UC | Лабораторный халат, защитные очки, нитриловые перчатки |
Оборудование | Химикаты |
Четыре стакана по 50 мл | 60 мл 0,01 М KMnO 4 |
Белый лист бумаги | 4 мл 3M H 2 SO 4 |
60 мл 0,02 М NaHSO 3 | |
6 мл 2М NaOH | |
Процедура:
- Поместите по 15 мл 0,01 М раствора KMnO 4 в каждый из четырех стаканов емкостью 50 мл, обозначенных буквами A, B, C и D.
 Поместите стаканы на белый лист бумаги для лучшей видимости.
Поместите стаканы на белый лист бумаги для лучшей видимости. - Отложите стакан D в качестве эталона; это степень окисления +7 Mn (фиолетовый)
- В стакан А добавьте 4 мл 3M H 2 SO 4 (кислотная среда). При перемешивании медленно добавьте ~32 мл 0,02 М раствора NaHSO 3 . Обратите внимание на переход от фиолетового к бесцветному. Это состояние +2 Mn .
2MNO4 — (AQ) + H + (AQ) + 5HSO 3 — (AQ) ↔ 2MN 2+ (AQ) ↔ 2MN 9. (AQ) ↔ 2MN (AQ) ↔ 2MN (AQ) ↔ 2MN .0076 (водн.) + 5SO 4 2- (водн.) + 3H 2 O (л)
4) В химический стакан B добавьте 6 мл 2M NaOH (основное состояние). При перемешивании медленно добавьте ~8 мл 0,02 М раствора NaHSO 3 . Обратите внимание на изменение цвета с фиолетового на зеленый. Это +6 состояние Mn.
Обратите внимание на изменение цвета с фиолетового на зеленый. Это +6 состояние Mn.
2MNO 4 — (AQ) + 3OH — (AQ) + HSO 3 — (AQ) № — (AQ) .0137 (водн.) + SO 4 2- (водн.) + 2H 2 O (л)
5) При перемешивании медленно добавьте ~20 мл 0,02 М NaHSO 3 в химический стакан C (нейтральное состояние). Обратите внимание на образование коричневого осадка, указывающего на состояние +4 Mn.
OH — + 2MNO 4 — (AQ) + 3HSO 3 — (AQ) ↔ 2mno 2 (S) + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + . 0137 (водный) + 2H 2 O (л)
0137 (водный) + 2H 2 O (л)
Опасности:
Перманганат калия является сильным окислителем, поэтому держите его подальше от восстановителей. KMnO 4 также окрашивает кожу. Серная кислота и гидроксид натрия могут вызвать сильные ожоги. При попадании на кожу промыть большим количеством воды.
СОП:
Коррозионное вещество – гидроксид натрия, серная кислота,
Окислитель – перманганат калия
Утилизация (на складе)
Цель состоит в том, чтобы преобразовать все соединения марганца в Mn(II) и выбросить его в раковину. Наполните пластиковый контейнер объемом 1 л 200 мл водопроводной воды. Добавьте содержимое каждого стакана в этот контейнер по одному. При необходимости подкислите раствор 1М HCl. Небольшими порциями при перемешивании добавляйте 2% NaHSO3 до тех пор, пока весь коричневый диоксид марганца не восстановится (раствор станет прозрачным). Нейтрализуйте и смойте в раковину большим количеством воды (не менее 10-кратного общего объема раствора).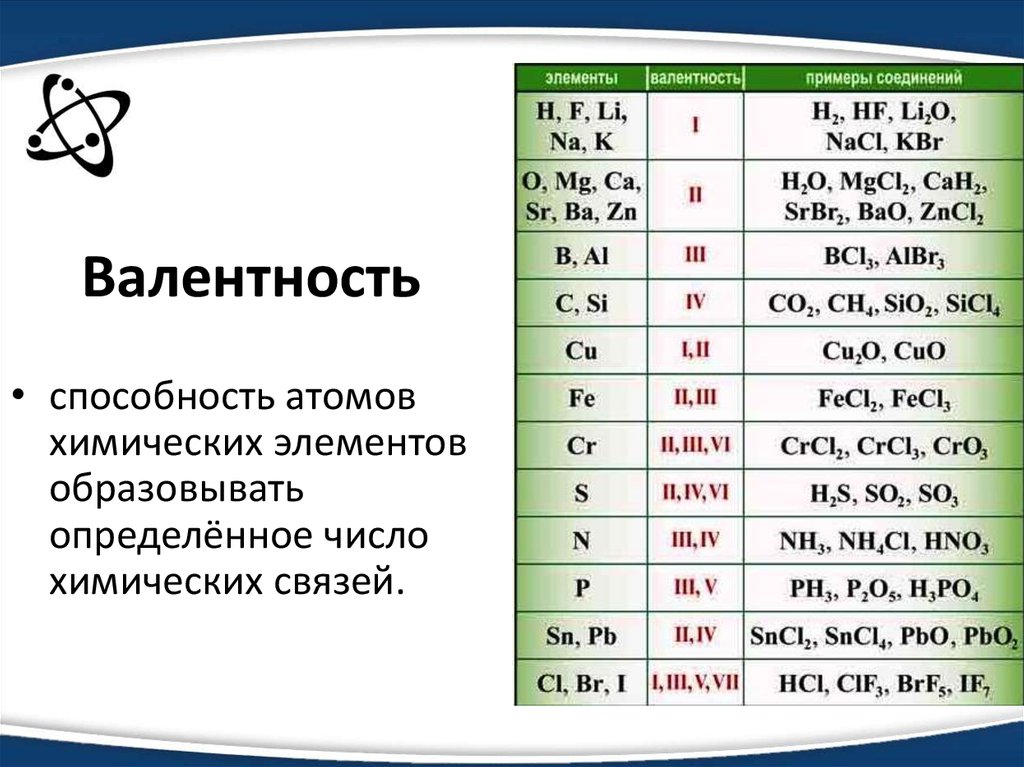
Статусы окисления марганца распространяются по лицензии CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги

Степень окисления Mn в MnO₄⁻
спросил 9-}$ есть. До сих пор я понял, что O имеет степень окисления -2, поэтому, поскольку существует 4 O, число превращается в -8. Что происходит с минусом на O? и какая степень окисления у Mn?
- степень окисления
$\endgroup$
$\begingroup$
Сумма степеней окисления всех атомов должна равняться общему заряду иона.
Например, для $\ce{Nh5+}$, если каждый атом водорода имеет степень окисления +1, а общий заряд +1, то мы можем найти степень окисления азота: 92-}$. Если каждый атом кислорода имеет степень окисления -2, а общий заряд равен -2, мы можем найти степень окисления серы:
$$\begin{aligned} 4(-2) + OS_\ce{S } &= -2\\ OS_\ce{S} &= -2 -4(-2) \\ OS_\ce{S} &= +6 \end{выровнено}$$
$\endgroup$
$\begingroup$
Видя, что кислород имеет степень окисления -2, а у вас 4 атома кислорода, общий заряд кислорода = -8.

 Поместите стаканы на белый лист бумаги для лучшей видимости.
Поместите стаканы на белый лист бумаги для лучшей видимости.