7 фактов о структуре Льюиса Cu[(nh4)4] 2+, характеристики —
By Сарнали Мукерджи
В этой статье будут описаны структура Льюиса Cu[(nh4)4] 2+ и 7 фактов об ионе Cu[(Nh4)4]2+, который в химии называют тетрааминовым ионом меди. Факты будут раскрыты через набросок структуры Льюиса этого сложного соединения.
Факты, которые будут описаны, иллюстрирующие внутренние характеристики соединения:
Котлеты из фарша с …
Please enable JavaScript
Котлеты из фарша с грибами, удивительные вкусные котлеты!😋
- Cu[(Nh4)4]2+ Название
- Cu[(Nh4)4]2+ Степень окисления
- Cu[(Nh4)4]2+ Магнитный момент
- Cu[(Nh4)4]2+ Форма
- Cu[(Nh4)4]2+ Цвет
- Cu[(Nh4)4]2+ Координационное число
- Cu[(Nh4)4]2+ структура Льюиса
- Cu[(Nh4)4]2+ Реакция с HCl
Комплексному соединению всегда необходимо иметь конкретное название, которое определяется применением правил, установленных IUPAC (Международным союзом теоретической и прикладной химии) с помощью его химической формулы.
Название, данное ИЮПАК Cu[(Nh4)4]2+, представляет собой тетраамин меди. Тетрааммин определяется выделением четырех аминогрупп, которые присоединены к одному иону меди.
Cu[(Nh4)4]2+ Степень окисленияСтепень окисления является одной из важных характеристик, которая определяет избыток или недостаток электронов в соединениях, то есть приобретение или потерю электрона в центральном атоме.
Степень окисления Cu в тетраамине меди составляет +2, поскольку общий комплексный ион имеет дефицит двух электронов, а соединение (Nh4)4 (аммиак) имеет нулевую степень окисления.
Cu[(Nh4)4]2+ Магнитный моментМагнитный момент относится к характеристике, которая указывает на магнитный дипольный момент, то есть тенденцию объектов или элементов выравниваться с определенной величиной магнитного поля.
Это соединение накладывает парамагнитный эффект. Магнитный момент Cu[(Nh4)4]2+ составляет 1. 73 м.н., это свойство надежно подтверждает факт о количестве n-спаренных электронов в этом соединении. Существует определенная формула, помогающая вычислить количество неспаренных электронов.
73 м.н., это свойство надежно подтверждает факт о количестве n-спаренных электронов в этом соединении. Существует определенная формула, помогающая вычислить количество неспаренных электронов.
Формула: количество неспаренных электронов = √n(n+2), где N относится к величине магнитного момента. Следовательно, это показывает, что один неспаренный электрон присутствует в соединении [√п (п + 2) = √1.73(1.73+2) = 1].
Cu[(Nh4)4]2+ ФормаФорма соединений выявляется путем расчета количества электронов, присутствующих в соединениях. Электронная конфигурация соединений достоверно отражает представление о форме соединения. Электронная конфигурация Куппера в Cu[(Nh4)4]2+: 1s2 2s2 2p6 3s2 3p6 3d0 4s0. Cu демонстрирует гибридизацию dsp2 с одним спаренным электроном. Соединение показывает квадратную планировочную форму в химии вместо тетраэдрической геометрии.
Цвет соединений зависит от обмена электронами на орбиталях. Перемещение электронов с одной орбитали на другую может влиять на степень окисления и отражает определенные элементы соединений.
Cu[(Nh4)4]2+ цвет от ВикипедияВ норме медь не имеет неспаренных электронов с заполненной D10-орбиталью, поэтому выглядит бесцветной. В Cu[(Nh4)4]2+ медь получает неспаренный электрон после добавления аммиака, что придает всему иону темно-синий цвет.
Cu[(Nh4)4]2+ Координационное числоКоординационное число относится к числу атомов, которые координируют или создают связи с другим атомом, участвующим в формировании общей сложной структуры.
Как соединение с четырьмя аммиаками, присоединяйтесь к одному ион Cu2+, что означает факт что соединение имеет четыре координационных числа. Этот комплексный ион имеет четыре сильных лиганда, поэтому он рассматривается как стабильное координационное соединение в ряду.
Число валентных электронов, присутствующих в Cu, равно 1, но в Cu2+ оно становится равным 9. Четыре соединения Nh4 содержат четыре атома азота, каждое из которых имеет одну неподеленную пару после связывания с тремя молекулами водорода. Следовательно, общее число электронов, присутствующих в четырех соединениях Nh4, равно 8.
Для получения стабильности происходит частичное разделение электронов между соединениями Cu2+ и Nh4. Согласно с Метод рисования Льюиса., структура этого соединения Cu занимает центральное положение в геометрии.
Полный эскиз Структура Льюиса показывает, что это соединение создает ковалентную связь, поскольку Cu является металлом, а Nh4 выглядит как неметалл, а как ионное соединение. Эта структура актуальна для представления электронного устройства и отсутствия электронов в комплексном ионе.
Cu[(Nh4)4]2+ Реакция с HClСоляная кислота (HCl) является сильной коррозионной кислотой, которая легко вступает в реакцию с соединениями.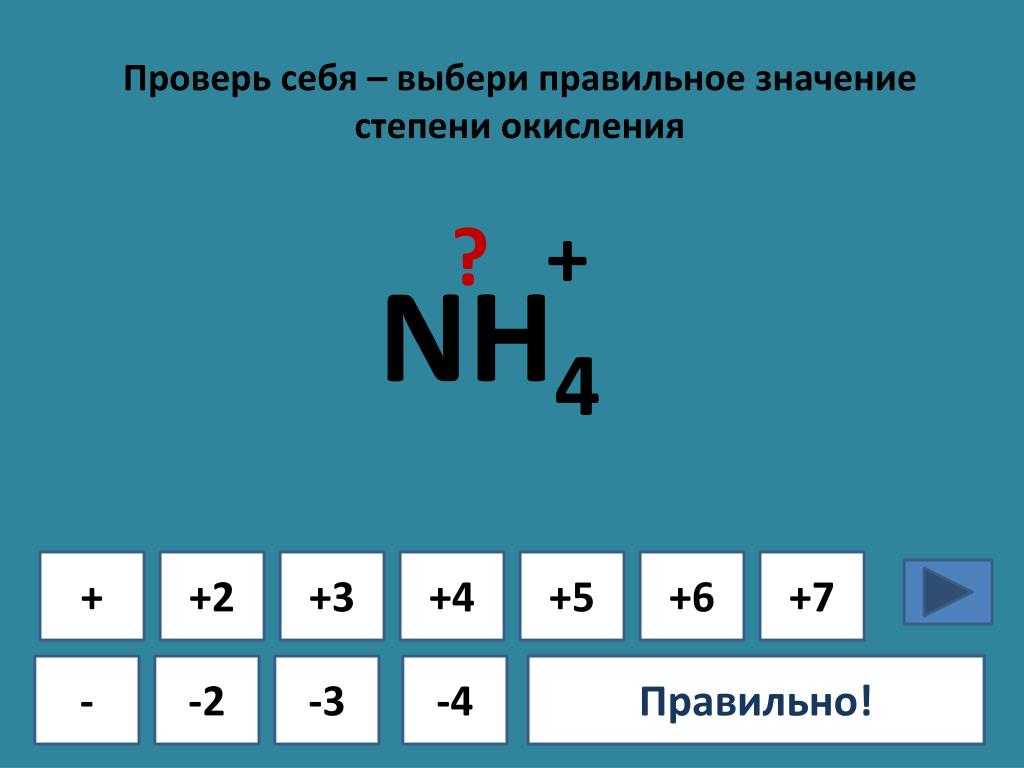 Реакция между этим комплексным ионом и HCl является своего рода реакцией, которая вызывает эффект изменения цвета как химическое свойство кислоты при взаимодействии с ионами.
Реакция между этим комплексным ионом и HCl является своего рода реакцией, которая вызывает эффект изменения цвета как химическое свойство кислоты при взаимодействии с ионами.
HCl сначала дает водный раствор тетраамина меди (II) в присутствии кислорода. Затем он дает избыток атома хлора I-й в середине реакции. Сбалансированное химическое уравнение приводится ниже, чтобы описать его процесс и причину проявления эффекта изменения цвета.
Cu[(Nh4)4(h3O)2]2+ + 4Cl = [CuCl]2- + 4Nh4 + 2h3O
Атом хлора добавляется к меди, так как сильное присутствие HCl разрушает ион. Другая часть комплексного иона, представляющая собой Nh4 (аммиак), извлекается из соединения. Это реакция замещения лиганда так как здесь происходит замещение сильного лиганда аммиаком в присутствии сильной кислоты.
Добавление ионов хлорида к меди превращает темно-синий цвет водного раствора тетраамина меди (II) вводят Зеленый цвет.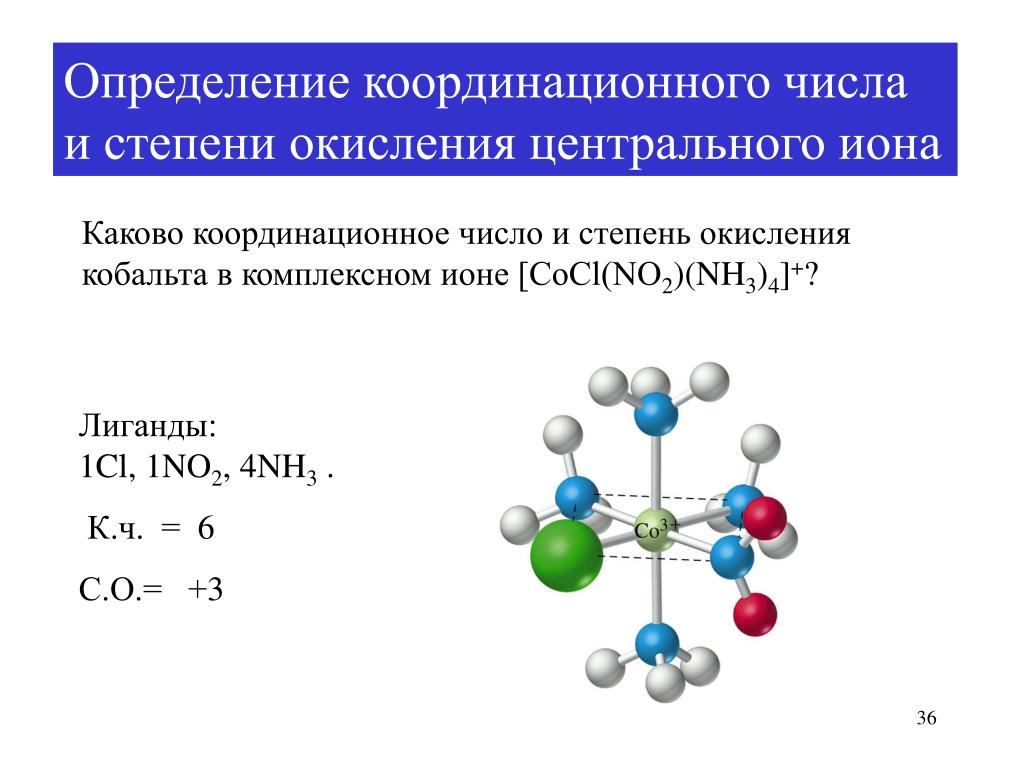 Это происходит за счет перехода электронов. Однако после вытеснения аммиака такое изменение окраски происходит Комплекс тетрахлормеди (II) и молекула воды выступает в качестве основного продукта этой реакции.
Это происходит за счет перехода электронов. Однако после вытеснения аммиака такое изменение окраски происходит Комплекс тетрахлормеди (II) и молекула воды выступает в качестве основного продукта этой реакции.
В этой статье широко обсуждался тетраамин меди (II), один из комплексных ионов и координационных соединений в химии. Исключительный факты об этом соединении и его реакции с соляной кислотой были объяснены в этой статье.
Раздел 6. Общая характеристика химических элементов и их соединений
Большую роль играют комплексные соединения в биохимических про-
цессах в медицине. Такие вещества, как хлорофил, гемоглобин, витамин В12, являются комплексными соединениями магния, железа и кобальта.
Среди
всех
типов
комплексных
соединений
наибольшей
токсичностью
обладают
карбонилы
металлов.
Газообразные
карбонилы
металлов,особенно
карбонилы
никеля
и
железа,
вызывают
воспаление
и
отек
легких
независимо
от
пути
попадания
в
организм.
Контрольные вопросы и упражнения
1. Укажите среди перечисленных комплексных соединений катион-
ный, анионный комплексы, бикомплекс:
Ba[Cr(SCN)4(Nh4)2]2; [Cu(Nh4)4]SO3; [Co(Nh4)6][Cr(CN)6].
2. Определите степени окисления комплексообразователей в соедине-
3. Вычислите заряды следующих комплексных ионов, образованных
хромом (+3): [CrCl(h3O)5]; [CrCl2(h3O)4]; [Cr(C2O4)2(h3O)2].
4. Найдите заряды комплексных частиц и укажите среди них катионы,
анионы и неэлектролиты: [Co+3(Nh4)5Cl]; [Cr+3(Nh4)4PO4];
[Ag+(Nh4)2]; [Cr+3(OH)6]; [Co+3(Nh4)3(NO2)3]; [Cu+2(h3O)4].
5. Укажите координационную формулу соединений MnCl2·6h3O;
ZrF4·2NaF;
PtCl2·KCl·Nh4;
CoBr2·4Nh4·2h3O.
6. Из каких молекул и ионов состоят соединения [Rh(Nh4)5h3O]Br3;
Na3[AlF6]; K3[Fe(CN)6].
7. Назовите комплексные соединения
K2[Be(OH)4]; [Pt(Nh4)4NO2Cl]SO4; [Ni(CO)4]; [Co(Nh4)6][Cr(CN)6].
8. Напишите уравнения внешнесферной диссоциации комплексного
соединения K[Au(CN)2Br2] и ступенчатой диссоциации комплекс-
ного иона.
9. На какие ионы в водных растворах полностью диссоциируют ком-
плексные соединения, состав которых выражается следующими мо-
лекулярными формулами: CoCl3·4Nh4; CoCl3·4Nh4·h3O; PtCl2·3Nh4;
PtCl2·Nh4·KCl; CrBr3·2Nh4·KBr?
10. Почему __________комплексные соединения Н2[Pt(CN)4] и [Ni(Nh4)4](OH)2 яв-
ляются сильными электролитами в противоположность простым
соединениям
HCN и Ni(OH)2?
11. Покажите
ступенчатый
характер
процесса
диссоциации
комплексов
Покажите
ступенчатый
характер
процесса
диссоциации
комплексов
[Cu(Nh4)4]2+ и [Pt(CN)4]2-. Чем определяется число ступеней?
12. Напишите выражения общих констант нестойкости для соединений
K2[Co(Nh4)2(NO2)4]; [Pt(Nh4)6]Cl4; [Pd(Nh4)2Cl2].
13. Сравнивая величины общих констант нестойкости, укажите наибо-
лее устойчивый комплексный ион
[HgCl4]2- [HgBr4]2- [HgJ4]2- [Hg(CN)4]2-
12
Селективное каталитическое окисление Nh4 на катализаторах на основе благородных металлов: современное состояние и перспективы на будущее
Селективное каталитическое окисление NH
3 на катализаторах на основе благородных металлов: состояние дел и перспективы на будущееТяньвэй Лан, † и Юфэй Чжао, † и Цзян Дэн, и Цзяньпин Чжан, и Лии Ши и и Дэнсонг Чжан * и
Принадлежности автора
* Соответствующие авторы
и Международная совместная лаборатория каталитической химии, Химический факультет, Исследовательский центр нанонауки и технологий, Колледж наук, Шанхайский университет, № 99 по Шангда-роуд, Шанхай 200444, Китай
Электронная почта: dszhang@shu. edu.cn
edu.cn
Аннотация
Селективное каталитическое окисление аммиака до азота и водяного пара (NH 3 -SCO) считается эффективным методом устранения опасных и едких газообразных веществ NH 3 в основном выделяется в результате селективного каталитического восстановления NO x с NH 3 единиц с использованием соответствующих катализаторов. Благодаря удовлетворительной низкотемпературной активности окисления аммиака катализаторы на основе благородных металлов являются основными группами, применяемыми в NH 9.0046 3 — Реакция SCO из-за их уникальных внутренних свойств. При этом важно, чтобы селективность по отношению к побочным продуктам, включая NO, NO 2 и N 2 O, была как можно ниже, чтобы высокая селективность N 2 соответствовала строгим экологическим требованиям. практические сценарии. Чтобы дать обзор реакции NH 3 -SCO, этот обзор начинается с общего понимания механизмов реакции и стратегий продвижения катализатора. После этого катализаторы на основе благородных металлов, а именно катализаторы на основе Pt, Ag, Ru, Ir, Pd, Au и Rh, обсуждаются с точки зрения регулирования активных частиц, адсорбции и активации реагентов и промежуточных продуктов, образование N-содержащих продуктов и эффекты сочетания с NH 3 — Катализаторы SCR. Наконец, представлено сжатое резюме предыдущей работы, а также разумные предложения и перспективы относительно будущих тенденций в этой области. Насколько нам известно, это первый всеобъемлющий обзор применения катализаторов на основе благородных металлов в реакции NH
практические сценарии. Чтобы дать обзор реакции NH 3 -SCO, этот обзор начинается с общего понимания механизмов реакции и стратегий продвижения катализатора. После этого катализаторы на основе благородных металлов, а именно катализаторы на основе Pt, Ag, Ru, Ir, Pd, Au и Rh, обсуждаются с точки зрения регулирования активных частиц, адсорбции и активации реагентов и промежуточных продуктов, образование N-содержащих продуктов и эффекты сочетания с NH 3 — Катализаторы SCR. Наконец, представлено сжатое резюме предыдущей работы, а также разумные предложения и перспективы относительно будущих тенденций в этой области. Насколько нам известно, это первый всеобъемлющий обзор применения катализаторов на основе благородных металлов в реакции NH 
7 фактов о структуре Льюиса Cu[(nh4)4] 2+, характеристики —
Сарнали Мукерджи
Cu[(nh4)4] 2+ структура Льюиса и 7 фактов о структуре Cu[(Nh4)4]2+ В этой статье будет описан ион, который в химии называется тетрааминовым ионом меди. Факты будут раскрыты через набросок структуры Льюиса этого сложного соединения.
Ниже приведены факты, иллюстрирующие внутренние характеристики соединения:
- Cu[(Nh4)4]2+ Наименование
- Cu[(Nh4)4]2+ Cu[(Nh4)4]2+ Магнитный момент
- Cu[(Nh4)4]2+ Форма
- Cu[(Nh4)4]2+ Цвет
- Cu[(Nh4)4] 2+ Координационный номер
- Cu[(Nh4)4]2+ Структура Льюиса
- Cu[(Nh4)4]2+ Реакция с HCl
Комплексному соединению всегда необходимо иметь конкретное название, которое определяется применением приведенных правил IUPAC (Международный союз теоретической и прикладной химии) с помощью его химической формулы.
Название, данное ИЮПАК Cu[(Nh4)4]2+, представляет собой тетраамин меди. Тетрааммин определяется выделением четырех аминогрупп, которые присоединены к одному иону меди.
Cu[(Nh4)4]2+ Степень окисленияСтепень окисления является одной из важных характеристик, которая определяет избыток или недостаток электронов в соединениях, то есть приобретение или потерю электрона в центральном атоме.
Степень окисления меди в тетраамине меди составляет +2, так как общий комплексный ион имеет дефицит двух электронов, а соединение (Nh4)4 (аммиак) имеет нулевую степень окисления.
Cu[(Nh4)4]2+ Магнитный моментМагнитный момент относится к характеристике, которая указывает на магнитный дипольный момент, то есть тенденцию объектов или элементов выравниваться с определенной величиной магнитного поля.
Это соединение обладает парамагнитным эффектом. Магнитный момент Cu[(Nh4)4]2+ равен 1,73 б. м. это свойство является надежным в установлении факта о количестве n спаренных электронов в этом соединении. Существует определенная формула, помогающая вычислить количество неспаренных электронов.
м. это свойство является надежным в установлении факта о количестве n спаренных электронов в этом соединении. Существует определенная формула, помогающая вычислить количество неспаренных электронов.
Конденсатор и емкость | Лучшие 2…
Пожалуйста, включите JavaScript
Конденсатор и емкость | Best 2022
Cu[(nh4)4] 2+ Структура Льюиса из ВикипедииФормула: количество неспаренных электронов = √ n(n+2), где N относится к величине магнитного момента. Следовательно, это показывает, что в соединении присутствует один неспаренный электрон [ √ n(n+2) = √ 1,73(1,73+2) = 1].
Cu[(Nh4)4]2+ Форма Форма соединений определяется путем подсчета количества электронов, присутствующих в соединениях. Электронная конфигурация соединений достоверно отражает представление о форме соединения. Электронная конфигурация Куппера в Cu[(Nh4)4]2+: 1s2 2s2 2p6 3s2 3p6 3d0 4s0. Cu демонстрирует гибридизацию dsp2 с одним спаренным электроном. Соединение показывает квадратную планировочную форму в химии вместо тетраэдрической геометрии.
Cu демонстрирует гибридизацию dsp2 с одним спаренным электроном. Соединение показывает квадратную планировочную форму в химии вместо тетраэдрической геометрии.
Цвет соединений зависит от обмена электронами на орбиталях. Перемещение электронов с одной орбитали на другую может влиять на степень окисления и отражает определенные элементы соединений.
Cu[(Nh4)4]2+ цвет из ВикипедииВ норме медь не имеет неспаренных электронов с заполненной орбиталью D10, поэтому она выглядит бесцветной. В Cu[(Nh4)4]2+ медь получает неспаренный электрон после добавления аммиака, что придает всему иону темно-синий цвет.
Cu[(Nh4)4]2+ Координационный номерКоординационный номер относится к числу атомов, которые координируют или создают связи с другим атомом, участвующим в формировании общей сложной структуры.
Как соединение с четырьмя аммиаками, присоединяйтесь к одному иону Cu2+, что означает тот факт, что соединение имеет четыре координационных числа. Этот комплексный ион имеет четыре сильных лиганда, поэтому он рассматривается как стабильное координационное соединение в ряду.
Этот комплексный ион имеет четыре сильных лиганда, поэтому он рассматривается как стабильное координационное соединение в ряду.
Число валентных электронов в Cu равно 1, а в Cu2+ становится 9. Четыре соединения Nh4 содержат четыре атома азота, каждое из которых имеет одну неподеленную пару после связывание с тремя молекулами водорода. Следовательно, общее число электронов, присутствующих в четырех соединениях Nh4, равно 8.
Частичное разделение электронов между соединениями Cu2+ и Nh4 имеет место для обеспечения стабильности. Согласно методу рисования Льюиса, структура этого соединения Cu занимает центральное положение в геометрии.
Полный эскиз структуры Льюиса показывает, что это соединение создает ковалентную связь, поскольку Cu является металлом, а Nh4 выглядит как неметалл, а как ионное соединение. Эта структура актуальна для представления электронного устройства и отсутствия электронов в комплексном ионе.
Соляная кислота (HCl) — это сильная коррозионная кислота, которая легко вступает в реакцию с соединениями. Реакция между этим комплексным ионом и HCl является своего рода реакцией, которая вызывает эффект изменения цвета как химическое свойство кислоты при взаимодействии с ионами.
HCl сначала дает водный раствор тетраамина меди (II) в присутствии кислорода. Затем он дает избыток атома хлора I-й в середине реакции. Сбалансированное химическое уравнение приводится ниже, чтобы описать его процесс и причину проявления эффекта изменения цвета.
Cu[(Nh4)4 (h3O)2]2+ + 4Cl = [CuCl]2- + 4Nh4 + 2h3O
Атом хлора добавляется к меди, так как сильное присутствие HCl разрушает ион. Другая часть комплексного иона, представляющая собой Nh4 (аммиак), извлекается из соединения. это реакция замещения лиганда так как здесь происходит замещение сильного лиганда Аммиак в присутствии сильной кислоты.
