Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
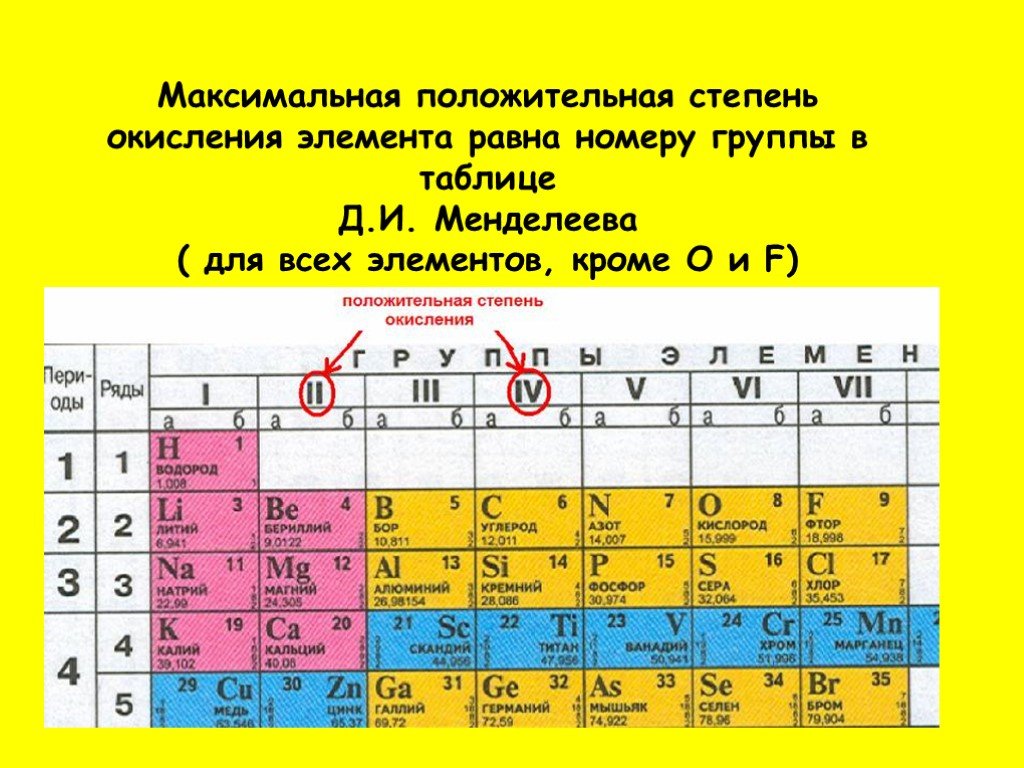
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Степень окисления. Большая российская энциклопедия
Химические величины
- Области знаний:
- Основные понятия и законы
- Другие наименования:
- Окислительное число
Сте́пень окисле́ния (окислительное число), формальный заряд атома в молекуле в предположении, что все электронные пары, осуществляющие химическую связь, полностью смещены в сторону более электроотрицательного элемента. Степень окисления химических элементов обозначают римской или арабской цифрой с предшествующим знаком (в отличие от заряда иона, где знак ставится после числа). Степень окисления атома в простом веществе равна нулю. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Алгебраическая сумма степеней окисления атомов в многозарядном ионе равна заряду иона. Значение степени окисления обычно является целочисленным и может изменяться от –4 до +8.
Степень окисления химических элементов обозначают римской или арабской цифрой с предшествующим знаком (в отличие от заряда иона, где знак ставится после числа). Степень окисления атома в простом веществе равна нулю. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Алгебраическая сумма степеней окисления атомов в многозарядном ионе равна заряду иона. Значение степени окисления обычно является целочисленным и может изменяться от –4 до +8.
Cтепень окисления водорода в большинстве его соединений (кроме гидридов металлов) принимают равной +1, степень окисления кислорода в большинстве соединений – равной –2. Исключениями являются пероксиды со связями О−О (степень окисления равна –1) и О−О−О (степень окисления дробная) и фториды кислорода (OF, O2F, O2F2, O3F2 и др.), у которых степень окисления атома О имеет положительные (+1, +2) или дробные значения.
Наиболее высокие положительные значения степени окисления металлов проявляются во фторидах (ReF7, OsF7), оксифторидах (Os+8O3F2), перманганатах (KMn+7O4), оксидах Ru+8O4, Os+8O4, Ir+8O4, Hs+8O4, Xe+8O4 и некоторых комплексах Pu. Наиболее высокие положительные значения степени окисления неметаллов свойственны S, Se, Te и Po (наибольшие значения +6), Cl, Br и I в галогенфторидах (ClF5, Br+7O3F, I+7O2F3) и их производных, а также Хе в XeF6 и его соединениях. Значение степени окисления –4 проявляют химические элементы подгруппы углерода. Дробные значения степени окисления имеют металлы в оксидах вида Fe3O4.
Наиболее высокие положительные значения степени окисления неметаллов свойственны S, Se, Te и Po (наибольшие значения +6), Cl, Br и I в галогенфторидах (ClF5, Br+7O3F, I+7O2F3) и их производных, а также Хе в XeF6 и его соединениях. Значение степени окисления –4 проявляют химические элементы подгруппы углерода. Дробные значения степени окисления имеют металлы в оксидах вида Fe3O4.
Степень окисления F, Cl, Br и I в ионных веществах равна –1, однако степени окисления Cl, Br и I в некоторых кислотах и солях могут иметь положительные значения: HCl+7O4, KCl+7O4. Cтепень окисления щелочных металлов принимают равной +1, щёлочноземельных металлов – +2, металлов 3-й группы (короткой формы периодической системы) – +3, высшие степени окисления элементов 4-й, 5-й, 6-й и частично 7-й и 8-й групп составляют соответственно +4, +5, +6, +7 и +8. Графическая зависимость высшей степени окисления от порядкового номера химического элемента имеет поэтому вид нерегулярной пилообразной кривой с максимумами у N (+5), Cl (+7), Mn (+7), Br (+7), Ru (+8), I (+7), Pr (+5), Os (+8) и минимумами у С, Si и Ge (по –4), а также у Sb (–3). При этом химические элементы, имеющие высокие степени окисления, проявляют и более низкие их значения.
При этом химические элементы, имеющие высокие степени окисления, проявляют и более низкие их значения.
Имеются публикации об обнаружении в твёрдом состоянии соединений Ag+4, Ca+1, Mg+1, Al+2, Ga+2, In+2, Tl+2, Dy+4, Tm+4, Fe+7, Fe+8, Rn+4, Rn+6, Pu+8, Am+7, Db+5, Sg+7, Bh+7, Hs+8 и других химических элементов с необычными значениями степени окисления. Длительное время публиковавшиеся сообщения о соединении XeF8 не подтвердились.
В ряде случаев степень окисления элемента не совпадает с его валентностью даже при совпадении абсолютных значений. Так, для органических соединений степень окисления углерода может составлять –4 (СН4), –3 (С2Н6), –2 (СH3Cl), –1 (C2H2), 0 (СН2Cl2), +1 (CHCl2 CHCl2), +2 (CHCl3), +4 (CCl4). У координационных соединений степень окисления центрального атома определяется при условном удалении всех лигандов вместе с электронными парами, связанными с центральным атомом.
У координационных соединений степень окисления центрального атома определяется при условном удалении всех лигандов вместе с электронными парами, связанными с центральным атомом.
Экспериментально определяемые истинные заряды атомов в соединениях отличаются от степеней окисления этих элементов. Понятие «степень окисления» используется при составлении уравнений окислительно-восстановительных реакций.
Раков Эдуард Григорьевич. Первая публикация: Большая российская энциклопедия, 2016.Дата публикации: 17 января 2023 г. в 00:28 (GMT+3)
19.1: Определение степени окисления углерода
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 225880
- В связи C-H H рассматривается так, как если бы он имел степень окисления +1.
 Это означает, что каждая связь C-H будет уменьшить степень окисления углерода на 1.
Это означает, что каждая связь C-H будет уменьшить степень окисления углерода на 1. - Для углерода, связанного с более электроотрицательным неметаллом X, таким как азот, кислород, сера или галогены, каждая связь C-X будет увеличивать степень окисления углерода на 1. (Некоторые неметаллы менее электроотрицательны, чем углерод , такие как фосфор, кремний или бор, но связи углерода с этими элементами встречаются гораздо реже.)
- Для углерода, связанного с другим углеродом, степень окисления не изменяется. Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления.
Таким образом, в отличие от металлов, которые почти всегда находятся в положительной степени окисления, степень окисления углерода может варьироваться в широких пределах, от -4 (в Ch5) до +4 (например, в CO2). Вот некоторые примеры.
(Не забывайте, что это называется «формализм» по какой-то причине. Заряд углерода не равен на самом деле +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Заряд углерода не равен на самом деле +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Поняв, как рассчитать степени окисления углерода, мы готовы к следующему шагу: пониманию изменяет
в степени окисления углерода посредством реакций, известных как окисления (когда степень окисления увеличивается) и восстановления (когда степень окисления уменьшается). Подробнее об этом в следующий раз.Лестница окисления
Каталожные номера
- http://www.masterorganicchemistry.co…e-of-a-carbon/
Авторы
- Джеймс Эшенхерст (MasterOrganicChemistry.com)
Вы, несомненно, уже знакомы с общей идеей окисления и восстановления: из общей химии вы узнали, что при окислении соединение или атом теряет электроны, а при восстановлении приобретает электроны. Вы также знаете, что реакции окисления и восстановления протекают парами: если один вид окисляется, другой должен одновременно восстанавливаться — отсюда и термин «окислительно-восстановительная реакция». поток электронов от одного металла к другому, например, реакция между ионом меди в растворе и металлическим цинком: 9{+2}_{(aq)} \tag{16.1.1}\]
Вы также знаете, что реакции окисления и восстановления протекают парами: если один вид окисляется, другой должен одновременно восстанавливаться — отсюда и термин «окислительно-восстановительная реакция». поток электронов от одного металла к другому, например, реакция между ионом меди в растворе и металлическим цинком: 9{+2}_{(aq)} \tag{16.1.1}\]
В органической химии окислительно-восстановительные реакции выглядят несколько иначе. Электроны в органической окислительно-восстановительной реакции часто передаются в виде гидрид-иона – протона и двух электронов. Поскольку они происходят вместе с переносом протона, их обычно называют реакциями гидрирования и дегидрирования : гидрид плюс протон образуют молекулу водорода (H 2 ). Будьте осторожны – не перепутайте термины hyd водород ионизация и дегидрирование дроген ионизация с гидратацией и дегидратацией – последние относятся к приросту и отщеплению молекулы воды (и являются , а не окислительно-восстановительными реакциями), в то время как первые относятся к приросту и потеря молекулы водорода .
Когда атом углерода в органическом соединении теряет связь с водородом и приобретает новую связь с гетероатомом (или с другим углеродом), мы говорим, что соединение дегидрировано или окислено. Очень распространенным биохимическим примером является окисление спирта в кетон или альдегид:
Когда атом углерода теряет связь с водородом и приобретает связь с гетероатомом (или с другим атомом углерода), это считается окислительным процессом, поскольку водород из всех элементов является наименее электроотрицательным. Таким образом, в процессе дегидрирования атом углерода претерпевает общую потерю электронной плотности – а потеря электронов есть окисление.
И наоборот, когда атом углерода в органическом соединении получает связь с водородом и теряет связь с гетероатомом (или с другим атомом углерода), мы говорим, что соединение гидрировано или восстановлено. Гидрирование кетона в спирт, например, в целом является обратным дегидрированию спирта, показанному выше. Ниже проиллюстрирована другая распространенная возможность — гидрирование (восстановление) алкена до алкана.
Гидрирование приводит к более высокой электронной плотности на атоме(ах) углерода, и, таким образом, мы считаем процесс восстановлением органической молекулы.
Обратите внимание, что ни гидрирование, ни дегидрирование не связаны с приобретением или потерей атома кислорода . Реакции, которые — включают приобретение или потерю одного или нескольких атомов кислорода, обычно называют «оксигеназными» и «редуктазными» реакциями.
По большей части, говоря об окислительно-восстановительных реакциях в органической химии, мы имеем дело с небольшим набором хорошо узнаваемых превращений функциональных групп. Поэтому очень полезно ознакомиться с идеей «степеней окисления» применительно к органическим функциональным группам. Сравнивая относительное количество связей с атомами водорода, мы можем упорядочить знакомые функциональные группы по степени окисления. В качестве примера возьмем ряд одноуглеродных соединений. Метан с четырьмя углеродно-водородными связями сильно восстановлен.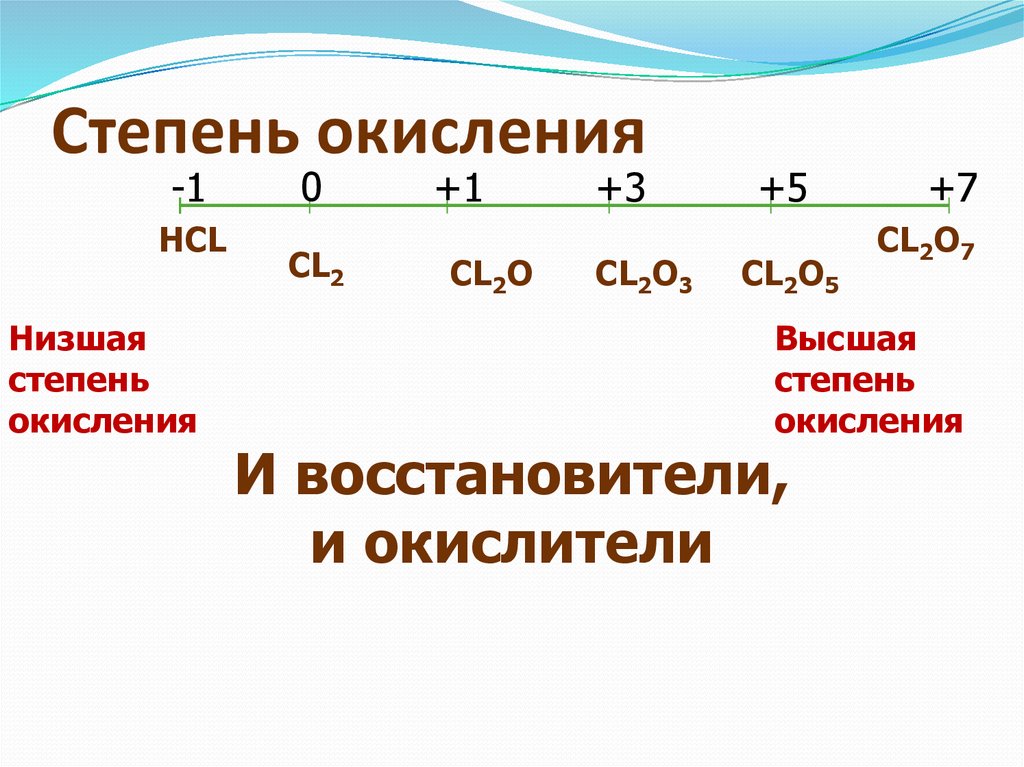
Эта закономерность верна для соответствующих функциональных групп органических молекул с двумя или более атомами углерода:
Алканы сильно восстановлены, в то время как спирты, а также алкены, простые эфиры, амины, сульфиды и сложные эфиры фосфорной кислоты – на одну ступень выше по шкале окисления, за которыми следуют альдегиды/кетоны/имины и эпоксиды, и, наконец, производные карбоновых кислот (диоксид углерода в верхней части списка окисления специфичен для одного углеродного ряда).
Обратите внимание, что в приведенном выше ряду двухуглеродных соединений этанол и этен считаются находящимися в одной и той же степени окисления. Вы уже знаете, что спирты и алкены взаимопревращаются путем присоединения или отщепления воды (например, в разделе 10.4.). Когда спирт дегидратируется с образованием алкена, один из двух атомов углерода теряет связь С-Н и приобретает связь С-С и, таким образом, окисляется. Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не меняется.
Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не меняется.
Вы должны научиться распознавать, когда реакция включает изменение степени окисления атомов углерода в органическом реагенте. Глядя, например, на следующее превращение, вы сможете быстро распознать, что это окисление: функциональная группа спирта превращается в кетон, что является одной ступенью вверх по лестнице окисления.
Аналогично, следующая реакция включает превращение производного карбоновой кислоты (тиоэфира) сначала в альдегид, а затем в спирт: это двойное восстановление , так как субстрат теряет две связи с гетероатомами и приобретает две связи с атомами водорода.
Реакция переноса ацила (например, превращение ацилфосфата в амид) не считается окислительно-восстановительной реакцией – степень окисления органической молекулы не изменяется по мере превращения субстрата в продукт, потому что связь с одним гетероатомом (кислородом) была просто обменена на связь с другим гетероатомом (азот).
Важно уметь распознавать, когда органическая молекула окисляется или восстанавливается, потому что эта информация говорит вам искать участие соответствующего окислительно-восстановительного агента, который восстанавливается или окисляется — помните, окисление и восстановление всегда происходят в тандем! Вскоре мы подробно узнаем о наиболее важных биохимических и лабораторных окислительно-восстановительных агентах.
- Органическая химия с акцентом на биологию Тим Содерберг (Университет Миннесоты, Моррис)
Элемент YouTube был исключен из этой версии текста. Вы можете просмотреть его онлайн здесь: http://pb.libretexts.org/ochem2walker/?p=116
Контент по лицензии CC, ранее опубликованный
- Статусы окисления органических молекул. Автор : Джеймс Эшенхерст. Расположен по адресу : https://www.masterorganicchemistry.com/. Лицензия : CC BY-NC-SA: Attribution-NonCommercial-ShareAlike
- Органическая химия с биологическим акцентом.
 Автор : Тим Содерберг. Расположен по адресу : https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry/Book%3A_Organic_Chemistry_with_a_Biological_Emphasis_(Soderberg). Проект : Химия LibreTexts. Лицензия : CC BY-NC-SA: Attribution-NonCommercial-ShareAlike
Автор : Тим Содерберг. Расположен по адресу : https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry/Book%3A_Organic_Chemistry_with_a_Biological_Emphasis_(Soderberg). Проект : Химия LibreTexts. Лицензия : CC BY-NC-SA: Attribution-NonCommercial-ShareAlike
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Теги
19.1. Определение степени окисления углерода
- В связи C-H H рассматривается так, как если бы он имел степень окисления +1.
 Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1.
Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1. - Для углерода, связанного с более электроотрицательным неметаллом X, таким как азот, кислород, сера или галогены, каждая связь C-X будет увеличивать степень окисления углерода на 1. (Некоторые неметаллы менее электроотрицательны, чем углерод , такие как фосфор, кремний или бор, но связи углерода с этими элементами встречаются гораздо реже.)
- Для углерода, связанного с другим углеродом, степень окисления не изменяется. Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления.
Таким образом, в отличие от металлов, которые почти всегда находятся в положительной степени окисления, степень окисления углерода может варьироваться в широких пределах, от -4 (в Ch5) до +4 (например, в CO2). Вот некоторые примеры.
(Не забывайте, что это называется «формализм» по какой-то причине. Заряд углерода не равен на самом деле +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Поняв, как рассчитать степени окисления углерода, мы готовы к следующему шагу: пониманию изменений в степени окисления углерода посредством реакций, известных как окисления (где степень окисления увеличивается), и редукции (где степень окисления снижена). Подробнее об этом в следующий раз.
Дополнительная литература
Лестница окисления
Ссылки
- http://www.masterorganicchemistry.co…e-of-a-carbon/
Авторы
- Джеймс Эшенхерст (MasterOrganicChemistry.com)
Окисление и восстановление органических соединений – обзор
Вы, несомненно, уже знакомы с общей идеей окисления и восстановления: из общей химии вы узнали, что при окислении соединение или атом теряет электроны, а при восстановлении приобретает электроны. Вы также знаете, что реакции окисления и восстановления протекают парами: если один вид окисляется, другой должен одновременно восстанавливаться — отсюда и термин «окислительно-восстановительная реакция». поток электронов от одного металла к другому, например, реакция между ионом меди в растворе и металлическим цинком: 9{+2}_{(водн.)} \tag{16.1.1}\]
Вы также знаете, что реакции окисления и восстановления протекают парами: если один вид окисляется, другой должен одновременно восстанавливаться — отсюда и термин «окислительно-восстановительная реакция». поток электронов от одного металла к другому, например, реакция между ионом меди в растворе и металлическим цинком: 9{+2}_{(водн.)} \tag{16.1.1}\]
В органической химии окислительно-восстановительные реакции выглядят несколько иначе. Электроны в органической окислительно-восстановительной реакции часто передаются в виде гидрид-иона – протона и двух электронов. Поскольку они происходят вместе с переносом протона, их обычно называют реакциями гидрирования и дегидрирования : гидрид плюс протон образуют молекулу водорода (H 2 ). Будьте осторожны – не перепутайте термины hyd водород ионизация и дегидрирование дроген ионизация с гидратацией и дегидратацией – последние относятся к приросту и отщеплению молекулы воды (и являются , а не окислительно-восстановительными реакциями), в то время как первые относятся к приросту и потеря молекулы водорода .
Когда атом углерода в органическом соединении теряет связь с водородом и приобретает новую связь с гетероатомом (или с другим углеродом), мы говорим, что соединение дегидрировано или окислено. Очень распространенным биохимическим примером является окисление спирта в кетон или альдегид:
Когда атом углерода теряет связь с водородом и приобретает связь с гетероатомом (или с другим атомом углерода), это считается окислительным процессом, поскольку водород из всех элементов является наименее электроотрицательным. Таким образом, в процессе дегидрирования атом углерода претерпевает общую потерю электронной плотности – а потеря электронов есть окисление.
И наоборот, когда атом углерода в органическом соединении получает связь с водородом и теряет связь с гетероатомом (или с другим атомом углерода), мы говорим, что соединение гидрировано или восстановлено. Гидрирование кетона в спирт, например, в целом является обратным дегидрированию спирта, показанному выше. Ниже проиллюстрирована другая распространенная возможность — гидрирование (восстановление) алкена до алкана.
Гидрогенизация приводит к более высокой электронной плотности на атоме(ах) углерода, и, таким образом, мы считаем процесс восстановлением органической молекулы.
Обратите внимание, что ни гидрирование, ни дегидрирование не связаны с приобретением или потерей атома кислорода . Реакции, которые — включают приобретение или потерю одного или нескольких атомов кислорода, обычно называют «оксигеназными» и «редуктазными» реакциями.
По большей части, говоря об окислительно-восстановительных реакциях в органической химии, мы имеем дело с небольшим набором хорошо узнаваемых превращений функциональных групп. Поэтому очень полезно ознакомиться с идеей «степеней окисления» применительно к органическим функциональным группам. Сравнивая относительное количество связей с атомами водорода, мы можем упорядочить знакомые функциональные группы по степени окисления. В качестве примера возьмем ряд одноуглеродных соединений. Метан с четырьмя углеродно-водородными связями сильно восстановлен. Далее в ряду идет метанол (на одну связь углерод-водород меньше, на одну связь углерод-кислород больше), за ним следуют формальдегид, формиат и, наконец, диоксид углерода на сильно окисленном конце группы.
Далее в ряду идет метанол (на одну связь углерод-водород меньше, на одну связь углерод-кислород больше), за ним следуют формальдегид, формиат и, наконец, диоксид углерода на сильно окисленном конце группы.
Эта закономерность справедлива для соответствующих функциональных групп органических молекул с двумя или более атомами углерода:
Алканы сильно восстанавливаются, в то время как спирты, а также алкены, простые эфиры, амины, сульфиды и эфиры фосфорной кислоты находятся на одну ступень выше по шкале окисления, за ними следуют альдегиды/кетоны/имины и эпоксиды и, наконец, производные карбоновых кислот ( двуокись углерода, находящаяся в верхней части списка окисления, характерна для одного ряда углерода).
Обратите внимание, что в приведенном выше ряду двухуглеродных соединений этанол и этен считаются находящимися в одной и той же степени окисления. Вы уже знаете, что спирты и алкены взаимопревращаются путем присоединения или отщепления воды (например, в разделе 10. 4.). Когда спирт дегидратируется с образованием алкена, один из двух атомов углерода теряет связь С-Н и приобретает связь С-С и, таким образом, окисляется. Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не меняется.
4.). Когда спирт дегидратируется с образованием алкена, один из двух атомов углерода теряет связь С-Н и приобретает связь С-С и, таким образом, окисляется. Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не меняется.
Вы должны научиться распознавать, когда реакция включает изменение степени окисления атомов углерода в органическом реагенте. Глядя, например, на следующее превращение, вы сможете быстро распознать, что это окисление: функциональная группа спирта превращается в кетон, что является одной ступенью вверх по лестнице окисления.
Аналогично, следующая реакция включает превращение производного карбоновой кислоты (тиоэфира) сначала в альдегид, а затем в спирт: это двойное восстановление , так как субстрат теряет две связи с гетероатомами и приобретает две связи с атомами водорода.
Реакция переноса ацила (например, превращение ацилфосфата в амид) , а не считается окислительно-восстановительной реакцией – степень окисления органической молекулы не изменяется по мере превращения субстрата в продукт, потому что связь к одному гетероатому (кислороду) просто обменяли на связь с другим гетероатомом (азот).

 Это означает, что каждая связь C-H будет уменьшить степень окисления углерода на 1.
Это означает, что каждая связь C-H будет уменьшить степень окисления углерода на 1. Автор : Тим Содерберг. Расположен по адресу : https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry/Book%3A_Organic_Chemistry_with_a_Biological_Emphasis_(Soderberg). Проект : Химия LibreTexts. Лицензия : CC BY-NC-SA: Attribution-NonCommercial-ShareAlike
Автор : Тим Содерберг. Расположен по адресу : https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry/Book%3A_Organic_Chemistry_with_a_Biological_Emphasis_(Soderberg). Проект : Химия LibreTexts. Лицензия : CC BY-NC-SA: Attribution-NonCommercial-ShareAlike  Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1.
Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1.