| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Олово | Химические свойства
Олово
В соответствии с конфигурацией внешних электронов атома 5s25р2 Олово имеет две степени окисления: +2 и +4; последняя более устойчива; соединения Sn (II) — сильные восстановители. Сухим и влажным воздухом при температуре до 100 °С олово практически не окисляется: его предохраняет тонкая, прочная и плотная пленка SnO2. По отношению к холодной и кипящей воде олово устойчиво. Стандартный электродный потенциал Олова в кислой среде равен -0,136 в.
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
Sn + O2 = SnO2.
Из разбавленных НCl и H2SO4 на холоду олово медленно вытесняет водород, образуя соответственно хлорид SnCl2 и сульфат SnSO4. В горячей концентрированной h3SO4 при нагревании Олово растворяется, образуя Sn(SO4)2 и SO2. Холодная (0°С) разбавленная азотная кислота действует на олово по реакции:
4Sn + 10HNO3 = 4Sn(NO3)2 + NH4NO3 + 3H2O.
При нагревании с концентрированной HNO3 (плотность 1,2-1,42 г/мл) олово окисляется с образованием осадка метаоловянной кислоты H2SnO3, степень гидротации которой переменна:
3Sn + 4HNO3 + nH2O = 3H2SnO3·nH2O + 4NO.
При нагревании Олова в концентрированных растворах щелочей выделяется водород и образуется гексагидростаниат:
Sn + 2KOH + 4H2O = K2[Sn(OH)6] + 2H2.
Кислород воздуха пассивирует Олово, оставляя на его поверхности пленку SnO2. Химически оксид (IV) SnO2 очень устойчив, а оксид (II) SnO быстро окисляется, его получают косвенным путем. SnO2 проявляет преимущественно кислотные свойства, SnO — основные.
С водородом олово непосредственно не соединяется; гидрид SnH4 образуется при взаимодействии Mg2Sn с соляной кислотой:
Mg2Sn + 4HCl = 2MgCl2 + SnH4.
Это бесцветный ядовитый газ, tкип -52 °С; он очень непрочен, при комнатной температуре разлагается на Sn и h3 в течение нескольких суток, а выше 150°С — мгновенно. Образуется также при действии водорода в момент выделения на соли Олова, например:
SnCl2 + 4HCl + 3Mg = 3MgCl2 + SnH4.
С галогенами олово дает соединения состава SnX2 и SnX4. Первые солеобразны и в растворах дают ионы Sn2+, вторые (кроме SnF4) гидролизуются водой, но растворимы в неполярных органических жидкостях. Взаимодействием олова с сухим хлором (Sn + 2Cl2 = SnCl4) получают тетрахлорид SnCl4; это бесцветная жидкость, хорошо растворяющая серу, фосфор, иод. Раньше по приведенной реакции удаляли Олово с вышедших из строя луженых изделий. Сейчас способ мало распространен из-за токсичности хлора и высоких потерь олова.
Взаимодействием олова с сухим хлором (Sn + 2Cl2 = SnCl4) получают тетрахлорид SnCl4; это бесцветная жидкость, хорошо растворяющая серу, фосфор, иод. Раньше по приведенной реакции удаляли Олово с вышедших из строя луженых изделий. Сейчас способ мало распространен из-за токсичности хлора и высоких потерь олова.
Тетрагалогениды SnX4 образуют комплексные соединения с Н2О, NH3, оксидами азота, РСl5, спиртами, эфирами и многими органическими соединениями. С галогеноводородными кислотами галогениды Олова дают комплексные кислоты, устойчивые в растворах, например H2SnCl4 и H2SnCl6. При разбавлении водой или нейтрализации растворы простых или комплексных хлоридов гидролизуются, давая белые осадки Sn(OH)2 или Н2SnО3·nН2О. С серой Олово дает нерастворимые в воде и разбавленных кислотах сульфиды: коричневый SnS и золотисто-желтый SnS2.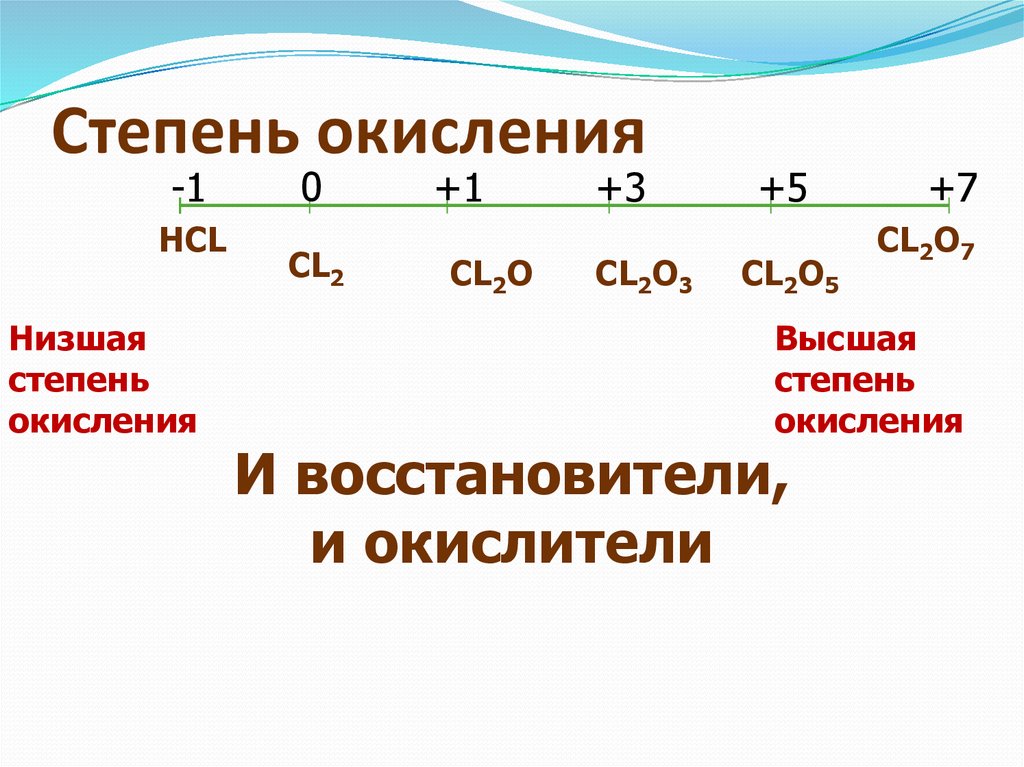
Модулированные степени окисления Sn на подложке, полученной из Cu2O, для селективного электрохимического восстановления CO2
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронная почта: (изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 2020 20 мая;12(20):22760-22770.
дои: 10.1021/acsami.0c00412. Epub 2020 7 мая.
Менгран Ли 1
, Сяохэ Тянь 1 , Сахил Гарг 1 , Томас Э. Руффорд 1 , Пейяо Чжао 2 , Юмин Ву 1 , Аня Хосефа Яго 3 , Лэй Гэ 1 4 , Виктор Рудольф 1 , Джефф Ван 1Принадлежности
- 1 Школа химического машиностроения, Университет Квинсленда, Сент-Люсия, 4072 Брисбен, Квинсленд, Австралия.

- 3 Центр микроскопии и микроанализа Университета Квинсленда, 4072 Брисбен, Квинсленд, Австралия.
- 4 Центр материалов будущего, Университет Южного Квинсленда, 4300 Спрингфилд, Австралия.
- PMID: 32337964
- DOI: 10.1021/acsami.0c00412
Менгран Ли и др.
Интерфейсы приложений ACS. .
. 2020 20 мая;12(20):22760-22770.
дои: 10.1021/acsami.0c00412. Epub 2020 7 мая.
Авторы
Менгран Ли 1 , Сяохэ Тянь 1 , Сахил Гарг 1 , Томас Э. Руффорд 1 , Пейяо Чжао 2 , Юмин Ву 1 , Аня Хосефа Яго 3 , Лэй Гэ 1 4 , Виктор Рудольф 1
Принадлежности
- 1 Школа химического машиностроения, Университет Квинсленда, Сент-Люсия, 4072 Брисбен, Квинсленд, Австралия.

- 2 Факультет химического машиностроения Массачусетского университета в Амхерсте, Амхерст, Массачусетс 01003, США.
- 3 Центр микроскопии и микроанализа Университета Квинсленда, 4072 Брисбен, Квинсленд, Австралия.
- 4 Центр материалов будущего, Университет Южного Квинсленда, 4300 Спрингфилд, Австралия.
- PMID: 32337964
- DOI: 10.1021/acsami.0c00412
Абстрактный
Достижение высокой каталитической селективности является сложной задачей, но имеет первостепенное значение для эффективного и недорогого электрохимического восстановления CO 2 (CO 2 R). В этой работе мы демонстрируем значительную корреляцию между селективностью CO 2 R к формиату и продолжительностью электроосаждения олова (Sn) на подложке, полученной из оксида меди (Cu 2 O). Время электроосаждения Sn, равное 120 с, привело к катоду с фарадеевской эффективностью формиата около 81% при -1,1 В по сравнению с обратимым водородным электродом (RHE), что было более чем на 37% выше, чем у фольги Sn и образца, обработанного для 684 с. Этот результат подчеркивает важную роль поверхности раздела между осажденным Sn и субстратом, полученным из меди, в определении селективности CO 2 R. Рентгеновские фотоэлектронные спектры высокого разрешения показали, что остаточные частицы меди на границах раздела Cu/Sn могут стабилизировать соединения Sn в степенях окисления 2+ и 4+, смесь которых необходима для селективного превращения формиата. . Такие эффекты модуляции, вероятно, возникают из-за умеренной электроотрицательности соединений меди, которая ниже, чем у Sn 2+ , но выше, чем у Sn 4+ .
В этой работе мы демонстрируем значительную корреляцию между селективностью CO 2 R к формиату и продолжительностью электроосаждения олова (Sn) на подложке, полученной из оксида меди (Cu 2 O). Время электроосаждения Sn, равное 120 с, привело к катоду с фарадеевской эффективностью формиата около 81% при -1,1 В по сравнению с обратимым водородным электродом (RHE), что было более чем на 37% выше, чем у фольги Sn и образца, обработанного для 684 с. Этот результат подчеркивает важную роль поверхности раздела между осажденным Sn и субстратом, полученным из меди, в определении селективности CO 2 R. Рентгеновские фотоэлектронные спектры высокого разрешения показали, что остаточные частицы меди на границах раздела Cu/Sn могут стабилизировать соединения Sn в степенях окисления 2+ и 4+, смесь которых необходима для селективного превращения формиата. . Такие эффекты модуляции, вероятно, возникают из-за умеренной электроотрицательности соединений меди, которая ниже, чем у Sn 2+ , но выше, чем у Sn 4+ . Наша работа подчеркивает важную роль подложки в селективности нанесенного катализатора и открывает новые возможности для усовершенствования селективных электродов для CO 9 .0175 2 электрохимическое восстановление.
Наша работа подчеркивает важную роль подложки в селективности нанесенного катализатора и открывает новые возможности для усовершенствования селективных электродов для CO 9 .0175 2 электрохимическое восстановление.
Ключевые слова: электрохимическое восстановление CO2; подложка катализатора; электроотрицательность; производство формиата; оловянный электрокатализатор.
Похожие статьи
Настройка селективности газодиффузионного электрода с полым волокном Cu для эффективного восстановления CO 2 до формиата путем контролируемого поверхностного электроосаждения Sn.
Раби Х., Чжан С., Гэ Л., Ху С., Ли М., Смарт С., Чжу З., Юань З. Раби Х. и др. Интерфейсы приложений ACS. 2020 13 мая; 12 (19): 21670-21681. дои: 10.1021/acsami.0c03681. Epub 2020 30 апр.
 Интерфейсы приложений ACS. 2020.
PMID: 32309923
Интерфейсы приложений ACS. 2020.
PMID: 32309923Синергетические эффекты на катализаторе из сплава Sn-Cu для эффективного электровосстановления CO 2 до формиата с высокой массовой активностью.
Е К, Цао А, Шао Дж, Ван Г, Си Р, Та Н, Сяо Дж, Ван Г. Йе К и др. Sci Bull (Пекин). 2020 15 мая;65(9)):711-719. doi: 10.1016/j.scib.2020.01.020. Epub 2020 23 января. Sci Bull (Пекин). 2020. PMID: 36659104
Настройка Sn-катализа для электрохимического восстановления CO 2 до CO через структуру Core/Shell Cu/SnO 2 .
Li Q, Fu J, Zhu W, Chen Z, Shen B, Wu L, Xi Z, Wang T, Lu G, Zhu JJ, Sun S. Ли Кью и др. J Am Chem Soc. 2017 29 марта; 139 (12): 4290-4293. doi: 10.1021/jacs.
 7b00261. Epub 2017 16 марта.
J Am Chem Soc. 2017.
PMID: 28291338
7b00261. Epub 2017 16 марта.
J Am Chem Soc. 2017.
PMID: 28291338Выявление нового эффекта субстрата, усиливающего электрокаталитическую активность дендритного олова в восстановлении СО 2 .
Чжан И., Чжан С., Бонд А.М., Чжан Дж. Чжан Ю и др. Phys Chem Chem Phys. 2018 21 февраля; 20 (8): 5936-5941. дои: 10.1039/c7cp07723h. Phys Chem Chem Phys. 2018. PMID: 29423495
Полученные из MOF Cu 2 Наносферы O/Cu, закрепленные в легированном азотом полом пористом углеродном каркасе, для повышения селективности и активности электрохимического превращения CO 2 в формиат.
Ли Д., Лю Т., Ян З., Чжэнь Л., Лю Дж., У Дж., Фэн Ю. Ли Д и др. Интерфейсы приложений ACS. 2020 12 февраля; 12 (6): 7030-7037.
 дои: 10.1021/acsami.9b15685. Epub 2020 31 января.
Интерфейсы приложений ACS. 2020.
PMID: 31964136
дои: 10.1021/acsami.9b15685. Epub 2020 31 января.
Интерфейсы приложений ACS. 2020.
PMID: 31964136
Посмотреть все похожие статьи
Цитируется
CO 2 Электролиз методом поверхностной инженерии электропривитых пиридинов на серебряных катализаторах.
Абдинежад М., Иртем Э., Фарзи А., Сассенбург М., Субраманиан С., Иглесиас ван Монфор Х.П., Рипепи Д., Ли М., Мидделкоп Дж., Сейфитокалдани А., Бурдыни Т. Абдинежад М. и соавт. Катал. 2022 1 июля; 12 (13): 7862-7876. doi: 10.1021/acscatal.2c01654. Epub 2022 17 июня. Катал. 2022. PMID: 35799769 Бесплатная статья ЧВК.
Влияние совместного легирования на катализаторы Cu/CaO для селективного гидрирования фурфурола в фурфуриловый спирт.

Калонг М., Ратчахат С., Кхемтонг П., Ассабумрунграт С., Шрифа А. Калонг М. и соавт. Наноматериалы (Базель). 2022 6 мая; 12 (9): 1578. дои: 10.3390/nano12091578. Наноматериалы (Базель). 2022. PMID: 35564286 Бесплатная статья ЧВК.
Последние достижения в разработке интерфейса для электрокаталитической реакции восстановления CO 2 .
Ли Дж., Аббас С.У., Ван Х., Чжан З., Ху В. Ли Дж. и др. Наномикро Летт. 2021 25 октября; 13 (1): 216. doi: 10.1007/s40820-021-00738-9. Наномикро Летт. 2021. PMID: 34694525 Бесплатная статья ЧВК. Обзор.
Изолированные интерфейсы атомов медь-олово, настраивающие электрокаталитический CO 2 преобразование.
Ren W, Tan X, Qu J, Li S, Li J, Liu X, Ringer SP, Cairney JM, Wang K, Smith SC, Zhao C.
 Рен В. и др.
Нац коммун. 2021 4 марта; 12 (1): 1449. doi: 10.1038/s41467-021-21750-y.
Нац коммун. 2021.
PMID: 33664236
Бесплатная статья ЧВК.
Рен В. и др.
Нац коммун. 2021 4 марта; 12 (1): 1449. doi: 10.1038/s41467-021-21750-y.
Нац коммун. 2021.
PMID: 33664236
Бесплатная статья ЧВК.
Полнотекстовые ссылки
Американское химическое общество
Укажите
Формат: ААД АПА МДА НЛМ
Отправить на
| 1 | Найдите число нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите число нейтронов | Fe | |
| 6 | Найдите число нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите число нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите число нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определите, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите число нейтронов | № | |
| 20 | Найдите число нейтронов | Золото | |
| 21 | Найдите число нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определите, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/самую простую формулу | Н_2О | |
| 27 | Найдите числа окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите число нейтронов | Rh | |
| 32 | Найдите число нейтронов | Нет | |
| 33 | Найдите число нейтронов | Пт | |
| 34 | Найдите число нейтронов | Быть | Быть |
| 35 | Найдите число нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите число нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите числа окисления | Х | |
| 43 | Весы | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите число нейтронов | Пн | |
| 47 | Найдите число нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найти электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите число нейтронов | Ли | |
| 57 | Найдите число нейтронов | В 92О | |
| 60 | Упростить | ч*2о | |
| 61 | Определите, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найдите числа окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите число электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | ПД | |
| 70 | Найдите число нейтронов | рт. |



 Интерфейсы приложений ACS. 2020.
PMID: 32309923
Интерфейсы приложений ACS. 2020.
PMID: 32309923 7b00261. Epub 2017 16 марта.
J Am Chem Soc. 2017.
PMID: 28291338
7b00261. Epub 2017 16 марта.
J Am Chem Soc. 2017.
PMID: 28291338 дои: 10.1021/acsami.9b15685. Epub 2020 31 января.
Интерфейсы приложений ACS. 2020.
PMID: 31964136
дои: 10.1021/acsami.9b15685. Epub 2020 31 января.
Интерфейсы приложений ACS. 2020.
PMID: 31964136
 Рен В. и др.
Нац коммун. 2021 4 марта; 12 (1): 1449. doi: 10.1038/s41467-021-21750-y.
Нац коммун. 2021.
PMID: 33664236
Бесплатная статья ЧВК.
Рен В. и др.
Нац коммун. 2021 4 марта; 12 (1): 1449. doi: 10.1038/s41467-021-21750-y.
Нац коммун. 2021.
PMID: 33664236
Бесплатная статья ЧВК.