Таблица менделеева — Электронный учебник K-tree
Электронный учебник
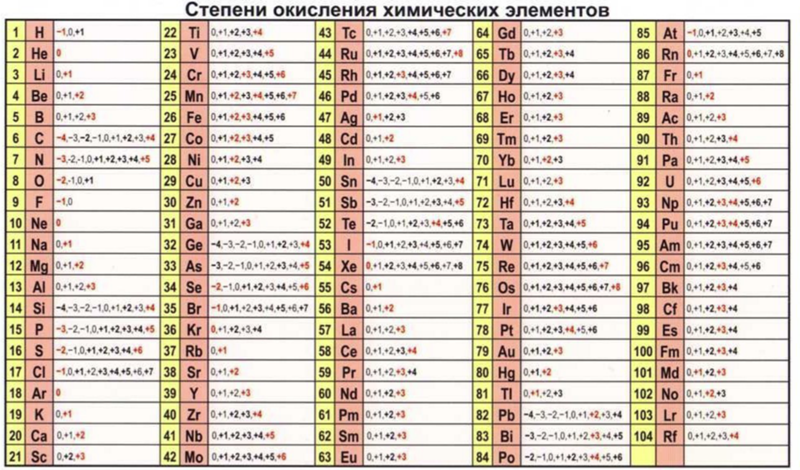
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Степень окисления титана
Степень окисления титана.
О степени окисления
Степень окисления титана
Валентность титана
Молярная масса титана
Плотность титана
Температура плавления титана
Температура кипения титана
Теплопроводность титана
Удельная теплоемкость титана
Удельная теплота сгорания титана
Электрическое сопротивление титана
Электропроводность титана
Все свойства атома титана
О степени окисления:
Степень окисления (окислительное число) – это вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону (катиону), чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона (аниона), чтобы окислить его до нейтрального атома.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения.
Значения степени окисления записывают арабскими цифрами сверху над символом элемента. При указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения: -5, -4, -3, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7.
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.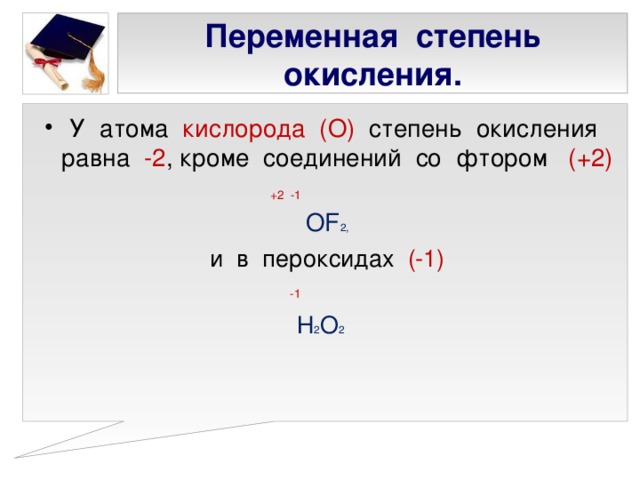
Степень окисления в ряде случаев не совпадает с валентностью. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как валентность равна IV.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей.
Степень окисления титана:
Степень окисления титана равна -2, -1, 0, +1, +2, +3, +4.
| Степень окисления титана в соединениях | |
| -2 | |
| -1 | |
| 0 | Ti |
| +1 | |
| +2 | TiH2, TiO, Ti(OH)2, TiF2, TiCl2 |
| +3 | Ti2O3, Ti(OH)3, TiF3, TiCl3 |
| +4 | TiF4, TiH4, TiO2, TiCl4, TiBr4 |
Все свойства атома титана
Источник: https://ru. wikipedia.org
wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности 151
Металл, Символ, Свойства, Факты, Соединения, Использование
Металлический титан
Титан представляет собой химический элемент или светло-серебристый металл группы 4 (IVB) в периодической таблице с символом Ti и атомным номером 22. Он имеет высокую температуру плавления, хорошую прочность на растяжение и свойства тепло- и электропроводности. Он образует гексагональную плотноупакованную кристаллическую решетку, как и большинство других переходных металлов.
Ti — очень полезный металл, который широко используется в промышленности. Титановый сплав в основном используется в высокоскоростных самолетах. Электронная конфигурация валентной оболочки металла: 3d 2 4с 2 . Следовательно, самая высокая и наиболее стабильная степень окисления или состояние титана составляет +4.
Кто открыл титан?
В 1791 году английский химик и минералог Уильям Грегор предпринял попытку открыть из титаносодержащей железной руды новый металл — ильменит (FeTiO 3 ). Но на самом деле он выделил нечистый оксид.
Но на самом деле он выделил нечистый оксид.
В 1794 году немецкий химик Мартин Генрих Клапрот получил такой же оксид из минерального рутила. Название элемента титан происходит от греческого слова титаны.
Свойства титана
Хорошие качества, коррозионная стойкость титана имеет электронную конфигурацию валентной оболочки [Ar] 3d 2 4s 2 . Поэтому в химии титана преобладала степень окисления +4.
| Титан | |||
| Химический символ | Ти | ||
| Дискавери | Уильям Грегор в 1791 году | ||
| Название образовано от | Word Titans (сыновья богини Земли в греческой мифологии) | ||
| Обычный изотоп | 48 Ти | ||
| Периодические свойства | |||
| Атомный номер | 22 | ||
| Атомный вес | 47. 867 867 | ||
| Электрон на оболочку | 2, 8, 10, 2 | ||
| Электронная конфигурация | [Ар] 3d 2 4 с 2 | ||
| Группа | 4 | ||
| Период | 4 | ||
| Блок | крестовина | ||
| Физические свойства | |||
| Состояние при 20 °C | Твердый | ||
| Место встречи | 1668 °С | ||
| Температура кипения | 3287 °С | ||
| Плотность | 4,50 г/см 3 | ||
| Молярная теплоемкость | 25,06 Дж моль −1 К −1 | ||
| Кристаллическая структура | Шестигранник с плотной насадкой (HCP) | ||
| Физические свойства | |||
| Атомный радиус (несвязанный) | 2,11 Å | ||
| Ковалентный радиус | 1,48 Å | ||
| Степени окисления | 4, 3 | ||
| Электроотрицательность | 1,54 (шкала Полинга) | ||
| Сродство к электрону | 7,622 кДж моль −1 | ||
| Энергия ионизации | 1-й | 2-й | 3-й |
| 658,81 | 1309,84 | 2652,55 | |
| Удельное электрическое сопротивление | 420 нОм⋅м при 20 °C | ||
| Номер КАС | 7440-32-6 | ||
Титан в периодической таблице
Переходный металл Ti помещен в группу 4 и период 4 периодической таблицы. Это элемент d-блока, который находится между скандием и ванадием.
Это элемент d-блока, который находится между скандием и ванадием.
Где добывают титан?
Титан является девятым по распространенности среди всех элементов и вторым среди переходных металлов. Он составляет почти 0,63 процента земной коры. Комбинированная форма металлов встречается в большинстве изверженных горных пород, песке, глине и почвах, в живых организмах (растительных и животных) и в естественных водоемах.
Металл был выделен металлургом Берцелиусом в 1825 г., а чистая форма М. Хантером в 1910 г. путем восстановления хлорида титана (TiCl 4 ) в герметичном стальном цилиндре.
Ильменит (FeTiO 3 ) и рутил (TiO 2 ) представляют собой две промышленные руды титана. В основном это происходит в Западной Австралии, Канаде, Китае, Южной Индии, Мозамбике, Малайзии, Новой Зеландии, Норвегии, Сьерра-Леоне, Южной Африке и Украине.
Изотопы титана
Природный титан состоит из пяти стабильных изотопов, таких как 46 Ti (8,0 процента), 47 Ti (7,3 процента), 48 Ti (73,8 процента), 49 Ti (5,5 процента) и 50 Ti (5,4%).
Производственный процесс
Получение чистого титана очень сложно из-за его реакционной способности при высоких температурах. Извлечение металла углеродным восстановлением вызывает ряд трудностей. Он очень реакционноспособен при высоких температурах и легко образует карбид, нитрид и оксид в результате реакции с углеродом, кислородом и азотом соответственно.- Извлечение металла осуществляется путем нагревания ильменита или рутила с углеродом и хлором при 900 °С.
- Тетрахлорид титана (TiCl 4 ), температура кипения 137 °С, отделяют от FeCl 3 фракционной перегонкой.
- TiCl 4 восстанавливается расплавленным магнием в атмосфере аргона с получением губчатого металлического титана.
TiCl 4 + 2 Mg → Ti + 2 MgCl 2 - Хлорид магния и избыток магния удаляют промывной водой и разбавленной соляной кислотой.
- Чистый титан получают нагреванием металла с йодом в вакуумированной стеклянной трубке с вольфрамовой нитью в центре трубки.

Факты о титане
- Титан представляет собой переходный металл с высокой температурой плавления, хорошей прочностью на растяжение и коррозионной стойкостью, относящийся к группе 4 периодической таблицы.
- Металл инертен при обычной температуре, но в мелкодисперсном состоянии загорается на воздухе (пирофор).
- При нагревании он соединяется с неметаллами, такими как кислород, азот, бор, углерод, кремний и водород.
- Нитриды (TiN), карбиды (TiC) и бориды (TiB, TiB 2 ) очень твердые, хорошо проводят электричество и химически очень инертны.
- Металл разлагается паром при 100 °C, но не подвергается воздействию разбавленных минеральных кислот, таких как серная кислота, соляная кислота или азотная кислота, при обычной температуре.
- Он не разъедает горячую водную щелочь, но расплавленная щелочь разъедает его с образованием титанатов.
Химические соединения
При изучении химии электронная конфигурация валентной оболочки титана имеет вид 3d 2 4с 2 . Следовательно, самая высокая и наиболее стабильная степень окисления Ti равна +4. Соединения более низкой степени окисления (0, II, III) легко окисляются с образованием Ti (IV).
Следовательно, самая высокая и наиболее стабильная степень окисления Ti равна +4. Соединения более низкой степени окисления (0, II, III) легко окисляются с образованием Ti (IV).
Для образования иона Ti +4 требуется высокая энергия ионизации. Это говорит о том, что химические соединения титана в состоянии +4 образуются за счет ковалентной связи.
Оксид титана
Оксид титана (TiO 2 ) имеет три кристаллические твердые формы: рутил, анатаз и брукит. Рутил является наиболее распространенной природной формой, которая используется в химической промышленности в качестве пигмента. Во всех структурах Ti координирован шестью атомами кислорода.
Ti 2 O 3 , оксид Ti (III) фиолетового цвета имеет структурный тип, аналогичный α-Al 2 O 3 .
TiO может быть получен путем нагревания TiO 2 с металлическим титаном. Он имеет кубическую кристаллическую структуру, похожую на хлорид натрия, но обычно нестехиометрическую, с одной шестой вакантной позиции для обоих ионов. Он используется в качестве металлического проводника.
Он используется в качестве металлического проводника.
Дисульфид титана
Дисульфид (TiS 2 ) является наиболее важным сульфидным соединением титана, образованным атомами серы. Он состоит из слоистой структуры. Он используется в качестве электрода для разработки литиевых батарей.
Галогениды
Все четыре галогенида, такие как TiF 4 , TiCl 4 , TiBr 4 и TiI 4 , известны. TiF 4 может быть получен реакцией металлов с фтором при 200 °C. Другие тетрагалогениды могут быть получены нагреванием TiO 2 с углеродом и галогеном.
В степени окисления +3 он также образует все четыре молекулы галогенидов. Они нерастворимы в воде и стабильны на воздухе. Они непропорциональны для образования галогенидов Ti (IV).
Металлоорганические соединения
Металлоорганические соединения титана были разработаны в 1960 году в результате открытия химического катализатора Циглера-Натта. Большое количество металлоорганических соединений получают путем химической связи, такой как сигма- и пи-связь.
Большое количество металлоорганических соединений получают путем химической связи, такой как сигма- и пи-связь.
Наиболее распространенным титаноорганическим комплексом является дихлорид титаноцена [(C 5 H 5 ) 2 TiCl 2 ]. Реактив Теббе и реактив Петасиса являются родственными соединениями дихлорида титаноцена.
Использование титана
- Благодаря своей высокой эффективности и низкой биологической токсичности комплекс титана (IV) является первым неплатиновым соединением, испытанным для лечения рака в медицине.
- Это бесполезный легирующий материал из-за его низкой плотности, высокой прочности на растяжение и отличной коррозионной стойкости. Добавление 0,1% титана в сталь повышает механическую прочность и коррозионную стойкость сплава. Титановые сплавы
- используются во многих химических и промышленных областях, таких как хранение щелочных растворов, соединений хлора и других агрессивных химических веществ Титановые сплавы
- также используются для изготовления рельсов, железнодорожных колес и других изделий.

- Его сплавы с марганцем, хромом, железом, молибденом, алюминием, ванадием и оловом. Эти сплавы используются в авиационной и ракетной промышленности благодаря своей легкости и механической прочности.
- Ферротитан получают плавлением ильменита или рутила с железом и коксом в электрической печи. Он используется в качестве поглотителя в сталелитейной промышленности для удаления кислорода и азота из стали.
- Оксид титана (TiO 2 ) широко используется в качестве белого пигмента из-за его превосходной кроющей способности, который получают тем же путем извлечения металла.
Титан (Ti) – Химические свойства, воздействие на здоровье и окружающую среду
Титан Химический элемент, Ti, атомный номер 22 и атомный вес 47,90. Его химическое поведение имеет много общего с кремнеземом и цирконием как элементом, принадлежащим к первой переходной группе. Его химия в водном растворе, особенно в более низких степенях окисления, имеет некоторое сходство с хромом и ванадием. Титан — это легкий переходный металл бело-серебристо-металлического цвета. Он прочный, блестящий, устойчивый к коррозии. Чистый титан не растворяется в воде, но растворяется в концентрированных кислотах. Этот металл образует пассивное, но защитное оксидное покрытие (приводящее к коррозионной стойкости) при воздействии повышенных температур на воздухе, но при комнатной температуре он не тускнеет.
Титан — это легкий переходный металл бело-серебристо-металлического цвета. Он прочный, блестящий, устойчивый к коррозии. Чистый титан не растворяется в воде, но растворяется в концентрированных кислотах. Этот металл образует пассивное, но защитное оксидное покрытие (приводящее к коррозионной стойкости) при воздействии повышенных температур на воздухе, но при комнатной температуре он не тускнеет.
Основная степень окисления 4+, хотя известны и состояния 3+ и 2+, но они менее стабильны. Этот элемент горит на воздухе при нагревании с образованием диоксида TiO 2 и при соединении с галогенами. Он восстанавливает водяной пар с образованием двуокиси и водорода и аналогичным образом реагирует с горячими концентрированными кислотами, хотя с соляной кислотой образует трихлорид. Металл поглощает водород с образованием TiH 2 и образует нитрид TiN и карбид TiC. Другими известными соединениями являются сера TiS 2 , а также низшие оксиды Ti 2 O 3 и TiO, а также серы Ti 2 S 3 и TiS. Соли известны в трех степенях окисления.
Соли известны в трех степенях окисления.
Области применения
Диоксид титана широко используется в качестве белого пигмента в наружных картинах из-за его химической инертности, высокой кроющей способности, непрозрачности для УФ-излучения и способности самоочищаться. Диоксид также использовался однажды в качестве отбеливающего и успокаивающего агента в фарфоровых эмалях, придавая им последний штрих большой яркости, твердости и кислотостойкости. Типичная помада содержит 10% титана.
Титановые сплавы характеризуются очень высокой прочностью на растяжение даже при высоких температурах, малым весом, высокой коррозионной стойкостью и способностью выдерживать экстремальные температуры. Благодаря этим свойствам они в основном используются в самолетах, трубах для силовых установок, броневой обшивке, военно-морских кораблях, космических кораблях и ракетах. Титан такой же прочный, как сталь, но на 45% легче.
В медицине титан используется для изготовления эндопротезов тазобедренного и коленного суставов, кардиостимуляторов, костных пластин и винтов и черепных пластин при переломах черепа. Он также использовался для прикрепления ложного тета.
Он также использовался для прикрепления ложного тета.
Титанаты щелочноземельных металлов обладают некоторыми замечательными свойствами. Уровень диэлектрической проницаемости изменяется от 13 для MgTiO 3 до различных миллиардов для твердых растворов SrTiO3 в BaTiO 3 . Титанат бария также имеет диэлектрическую проницаемость 10 000 вблизи 120ºC, что является его точкой Кюри; имеет низкий диэлектрический гистерезис. Керамические преобразователи, содержащие титанат бария, выгодно отличаются от сегнетовой соли по термостабильности и от кварца по силе воздействия и способности формировать керамику в различных формах. Соединение использовалось в качестве генератора ультразвуковых колебаний и детектора звука.
Титан в окружающей среде
Хотя в природе он не связан с другими элементами, титан является девятым по распространенности элементом в земной коре (0,63% по массе) и присутствует в большинстве магматических пород и в полученных отложениях. от них. Важными минералами титана являются рутил, брукит, анатаз, ильменит и титанит. Основная добытая руда, ильменит, встречается в виде обширных месторождений песка в Западной Австралии, Норвегии, Канаде и Украине. Крупные месторождения рутила в Северной Америке и Южной Африке также вносят значительный вклад в мировые поставки титана. Мировое производство металла составляет около 90,000 тонн в год, а двуокиси титана – 4,3 млн тонн в год.
от них. Важными минералами титана являются рутил, брукит, анатаз, ильменит и титанит. Основная добытая руда, ильменит, встречается в виде обширных месторождений песка в Западной Австралии, Норвегии, Канаде и Украине. Крупные месторождения рутила в Северной Америке и Южной Африке также вносят значительный вклад в мировые поставки титана. Мировое производство металла составляет около 90,000 тонн в год, а двуокиси титана – 4,3 млн тонн в год.
Диоксид титана, TiO 2 , обычно встречается в черной или коричневатой форме, известной как рутил. Реже встречаются в природе естественные формы анатазита и брукита. И чистый рутил, и чистый анатазит имеют белый цвет. Черный основной оксид FeTiO 3 встречается в природной форме в виде природного минерала, называемого ильменитом; это основной коммерческий источник титана.
Влияние титана на здоровье Биологическая роль титана неизвестна. В организме человека имеется определяемое количество титана, и было подсчитано, что мы потребляем около 0,8 мг в день, но большая часть проходит через нас, не адсорбируясь.