Напишите уравнения реакций,с помощь которых можно осуществить следующие превращения: S-ZnS-SO2-h3SO3-K2SO3 — Знания.site
Последние вопросы
Химия
10 минут назад
ПОЖАЛУЙСТА ЛЮДИ ДОБРЫЕ ПОМОГИТЕ:(Химия
14 минут назад
Решите пожалуйста
В 1 л воды растворяется 4 л сероводорода при н.у. Определите растворимость этого газа в воде.
Химия
1 час назад
Помогите по химиии 9класс котрошаХимия
1 час назад
2.
Химия
1 час назад
Химия самостоятельная работаХимия
1 час назад
СРОЧНО ДАЮ 50 БАЛЛОВ 19. Яка маса осаду утвориться при взаємодії 2,24 л карбон (IV) оксиду з барій гідроксидом?Химия
1 час назад
СРОЧНО ДАЮ 20 БАЛЛОВ 13. Вкажіть речовини, з якими може взаємодіяти Cu(OН)2 : а) SO2 ; б) h3SO4 ; в) Na2CO3 ; г) MgO .
Химия
1 час назад
Из 21 г предельного одноатомного спирта в результате окисления было получено 25,9 г кислоты. Установите строениеХимия
3 часа назад
Химия 10 классХимия
3 часа назад
11.При сливании 550 г 20% раствора и 90 г 10% раствора гидроксида натрия. получили раствор с новой массовой долей. Какова новая массовая доля растворённого вещества в полученном растворе?Химия
4 часа назад
Вычислите массу и количество оксида фосфора(V),образующегося в результате взаимодействия 9,8г фосфора с кислородом
Химия
4 часа назад
Вычислите массу и количество кислорода,образующегося в результате разложения 6,2г оксида
Химия
6 часов назад
Срочно помогите 100 балловХимия
6 часов назад
ПОЖАЛУЙСТА ПОСОГИТЕ СРОЧНААА Какой объём воздуха понадобится для полного ускорения бутанола массой 37 г Какое количество диоксида углерода и воды при этом образуется Химия
8 часов назад
Вычислите какая масса меди сгорела, если образовалось 50 г оксида меди (2)
Все предметы
Русский
Россия
English
United States
Bahasa Indonesia
Indonesia
English
India
English
Philippines
Polski
Polska
How much to ban the user?
1 hour 1 day
Файлы cookie
Мы используем файлы cookie для анализа нашего трафика.
Закрывая этот баннер, нажимая на ссылку или продолжая просмотр другим способом, вы соглашаетесь на использование файлов cookie.
Privacy policy
Контрольная работа по химии 9 класс «Неметаллы»
Тема урока: Контрольная работа по теме: «Неметаллы»
Цель урока: определение уровня знаний, сформированности и навыков, комплексного их применения. Закрепление и систематизация знаний по теме «Неметаллы».
Задачи:
Образовательные: проверить знания, умения и навыки учащихся, сформированные при изучении темы «Неметаллы».
Развивающие: развивать навык самостоятельности; химический язык, вычислительные навыки; логическое мышление, память, внимание, развивать умение самоконтроля и самопроверки.
Воспитательные: воспитывать интерес к химии, аккуратность, желание выполнить работу на хорошо и отлично.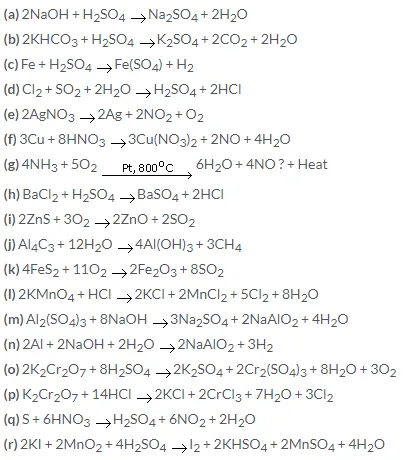
Тип урока: урок контроля умений и навыков.
Оборудование: тетрадь для контрольных работ, варианты контрольных работ.
Ход урока:
Организационный момент.
Сообщение темы урока: Контрольная работа по теме: «Неметаллы»
Знакомство с текстом контрольной работы.
Работа в тетрадях. Оформление тетради (число, месяц)
Контрольная работа по теме: «Неметаллы» 9 класс
Вариант 1
1. Запишите электронную формулу химического элемента с порядковым номером 15.
2. Определите, в каких реакциях N является окислителем, а в каких восстановителем:
а) при взаимодействии с металлом;
б) при взаимодействии с водородом;
в) при взаимодействии с кислородом.
(запишите эти реакции!)
3. Осуществить цепочку превращений. Si→Mg2Si→SiO2→Na2SiO3→H2SiO3→SiO2
4. Предположите план распознавания растворов: сульфата, хлорида и иодида натрия.
Предположите план распознавания растворов: сульфата, хлорида и иодида натрия.
Запишите уравнения использованных реакций.
5. Вычислите массу осадка, выпавшего при сливании 104 мг 20%-го раствора хлорида бария с избытком раствора серной кислоты.
Контрольная работа по теме: «Неметаллы» 9 класс
Вариант 2
1. Запишите электронную формулу химического элемента с порядковым номером 16.
2. Определите, в каких реакциях Р является окислителем, а в каких восстановителем:
а) при взаимодействии с металлом;
б) при взаимодействии с водородом;
в) при взаимодействии с кислородом.
(запишите эти реакции!)
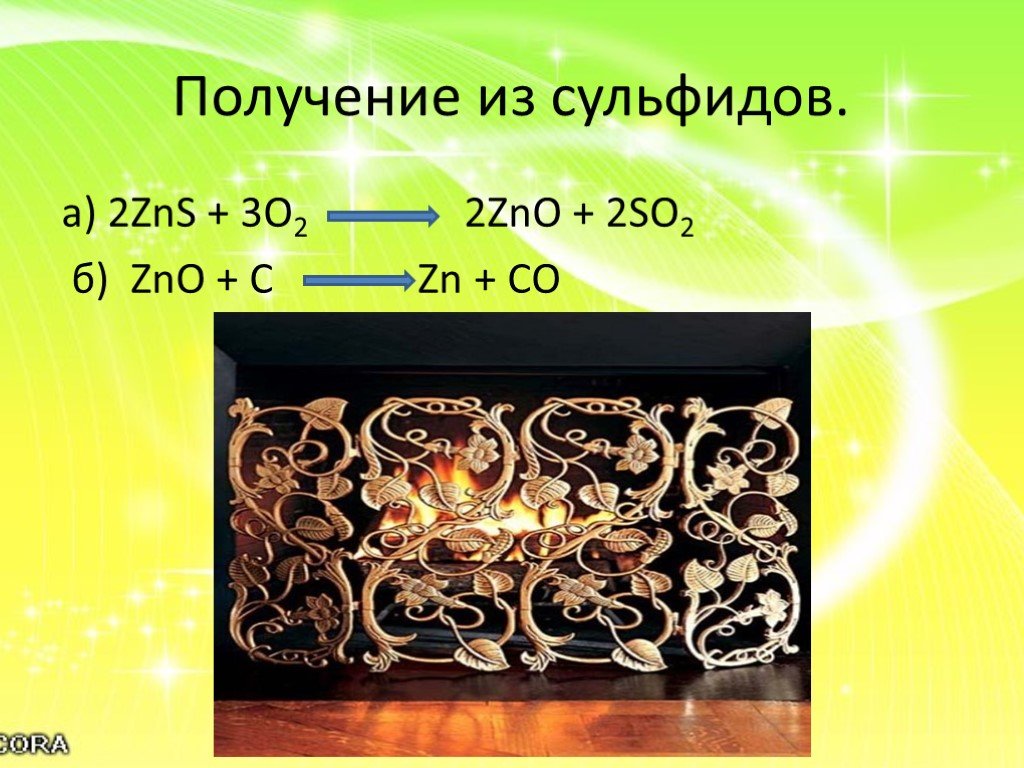
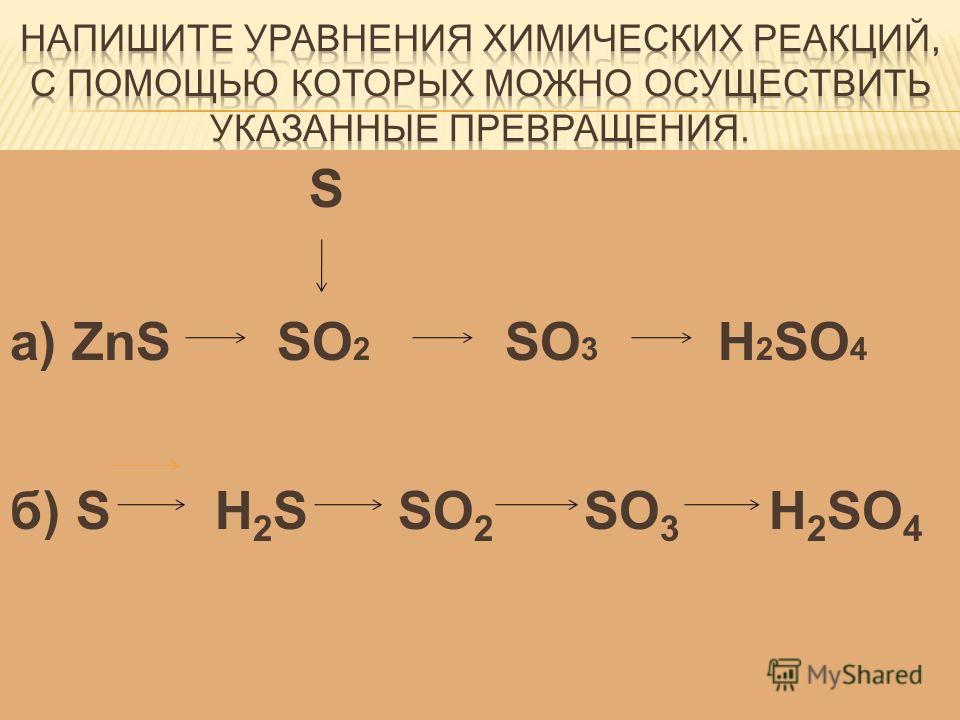
3. Осуществить цепочку превращений. S → ZnS → SO2 →SO3 → H2SO4 → BaSO4
4. Предположите план распознавания растворов: соляной, серной, азотной кислот. Запишите уравнения использованных реакций.
Предположите план распознавания растворов: соляной, серной, азотной кислот. Запишите уравнения использованных реакций.
5. Какой объем аммиака можно получить при взаимодействии 10,7 кг хлорида аммония с гидроксидом кальция, если доля выхода продукта 98%?
Контрольная работа по теме: «Неметаллы» 9 класс
Вариант 3
1. Запишите электронную формулу химического элемента с порядковым номером 17.
2. Определите, в каких реакциях S является окислителем, а в каких восстановителем:
а) при взаимодействии с металлом;
б) при взаимодействии с водородом;
в) при взаимодействии с кислородом.
(запишите эти реакции!)
3. Осуществить цепочку превращений. NH3→NO→NO2→HNO3→Cu(NO3)2→CuO
4. Предположите план распознавания растворов: фосфата, карбоната и гидроксида натрия. Запишите уравнения использованных реакций.
Предположите план распознавания растворов: фосфата, карбоната и гидроксида натрия. Запишите уравнения использованных реакций.
5. К раствору, в котором находится 42,6 грамм нитрата алюминия, прилили раствор, содержащий 16 килограмм гидроксида натрия. Рассчитайте массу образовавшегося осадка.
ПРИЛОЖЕНИЕ
Вариант 1
1.
2. а) 6Li + N2 = 2Li3N (ок-ль)
б) 3h3 + N2=2Nh4 (ок-ль)
в) N2 + O2=2NO (вост-ль)
3 .Si→Mg2Si→SiO2→Na2SiO3→H2SiO3→SiO2
1) Si +2 MgO = Mg2Si + O2
2) Mg2Si + 2O2 = 2MgO + SiO2
3) 2NaOH+SiO2=Na2SiO3+h3O (Na2CO3+SiO2=Na2SiO3+CO2)
4) Na2SiO3 + 2HCl = 2NaCl + h3SiO3
5) h3SiO3 = SiO2 + h3O
4. в пробирки капаем р-р BaCl2 и в пробирке с Na2SO4 образуется осадок белого цвета, в двух других изменений нет
в пробирки капаем р-р BaCl2 и в пробирке с Na2SO4 образуется осадок белого цвета, в двух других изменений нет
Na2SO4+BaCl2=BaSO4↓+ 2NaCl
Качественная реакция на хлорид-ион – реакция с нитратом серебра AgNO3. Белый осадок хлорида серебра выпадает в той пробирке, где находится хлорид натрия.
NaCl + AgNO3= AgCl↓ + NaNO3
прилить раствор AgNO3 там, где был иодид, выпадет желтый осадок желтого цвета
AgNO3 + NaI = AgI↓ + NaNO3
5.
Дано: | СИ | Решение: |
m(BaCl2)=104мг w(BaCl2)=20% | 0,104 г 0,2 | h3SO4+BaCl2 BaSO4 +2HCl m в-ва(BaCl2) = w(BaCl2)*m р-ра(BaCl2) = 0,2*0,104=0,0208 г m(BaCl2)= 1моль*208 г/моль=208 г m(BaSO4)=233г HSO4 в избытке расчет по недостатку M (BaCl2) = 208г/моль 0,0208/ 208= x/233 X=0,0208*233/208=0,0233 |
m(BaSO4)-? |
Ответ: m(BaSO4)=0,0233г=233 мг
Вариант 2
1.
2.а) 3Li + P = Li3P (ок-ль)
б) 3h3 + 2P=2Ph4 (ок-ль)
в) 4P +5O2 = 2P2O5 (вост-ль)
3.S → ZnS → SO2 →SO3 → H2SO4 → BaSO4
1)S+Zn= ZnS
2) 2ZnS+3O2 = ZnО+ 2SO2
3) 2SO2+ O2 = 2SO3 (SO2+ NaSO3 = SO3 + NaSO2 )
4)SO3+h3O= h3SO4
5)h3SO4 + BaCL2 = BaSO4 + 2HCL
4. Серную кислоту определим по сульфат-иону. Качественная реакция на сульфат-ион – реакция с хлоридом бария.
H2SO4+ BaCl2 = BaSO4↓ + 2HCl (осадок белого цвета)
Во второй пробирке выпадает осадок сульфата бария, значит в колбе номер два – серная кислота. Соляную кислоту можно определить по иону хлора качественной реакцией с нитратом серебра.
HCl + AgNO3 = AgCl↓ + HNO3 (белый осадок)
В пробирке с соляной кислотой выпадает белый осадок хлорида серебра. В колбе номер один – соляная кислота. Остается убедиться в том, что в последней пробе – азотная кислота. Опустим в пробирку кусочек меди и нагреем раствор. Образуется голубой раствор нитрата меди и выделяется бурый газ – диоксид азота.
4HNO3 + Cu = Cu(NO3)2 + 2NO2↑ +2H2O
5.
Дано: | СИ | Решение: |
m(Nh5CL)=10,7кг wвых.(практ.)=298% | 10700 г 0,98 | 2Nh5CL+Ca(OH)2=2Nh4+CaCl2+2h3O M(Nh5Cl)=53,5 г/моль m(Nh5Cl)= n*M=2*53,5=107 г n=m/M=10700/53,5=200 моль n=v/vm v=n*vm=2*22,4=44,8 10700г/107г=x л/44,8л х теор. w=m пр/m теор=v пр/v теор v пр=v теор*w=0,98*44880=4390,4 л или 4480л=100% х л=98% х=4390,4 л |
v(Nh4)-? |
Ответ: v(Nh4)=4390,4 л
Вариант 3
1.
2.а) 2Li+S=Li2S (ок-ль)
б) Н2 + S = h3S (t) (ок-ль)
в) O2 + S = SO2 (вост-ль)
3.NH3→NO→NO2→HNO3→Cu(NO3)2→CuO
4Nh4 +5O2 =4NO+6h3O
2NO+O2 =2NO2
4NO2 +2h3O+O2 =4HNO3
2HNO3 +Cu(OH)2 =Cu(NO3)2 +2h3O
2Cu(NO3)2 = 2CuO +4NO2 +O2
4.Для карбоната:Na2CO3 +AgNO3 = Ag2CO3 (бледно-желтый осадок) + 2NaNO3
Для фосфата:Na3PO4 +3LiNO3 = 3NaNO3 + LiPO4 (белый осадок)
Для гидроксида:2NaOH+CuSO4 = Cu(OH)2 (синий осадок) + NaSO4
5.
Дано: | СИ | Решение: |
m(Al(NO3)3)=42,6 г m(NaOH)=1,6 кг | 1600 | Al(NO3)3+3NaOH Al(OH)3+3NaNO3 n(Al(NO3)3)=m/M=42,6/213=0,2моль n(NaOH)=m/M=1600/40=40 моль по уравнению реакции NaOH в избытке n (Al(OH)3)= n(Al(NO3)3)=0,2моль m (Al(OH)3)=n*M=0,2*78=15,6 г |
m (Al(OH)3)-? |
Ответ: m (Al(OH)3)=15,6 г
При нагревании сульфида цинка в присутствии кислорода происходит следующая реакция: ZnS + O2 → ZnO + SO2. Если 1,72 моля ZnS нагреть в…
Цитата страницы Начать эссе значок-вопрос Спросите репетитораНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяСсылайтесь на эту страницу следующим образом:
«При нагревании сульфида цинка в присутствии кислорода происходит следующая реакция: ZnS + O2 → ZnO + SO2.
Предельным реагентом в химическом уравнении является реагент, который полностью расходуется при протекании химической реакции. В результате реагент определяет, как долго будет происходить реакция.
Реакция между сульфидом цинка и кислородом дает оксид цинка и диоксид серы.
Химическое уравнение реакции:
2ZnS + 3O2 → 2ZnO + 2SO2
2 моля ZnS реагируют с 3 молями O2 с образованием 2 молей ZnO и 2 молей SO2.
Для полного израсходования обоих реагентов отношение количества доступных молей ZnS к количеству доступных молей O2 должно быть 2/3 = 0,66. Соотношение молей доступных реагентов составляет 1,72/3,04 = 0,56. Это значение меньше 0,66, что указывает на то, что доступного количества ZnS меньше, чем требуется.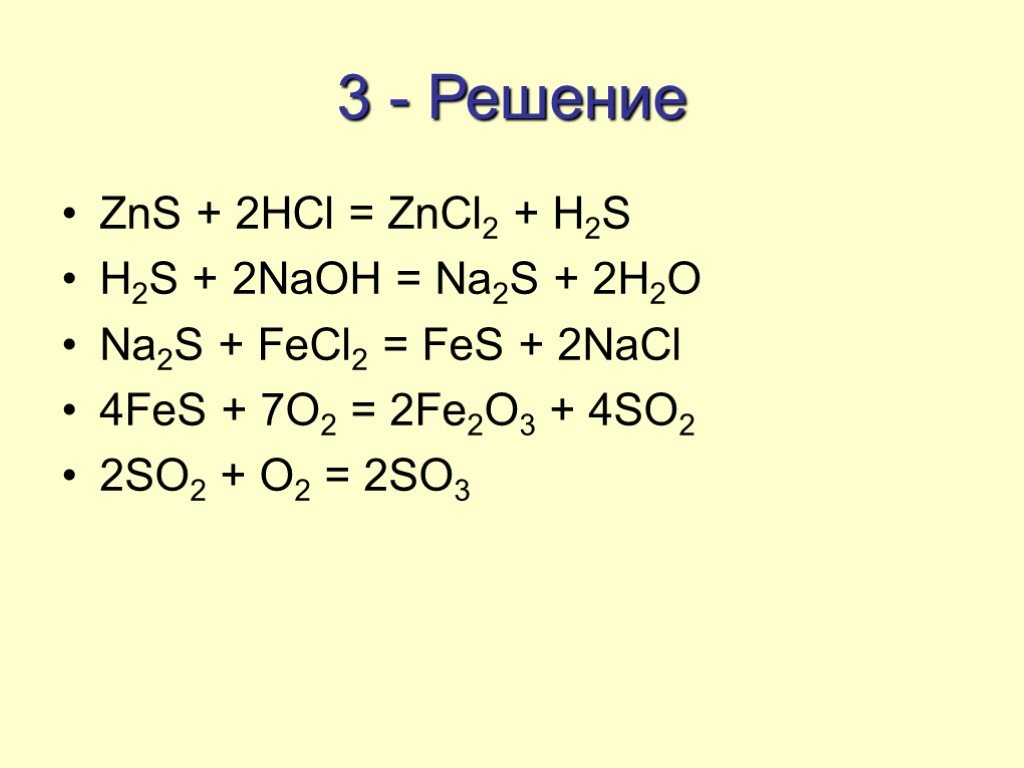
Утверждено редакцией eNotes
Химия
Последний ответ опубликован 02 июня 2013 г. в 20:16:05.
Что удерживает атомы вместе в ионных связях?
2 Ответы воспитателя
Химия
Последний ответ опубликован 23 сентября 2012 г. в 3:35:39.ЯВЛЯЮСЬ
Является ли CO2 + h3O ->h3CO3 окислительно-восстановительной реакцией?
1 Ответ воспитателя
Химия
Последний ответ опубликован 08 февраля 2011 г. в 4:43:41.
Напишите символ для катиона и аниона, изоэлектронных криптону. Может ли катион быть изоэлектронным аниону того же периода? Объяснять.
1 Ответ воспитателя
Химия
Последний ответ опубликован 19 ноября 2012 г.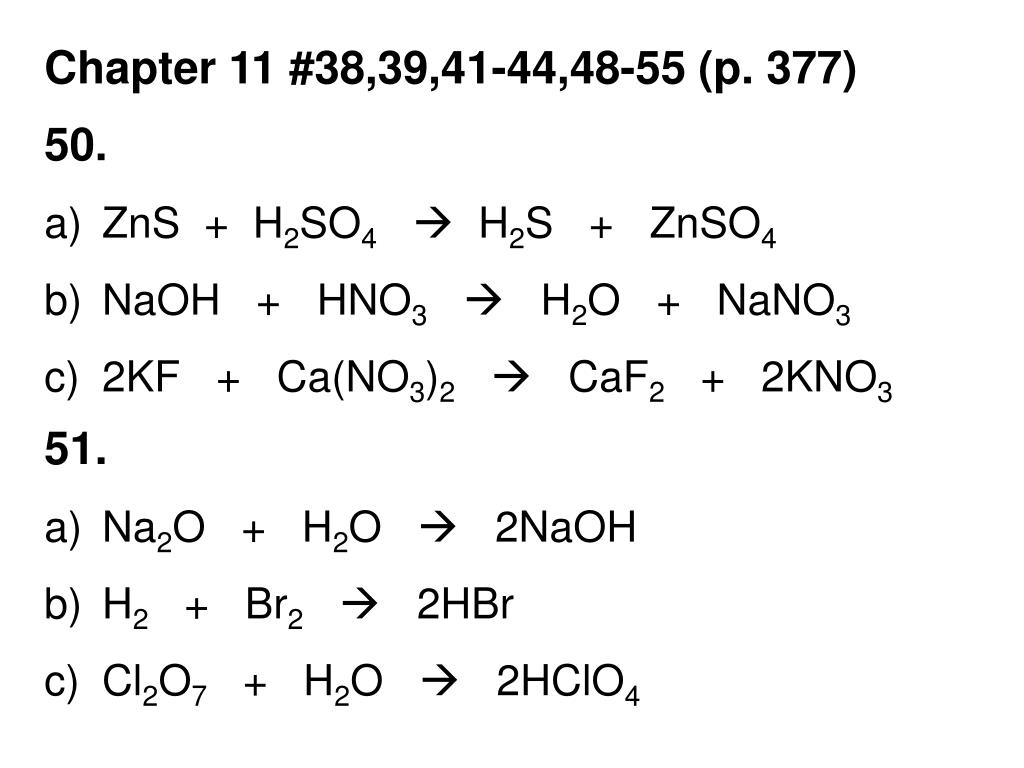 в 17:41:47.
в 17:41:47.
Оксид ванадия (V) используется в качестве катализатора в приведенной ниже реакции.2 SO2 (г) + O2 (г) —> 2 SO3 (г)Объясните, как оксид ванадия (V) способен снижать энергию активации и повышать скорость…
1 Ответ воспитателя
Химия
Последний ответ опубликован 05 февраля 2012 г. в 11:41:27.
. Откуда известна полнота отделения бензойной кислоты от хлористого натрия при добавлении раствора AgNO3? Опыт был по кристаллизации. этот вопрос основан на…
1 Ответ воспитателя
Демонстрации — Цинк + Сера
Демонстрации — Цинк + Сера| Панель навигации | |
| ОСНОВНОЙ | Демонстрации |
Цинк — голубовато-белый металл, используемый для цинкования железа, а также
в сплавах, батареях и резине. Сера — желтая, хрупкая
неметалл; его также можно найти в усиленной форме. Цинк и сера реагируют
друг с другом бурно производить сульфид цинка ; реакция
сопровождается энергичным выделением газа, тепла и света:
Сера — желтая, хрупкая
неметалл; его также можно найти в усиленной форме. Цинк и сера реагируют
друг с другом бурно производить сульфид цинка ; реакция
сопровождается энергичным выделением газа, тепла и света:
| Zn(s) + S(s) ——> ZnS(s) | [один из самых простых химические уравнения балансировать!] |
Продукты реакции также включают небольшие количества оксида цинка (ZnO) и диоксид серы (SO 2 ).
Эта реакция производит достаточно горячего газа для запуска небольших ракет; это был один моделей ракетного топлива, описанных Гомером Хикамом в его книге «Ракета ». Мальчики (Delacorte Pr; 1998) [снято как Октябрьское небо (Юниверсал Студиос, 1999)].
В первой демонстрации ниже порошкообразный цинк и сера смешиваются в
фарфоровая выпарная чаша, нагретая пламенем; смесь горит с
желтовато-зеленое пламя и оставляет осадок желтого сульфида цинка в
блюдо. Во втором видеоклипе более крупный образец поджигается в
чаша для выпаривания, которая разбивается; и в третьем клипе аналогичная смесь
разбивает большой фарфоровый тигель.
Во втором видеоклипе более крупный образец поджигается в
чаша для выпаривания, которая разбивается; и в третьем клипе аналогичная смесь
разбивает большой фарфоровый тигель.
Видеоклип 1: РЕАЛЬНЫЙ, 3,33 МБ
Видеоклип 2: РЕАЛЬНЫЙ, 1,41 МБ
Видеоклип 3: РЕАЛЬНЫЙ, 2,62 МБ
!!! Опасности !!!
Эта реакция производит большое количество тепловой энергии; очистить территорию от горючие материалы.
Эту реакцию следует проводить в вытяжном шкафу или в открытом, хорошо проветриваемом помещении. область. Если вы делаете это в вытяжном шкафу, будьте готовы потратить некоторое время на вытирание порошок сульфида цинка со всех поверхностей в вытяжке.
Процедуры
Бассам З.



 = 4480 л
= 4480 л