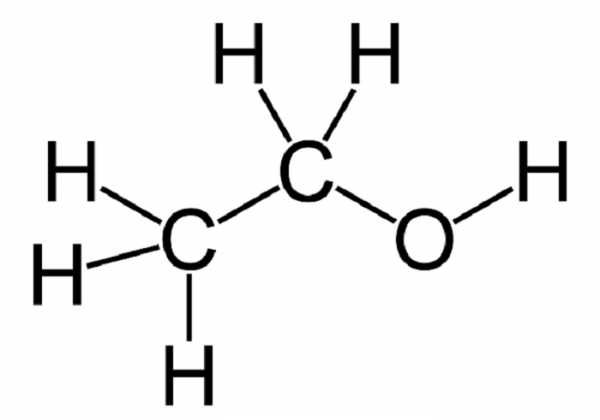
Органическая химияСтруктурная изомерия и структурные формулыСтруктурная изомерияСреди органических соединений распространено явление изомерии. Имеется множество соединений углерода, обладающих одинаковым качественным и количественным составом и одинаковым молекулярным весом, но совершенно различными физическими, а зачастую и химическими свойствами. Например, состав С2Н6О и, соответственно молекулярный вес 46,07 имеют два различных изомерных органических вещества:
Другой пример: Формула С2Н4О2 может соответствовать как уксусной кислоте, так и гликолевому альдегиду. Структурные формулыДля того чтобы избежать путаницы для записи формул таких веществ используют структурные формулы. Структурная формула — это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в соединении, выраженное на плоскости. Связи в структурных формулах обозначаются валентными черточками. Так, структурные формулы веществ, приведённых в качестве примеров выше, будут выглядеть следующим образом: Подобное графическое изображение структурных формул довольно сложно и требует времени. Часто формулы органических соединений пишут таким образом, чтобы они давали представление о длине углеводородной цепи и о присутствующих в молекуле функциональных группах. Выделение фунуциональных групп важно потому, что именно они во многом определяют химические свойства соединения Так, формулы вышеприведённых веществ могут быть записаны следующим образом:
Внешняя электронная оболочка атома углерода состоит из четырех электронов, с помощью которых он образует четыре ковалентных связи с другими атомами. С помощью простых (одинарных) ковалентных связей атом углерода может присоединить к себе четыре других атома. Но атомы могут связываться не только одинарной, но и двойной или тройной ковалентной связьюсвязью. В структурных формулах такие связи обозначаются двойными или тройными чёрточками. Примерами соединений с двойными и тройными связями являются этилен С2Н4 и ацетилен С2Н2: | Биохимия |
kurenie.me
| Химическая формула | Название соединения | Номер по классификатору CAS |
|---|---|---|
| D2O | оксид дейтерия | 7732-20-0 |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| LaCl3 | Хлорид лантана (III) | 10099-58-8 |
| LaPO4 | Фосфат лантана (III) | 14913-14-5 |
| Li(AlSi2O6) | Кеатит | |
| LiBr | Бромид лития | 7550-35-8 |
| LiBrO3 | Бромат лития | |
| LiCN | Цианид лития | |
| LiC2H5O | Этилат лития | |
| LiF | фторид лития | 7789-24-4 |
| LiHSO4 | Гидросульфат лития | |
| LiIO3 | Иодат лития | |
| LiNO3 | Нитрат лития | |
| LiTaO3 | Танталат лития | |
| Li2CrO4 | Хромат лития | |
| Li2Cr2O7 | Дихромат лития | |
| Li2MoO4 | Ортомолибдат лития | 13568-40-6 |
| Li2NbO3 | Метаниобат лития | |
| Li2SO4 | Сульфат лития | 10377-48-7 |
| Li2SeO3 | Селенит лития | |
| Li2SeO4 | Селенат лития | |
| Li2SiO3 | Метасиликат лития | 10102-24-6 |
| Li2SiO4 | Ортосиликат лития | |
| Li2TeO3 | Теллурит лития | |
| Li2TeO4 | Теллурат лития | |
| Li2TiO3 | Метатитанат лития | 12031-82-2 |
| Li2WO4 | Ортовольфрамат лития | 13568-45-1 |
| Li2ZrO3 | Метацирконат лития | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| PH3 | phosphine | 7803-51-2 |
| POCl3 | phosphoryl chloride | 10025-87-3 |
| PO43− | phosphate ion | |
| P2I4 | phosphorus(II) iodide | |
| P2O74− | pyrophosphate ion | |
| P2S3 | phosphorus(III) sulfide | |
| P2Se3 | phosphorus(III) selenide | |
| P2Se5 | phosphorus(V) selenide | |
| P2Te3 | phosphorus(III) telluride | |
| P3N5 | phosphorus(V) nitride | 12136-91-3 |
| P4O10 | tetraphosphorus decaoxide | 16752-60-6 |
| Pb(CH3COO)2·3H2O | ацетат свинца — тригидрат | |
| PbCO3 | lead carbonate cerussite | |
| Pb(C2H5)4 | tetraethyllead | |
| PbC2O4 | lead oxalate | |
| PbCrO4 | lead chromate | |
| PbF2 | lead fluoride | 7783-46-2 |
| Pb(IO3)2 | lead iodate | |
| PbI2 | lead(II) iodide | 10101-63-0 |
| Pb(NO3)2 | lead(II) nitrate lead dinitrate plumbous nitrate | |
| Pb(N3)2 | lead azide | |
| PbO | lead(II) oxide litharge | 1317-36-8 |
| Pb(OH)2 | plumbous hydroxide | |
| Pb(OH)4 | plumbic hydroxide plumbic acid | |
| Pb(OH)62− | plumbate ion | |
| PbO2 | lead(IV) oxide lead dioxide | 1309-60-0 |
| PbS | сульфид свинца галенит | 1314-87-0 |
| PbSO4 | сульфат свинца(II) | 7446-14-2 |
| Pb3(SbO4)2 | lead antimonate | |
| PtBr2 | platinum(II) bromide | |
| PtBr4 | platinum(IV) bromide | |
| PtCl2 | platinum(II) chloride | |
| PtCl4 | platinum(IV) chloride | |
| PtI2 | platinum(II) iodide | |
| PtI4 | platinum(IV) iodide | |
| [Pt(NH2CH2CH2NH2)3]Br4 | tris(ethylenediamine)platinum(IV) bromide | |
| [Pt(NH3)2(H2O)2Cl2]Br2 | diamminediaquadichloroplatinum(VI) bromide | |
| PtO2 | platinum(IV) oxide | 50417-46-4 |
| PtS2 | platinum(IV) sulfide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| RbAl(SO4)2·12H2O | rubidium aluminum sulfate — dodecahydrate | |
| RbBr | rubidium bromide | 7789-39-1 |
| RbC2H3O2 | rubidium acetate | |
| RbCl | rubidium chloride | 7791-11-9 |
| RbClO4 | rubidium perchlorate | |
| RbF | rubidium fluoride | 13446-74-7 |
| RbNO3 | rubidium nitrate | 13126-12-0 |
| RbO2 | rubidium superoxide | |
| Rb2C2O4 | rubidium oxalate | |
| Rb2CrO4 | rubidium chromate | |
| Rb2PO4 | rubidium orthophosphate | |
| Rb2SeO3 | rubidium selenite | |
| Rb2SeO4 | rubidium selenate | |
| Rb3C6H5O7·H2O | rubidium citrate — monohydrate | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| SCN− | thiocyanate | |
| SF4 | sulfur tetrafluoride | |
| SF6 | sulfur hexafluoride | 2551-62-4 |
| SOF2 | thionyl difluoride | 7783-42-8 |
| SO2 | sulfur dioxide | 7446-09-5 |
| SO2Cl2 | sulfuryl chloride | 7791-25-5 |
| SO2F2 | sulfuryl difluoride | 2699-79-8 |
| SO2OOH− | peroxymonosulfurous acid (aqueous) | |
| SO3 | sulfur trioxide | 7446-11-9 |
| SO32− | sulfite ion | |
| SO42− | sulfate ion | |
| S2Br2 | sulfur(II) bromide | 71677-14-0 |
| S2O32− | thiosulfate ion | |
| S2O72− | disulfate ion | |
| SbBr3 | antimony(III) bromide | 7789-61-9 |
| SbCl3 | antimony(III) chloride | 10025-91-9 |
| SbCl5 | antimony(V) chloride | 7647-18-9 |
| SbI3 | antimony(III) iodide | 7790-44-5 |
| SbPO4 | antimony(III) phosphate | |
| Sb2OS2 | antimony oxysulfide kermesite | |
| Sb2O3 | antimony(III) oxide | 1309-64-4 |
| Sb2O5 | antimony(V) oxide | |
| Sb2S3 | antimony(III) sulfide | 1345-04-6 |
| Sb2Se3 | antimony(III) selenide | 1315-05-5 |
| Sb2Se5 | antimony(V) selenide | |
| Sb2Te3 | antimony(III) telluride | |
| Sc2O3 | scandium oxide scandia | |
| SeBr4 | selenium(IV) bromide | |
| SeCl | selenium(I) chloride | |
| SeCl4 | selenium(IV) chloride | 10026-03-6 |
| SeOCl2 | selenium(IV) oxychloride | 7791-23-3 |
| SeOF2 | selenyl difluoride | |
| SeO2 | selenium(IV) oxide | 7446-08-4 |
| SeO42− | selenate ion | |
| SeTe | selenium(IV) telluride | 12067-42-4 |
| SiBr4 | silicon(IV) bromide | 7789-66-4 |
| SiC | карбид кремния | 409-21-2 |
| SiCl4 | silicon(IV) chloride | 10026-04-7 |
| SiH4 | силан | 7803-62-5 |
| SiI4 | silicon(IV) iodide | 13465-84-4 |
| SiO2 | диоксид кремния silica кварц | 7631-86-9 |
| SiO44− | silicate ion | |
| Si2O76− | disilicate ion | |
| Si3N4 | silicon nitride | 12033-89-5 |
| Si6O1812− | cyclosilicate ion | |
| SnBrCl3 | tin(IV) bromotrichloride | |
| SnBr2 | tin(II) bromide | 10031-24-0 |
| SnBr2Cl2 | tin(IV) dibromodichloride | |
| SnBr3Cl | tin(IV) tribromochloride | 14779-73-8 |
| SnBr4 | tin(IV) bromide | 7789-67-5 |
| SnCl2 | tin(II) chloride | 7772-99-8 |
| SnCl2I2 | tin(IV) dichlorodiiodide | |
| SnCl4 | tin(IV) chloride | 7646-78-8 |
| Sn(CrO4)2 | tin(IV) chromate | |
| SnI4 | tin(IV) iodide | 7790-47-8 |
| SnO2 | tin(IV) oxide | 18282-10-5 |
| SnO32− | stannate ion | |
| SnS | tin(II) sulfide | 1314-95-0 |
| SnS2 | tin(IV) sulfide | |
| Sn(SO4)2·2H2O | tin(IV) sulfate — dihydrate | |
| SnSe | tin(II) selenide | 1315-06-6 |
| SnSe2 | tin(IV) selenide | |
| SnTe | tin(II) telluride | 12040-02-7 |
| SnTe4 | tin(IV) telluride | |
| Sn(VO3)2 | tin(II) metavanadate | |
| Sn3Sb4 | tin(IV) antimonide | |
| SrBr2 | strontium bromide | 10476-81-0 |
| SrBr2·6H2O | strontium bromide — hexahydrate | |
| SrCO3 | strontium carbonate | |
| SrC2O4 | strontium oxalate | |
| SrF2 | strontium fluoride | 7783-48-4 |
| SrI2 | strontium iodide | 10476-86-5 |
| SrI2·6H2O | strontium iodide — hexahydrate | |
| Sr(MnO4)2 | strontium permanganate | |
| SrMoO4 | strontium orthomolybdate | 13470-04-7 |
| Sr(NbO3)2 | strontium metaniobate | |
| SrO | strontium oxide | 1314-11-0 |
| SrSeO3 | strontium selenite | |
| SrSeO4 | strontium selenate | |
| SrTeO3 | strontium tellurite | |
| SrTeO4 | strontium tellurate | |
| SrTiO3 | титанат стронция | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| T2O | оксид трития tritiated water | 14940-65-9 |
| TaBr3 | бромид тантала (III) | |
| TaBr5 | бромид тантала (V) | |
| TaCl5 | Хлорид тантала(V) | 7721-01-9 |
| TaI5 | Иодид тантана(V) | |
| TaO3− | tantalate ion | |
| TcO4− | pertechnetate ion | |
| TeBr2 | tellurium(II) bromide | |
| TeBr4 | tellurium(IV) bromide | |
| TeCl2 | tellurium(II) chloride | |
| TeCl4 | tellurium(IV) chloride | 10026-07-0 |
| TeI2 | tellurium(II) iodide | |
| TeI4 | tellurium(IV) iodide | |
| TeO2 | tellurium(IV) oxide | 7446-07-3 |
| TeO4− | tellurate ion | |
| TeY | yttrium telluride | 12187-04-1 |
| Th(CO3)2 | thorium carbonate | 19024-62-5 |
| Th(NO3)4 | thorium nitrate | 13823-29-5 |
| TiBr4 | titanium(IV) bromide | 7789-68-6 |
| TiCl2I2 | titanium(IV) dichlorodiiodide | |
| TiCl3I | titanium(IV) trichloroiodide | |
| TiCl4 | titanium tetrachloride | 7550-45-0 |
| TiO2 | оксид титана (IV) рутил | 1317-70-0 |
| TiO32− | titanate ion | |
| TlBr | thallium(I) bromide | 7789-40-4 |
| TlBr3 | thallium(III) bromide | |
| Tl(CHO2) | thallium(I) formate | |
| TlC2H3O2 | thallium(I) acetate | 563-68-8 |
| Tl(C3H3O4) | thallium(I) malonate | |
| TlCl | thallium(I) chloride | 7791-12-0 |
| TlCl3 | thallium(III) chloride | |
| TlF | thallium(I) fluoride | 7789-27-7 |
| TlI | thallium(I) iodide | 7790-30-9 |
| TlIO3 | thallium(I) iodate | |
| TlI3 | thallium(III) iodide | |
| TiI4 | titanium(IV) iodide | 7720-83-4 |
| TiO(NO3)2 · xH2O | titanium(IV) oxynitrate — hydrate | |
| TlNO3 | thallium(I) nitrate | 10102-45-1 |
| TlOH | thallium(I) hydroxide | |
| TlPF6 | thallium(I) hexafluorophosphate | 60969-19-9 |
| TlSCN | thallium thiocyanate | |
| Tl2MoO4 | thallium(I) orthomolybdate | |
| Tl2SeO3 | thallium(I) selenite | |
| Tl2TeO3 | thallium(I) tellurite | |
| Tl2WO4 | thallium(I) orthotungstate | |
| Tl3As | thallium(I) arsenide | |
| Химическая формула | Название соединения | Номер по классификатору CAS |
| Zn(AlO2)2 | алюминат цинка | |
| Zn(AsO2)2 | арсенит цинка | 10326-24-6 |
| ZnBr2 | бромид цинка | 7699-45-8 |
| Zn(CN)2 | цианид цинка | 557-21-1 |
| ZnCO3 | карбонат цинка | 3486-35-9 |
| Zn(C8H15O2)2 | каприлат цинка | 557-09-5 |
| Zn(ClO3)2 | хлорат цинка | 10361-95-2 |
| ZnCl2 | хлорид цинка | 7646-85-7 |
| ZnCr2O4 | хромит цинка | 12018-19-8 |
| ZnF2 | фторид цинка | 7783-49-5 |
| Zn(IO3)2 | иодат цинка | 7790-37-6 |
| ZnI2 | иодид цинка | 10139-47-6 |
| ZnMoO4 | ортомолибдат цинка | |
| Zn(NO2)2 | нитрит цинка | 10102-02-0 |
| Zn(NO3)2 | нитрат цинка | 7779-88-6 |
| Zn(NbO3)2 | метаниобат цинка | |
| ZnO | оксид цинка | 1314-13-2 |
| ZnO2 | пероксид цинка | 1314-22-3 |
| Zn(OH)2 | гидроксид цинка | 20427-58-1 |
| Zn(OH)42− | zincate ion | |
| ZnS | сульфид цинка сфалерит | 1314-98-3 |
| Zn(SCN)2 | тиоцианат цинка | 557-42-6 |
| ZnSO4 | сульфат цинка | 7733-02-0 |
| ZnSb | антимонид цинка | 12039-35-9 |
| ZnSe | селенид цинка | 1315-09-9 |
| ZnSeO3 | селенит цинка | |
| ZnSnO3 | станнат цинка | |
| Zn(TaO3)2 | метатанталат цинка | |
| ZnTe | теллурид цинка | 1315-11-3 |
| ZnTeO3 | теллурит цинка | |
| ZnTeO4 | теллурат цинка | |
| ZnTiO3 | метатитанат цинка | |
| Zn(VO3)2 | метаванадат цинка | |
| ZnWO4 | zinc orthotungstate | |
| ZnZrO3 | метацирконат цинка | |
| Zn2P2O7 | пирофосфат цинка | 7446-26-6 |
| Zn2SiO4 | ортосиликат цинка | 13597-65-4 |
| Zn3(AsO4)2 | арсенат цинка | 13464-44-3 |
| Zn3As2 | арсенид цинка | |
| Zn3N2 | нитрид цинка | 1313-49-1 |
| Zn3P2 | фосфид цинка | 1314-84-7 |
| Zn3(PO4)2 | фосфат цинка | 7779-90-0 |
| Zn3Sb2 | антимонид цинка | |
| ZrB2 | борид циркония | 12045-64-6 |
| ZrBr4 | бромид циркония | 13777-25-8 |
| ZrC | карбид циркония | 12020-14-3 |
| ZrCl4 | тетрахлорид циркония | 10026-11-6 |
| ZrF4 | фторид циркония | 7783-64-4 |
| ZrI4 | иодид циркония | 13986-26-0 |
| ZrN | нитрид циркония | 25658-42-8 |
| Zr(OH)4 | гидроксид циркония | 14475-63-9 |
| ZrO2 | диоксид циркония бадделеит | 1314-23-4 |
| ZrO32− | цирконат-ион | |
| ZrP2 | фосфид циркония | 12037-80-8 |
| ZrS2 | сульфид циркония | 12039-15-5 |
| ZrSi2 | силицид циркония (ди)силицид циркония[1] | 12039-90-6 |
| ZrSiO4 | ортосиликат циркония циркон | 10101-52-7 |
| Zr3(PO4)4 | фосфат циркония |
dic.academic.ru
Ответы@Mail.Ru: C2h5O-это что за вещество?
Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов. Это один из наиболее важных альдегидов, широко встречающийся в природе и производящийся в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями, как результат их метаболизма. Также производится окислением этанола, и большинство людей считают его причиной похмелья.
полимер уксусного алдегида или Этиленоксид
спирт) а если добавить Н2 то получится водка)
просто уксусный альдегид Ch4COH
touch.otvet.mail.ru
ЭТАН, C2H6 — это… Что такое ЭТАН, C2H6?
Этан — ЭТАН, C2H6, углеводород, бесцветный горючий газ, tкип 88,6°C. Содержится в нефтяных и природных газах. Сырье в промышленном органическом синтезе. … Иллюстрированный энциклопедический словарь
Этан — Этан … Википедия
Этан — углеводород предельного ряда С2Н6; встречается в природе, ввыделениях из почвы нефтеносных местностей. Искусственно получен впервый раз Кольбе и Франкландом в 1848 г. при действии металлическогокалия на пропионнитрил, ими же в следующем 1849 году … Энциклопедия Брокгауза и Ефрона
Этан — углеводород предельного ряда С2h5; встречается в природе, в выделениях из почвы нефтеносных местностей. Искусственно получен в первый раз Кольбе и Франкландом в 1848 г. при действии металлического калия на пропионнитрил, ими же в следующем 1849… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
этан — Яктырткыч газга һәм нефть газына катнашкан янучан төссез газ; углеводород; C2H6 … Татар теленең аңлатмалы сүзлеге
Гомологические ряды — (от греч. homólogos соответственный, подобный) группы родственных (с одинаковыми химическими функциями и однотипной структурой) органических соединений, различающихся на одну или несколько метиленовых групп СН2 . Группа СН2 называется… … Большая советская энциклопедия
Добыча газа — Содержание 1 Химический состав 2 Физические свойства 3 Месторождения природного газа … Википедия
Природные газы — Содержание 1 Химический состав 2 Физические свойства 3 Месторождения природного газа … Википедия
Энергоносители — (Energy) Понятие энергоносителей, виды энергоносителей Понятие энергоносителей, виды энергоносителей, альтернативные энергоносители Содержание Содержание Природний газ Торф Ядерное томливо против черного золота Альтернативные Топливные брикеты… … Энциклопедия инвестора
Углерод — (латинское Carboneum) С, химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Известны два стабильных изотопа: 12C (98,892%) и 13C (1,108%). Из радиоактивных изотопов наиболее важен 14C с… … Большая советская энциклопедия
dic.academic.ru
Что такое B2B, B2C, C2C? – ДеньгоДел.com
В мировой экономике и бизнесе существует взаимодействие между их субъектами. В бизнесе присходит взаимодействие производителя или продавца товаров или услуг и его клиентов. Есть другие модели.
B2B

От англ. «business to business». Бизнес для бизнеса. Эта бизнес-модель – форма взаимодействия двух организаций. Не работает на потребителей. Одна организация создаёт, продает, сдает в аренду или лизинг материальные объекты другой организации. Вторая — продаёт, перерабатывает с помощью первой компании. Но главная цель этого — получения прибыли.
Примеры:
1) производство барно-ресторанного оборудования. Организации производства оборудования продают его другим компаниям, а не конечным покупателям. Нужна ли барная стойка дома? А вот ресторану, кафе или бару без неё не извлечь прибыль. Любые производства оборудования для другого бизнеса – часть B2B рынка;
2) рекламные агентства. Фирмам и организациям нужна реклама. Рекламные агентства выполняют услуги другим компаниям, помогающие в построении предпринимательской деятельности. Рекламные агентства работают на те компании, которые они рекламируют (их товары, проекты) и не работают на конечных потребителях продукта, то есть рекламы.
3) консалтинговые компании. Консалтинг – консультации в финансовой, экономической, юридической сферах для других компаний. Они же являются клиентами. У консалтинговых компаний нет прямой взаимосвязи с потребителями услуг своих клиентов, поэтому они и относятся к B2B бизнесу.
Крупные и известные компании в сфере B2B: IBM, Oracle, Intel, General Electric, Роснефть.
B2C
От англ. «business to consumer». Бизнес для потребителя. Основа такой формы – взаимоотношения между организацией и частными лицами. B2C продают товары или услуги, которые предназначаются непосредственно для потребителей, использующие их в своих личных целях.
Примеры:
1) Интернет-магазин выставляет на продажу товары, которые приобретаются частными покупателями для личных нужд. Если речь идет об интернет-магазинах, например, того же ресторанного оборудования, о котором упоминалось выше, то такой бизнес не будет относиться к B2C. А интернет-магазин для дома или одежды – яркий пример B2C;
2) юридические компании. Фирмы, предоставляющие юридические услуги частным клиентам, относятся к B2C бизнесу. Это могут быть нотариальные услуги, оформление сделок, составление договоров. Но только в том случае, когда конечным потребителем является частное лицо и используются эти услуги в личных целях — например, человек, захотевший оформить завещание. Есть юридические компании, работающие и в секторе B2B, например, юридическое сопровождение бизнеса.
Крупные и известные компании в сфере B2C: Dell, Ikea, Inditex, Wal-Mart, Starbucks.

C2C
От англ. «consumer-to-consumer». Потребитель для потребителя. Обозначает схему электронной торговли конечного потребителя с конечным потребителем.
В этом процессе участвует третья сторона – торговая площадка, на которой происходит эта продажа.
Примеры:
1) веб-порталы с объявлениями о купле-продаже. Сам портал является той самой третьей стороной, которая обеспечивает условия для осуществления взаимодействия.
2) интернет-аукционы. Аукцион – это торговая площадка, где частные лица – потребители – покупают или продают различные вещи. К сфере C2C будет относиться именно взаимодействие продавцов и покупателей;
3) печатные газеты с объявлениями.
Крупные и известные площадки: Ebay, Craigslist, Gumtree, Avito.
dengodel.com
Этиловый спирт — Циклопедия
| Этиловый спирт | |
| Общие | |
|---|---|
| Систематическое наименование | Этанол |
| Традиционные названия | Этиловый спирт |
| Химическая формула | С2H5OH |
| Рац. формула | СH3СH2OH |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 46,069 г/моль |
| Плотность | 0,7893 г/см³ |
| Поверхностное натяжение | 22,39 · 10−3 Н/м при 20 °C Н/м |
| Термические свойства | |
| Т. плав. | −114,3 °C |
| Т. кип. | +78,4 °C |
| Т. всп. | 13 °C |
| Т. свспл. | +363 °C |
| Пр. взрв. | 3,28 — 18,95 % |
| Тройная точка | −114,3 °C, ? Па |
| Кр. точка | +241 °C, 63 бар |
| Мол. теплоёмк. | 112,4 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Химические свойства | |
| pKa | 15,9 |
| Растворимость в воде | неограничена |
| Оптические свойства | |
| Показатель преломления | 1,3611 |
| Структура | |
| Дипольный момент | (газ) 1,69 Д |
| Классификация | |
| Рег. номер CAS | 64-17-5 |
| Рег. номер PubChem | 702 |
| SMILES | CCO |
| Безопасность | |
| ЛД50 | 10 300 мг/кг |
| Токсичность | метаболит, малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Этиловый спирт (этанол, метилкарбинол, винный спирт) — одноатомный алифатический спирт, бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом. Относится к сильнодействующим наркотикам, вызывающим сначала возбуждение, а затем паралич нервной системы. Имеет формулу CH3CH2OH (упрощённо: С2Н5ОН)[1].
Этиловый спирт получают сбраживанием пищевого сырья. С 1930−1950-х гг. были разработаны способы получения синтетического спирта гидратацией этилена и гидрированием ацетальдегида. Гидратация этилена стала основным способом производства этилового спирта в 1970-е гг.[2]
Этиловый спирт прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, имеет наркотический эффект: вызывает опьянение, а при многократном употреблении вызывает алкоголизм. Также вредно воздействует на зародыш ребенка.
[править] Физические свойства
Этиловый спирт — горючая прозрачная жидкость. Температура плавления = — 114.15 °С, температура кипения = 78,39 °С, плотность 0,7893 г/см³. [2] Молярная масса = 46,069.[3]
[править] Химические свойства
Этанол смешивается во всех соотношениях с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином; образует азеотропные смеси с водой; бензолом; гексаном; толуолом; этилацетатом, а также тройные азеотропные смеси.
Этиловый спирт реагирует с щелочными металлами и с магнием с образованием этилатов и водорода.
Например при реакции с натрием Na образуется этилат натрия:
2C2H5OH + 2Na → 2C2H5ONa + Н2↑
Аналогично идёт реакция с калием K:
2C2H5OH + 2К → 2С2Н5ОК + Н2↑
Этанол вступает в реакцию гидрогалогенирования в присутствии хлорида цинка:
CH3CH2OH + HCl → CH3CH2Cl + H2O
При поджигании на воздухе этиловый спирт горит бледно-голубым, синеватым пламенем:
C2H5OH + 3O2 → 2CO2↑ + 3H2O
При нагревании в колбе с холодильником этанола с галогеноводородной кислотой, например с HBr (или смесью NаHBr и H2SO4, дающей при реакции бромистый водород), то будет отгоняться маслянистая жидкость — бромистый этил C2H5Вг:
C2H5OH + HBr → C2H5HBr + H2O
При нагревании с серной кислотой (при температуре меньше 120 °C), этиловый спирт превращается в диэтиловый эфир (реакция дегидратации):
2C2H5OH → C2H5-O-C2H5 + H2O
Вступает в реакцию дегидратации в присутствии серной кислоты при температуре больше 120 °C с образованием непредельного углеводорода:
CH3CH2OH → CH2CH2 + H2O
Этиловый спирт реагируя с карбоновыми кислотами в присутствии серной кислоты при нагревании приводит к реакции этерификации, например в реакции с уксусной кислотой образуется уксусно-этиловый эфир:
СН3СООН + С2Н5ОН → СН3СООC2H5 + H2O
Этанол получают в основном двумя способами: микробиологическим (спиртовое брожение) и синтетический (гидратация этилена):
Спиртовое брожение представляет собой биохимический процесс превращения сахара в спирт с выделением углекислого газа под воздействием дрожжей вида Saccharomyces cerevisiae и др., по формуле:
C6H12O6 → 2C2H5OH + 2CO2 + 27 ккал
Данный метод в основном применяется в пищевой промышленности, не только для производства этилового спирта, но и например при производстве хлебобулочных изделий, при этом дрожжи, выделяемый углекислый газ разрыхляет и поднимает тесто.
В химической промышленности, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
Первый вариант — прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2=CH2 + H2O → C2H5OH
Второй вариант — гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа:
CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH (этилсерная кислота)
CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4
Реакция осложняется образованием диэтилового эфира.
[править] Практическое значение
Этиловый спирт широко применяется в промышленности.
Этиловый спирт идёт на изготовление спиртных напитков.
Этанол является растворителем в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, взрывчатых веществ и пр.
Этот спирт служит сырьём для производств диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этиламина, этилакрилатов, этилсиликатов и пр. Этиловый спирт — компонент антифриза, топливо для реактивных двигателей.
Для технических целей часто используют денатурированный спирт (денатурат) — спирт-сырец, содержащий добавки красителя, окрашивающего этиловый спирт в сине-фиолетовый цвет, и специфических веществ, придающих ему неприятный запах и вкус. Денатурат ядовит.
В медицине этиловый спирт применяется для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов.
Мозг и алкоголь — Вячеслав Дубынин // ПостНаука [15:27]Этанол чрезвычайно гигроскопичен, при концентрации выше 70% (по объему) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении вызывает алкоголизм.
ПДК в атмосфере воздухе 5 мг/м³, в воздухе рабочей зоны 1000 мг/м³.
Помимо признанного ВОЗ и ГОСТ наркотического действия, этиловый спирт обладает тератогенным действием (отрицательно воздействует на зародыш, см. в частности Зависимость числа дебилов от потребления алкоголя), его употребление многократно повышает риски преступности и психиатрических проблем, а также является одной из ведущих причин смертности в России (в частности, вследствие убийств, самоубийств и ведущих причин смертности — атеросклеротического кардиосклероза и нарушения мозгового кровообращения).
cyclowiki.org
Что такое Алкоголь или спирт, C 2H6 O, или C 2H5 OH
Значение слова Алкоголь или спирт, C 2H6 O, или C 2H5 OH по словарю Брокгауза и Ефрона:
Алкоголь или спирт, C 2H6 O, или C 2H5 OH (этильный, или винный, алкоголь, метилкарбинол). — Обыкновенный, или абсолютный (т. е. безводный), спирт представляет бесцветную, удобоподвижную, легко воспламеняющуюся жидкость, жгучую на вкус, более легкую, чем вода, с удельным весом 0,7947 при 15° Цельсия. При обыкновенном барометрическом давлении в 760 миллим. алкоголь кипит при 78,5° Ц. и при —1 00° еще не затвердевает. Благодаря этому свойству алкоголь употребляется для наполнения термометров, предназначенных для измерения весьма низких температур. Тогда как ртуть замерзает уже при —4 0°, алкоголь лишь при очень низких температурах (—1 29°) делается густым, как масло, и наконец затвердевает только при —1 30,5°. А. составляет существенное опьяняющее начало всех спиртных напитков и образуется обыкновенно при брожении (см. это сл.) сахаристых веществ, при чем сахар не в очень концентрированных растворах расщепляется под влиянием дрожжей на спирт, углекислоту и некоторые другие продукты брожения (некоторые гомологи спирта — глицерин, янтарн. кисл. и др.). Этильный спирт можно получать, как показал Бертело, из веществ неорганического происхождения, а именно при взбалтывании с английской серной кислотой этилена, или маслородного газа, получающегося искусственно, а также и при сухой перегонке каменного угля. При продолжительном взбалтывании значительное количество этиленного газа растворяется в серной кислоте и переходит в этилсерную кислоту, которая при нагревании с водой распадается на алкоголь и серную кислоту. Этот лабораторный способ образования алкоголя не нашел себе практического применения, так как получение его из сахара значительно удобнее и выгоднее с экономической стороны. Спирт часто получается из частей растений, не содержащих сахара, а лишь крахмал, как, например, из картофельных клубней или муки спелых семян хлебных растений (ржи, пшеницы, риса, маиса). При этом сначала должно посредством особого процесса перевести крахмал в сахар. Это достигается при действии особого вещества, диастаза, заключающегося в растениях в небольшом количестве. о присутствии сахара в измененных таким образом растительных частях, напр. в солоде и сусле, можно судить по сладкому их вкусу. Прибавляя воды к этим содержащим сахар смесям, если только они уже не содержат ее в достаточном количестве, как, напр., выжатый виноградный сок, и оставляя их бродить, получают сильно разбавленный водою алкоголь в смеси с различными другими веществами. Такая содержащая алкоголь жидкость, полученная при брожении виноградного сока, называется вином. пиво получается тем же путем из ячменного солода, затертого с водой. Эти напитки, однако, содержат сравнительно мало алкоголя: самые крепкие вина южных стран, только не разбавленные алкоголем, что нередко практикуется при их приготовлении, никогда не заключают более 14 %, а самое крепкое пиво — более 6 % алкоголя. Для получения более богатых алкоголем напитков нужно, как это делается при приготовлении водки, подвергать перегонке спиртовые жидкости, полученные посредством брожения. Таким образом получается более крепкий, 80 —9 0-процентный алкоголь, так называемый спирт (spiritus vini rectificatus), a разбавляя его водой до 40 —5 0 процентов, приготовляют обыкновенную водку. Водку гонят не только из перебродивших заторов картофеля или хлебных зерен, но также из вина и получают таким образом французскую водку и коньяк. Подобным же путем на Антильских островах и в Ост-Индии получают ром из перебродившего сока сахарного тростника, а также из патоки и прочих сахарных отбросов. из перебродившего риса и сахаристого сока кокосовой и финиковой пальмы гонят арак. Одной только перегонкой невозможно вполне обезводить алкоголь, хотя он значительно летучее воды, — так как он увлекает при этом с собой значительное количество водяных паров. При первой перегонке получают в особо устроенных аппаратах почти 80-градусный спирт, нечистый алкоголь. При дальнейшей дистилляции этой жидкости получают в первых порциях 90-процентный алкоголь — spiritus vini rectificatissimus. Перегонкой в настоящее время можно получить алкоголь крепости от 98 до 99 %. Если хотят еще более обезводить спирт и получить абсолютный, т. е. не содержащий воды, алкоголь, то нужно к нему прибавить какое-либо вещество, имеющее большее сродство к воде, чем сам алкоголь. Для этой цели на заводах спирт перегоняют несколько раз под хлористым кальцием, в меньших же количествах, лабораторным путем, удобнее обезвоживать спирт негашеной известью или безводным медным купоросом. Сродство воды к алкоголю очень значительно. Он отнимает воду не только от некоторых солей, но поглощает ее из воздуха, из растительных и животных тканей. От этого зависит стягивающий вкус чистого алкоголя и его вредное действие при приемах в большом количестве. Земмеринг нашел, что алкоголь отнимает воду от животного пузыря и при этом его настолько высушивает, что уже более не смачивает его стенок. Земмеринг основал на этом способ обезвоживать алкоголь. для этого наливают 50-процентную водку в бычачий пузырь, крепко завязывают его и вешают у теплой печи. Вода проникает через пузырь и испаряется на его поверхности, тогда как спирт сгущается до 97 процентов. При этом значительное количество алкоголя теряется, так как он проникает через поры незаполненной верхней части пузыря. При смешении воды с алкоголем происходит разогревание, и объем смеси делается меньше в сравнении с суммой объемов воды и алкоголя до смешения. Максимум сжатия соответствует почти гидрату C 6H6O + 3H2 O, причем 49,836 объемов воды и 53,939 объемов алкоголя при 0° дают 100 объемов смеси вместо 103,775. Классическое исследование по этому вопросу представляет докторская диссертация проф. Д. И. Менделеева «О соединении спирта с водою», 1865 г. — С эфиром, многими кислотами, летучими маслами и т. д. алкоголь смешивается во всех пропорциях. он растворяет жиры, почти все алкалоиды, смолы, красящие вещества, йод, бром, небольшие количества серы и фосфора, многие соли и поглощает многие газы в более значительном количестве, нежели вода. При действии окисляющих веществ алкоголь переходит в альдегид и уксусную кислоту. С особыми азотистыми органическими веществами (ферментами) слабый спирт дает в соприкосновении с воздухом уксусную кислоту. На этом основано скисание спиртных напитков и приготовление уксуса. Алкоголь имеет весьма обширное применение. на первом месте, конечно, должно поставить потребление его в виде спиртных напитков. В разведенном состоянии в виде вина, пива и водки малые дозы алкоголя производят благотворное возбуждение нервной системы, переходящее в опьянение при более значительных приемах. Продолжительное и чрезмерное употребление алкоголя даже в разведенном состоянии в виде водки ведет к разрушению организма (см. Алкоголизм). Применение алкоголя для технических целей чрезвычайно разнообразно. Так, напр., благодаря своей водоотнимающей способности он употребляется для сохранения легко изменяющихся веществ, а благодаря своей способности растворять множество веществ алкоголь идет на приготовление различных лаков, а в парфюмерии — для получения эссенций и т. п. Химик и фармацевт употребляют его для приготовления множества препаратов (эфира, хлороформа, хлораля, некоторых каменноугольных красок), растворов и тинктур. Далее, он является горючим материалом, преимущественно в лампах, предназначенных давать сильный жар. Для освещения алкоголь сам по себе не употребляется, так как он горит голубоватым, едва светящим и не коптящим пламенем. для этой цели его смешивают с терпентинным маслом (камфином). Наконец, благодаря своей легкой окисляемости в разведенном состоянии алкоголь употребляется для приготовления уксуса. Относительно фабричного способа получения алкоголя см. Спирт.

xn—-7sbbh7akdldfh0ai3n.xn--p1ai