Оксид хлора(VII) — это… Что такое Оксид хлора(VII)?
У этого термина существуют и другие значения, см. Оксид хлора.
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид.
Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0,1709 нм, в группах ClО3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C2, молекула полярна (μ = 2,40·10−30 Кл·м).
Свойства
Хлорный ангидрид представляет собой бесцветную маслянистую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:
- ΔH = 135 кДж/моль
Медленно растворяется в холодной воде, образуя хлорную кислоту:
Хлорный ангидрид является сильным окислителем.
Получение
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
dic.academic.ru
Оксид хлора(VII) — Википедия. Что такое Оксид хлора(VII)
Материал из Википедии — свободной энциклопедии
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7,
(хлорный ангидрид) — кислотный оксид. Высший оксид хлора, в котором он проявляет степень окисления +7.
Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0,1709 нм, в группах ClО3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C2, молекула полярна (μ = 2,40·10−30 Кл·м).
Свойства
Хлорный ангидрид представляет собой бесцветную маслянистую ядовитую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:
- 2Cl2O7→2Cl2+7O2{\displaystyle {\mathsf {2Cl_{2}O_{7}\rightarrow 2Cl_{2}+7O_{2}}}} ΔH = 135 кДж/моль
Медленно растворяется в холодной воде, образуя хлорную кислоту:
- Cl2O7+h3O→2HClO4{\displaystyle {\mathsf {Cl_{2}O_{7}+H_{2}O\rightarrow 2HClO_{4}}}}
Хлорный ангидрид является сильным окислителем.
Получение
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
- 2HClO4+P2O5→Cl2O7+2HPO3{\displaystyle {\mathsf {2HClO_{4}+P_{2}O_{5}\rightarrow Cl_{2}O_{7}+2HPO_{3}}}}
Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
wiki.sc
Как получить оксиды хлора 🚩 формула оксида хлора 🚩 Естественные науки
Хлор образует с кислородом целый ряд оксидов, общее число которых составляет целых пять видов. Все их можно описать общей формулой ClxOy. В них валентность хлора меняется от 1 до 7.Валентность разных оксидов хлора различна: Cl2O — 1, Cl2O3 — 3, ClO2 — 4, Cl2O6 — 6, Cl2O7 — 7.
Оксид хлора(I) применяют для производства гипохлоритов, которые являются сильными отбеливающими и обеззараживающими агентами.
Оксид хлора(II) активно применяют для отбеливания муки, целлюлозы, бумаги и других вещей, а также для стерилизации и дезинфекции.
Оксид хлора(VI) и оксид хлора(VII) применяют для синтеза органических соединений.
Данный оксид на крупнотоннажных производствах получают двумя способами.
1. По методу Пелуза. Проводят реакцию между газообразным хлором и оксидом ртути. В зависимости от условий может образоваться иное соединение ртути, однако целевой продукт остается. После этого газообразный оксид хлора сжижают при температуре -60 градусов Цельсия.
Уравнения реакции, описывающие метод Пелуза:
2HgO + Cl2 = Hg2OCl2 + Cl2O
HgO + 2Cl2 = HgCl2 + Cl2O
2. Взаимодействие хлора с водным раствором карбоната натрия по реакции:
2Cl2 + 2Na2CO3 + h3O = 2NaHCO3 + Cl2O + 2NaCl
Карбонат натрия может быть заменен другими карбонатами щелочных или щелочноземельных металлов.
Единственный промышленный метод получения диоксида хлора основан на взаимодействии хлората натрия и диоксида серы в кислой среде. Результатом такого взаимодействия становится реакция:
2NaClO3 + SO2 + h3SO4 = 2NaHSO4 + ClO2
В промышленности Cl2O6 получают взаимодействием диоксида хлора с озоном:
2ClO2 + 2O3 = 2O2 + Cl2O6
1. Осторожное нагревание хлорной кислоты с фосфорным ангидридом приводит к отделению маслянистой жидкости, которая является оксидом хлора (VII). Весь процесс описывается реакцией:
2HClO4 + P4O10 = h3P4O11 + Cl2O7
2. Второй способ получения данного оксида связан с электричеством. Если проводить электролиз раствора хлорной кислоты, то в анодном пространстве можно обнаружить Cl2O7.
3. Нагревание в вакууме перхлоратов переходных металлов приводит к образованию оксида хлора (VII). Наиболее часто нагревают перхлорат ниобия либо молибдена.
Cl2O: при стандартных условиях буровато-желтый газ с запахом хлора, а при температуре ниже +2 градусов Цельсия золотисто-красная жидкость. Взрывоопасен в больших концентрациях.
ClO2: при стандартных условиях – газ с характерным запахом красно-желтого цвета, при температуре ниже +10 градусов Цельсия – красно-коричневая жидкость. Взрывается на свету, в присутствии восстановителей и при нагревании.
Cl2O6: неустойчивый газ, который начинает разлагаться при температуре от 0 до +10 градусов Цельсия с образованием диоксида хлора, при 20 градусах Цельсия образуется хлор. Ввиду образования диоксида хлора – взрывоопасен.
Cl2O7: бесцветная маслянистая жидкость, которая при нагревании выше 120 градусов Цельсия взрывается. Может детонировать от удара.
Хлорная кислота, растворенная в воде, считается самой сильной среди одноосновных кислот. Она имеет ярко выраженные свойства окислителя и применяется в качестве катализатора.
Содержание статьи

Хлорная кислота представляет собой бесцветную жидкость, сильно дымящуюся и быстро испаряющуюся на воздухе. Хлор в ее составе имеет максимальную степень окисления, характерную для него, поэтому эта кислота является сильнейшим окислителем. Хорошо растворяется в органических растворителях: хлороформе, хлористом метилене, а также в воде (в любых соотношениях, образуя гидраты). Концентрированные водные растворы хлорной кислоты имеют маслянистую консистенцию. Ее соли называются перхлоратами.
Хлорная кислота — взрывоопасное вещество. При обращении с ней требуется повышенная осторожность (разрешается хранение только в плотно закрытых емкостях). Помещения, где содержатся емкости, должно хорошо проветриваться. Не допускаются перепады температуры. Это не касается ее водных растворов, они не так опасны. Их окислительная способность в несколько раз ниже, они не могут взорваться и обладают довольно хорошей устойчивостью. Нельзя смешивать хлорную кислоту с растворами-окислителями. Она считается одной из сильнейших кислот. Даже некоторые кислотные соединения, попадая в нее, ведут себя как основания.
В промышленности получают водный раствор хлорной кислоты, а также безводный аналог. Последний вид можно получить с помощью реакции перхлората калия или натрия с концентрированной серной кислотой. Существует и второй способ: взаимодействие олеума с разбавленной серной кислотой. Водный раствор серной кислоты также можно получить двумя путями: при электрохимическом окислении хлора в концентрированной соляной кислоте или же через обменное разложение перхлоратов калия и натрия.
Хлорная кислота используется при разложении сложных руд на составляющие, а также в качестве катализатора. Она имеется во всех химических лабораториях, так как необходима для множества опытов по аналитической химии. Эта кислота применяется как сильный окислитель. Ее нельзя долго хранить, так как она способна самопроизвольно разлагаться, что может спровоцировать мощный взрыв.
Ее используют для получения перхлоратов. Перхлорат калия, соль, практически нерастворимая в воде, применяется при изготовлении взрывчатых веществ. Перхлорат магния, известный как ангидрон, выступает в роли осушителя, так как способен поглощать жидкости.
www.kakprosto.ru
Кислоты хлора | Дистанционные уроки
29-Окт-2012 | Нет комментариев | Лолита Окольнова
Хлор — самый богатый на кислоты элемент!
5 кислот — таким рекордом может похвастаться не каждый!
Хлор — элемент 7-й группы главной подгруппы и к тому же 3-го периода.
Что это означает?
Это означает много степеней окисления! 🙂
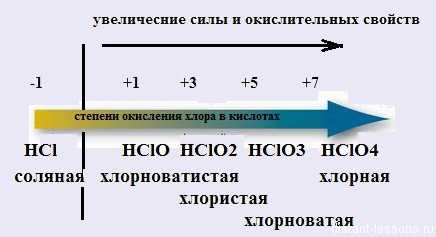
- Т.к. элемент находится в 7-й группе, то ему не хватает всего 1 электрона до завершения электронной оболочки — минимальная степень окисления хлора = -1.
- Т.к. хлор находится в 3-ем периоде, то он может распаривать электроны с p-подуровня на d-подуровень — степени окисления +1, +3, +5 и +7.
- HCl — хлороводородная или соляная кислота.
Степень окисления хлора= -1.
Сильная кислота. Едкая жидкость, дымит на воздухе. В воде практически полностью диссоциирует на ионы:HCl = H(+) + Cl(-) .
Ей присущи все свойства кислот: взаимодействие с металлами до водорода, взаимодействие с основными оксидами, с основаниями, с солями.

При взаимодействии с окислителями окисляется до Cl2:
2HCl + h3SO4 = SO2 + Cl2↑ + 2h3O
2. HClO — хлорноватистая кислота.
Степень окисления хлора = +1.
Бесцветный раствор. Это очень слабая кислота. Неустойчивая. Небольшая степень диссоциации. Ей соответствует кислотный оксид Cl2O.
Получение:
Сl2 + h3O = HCl + HClO
Cl2O + h3O = 2HClO
НО: это сильная кислота-окислитель: 2HClO + h3S = S + Cl2 + h3O
Cоли — гипохлориты.
3. HClO2 — хлористая кислота.
Степень окисления хлора = +3.
Бесцветная. Кислота средней силы. Неустойчивая. Ей соответствует кислотный оксид Cl2O3.
Проявляет окислительные свойства.
Соли — хлориты.
4. HClO3 — хлорноватая кислота.
Степень окисления хлора = +5
В свободном виде она не получена, «живет» только в растворах. Сильное вещество как просто кислота, и как кислота-окислитель. Кислотный оксид — Cl2O5.
Сильная кислота — окислитель: HClO3 + S + h3O= h3SO4 + HCl
Соли — хлораты.
5. HClO4 — хлорная кислота.
Степень окисления хлора= +7
Одна из самых сильных кислот, одна из самых сильных окислителей.
Взрывоопасна. Бесцветная, летучая, парит на воздухе.
Кислотный оксид — Cl2O7.
Соли — перхлораты.
Обратите внимание на изменение свойств кислот с изменением степени окисления:
- хлор в минимальной степени окисления дает сильную кислоту, но не окислитель;
- с увеличением степени окисления увеличивается сила кислот и окислительные свойства
Еще на эту тему:
Обсуждение: «Кислоты хлора»
(Правила комментирования)distant-lessons.ru
Оксиды хлора — Википедия. Что такое Оксиды хлора
Материал из Википедии — свободной энциклопедииОксиды хлора — неорганические химические соединения хлора и кислорода, общей формулой: ClхOу.
Хлор образует следующие оксиды: Cl2O, Cl2O2 (ClClO2), Cl2O3 (ClOClO2), ClO2 (радикал), Cl2O4 (ClOClO3), Cl2O6 (O2ClOClO3), Cl 2O7. Кроме того известны неустойчивые соединения: пероксид хлора(I) ClOOCl, ClOClO, короткоживущий радикал ClO, радикал хлорпероксил ClOO и радикал триоксид хлора ClO3.
Ниже в таблице представлены свойства устойчивых оксидов хлора:
| Свойство | Cl2O | ClO2 | ClOClO3 | Cl2O6 | Cl2O7 |
|---|---|---|---|---|---|
| Оксид хлора(I) | Диоксид хлора | Оксид хлора(VI) | Оксид хлора(VII) | ||
| Цвет и состояние при комн. температуре | Жёлто-коричневый газ | Жёлто-зелёный газ | Светло-жёлтая жидкость | Тёмно-красная жидкость | Бесцветная жидкость |
| Степень окисления хлора | (+1) | (+4) | (+3), (+5) | (+5), (+7) | (+7) |
| Тпл, °C | −120,6 | −117 | 3,5 | −91,5 | |
| Ткип, °C | 2,0 | 11 | 44,5 | 203 | 81 |
| Плотность (ж, 0°C), г·см−3 | — | 1,64 | 1,806 | — | 2,02 |
| ΔH°обр (газ, 298 К), кДж·моль−1 | 80,3 | 102,6 | ~180 | (155) | 272 |
| ΔG°обр (газ, 298 К), кДж·моль−1 | 97,9 | 120,6 | — | — | — |
| S°обр (газ, 298 К), Дж·K−1·моль−1 | 265,9 | 256,7 | 327,2 | — | — |
| Дипольный момент, Д | 0,78 ± 0,08 | 1,78 ± 0,01 | — | — | 0,72 ± 0,02 |
Литература
wiki.sc
