Тема 14. Количество вещества. Молярная масса.
Часть I
1. Единицей количества вещества является моль. Обозначается n или ню.
2. Моль — это также количество вещества, в котором содержится молекул или частиц вещества. Это число называется числом Авогадро и обозначается Nа.
3. Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его Mr или Ar.
4. Масса 1 моль вещества называется молярной массой — M. Она измеряется в г/моль и численно равна Mr вещества.
5. Количество вещества — это величина, равная отношению массы вещества к его молярной массе:
n = m/M => m = n• M.
6. Число частиц вещества равно произведению числа Авогадро на количество вещества:
N = n •Na => n = N/Na.
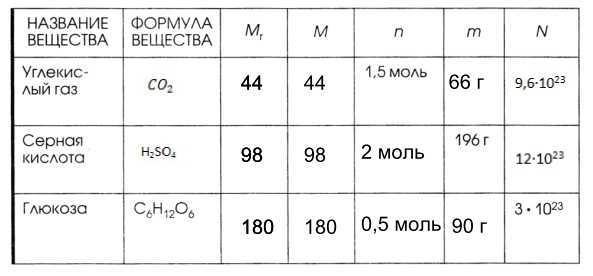
7. Дополните таблицу, делая необходимые вычисления.
Часть II
1. Впишите пропущенные числа.
1) Ar(Na)=23 => 23 г натрия содержат атомов Na.
2) Мг(02)=32 => 32 г кислорода содержат молекул 02.
3) Мг (СО) = 28 => 28 г угарного газа содержат молекул СО.
2. Установите соответствие между названием величины и её условным обозначением.
3. Впишите пропущенные названия веществ, частиц вещества, числа и единицы измерения.
1) 1 моль вещества Н2 содержит молекул.
2) молекул углекислого газа С02 составляют количество вещества, равное 0,5 моль.
3) 64 г вещества О2 составляют количество вещества, равное 2 моль.
4) 0,5 моль серной кислоты H2S04 составляют массу вещества, равную 49 г.
4. Запишите формулу, по которой можно рассчитать молярную массу вещества, если известно его количество и масса.
М = m•N
5. Запишите формулу, по которой можно рассчитать массу вещества, если известно число структурных частиц данного вещества.
m = N•M/Na
6. Какие величины можно рассчитать, если известно количество вещества?
Массу, число частиц.
7. Сколько молекул содержится в 180 г воды? Решите задачу двумя способами.
8. Придумайте условие задачи, используя величины из задания 2. Найти массу воды химическим количеством 10 моль. Решите её любым способом.
superhimik.ru
Количество вещества. Молярная масса.
Урок химии в 8-м классе. Тема: «Количество вещества. Молярная масса вещества»
Учитель МБОУ СОШ № 42 Цхурбаева Н.А.
Тип урока: Урок изучения и первичного закрепления знаний.
Цели и задачи урока:
1. Образовательные:
а) Ввести понятие о количестве вещества и единицах его измерения: моль, ммоль, кмоль.
б) Дать представление о постоянной Авогадро.
в) Показать взаимосвязь массы, количества вещества и числа частиц.
г) Научить решать задачи по химии.
д) Научить выполнять задания по образцу и переносу знаний в новую ситуацию.
2. Воспитательные:
а) Формирование познавательной потребности.
б) Формирование стремления к глубокому усвоению знаний.
в) Воспитание аккуратности в оформлении и записи задач.
3. Развивающие:
а) Развивать умения применять знания на практике.
б) Развивать логическое мышление учащихся.
в) Развивать умение анализировать условия.
г) Развивать умение работать в должном темпе, организованность.
Методы, используемые на уроке: Объяснительно-иллюстративный, репродуктивный.
Формы работы: Фронтальная, парная.
Этапы урока:
Организация начала.
Проверка домашнего задания.
Подготовка к активной учебно-познавательной деятельности.
Усвоение новых знаний.
Закрепление знаний.
Первичная проверка понимания.
Подведение итогов урока.
Информация о домашнем задании.
Ход урока
1.Организация учащихся.
2. Проверка усвоения знаний:
Как делятся все химические элементы по их положению в ПСЭ?
Какое явление называется аллотропией? Приведите примеры.
Чем отличаются по строению атомы металлов от атомов неметаллов?
3. Изучение нового материала
Учитель. Ещё с начальной школы вам известны единицы измерения массы, длины. Это всё физические величины. А что же изучает химия? Ответ: это наука о веществах
Учитель :А в чём измерять вещества? Ведь невозможно же отсчитать число молекул и атомов из-за их малого размера. Необходима величина, которая бы объединила массу и число частиц. На помощь пришли ученые и предложили брать столько граммов вещества, которое соответствует его относительной атомной или относительной молекулярной массе
Для Н2—— 2г , Мr(Н2) =2
Для СО2——44г, Мr(СО2) = 44
.
— Для подсчёта количества вещества, пользуются единицей измерения как МОЛЬ. И в 1 моль вещества содержится 6 *1023 частиц этого вещества.
МОЛЬ — ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 * 1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА. (Презентация, слайд 1.)
Записываем это определение в тетрадь.
— 6 *1023 — число постоянное и названо в честь итальянского учёного Амедео Авогадро, называется постоянная Авогадро и обозначается NA.
Чтобы найти число молекул вещества в определённом количестве вещества надо:
N = NA* n,
где N — число молекул
NA — постоянная Авогадро, молек./моль
n — количество вещества, моль
Следовательно, n = N / NA и NA = N / n (Презентация, слайд 2.)
— Показать простые и сложные вещества количеством 1 моль.
— Как вы думаете я отмеряла эти вещества? Считала количество молекул и атомов? Нет, я их просто взвешивала.
МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ, обозначается М и измеряется в г/моль. (Презентация, слайд 3.)
Записываем это определение в тетрадь.
Т.е. чтобы отмерить 1 моль вещества нужно отмерить массу, равную его Ar или Mr .
1 моль Fe весит 56г a М(Fe) = 56 г/моль
1 моль S весит 32г a M(S) = 32 г/моль
1 моль Na Cl весит 58,5г a M(NaCl) = 58,5 г/моль
1 моль CuSO4 весит 160г a M(CuSO4) = 160 г/моль (Презентация, слайд 4.)
— Если я возьму 64 г серы, сколько это будет молей? Как вы это нашли? Значит, чтобы найти количество вещества нужно его массу разделить на молярную массу:
n = m / M и, следовательно, m = n* M и M = m/n. (Презентация, слайд 5.)
5. — Теперь решим простые задачи:
Задача 1. (Презентация, слайд 6.)
Найти массу 24 * 1023 молекул озона.
Дано
Формулы
Решение
О3
m = M * n
n = 24 *1023/6 *1023 = 4 моль
N = 24 * 1023молекул
n = N/NA
M(O3) = 48 г/моль
m = ?
m = 48 *4 = 192 г
Задача 2. (Презентация, слайд 6.)
Сколько молекул содержится в 111г гидроксида кальция Ca(OH) 2?
Дано
Формула
Решение
Ca(OH)2
N = NA * n
M(Ca(OH)2) = 74 г/моль
m = 111г
n = m/M
n = 111/74 = 1,5 моль
N = ?
N = 6 *1023 *1,5 = 9 *1023молекул
— Вы знаете, что основная единица измерения массы — это грамм, величина в 1000 раз большая — килограмм, а в 1000 раз меньшая — миллиграмм. Такая же зависимость прослеживается относительно физико-химических величин и их единиц. Рассмотрим таблицу, лежащую перед вами на парте: (Презентация, слайд 7.)
Приложение 1.
Величина, её обозначение
Единицы величины
Основная
В 1000 раз большая
В 1000 раз меньшая
Масса, m
г
кг
мг
Количество вещества, n
моль
кмоль
ммоль
Молярная масса, М
г/моль
кг/кмоль
мг/ммоль
Постоянная Авогадро, NA
6 *1023 в 1 моль
6 *1026 в 1 кмоль
6 *1020 в 1 ммоль
Решим задачки устно: (Презентация, слайд 8.)
1. Сколько молекул кислорода содержится в 2 моль его? Какую массу будет иметь это количество кислорода?
2. Какую массу имеют 5 кмоль водорода? Сколько молекул водорода содержится в этом его количестве?
3. Сколько весят 3*1020 молекул воды?
6. Закрепление
1. Как обозначается количество вещества и в чём измеряется?
2. Сколько частиц содержит 1 моль любого вещества, как эта величина называется?
3. Чтобы отмерить 1 моль вещества, что надо сделать?
4. Что называется молярной массой, как обозначается, в чём измеряется, чему численно равна?
7. Подведение итогов урока, выставление оценок.
8. Домашнее задание: п.16, №2,3 — письменно (Учебник — О.С.Габриелян, Химия-8,.)
купить
1
infourok.ru
Урок 9. Молярная масса и молярный объем – HIMI4KA
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.

Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.

Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер

[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер

[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер

[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер

[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
himi4ka.ru
Количество вещества. Число Авогадро
Количество вещества и молярная масса
Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы,ионы и др.)
Единица измерения количества вещества в системе СИ 1 моль.
Число структурных единиц в 1 моле вещества называется числом Авогадро:
Молярная масса вещества, выраженная в граммах, численно равна его относительной молекулярной массе:
Количество вещества может быть рассчитано по формуле:
где число молекул в веществе массой .
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Количество вещества, моль, молярная масса и молярный объем
Разделы: Химия
Урок 1.
Тема: Количество вещества. Моль
Химия – это наука о веществах. А как измерять вещества? В каких единицах? В молекулах, из которых состоят вещества, но сделать это очень сложно. В граммах, килограммах или миллиграммах, но так измеряют массу. А что если объединить массу, которую измеряют на весах и число молекул вещества, возможно ли это?
а) H-водород
Ан= 1а.е.м.
1а.е.м = 1,66*10-24г
Возьмем 1г водорода и подсчитаем количество атомов водорода в этой массе (предложите это сделать ученикам с помощью калькулятора).
Nн= 1г / (1,66*10-24) г = 6,02*1023
б) O-кислород
Ао= 16а.е.м = 16*1.67* 10-24 г
No= 16г / (16 *1.66 * 10-24) г =6,02 * 1023
в) C-углерод
Ас= 12а.е.м = 12*1.67*10-24 г
Nc= 12г / (12* 1.66*10-24) г = 6,02*1023
Сделаем вывод: если мы возьмем такую массу вещества, которая равна атомной массе по величине, но взята в граммах, то там будет всегда (для любого вещества) 6.02 *1023 атомов этого вещества.
H2O — вода
= 18 а.е.м.
= 18г / (18* 1.66*10-24) г =6,02*1023 молекул воды и т.д.
Nа = 6,02*1023 — число или постоянная Авогадро.
Моль — количество вещества, в котором содержится 6,02 *1023 молекул, атомов или ионов, т.е. структурных единиц.
Бывает моль молекул, моль атомов, моль ионов.
, где
n – число молей,(число молей часто обозначают — ню),
N — число атомов или молекул,
Nа = постоянная Авогадро.
Кмоль = 103моль, ммоль = 10-3моль.
Показать портрет Амедео Авогадро на мультимедийной установке и кратко рассказать о нем, или поручить ученику подготовить небольшой доклад о жизни учёного.
Урок 2.
Тема « Молярная масса вещества»
Чему же равна масса 1 моля вещества? ( Вывод учащиеся часто могут сделать сами.)
Масса одного моля вещества равна его молекулярной массе, но выражена в граммах. Масса одного моля вещества называется молярной массой и обозначается – M.
Формулы:
, где
М — молярная масса,
n — число молей,
m — масса вещества.
Масса моля измеряется в г/моль, масса кмоля измеряется в кг/кмоль, масса ммоля измеряется в мг/моль.
Заполнить таблицу (таблицы раздаются).
Вещество |
Число молекул |
Молярная масса |
Число молей |
Масса вещества |
H2 |
|
|
5моль |
|
Н2SO4 |
|
|
|
980г |
FeCl2 |
12,04*1026 |
|
|
|
Урок 3.
Тема: Молярный объем газов
Решим задачу. Определите объем воды, масса которой при нормальных условиях 180 г.
Дано:
| m (H2O) = 180г | V(h3O) = = 180 мл |
(H2O) = 1 г/мл |
|
Т.е. объем жидких и твердых тел считаем через плотность.
Но, при расчёте объёма газов не обязательно знать плотность. Почему?
Итальянский ученый Авогадро определил, что в равных объемах различных газов при одинаковых условиях (давлении, температуре) содержится одинаковое число молекул — это утверждение называется законом Авогадро.
Т.е. если при равных условиях V(H2) =V(O2) , то n(H2) =n(O2), и наоборот если при равных условиях n(H2) =n(O2) то и объемы этих газов будут одинаковы. А моль вещества всегда содержит одно и тоже число молекул 6,02 *1023 .
Делаем вывод – при одинаковых условиях моли газов должны занимать один и тот же объем.
При нормальных условиях (t=0, P=101,3 кПа. или 760 мм рт. ст.) моли любых газов занимают одинаковый объем. Этот объем называется молярным.
Vm=22,4 л/моль
1кмоль занимает объём -22,4 м3/кмоль, 1ммоль занимает объем -22,4 мл/ммоль.
Пример 1. (Решается на доске):
| Дано: | Решение: |
n(H2) = 10 моль |
Пример 2. (Можно предложить решить ученикам):
| Дано: | Решение: |
m(H2)=20г |
Предложить учащимся заполнить таблицу.
Вещество |
Число молекул |
Масса вещества |
Число молей |
Молярная масса |
Объем |
CO2 |
|
264г |
|
|
|
N2 |
120,4*1023 |
|
|
|
|
Cu |
|
192г |
|
|
|
Сl2 |
|
|
|
|
112м3 |
15.01.2009
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
2.2 Относительные атомные и молекулярные массы. Количество вещества. Моль.
Еще одна важная характеристика атома, кроме заряда ядра, это масса атома. Истинная масса атома называется абсолютной атомной массой ma. Например, масса атома углерода равна 1,99∙10–26 кг, а масса атома водорода еще меньше:
ma (C) = 1,993∙10–26 кг; ma (H) = 1.67∙10–27 кг.
Понятно, что выражать массы атомов в килограммах или граммах неудобно из-за очень малых значений.
Атомная масса – число, которое показывает, во сколько раз масса атома данного элемента больше массы какого-то стандартного атома (или его части), принятой за единицу*. В качестве стандартного атома для определения атомных масс с 1961 г. принят изотоп углерода-12 (12С). За единицу атомной массы принята масса 1/12 части изотопа углерода-12. Она называется атомной единицей массы (а.е.м.), иногда – углеродной единицей (у.е.), и равна
1 а.е.м. = 1,667∙10–27 кг.
Относительную атомную массу (Аr) любого химического элемента можно вычислить, разделив абсолютную массу этого элемента на 1 а.е.м., согласно формуле Аr(Х) = ma (Х)/ 1 а.е.м., например:
Аr(С) = ma (С)/ 1 а.е.м. = 1,993∙10–26 кг /1,667∙10–27 кг ≈ 12;
Аr(О) = ma (О)/ 1 а.е.м. = 2,667∙10–26 кг /1,667∙10–27 кг ≈16;
Аr(Н) = ma (H)/ 1 а.е.м. = 1.67∙10–27 кг / 1,667∙10–27 кг ≈ 1.
* Масса и вес – это разные понятия. Вес любого предмета уменьшается по мере удаления от поверхности Земли, а масса его остается неизменной. Удаленные в космос тела вообще не имеют веса («состояние невесомости»), но имеют ту же массу, что и на Земле. В старых учебниках используется термин «атомный вес».
Для молекул: относительной молекулярной массой называется масса молекулы, выраженная в а.е.м. Относительная молекулярная масса какого-либо вещества равна сумме относительных атомных масс атомов, входящих в состав этой молекулы.
Например, Аr(О) равна 16, Аr(Н) равна 1, следовательно, относительная молекулярная масса Мr молекулы воды будет равна
Мr (Н2О) = 2∙ Аr(Н) + Аr(О) = 2∙1 + 16 = 18 а.е.м.
На практике мы не встречаемся с отдельными атомами или молекулами, поэтому в химии часто используют понятие – количество вещества, которое подразумевает число структурных единиц (атомов, молекул, ионов и др.частиц), образующих данное вещество. Обозначают количество вещества латинской буквой n или греческой буквой ν.
За единицу количества вещества принят 1 моль (от латинского moles – масса) – такое количество вещества, которое содержит столько же структурных единиц (атомов, молекул, ионов …), сколько содержится атомов в 12 граммах чистого изотопа углерода-12, а именно 6,02∙1023. Число атомов в 12 граммах (0,012 кг) углерода равно 0,012 (кг/моль) /1,993∙10–26 (кг) = 6,02∙1023 моль–1.
Это число называется числом Авогадро (или постоянной Авогадро) и обозначают символом NА. Таким образом, один моль любого вещества содержит 6,02∙1023 молекул, атомов или других структурных единиц, например:
1 моль алюминия Al содержит 6,02∙1023 атомов алюминия;
1 моль хлора Сl2 cодержит 6,02∙1023 молекул Сl2, но атомов Сl здесь будет в два раза больше, т.к. молекула хлора является двухатомной;
1 моль воды Н2О содержит 6,02∙1023 молекул Н2О.
Массу 1 моль данного вещества называют молярной массой, обозначают символом М и выражают в кг/моль или г/моль. Молярная масса – это величина, равная отношению массы вещества к количеству этого вещества М = m/ν; численно совпадает с относительной молекулярной массой вещества Мr или с относительной атомной массой Аr (если вещество состоит из атомов):
Натрий Na Аr = 23 М = 23 г/моль
Хлор Cl2 Мr= 71 М = 71 г/моль
Хлорид натрия NaCl Мr= 58,5 М = 58,5 г/моль
Следовательно, в 23 г натрия содержится 6,02∙1023 атомов натрия, в 18 г воды Н2О содержится 6,02∙1023 молекул Н2О.
studfiles.net
Молярная масса. Количество вещества. Молярный объем.

Одинаковое ли число молекул содержится в:
1)3 л азота и 3 л кислорода при одинаковых условиях?
2)2 л бензина и 2 л воды при одинаковых условиях?

Молярная масса — M
численно равна относительной молекулярной массе:
M = Mr
Количества веществ, массы которых численно равны их относительным молекулярным массам, содержат одинаковое
Например:число18 г водымолекул(H O). и 2 г
2
водорода(h3) содержат одинаковое число молекул.

Одинаковое или разное число молекул
содержится1.36 г воды и 4в:г водорода?
2.16 г кислорода (О2) и 18 г воды?
Отношение массы вещества
к его молярной массе называется количеством
вещества (n).
m n моль
n m г
M г/мол?
M ь
M mn m M n

Молярная масса – масса одного моль вещества.
М
г/моль
Вычислите молярную массу углекислого газа.
Мr (СО2) = 12 + 16*2 = 44
M= Mr
M(СО2) = 44 г/моль

Моль – единица количества вещества.
Равные количества вещества содержат одинаковое число
молекул.
1 моль любого вещества содержит6,02 1023
Постоянная
структурныхАвогадро:частиц.1
NA 6,02 1023 моль

•NA больше, чем площадь Земли в кв.мм
•Если взять 1 моль долларовых бумажек, то они покроют все материки Земли
двухкилометровым
•В пустыне Сахараслоем. содержится менее 3
моль самых мелких песчинок.

Задача 1.
•Какому количеству
вещества соответствует масса кислорода, равная 3,2 г?
•Ответ: 0,1 моль
studfiles.net
