SO3, степень окисления серы и кислорода в нем
Общие сведения об оксиде серы (VI) и степени окисления в SO3
Брутто-формула – SO3 (строение молекулы показано на рис. 1). Молярная масса серного ангидрида равна – 80,06 г/моль.
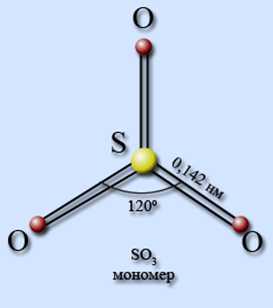
Рис. 1. Строение молекулы оксида серы (VI) с указанием валентного угла и длины химической связи.
Разлагается при высоких температурах. В твердом состоянии существует в виде аморфного летучего тримераS3O9, цепного слоистого и сетчатого полимеров (SO3)n; ниже 25oC тример переходит в полимер. Хорошо растворяется в безводной серной кислоте. Проявляет кислотные свойства.
SO3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав триоксида серы, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(-2) = 0;
x — 6 = 0;
x = +6.
Значит степень окисления серы в оксиде серы (VI) равна (+6):
S+6O-23.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
K2SO3, степень окисления калия и др элементов
Общие сведения о сульфите калия и степени окисления в K2SO3
Брутто-формула – K2SO3. Молярная масса равна – 158,26 г/моль.
Рис. 1. Сульфит калия. Внешний вид. Строение молекулы.
Хорошо растворяется в воде (гидролизуется по аниону). Разлагается кислотами-неокислителями. Типичный восстановитель. Окисляется кислородом воздуха.
K2SO3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав сульфита калия, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления калия постоянна и равна номеру группы в Периодической таблице Д.И. Менделеева, в которой он находится, со знаком плюс, т.е. (+1). Степень окисления кислорода в составе неорганических кислот, а, следовательно, и в составе их кислотных остатков, всегда равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+1) + х + 3×(-2) = 0;
2 + х — 6 = 0;
x — 4 = 0;
x = +4.
Значит степень окисления серы в сульфите калия равна (+4):
K+12S+4O-23.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Na2SO3, степень окисления серы и др элементов
Общие сведения о сульфите натрия и степени окисления в Na2SO3
Брутто-формула – Na2SO3. Молярная масса сульфита натрия равна 126,04 г/моль.

Рис. 1. Сульфит натрия. Внешний вид.
Хорошо растворяется в воде (гидролизуется по аниону). В ОВР является сильным восстановителем, но способен проявлять и слабые окислительные свойства.
Na2SO3, степени окисления элементов в нем
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Сульфит-ион – это кислотный остаток сернистой кислоты, формула которой H2SO3. В её составе имеется два атома водорода, следовательно, степень окисления равна ( — 2). Степень окисления кислорода в составе кислот, а, следовательно, и их остатков, всегда равна (-2). Определим степень окисления серы в составе сульфит-иона, для чего примем за «х» её значение составим уравнение электронейтральности:
x + 3×(-2) = -2;
x — 6 = -2;
x = +4.
Степень окисления серы равна (+4).
Степень окисления натрия постоянна. Она равна номеру группы Периодической системы Д.И. Менделеева, в которой расположен данный элемент, со знаком плюс (натрий – металл), т.е. (+1):
Na+12S+6O-23.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Al2(SO4)3, степень окисления серы и др элементов
Общие сведения о сульфате алюминия и степени окисления в Al2(SO4)3
Брутто-формула – Al2(SO4)3. Молярная масса сульфата алюминия равна 342,15 г/моль.

Рис. 1. Сульфат алюминия. Внешний вид.
Хорошо растворяется в воде (гидролизуется по катиону). В кипящей воде разлагается. Не реагирует с кислотами. Полностью разлагается щелочами в растворе и при спекании, реагирует с гидратом аммиака. Вступает в реакции обмена.
Al2(SO4)3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав сульфата алюминия, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления алюминия постоянна и равна номеру группы Периодической системы Д.И. Менделеева, в которой он расположен, со знаком плюс (алюминий – металл), т.е. (+3). Степень окисления кислорода в составе кислот, а, значит и в их остатках равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+3) + 3× х + 12× (-2)= 0;
6 + 3х – 24= 0;
3х — 18= 0;
x = +6.
Степень окисления серы в сульфате алюминия равна (+6):
Al+32(S+6O-24)3.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Cr2(SO4)3, степень окисления хрома и др элементов
Общие сведения о сульфате хрома (III) и степени окисления в Cr2(SO4)3
Брутто-формула — Cr2(SO4)3. Молярная масса равна – 392,16 г/моль.
Рис. 1. Сульфат хрома (III). Внешний вид.
Растворяется в воде (гидролизуется по катиону). Образует кристаллогидраты составов Cr2(SO4)3×18H2O иCr2(SO4)3×6H2O. Проявляет слабые окислительно-восстановительные свойства.
Cr2(SO4)3, степени окисления элементов в нем
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Сульфат-ион – это кислотный остаток серной кислоты, формула которой H2SO4. В её составе имеется два атома водорода, следовательно, степень окисления сульфат-ионе равна (-2). Степень окисления кислорода в составе кислот, а, следовательно, и их остатков равна (-2). Для нахождения степени окисления серы в составе сульфат-иона примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4× (-2) = -2;
x — 8 = -2;
x = +6.
Степень окисления хрома найдем аналогичным образом:
2×у + 3× (+6) + 12× (-2) = 0;
2у + 18 – 24 = 0;
2у — 6 = 0;
2у = + 6;
y= +3.
Степень окисления хрома в сульфате хрома (III) равна (+3): Cr+32(SO4)3.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Какая степень окисления у СО2?
Степень окисления (СО) простого вещества равна 0. Если в соединении, то сумма всех СО тоже равна 0. Поэтому если вы знаете СО одного элемента, то его СО + х = 0. Например, СО2. Кослород всегда -2, поэтому С +4. СО веществ, которые постоянны надо выучить. Вот пять правил: 1. СО элемента в сложном веществе всегда равна нулю. 2. Степень окисления металла всегда положительна и равна валентности 3. степени окисления неметаллов различны, но фтор ВСЕГДА -1; водород почти всегда +1, но с металлами, в гидридах -1; кислород почти всегда -2, кроме пероксидов и оксида фтора. 4. Главное: степень окисления элементов в кислотном остатке кислоты и её солей ОДИНАКОВЫ 5. Алгебраическая степень окисления всех элементов равна нулю.Тебя научат.. . Кислород не всегда -2, хотя для школы это не важно, а степень окисления «у СО2» — кривая терминология. Она только у атомов в соединении.
touch.otvet.mail.ru
Степень окисления в химии
Понятие «степень окисления»
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Для кислорода, также имеющего высокое значение электроотрицательности, характерна отрицательная степень окисления обычно (-2), в пероксидах (-1). Исключение составляет соединение состава OF2, в котором степень окисления кислорода равна (+2).
Степень окисления щелочных и щелочноземельных элементов
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Постоянную степень окисления (+1) в большинстве соединений проявляет водород, например H+1Cl-1, H+12O-2, P-3H+13. Однако в гидридах степень окисления водорода – (-1), например Li+1H-1, Ca+2H-12.
Понятие степени окисления для большинства соединений имеет условных характер, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях состава KNO2 и HNO3. Степень окисления водорода и щелочных металлов в соединениях равна (+), а степень окисления кислорода – (-2). Соответственно степень окисления азота равна:
KNO2 1+ x +2×(-2) = 0, x=+3.
HNO3 1+x+ x +3×(-2) = 0, x=+5.
Аналогичным образом можно определить степень окисления элементов в любых соединениях. Для примера приведем соединения азота с разными степенями окисления: N-3H+13, N-22H+12, N-1H+12O-2H+1, No2, N+12O-2, N+2O-2, Na+1N+3O-22, N+4O-22, K+N+5O-23.
Примеры решения задач
ru.solverbook.com
