MnCl2, степень окисления марганца и хлора в нем
Общие сведения о хлориде марганца (II) и степени окисления в MnCl2
Температура плавления 650oC, кипения – 1231oC. Брутто-формула – MnCl2. Молярная масса хлорида марганца (II) равна 125,84 г/моль.

Рис. 1. Хлорид марганца (II). Внешний вид.
Хорошо растворяется в воде (гидролизуется по катиону) и хлороводородной кислоте. Образует кристаллогидраты состава MnCl2×4H2O и MnCl2×2H2O, которые имеют строение [Mn(H2O)4Cl2] и [Mn(H2O)2Cl2]. Не реагирует с водородом. Разлагается щелочами, гидратом аммиака. Окисляется кислородом, озоном, фтором и хлором. Вступает в реакции обмена и комплексообразования.
MnCl2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав хлорида марганца (II), сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Хлорид-ион – это кислотный остаток хлороводородной кислоты, формула которой HCl. В её составе имеется один атом водорода, следовательно, степень окисления хлора в хлорид-ионе равна (-1).
Для нахождения степени окисления марганца примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2× (-1)= 0;
х– 2 = 0;
x = +2.
Значит степень окисления марганца в хлориде марганца (II) равна (+2):
Mn+2Cl-12.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Определить кислотность pH | 0.76M(HCl)(solution) | |
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| 7 | Найти число нейтронов | Fe | |
| 8 | Найти число нейтронов | Tc | |
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | Определить, растворима ли смесь в воде | ||
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | H_2O | |
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | H_2O | |
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| 37 | Найти число нейтронов | Na | |
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | Найти массу одного моля | H_2SO_4 | |
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | ||
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | Os | |
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | N | ||
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
www.mathway.com
Марганец -общая характеристика элемента, химические свойства хрома и его соединений
Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd54s2 ; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
+7 — Mn2O7 , MnO4— ,HMnO4 ,KMnO4
+ 6 — MnO42- , K2MnO4
+4 — MnO2 , Mn(SO4)2 ,MnF4 ,K3[MnF6]
+3 — Mn2O3, MnO(OH),Mn2(SO4)3 ,MnF , K3[MnF6]
+ 2 — Mn2+ , MnO, Mn(OH)2 , MnSO4 ,MnCl2
0 — Mn
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn‖‖‖ и Мn IV — амфотерные свойства, для соединений МnVI и МnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn→(O2, до450oC) MnO2 →( O2, до 800oC) Mn2O3
Mn→MnO+( MnIIMn2II)O4 “окалина “ ( O2, выше 800oC)
Mn+Cl2→MnCl2 , (200oC) Mn+S→ MnS (до1580oC)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
Мn (порошок) + 2Н+ = Мn2+ + Н2↑
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Мn + 2Н2SO4(конц.) = МnSO4 + SO2↑+ 2Н2O
3Мn + 8HNO3(разб.) = 3Мn(NO3)2 + 2NO↑ + 4Н2O
Получение марганца в промышленности — восстановление пиролюзита МnO2 или гаусманита (МnIIMnIII)O4 коксом или алюминием:
МnO2 + С (кокс) = Мn + СO2 (600 °С)
3(МnII MnIII)O4 + 8Аl = 9Мn + 4А12O3(700-900 °С)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
2MnSO4+2H2O→2Mn↓+O2↑+2H2SO4 (40oC, эликтролиз)
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4МnO2 = 2Мn2O3 + O2 (530-585 °С)
2МnO2 + 2Н2SO4(конц.) = МnSO4 + O2↑ + 2Н2O (кипячение)
МnO2 + 4НС1(конц.) = МnС12 + С12↑ + 2Н2O
МnO2 + Н2SO4(гор.) + КNO2 = МnSO4 + КNO3 + Н2O
МnO2 + 2Н2SO4 + 2FeSO4 = МnSO4 + Fе2(SO4)3 + 2Н2O
МnO2 + 2КОН + КNO3 = К2MnO4 + KNO2 + Н2O (350-450 °С)
ЗМnO2 + ЗК2CO3 + КС1O3 = ЗК2MnO4+ КС1 + ЗCO2 (400 °С)
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO42-. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
3K2MnO4(конц) +2H2O→(t) 2KMnO4+MnO2↓+4KOH
3K2MnO4(разб)+4HCl=2KMnO4+MnO2↓+2H2O+4KCl
K2 MnO4 +8HCl(конц)=MnCl2+2Cl2↑+4H2O+2KCl
3K2MnO4+2H2O+4CO2(г)=2KMnO4+MnO2↓+4KHCO3
2K2 MnO4+Cl2(насыщ)=2KMnO4+2KCl
2K2MnO4+2H2O→ H2↑+2KMnO4+KOH (эликтролиз)
Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до МnII , в нейтральной среде – до Mn IV в сильнощелочной среде — до МnVI
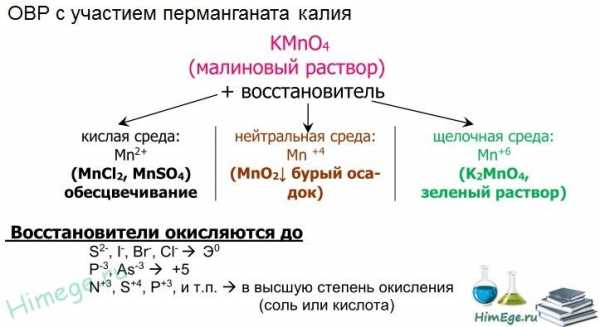
Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)
4КМnO4 + 2Н2O→МnO2↓+ 3O2↑ + 4КОН (t)
2КМnO4(т) + 16НСl(конц.) = 2МnС12 + 5С12↑ + 8Н2O + 2КС1 (80°С)
2КМnO4(т) + 2Н2SO4(96%) = 2КНSO4 + Мn2O7 + Н2O (на холоду)
4КМnO4(насыщ.) + 4КОН (15%) = 4К2МnO4+ O2↑ + 2Н2O (100 °С)
2КМnO4 + 2(NН3• Н2O)= 2МnO2↓ + N2↑ + 4Н2O+ 2КОН (50 °С)
2МnO4— + 16Н+ +10I— = 5I2+2Мn2+ + 8Н2O
2МnO4— + 6Н+ + 5Н2O2(разб.) = 2Мn2+ + 5O2↑+ 8Н2O
2МnO4— + 6Н+ + 5SO32- =2Мn2+ + 5SO42- + ЗН2O
МnO4— + 8Н+ + 5Fе2+ = Мn2+ + 5Fе3+ + 4Н2O
2МnO4— + 6Н+ + 5NO2— = 2Мn2+ + 5NО3— + 3Н2O
2МnO4— + 3Н2S (насыщ.) = 2МnO2↓ + 3S↓ + 2Н2O + 2OН—
2МnO4— + Н2O + 3SO32- = 2МnO2↓ + 3SO42-+ 2OH—
2МnO4— + 2Н2O + ЗМn2+ = 5МnO2↓ + 4Н+ (50-80 °С)
2МnO4— + 2OH—(конц.) + SO32- = 2МnO42-+ SO42- + Н2O
Получение — электролиз раствора К2MnO4
himege.ru
Образовательный портал |Характерные степени окисления и соединения
Электронная конфигурация валентного слоя
Получение
Природное соединение – ПИРОЛЮЗИТ MnO2
Алюмотермия: 3MnO2 + 4Al 2Al2O3 + 3Mn
Характерные степени окисления и соединения.
| +2 | +4 | +6 | +7 |
| MnO – основный оксид Mn(OH)2 Соли – с кислотами: MnCl2, MnSO4 (бесцветные) | MnO2 (пиролюзит) (бурый осадок) | Соли – манганаты K2MnO4 (зеленые) | Mn2O7 Кислотный оксид (зеленая жидкость) |
| Марганцевая кислота HMnO4 Соли – перманганаты KMnO4 (фиолетовые) |
Химические свойства
При нагревании марганец взаимодействует с кислородом, галогенами, серой. При взаимодействии марганца с кислородом образуется диоксид марганца:
Mn + O2 MnO2 Mn + S MnS
Растворяется в кислотах-неокислителях:
Mn + 2HCl MnCl2 + H2
С концентрированной серной кислотой реакция идёт по уравнению:
Mn + 2H2SO4(конц.) MnSO4 + SO2 + 2H2O
С разбавленной азотной кислотой реакция идёт по уравнению:
3Mn + 8HNO3(разб.) 3Mn(NO3)2 + 2NO + 4H2O
В щелочном растворе марганец устойчив.
Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2 водородом:
MnO2 + H2MnO + H2O
Гидроксид марганца (II) Mn(OH)2 — светло-розовое нерастворимое в воде основание: MnSO4 + 2NaOH Mn(OH)2+ Na2SO4
Гидроксид марганца (II) Mn(OH)2 в водных растворах проявляет основные свойства, то есть растворяется в кислотах, но не растворяется в щелочах: Mn(OH)2 + 2HCl = MnCl2+ 2H2O
В присутствии солей аммония Mn(OH)2 легко растворяется. Возможность протекания данной реакции обусловлена тем, что ее продукт — гидроксид аммония, гораздо более слабое основание, чем гидроксид марганца (II):
Mn(OH)2 + 2NH4Cl = MnCl2 + 2NH4OH
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O22MnO2 + 2H2O
Марганец (II) образует различные соли, в том числе сульфиды. Сульфид марганца (II) можно получить прямым синтезом или по обменным реакциям в растворах: MnSO4 + (NH4)2S = MnS+ (NH4)2SO4
Соединения Mn(IV)
Оксид марганца (IV) MnO2 — тёмно-коричневый порошок, нерастворимый в воде.
Образуется при термическом разложении нитрата марганца (II):
Mn(NO3)2 MnO2 + 2NO2
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 6000C) или Mn3O4 (при 10000C).
Сильный окислитель в кислой среде, переходит в +2:
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
Под действием сильных окислителей в сплаве со щелочью переходит в степень окисления +6:
MnO2 + Na2CO3 + NaNO3 (спл) Na2MnO4 + NaNO2 + CO2
Соединения Mn(VI)
Степень окисления +6 у марганца наименее устойчива: существует только в сильнощелочном растворе в виде солей зеленого цвета – МАНГАНАТОВ.
Манганаты получаются при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMnO4 + 2KOH Na2SO4 + 2K2MnO4 + H2O; или при окислении солей и оксидов марганца +2 и +4 сильными окислителями в присутствии щелочи:
3MnSO4 + 2KClO3 + 12KOH (спл) 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
Водой манганаты быстро разлагаются
(диспропорционируют на +7 и +4):
3K2MnO4 + 2H2O 2KMnO4 + MnO2 + 4KOH
Манганаты можно легко окислить хлором:
2K2MnO4 + Cl2 2KMnO4 + 2KCl
Соединения Mn(VII)
Оксид марганца (VII) Mn2O7 — тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический KMnO4 (марганцевая кислота HMnO4 нестабильна):
2KMnO4 + H2SO4Mn2O7 + K2SO4 + H2O
При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH 2KMnO4 + H2O
Перманганат калия KMn+7O4 —тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода: 2KMnO4 K2MnO4 + MnO2 + O2
При стоянии в растворе постепенно распадается:
4KMnO4 + 2H2O 4MnO2 + 4KOH + 3O2
Под действием серной кислоты (60%) и горячей щелочи перманганат также выделяет кислород:
4KMnO4 + 6H2SO4 4MnSO4 + 5O2 + 2K2SO4 + 6H2O
4KMnO4 + 4KOH –(t) 4K2MnO4 + O2+ 2H2O
Перманганат калия с восстановителями в разных средах:
| | KMnO4 (малиновый раствор) + восстановитель | |
| кислая среда: Mn2+ (MnCl2, MnSO4) обесцвечивание | нейтральная среда: Mn +4 (MnO2 бурый осадок) | щелочная среда: Mn+6 (K2MnO4, зеленый раствор) |
Повышение степеней окисления марганца:
| Mn+2,+4 – оксид, гидроксид, соли | + очень сильные окислители: KNO3, кислородсодержащие соли хлора (в расплаве) | Щелочная среда: Mn+6 Образуется: K2MnO4 – манганат |
| Mn+2– соли | + очень сильные окислители: PbO2, KBiO3 | Кислая среда: Mn+7 Образуется: KMnO4— перманганат HMnO4 — марганцевая кислота |
1piar.ru
Свойства марганца | Дистанционные уроки
07-Ноя-2012 | Нет комментариев | Лолита Окольнова
Еще один d-элемент — марганец — Mn.
Электронное строение атома
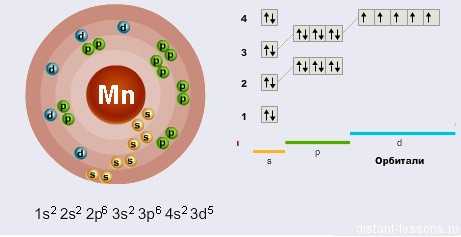
В отличие от Хрома, у марганца не наблюдается провала электронов. На внешнем уровне их 7 (2 s-электрона и 5 d-электронов). Соответственно, степень окисления марганца может быть +2, +3, +4, +6, +7 (+1, +5 — очень редкие, мало характерны).
Серебристо-белый металл. Так же, как и хром, малоактивный — легко на воздухе пассивируется — окисляется кислородом.
- Взаимодействие с водой: Mn + 2h3O = (t) =Mn(OH)2 + h3
В школьном курсе химии чаще всего встречаются соединения марганца: соли Mn(+2), оксид MnO2 и соли — перманганаты. Их свойства мы и рассмотрим.
- Mn(2+) — вступает в обычные обменные реакции:
MnCl2 + h3SO4 = MnSO4 + 2HCl
MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl - MnO2 — часто реагирует как окислитель:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2h3O.
- Манганаты: K2MnO4 раствор зеленого цвета— тоже очень сильные окислители.
- Восстановление перманаганатов происходит следующим образом:
- в кислой среде — до соединений Mn(2+)
- в нейтральной — до Mn(4+) — MnO2, например.
- в щелочной — до Mn (6+)
Эта схема отражает изменение цветов соединений марганца при повышении степени окисления.
Категории: |
Обсуждение: «Свойства марганца»
(Правила комментирования)distant-lessons.ru
Окислительно-восстановительные реакции
.
maratakm.narod.ru
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Определить кислотность pH | 0.76M(HCl)(solution) | |
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| 7 | Найти число нейтронов | Fe | |
| 8 | Найти число нейтронов | Tc | |
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | Определить, растворима ли смесь в воде | H_2O | |
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | H_2O | |
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | H_2O | |
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| 37 | Найти число нейтронов | Na | |
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | Найти массу одного моля | H_2SO_4 | |
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | O | |
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | Os | |
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | Найти число протонов | N | |
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
www.mathway.com
