Нормы ХГЧ по неделям беременности
Нормы ХГЧ по неделям беременности — Частный роддом Клиники ЕкатерининскаяСодержание
- Таблица средних норм ХГЧ
- Таблица средних норм ХГЧ при вынашивании двойни
- Таблица средних значений ХГЧ после ЭКО при прижившейся двойне
- Нормы для свободной β- субъединицы ХГЧ
- Норма РАРР-А
- Что делать, если у меня высокий риск?
- Как подтвердить или опровергнуть результаты скрининга?
- Врач говорит, что мне нужно сделать аборт. Что делать?
Одним из основных анализов при беременности является изучение уровня гормона беременности – ХГЧ или хорионического гонадотропина человека. Если будущим мамочкам хочется узнать соответствует ли уровень гормона норме, мы сделали сводную таблицу значений
Таблица средних норм ХГЧ:
| Срок гестации | HCG в мЕд/мл | HCG в мМе/мл | HCG в нг/мл |
| 1-2 недели | 25-156 | 5-25 (сомнительный результат) | — |
| 2-3 недели | 101-4870 | 5-25 (сомнительный результат) | — |
| 3-4 недели | 1100 – 31500 | 25-156 | — |
| 4-5 недель | 2560 – 82300 | 101-4870 | — |
| 5-6 недель | 23100 – 151000 | 1110 -31500 | — |
| 6-7 недель | 27300 – 233000 | 2560 -82300 | — |
| 7-11 недель | 20900 – 291000 | 23100 -233000 | 23,7 — 130,4 |
| 11-16 недель | 6140 – 103000 | 20900 -103000 | 17,4 — 50,0 |
| 16-21 неделя | 4720 – 80100 | 6140 – 80100 | 4,67 — 33,3 |
| 21-39 недель | 2700 – 78100 | 2700 -78100 | — |
Таблица средних норм ХГЧ при вынашивании двойни:
| Срок гестации, недели | Средний диапазон концентрации ХГЧ (мЕд/мл) |
| 1-2 недели | 50 – 112 |
| 2-3 недели | 209 – 9740 |
| 3-4 недели | 2220 – 63000 |
| 4-5 недель | 5122 – 164600 |
| 5-6 недель | 46200 – 302000 |
| 6-7 недель | 54610 – 466000 |
| 7-11 недель | 41810 – 582000 |
| 11-16 недель | 12280 – 206000 |
| 16-21 неделя | 9440 – 160210 |
| 21-39 недель | 5400 – 156200 |
Таблица средних значений ХГЧ после ЭКО при прижившейся двойне:
| Срок гестации, нед | Диапазон значений ХГЧ, мЕд/мл |
| 1-2 недели | 50 – 600 |
| 2-3 недели | 3000 – 10000 |
| 3-4 недели | 20000 – 60000 |
| 4-5 недель | 40000 – 200000 |
| 5-6 недель | 100000 – 400000 |
| 6-7 недель | 100000 – 400000 |
| 7-11 недель | 40000 – 200000 |
| 11-16 недель | 40000 – 120000 |
| 16-21 неделя | 20000 – 70000 |
| 21-39 недель | 20000 – 120000 |
Нормы для свободной β- субъединицы ХГЧ
Измерение уровня свободной β-субъединицы ХГЧ позволяет более точно определить риск синдрома Дауна у будущего ребенка, чем измерение общего ХГЧ.
Нормы для свободной β- субъединицы ХГЧ в первом триместре:
| Срок гестации, нед | HCG в нг/мл |
|---|---|
| 9 недель | 23,6 – 193,1 нг/мл, или 0,5 – 2 МоМ |
| 10 недель | 25,8 – 181,6 нг/мл, или 0,5 – 2 МоМ |
| 11 недель | 17,4 – 130,4 нг/мл, или 0,5 – 2 МоМ |
| 12 недель | 13,4 – 128,5 нг/мл, или 0,5 – 2 МоМ |
| 13 недель | 14,2 – 114,7 нг/мл, или 0,5 – 2 МоМ |
Внимание! Нормы в нг/мл могут отличаться в разных лабораториях, поэтому указанные данные не окончательны, и вам в любом случае нужно проконсультироваться с врачом. Если результат указан в МоМ, то нормы одинаковы для всех лабораторий и для всех анализов: от 0,5 до 2 МоМ.
Если ХГЧ не в норме, то:
- Если свободная β-субъединица ХГЧ выше нормы для вашего срока беременности, или превышает 2 МоМ, то у ребенка повышен риск синдрома Дауна.

- Если свободная β-субъединица ХГЧ ниже нормы для вашего срока беременности, или составляет менее 0,5 МоМ, то у ребенка повышен риск синдрома Эдвардса.
Норма РАРР-А
РАРР-А, или как его называют, «плазматический протеин А, ассоциированный с беременностью», это второй показатель, используемый в биохимическом скрининге первого триместра. Уровень этого протеина постоянно растет в течение беременности, а отклонения показателя могут указывать на различные заболевания у будущего ребенка.
Норма для РАРР-А в зависимости от срока беременности:
| Срок гестации, нед | HCG в нг/мл |
|---|---|
| 8-9 недель | 0,17 – 1,54 мЕД/мл, или от 0,5 до 2 МоМ |
| 9-10 недель | 0,32 – 2, 42 мЕД/мл, или от 0,5 до 2 МоМ |
| 10-11 недель | 0,46 – 3,73 мЕД/мл, или от 0,5 до 2 МоМ |
| 11-12 недель | 0,79 – 4,76 мЕД/мл, или от 0,5 до 2 МоМ |
| 12-13 недель | 1,03 – 6,01 мЕД/мл, или от 0,5 до 2 МоМ |
| 13-14 недель | 1,47 – 8,54 мЕД/мл, или от 0,5 до 2 МоМ |
Внимание! Нормы в нг/мл могут отличаться в разных лабораториях, поэтому указанные данные не окончательны, и вам в любом случае нужно проконсультироваться с врачом.Если результат указан в МоМ, то нормы одинаковы для всех лабораторий и для всех анализов: от 0,5 до 2 МоМ.
Если РАРР-А не в норме:
- Если РАРР-А ниже для вашего срока беременности, или составляет менее 0,5 МоМ, то у ребенка повышен риск синдрома Дауна и синдрома Эдвардса.
- Если РАРР-А выше нормы для вашего срока беременности, либо превышает 2 МоМ, но при этом остальные показатели скрининга в норме, то нет никакого повода для беспокойства.
Исследования показали, что в группе женщин с повышенным уровнем РАРР-А во время беременности риск заболеваний у плода или осложнений беременности не выше, чем у остальных женщин с нормальным РАРР-А.
Что делать, если у меня высокий риск?
Если в итоге скрининга у вас был обнаружен повышенный риск рождения малыша с синдромом Дауна, то это еще не повод прерывать беременность. Вас направят на консультацию к врачу генетику, который при необходимости порекомендует пройти обследования: биопсию ворсин хориона или амниоцентез
Как подтвердить или опровергнуть результаты скрининга?
Если вы думаете, что скрининг был проведен неправильно, то вам следует пройти повторное обследование в другой клинике, но для этого необходимо повторно сдать все анализы и пройти УЗИ. Данный способ возможен, только если срок беременности на момент осмотра не превышает 13 недель и 6 дней.
Данный способ возможен, только если срок беременности на момент осмотра не превышает 13 недель и 6 дней.
Врач говорит, что мне нужно сделать аборт. Что делать?
К сожалению, бывают такие ситуации, когда врач настойчиво рекомендует или даже заставляет сделать аборт на основании результатов скрининга. Запомните: ни один врач не имеет права на такие действия. Скрининг не является окончательным методом диагностики синдрома Дауна и, только на основании плохих его результатов, не нужно прерывать беременность.
Скажите, что вы хотите проконсультироваться с генетиком и пройти диагностические процедуры для выявления синдрома Дауна (или другого заболевания): биопсию ворсин хориона (если срок беременности у вас 10-13 недель) или амниоцентез (если срок беременности 16-17 недель).
Автор статьи:
Ананьина Анна Александровна
Акушер-гинеколог
Высшая категория
Стаж работы с 2010 года
Записаться
Употребляйте больше продуктов, богатых железом: говяжий язык, печень, гречневую и овсяную крупы, чернослив, курагу, зеленые яблоки и др.
Необходима медикаментозная терапия с использованием препаратов, содержащих железо. Если проблема связана с недостаточным поступлением железа в организм – нужен один комплекс лекарств, если со всасыванием – другой. Подбирать препараты должен врач.
При более тяжелых формах анемии может потребоваться инъекционная терапия.
Если нет противопоказаний, естественные роды возможны. Принимать решение о возможности ЕР должен только акушер-гинеколог.
Сдать анализы
- Рентгенография органов грудной клетки
- КСР
- Гепатит B HBsAg
- Гепатит C Anti-HCV
- Краснуха IgM
- Краснуха IgG
- ВИЧ
- Б/П на флору и чувств. — из зева
Консультация специалистов:
- Консультация терапевта
С увеличением срока беременности и ростом малыша матка увеличивается – это может приводить к повышенному тонусу. Иногда напряжение возникает в ответ на шевеления ребенка. Сильные физические нагрузки, стрессы, переутомление беременной могут также приводить к повышенному тонусу.
На ранних сроках беременности тонус матки может быть связан, прежде всего, со сниженной выработкой прогестерона. В этом случае врач назначает пациентке лечение препаратами прогестерона.
Симптомы повышенного тонуса
Все беременные женщины ощущают тонус по-разному. Кто-то — как тяжесть и напряжение внизу живота. Другие — как тянущую боль в области поясницы. Во 2 и 3 триместрах беременности женщина может ощутить тонус, положив руку на живот: матка становится «каменной», затем расслабляется.
Акушер-гинеколог
Врач первой категории
Стоимость приема
уточняйте в Call-центре
Акушер-гинеколог
Врач первой категории
Стоимость приема
2500 ₽
Акушер-гинеколог
Врач высшей категории
Кандидат медицинских наук
Стоимость приема
уточняйте в Call-центре
Акушер-гинеколог
Врач первой категории
Стоимость приема
уточняйте в Call-центре
Акушер-гинеколог
Врач высшей категории
Стоимость приема
уточняйте в Call-центре
Акушер-гинеколог / Гинеколог
Врач высшей категории
Кандидат медицинских наук
Стоимость приема
2500 ₽
Акушер-гинеколог
Врач высшей категории
Стоимость приема
2500 ₽
Акушер-гинеколог
Врач второй категории
Стоимость приема
уточняйте в Call-центре
Мобильное приложение клиники
Вы можете записаться к врачу, получить анализы
и многое другое. ..
..
Заполните форму для записи на прием или заказа обратного звонка
Я соглашаюсь с политикой обработки персональных данных и пользовательским соглашением , а также даю согласие на обработку персональных данных .
Запишись на консультацию
Я соглашаюсь с политикой обработки персональных данных и пользовательским соглашением , а также даю согласие на обработку персональных данных .
Продолжая использовать rd.clinic23.ru, вы соглашаетесь на использование файлов cookie. Как запретить использование определенных файлов cookie можно найти в Политике
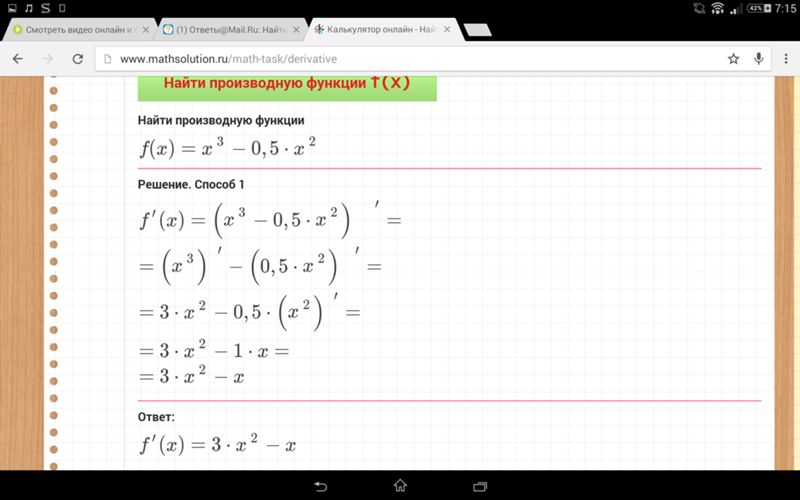
Кристаллогидраты. Задачи на кристаллогидраты | CHEMEGE.RU
Кристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
Например, медный купорос:
CuSO4·5H2O
Кристаллогидраты растворяются в воде, при этом протекают сложные физико-химические процессы, но, если говорить про конечный результат, вещество диссоциирует, а кристаллизационная вода отделяется и попадает в раствор. Условно процесс растворения можно записать в виде уравнения:
CuSO4·5H2O → CuSO4 + 5H2O
Но в ЕГЭ по химии лучше не записывать растворение кристаллогидрата, как химическую реакцию!
Названия кристаллогидратов, которые могут встретиться в ЕГЭ по химии:
CuSO4·5H2O — медный купорос, пентагидрат сульфата меди (II)
Na2CO3 × 10H2O — кристаллическая сода, декагидрат карбоната натрия
ZnSO4 × 7H2O — цинковый купорос, гептагидрат сульфата цинка
Как решать задачи на кристаллогидраты?
Рассмотрим приемы, которые можно использовать при решении задач на кристаллогидраты, на примере.
| 1. В 300 мл воды растворили 7,6 г CuSO4·5H2O (медного купороса). Определите массовую долю CuSO4 в образовавшемся растворе. |
Для определения массы соли в составе кристаллогидрата по массе кристаллогидрата можно использовать два способа.
Первый способ.
В составе кристаллогидрата медного купороса на одну частицу кристаллогидрата приходится одна частица сульфата меди (II). На две частицы кристаллогидратов тогда приходится две частицы сульфата меди и т.д. Аналогично на 1 порцию (моль) частиц кристаллогидрата приходится 1 порция (1 моль) частиц сульфата меди (II).
То есть молярное соотношение (отношение количества вещества) кристаллогидрата CuSO4·5H2O и сульфата меди (II) равно CuSO4 1:1
n(CuSO4·5H2O):n(CuSO4) = 1:1
Или:
n(CuSO4·5H2O) = n(CuSO4)
Находим молярные массы гидрата и сульфата меди (II):
М(CuSO4·5H2O) = 64 + 32 + 64 + 5·18 = 250 г/моль
М(CuSO4) = 64 + 32 + 64 = 160 г/моль
Количество вещества кристаллогидрата:
n(CuSO4·5H2O) = m/M = 7,6/250 = 0,0304 моль
n(CuSO4) = n(CuSO4·5H2O) = 0,0304 моль
Масса сульфата меди в составе кристаллогидрата:
m(CuSO4) = M·n = 160 г/моль·0,0304 моль = 4,864 г
Второй способ.
Определим массовую долю сульфата меди в составе кристаллогидрата:
ω(CuSO4) = М(CuSO4)/М(CuSO4·5H2O) = 160 г/моль/250 г/моль = 0,64 или 64%
Тогда массу сульфата меди в образце кристаллогидрата массой 7,6 г можно определить, зная массовую долю сульфата меди:
m(CuSO4) = ω(CuSO4) · m(CuSO4·5H2O) = 0,64 · 7,6 г = 4,864 г
Масса исходной воды:
m(H2O) = ρ·V = 1 г/мл · 300 мл = 300 г
Массу раствора сульфата меди (II) находим по принципу материального баланса: складываем все материальные потоки, которые пришли в систему, вычитаем уходящие материальные потоки.
mр-ра(CuSO4) = m(CuSO4·5H2O) + m(H2O) = 7,6 г + 300 г = 307,6 г
Массовая доля сульфата меди (II) в конечном растворе:
ω(CuSO4) = m(CuSO4)/mр-ра(CuSO4) = 4,864 г/307,6 г = 0,0158 или 1,58%
Ответ: ω(CuSO4) = 0,0158 или 1,58%
2. Какую массу железного купороса (FeSO4•7H2O) надо взять, чтобы приготовить 1,25 л раствора сульфата железа с массовой долей 9%, если плотность этого раствора 1,086 г/мл? Какую массу железного купороса (FeSO4•7H2O) надо взять, чтобы приготовить 1,25 л раствора сульфата железа с массовой долей 9%, если плотность этого раствора 1,086 г/мл? |
| 3. В растворе хлорида алюминия с ω(AlCl3) = 2% растворили 100 г кристаллогидрата AlCl3·6H2O. Вычислите, какой стала массовая доля AlCl3 в полученном растворе, если объём раствора 1047 мл, а его плотность 1,07 г/мл. |
4. Вычислите массы FeSO4·7H2O (железного купороса) и воды, необходимые для приготовления 500 г раствора с массовой долей FeSO4 7%.
5. Вычислите объём воды и массу кристаллогидрата Na2SO4·10H2O (глауберовой соли), которые требуются для приготовления 500 г раствора с массовой долей Na2SO4 15%.
6. Какую массу кристаллогидрата Na2SO4·10H2O необходимо растворить в 400 мл воды, чтобы получить раствор с ω(Na2SO4) = 10%?
7. Нужно приготовить 320 г раствора с ω(CuSO4) = 12%. Рассчитайте массу кристаллогидрата CuSO4·5H2O и массу раствора с ω1(CuSO4) = 8%, которые потребуются для приготовления заданного раствора.
8. Вычислите, какую массу кристаллогидрата AlCl3·6H2O нужно растворить в 1 кг раствора хлорида алюминия с массовой долей AlCl3 2%, чтобы получить раствор с массовой долей AlCl3 3%.
9. Сколько граммов кристаллогидрата Na2SO4·10H2O необходимо добавить к 100 мл раствора сульфата натрия с массовой долей Na2SO4 8% и плотностью 1,07 г/мл, чтобы удвоить массовую долю Na2SO4 в растворе?
10. Какую массу CuSO4·5H2O (медного купороса) нужно растворить в 1 кг раствора сульфата меди(II) с массовой долей CuSO4 5%, чтобы получить раствор с массовой долей CuSO4 10%?
Какую массу CuSO4·5H2O (медного купороса) нужно растворить в 1 кг раствора сульфата меди(II) с массовой долей CuSO4 5%, чтобы получить раствор с массовой долей CuSO4 10%?
11. Вычислите массу CuSO4·5H2O (медного купороса), необходимую для приготовления 5 л раствора с массовой долей CuSO4 8% (плотность раствора 1,084 г/мл)? Рассчитайте молярную концентрацию CuSO4 в этом растворе.
12. Массовая доля кристаллизационной воды в кристаллогидрате сульфата натрия (Na2SO4·xH2O) составляет 55,9%. Определите формулу кристаллогидрата. Вычислите массовую долю сульфата натрия в растворе, полученном при
растворении 80,5 г данного кристаллогидрата в 2 л воды.
13. К раствору сульфата железа(II) с массовой долей FeSO4 10% добавили 13,9 г кристаллогидрата этой соли. Получили раствор массой 133,9 г, с массовой долей FeSO4 14,64%. Определите формулу кристаллогидрата.
Определите формулу кристаллогидрата.
14. После растворения 13,9 г кристаллогидрата сульфата железа(II) (FeSO4·xH2O) в 86,1 г воды массовая доля FeSO4 в растворе оказалась равной 7,6%. Определите формулу кристаллогидрата.
15. При охлаждении 200 мл раствора сульфата магния с ω(MgSO4) = 24% (плотность раствора 1,270 г/мл) образовался осадок кристаллогидрата MgSO4·7H2O массой 61,5 г. Определите массовую долю MgSO4 в оставшемся
растворе.
16. При охлаждении 400 мл раствора сульфата меди(II) с массовой долей CuSO4 25% (плотность раствора 1,19 г/мл) образовался осадок кристаллогидрата CuSO4·5H2O массой 50 г. Определите массовую долю CuSO4 в оставшемся растворе.
17. При охлаждении 500 г раствора сульфата железа(II) с массовой долей FeSO4 35% выпало в осадок 150 г кристаллогидрата FeSO4·7H2O. Определите массовую долю FeSO4 в оставшемся растворе.
Определите массовую долю FeSO4 в оставшемся растворе.
18. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 8,4 г железа и после завершения реакции ещё 100 г 9,8%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
19. Медный купорос (CuSO4 × 5H2O) массой 100 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 32,5 г цинка и после завершения реакции ещё 560 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в полученном растворе.
20. К 20%-ному раствору соли, полученному при растворении в воде 50 г медного купороса (CuSO4 × 5H2O), добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 146 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю хлороводорода в образовавшемся растворе. (Процессами гидролиза пренебречь.)
Определите массовую долю хлороводорода в образовавшемся растворе. (Процессами гидролиза пренебречь.)
21. Нитрид натрия массой 8,3 г растворили в 490 г 20%-ного раствора серной кислоты. К полученному раствору добавили 57,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю кислоты в конечном растворе. Учитывать образование только средних солей.
22. Медный купорос (CuSO4 × 5H2O) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
23. Медный купорос (CuSO4 × 5H2O) массой 37,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 11,2 г железа и после завершения реакции ещё 100 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
Определите массовую долю соли в полученном растворе.
24. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 20%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 292 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
25. При растворении 25 г медного купороса (CuSO4 × 5H2O) в воде был получен 20%-ный раствор соли. К этому раствору добавили измельчённую смесь, образовавшуюся в результате прокаливания порошка алюминия массой 2,16 г с оксидом железа(III) массой 6,4 г. Определите массовую долю сульфата меди(II) в полученном растворе.
26. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
После завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
27. Свинцовый сахар ((CH3COO)2Pb × 3H2O) массой 37,9 г растворили в воде и получили 10%-ный раствор соли. К этому раствору добавили 7,8 г цинка и после завершения реакции добавили еще 156 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
28. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
29. При растворении в воде 114,8 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 12 г магния. После завершения реакции к полученной смеси прибавили 365 г 20%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
К полученному раствору добавили 12 г магния. После завершения реакции к полученной смеси прибавили 365 г 20%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
30. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 200 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
Ответ: w(NaOH) = 3,8%
31. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 16%. К этому раствору добавили 26 г цинка и после завершения реакции ещё 320 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
32. Фосфид кальция массой 18,2 г растворили в 182,5 г 20%-ного раствора соляной кислоты. К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю карбоната натрия в конечном растворе.
К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю карбоната натрия в конечном растворе.
Ответ: w(Na2CO3) = 6%
Задачи на состав и определение формулы кристаллогидратов:
- Вычислите массовую долю бария в кристаллогидрате гидроксида бария, в котором число атомов водорода в 1,8 раз больше числа атомов кислорода.
- Имеется смесь равных масс гептагидрата гидрофосфата натрия и дигидрата дигидрофосфата натрия. Сколько в это смеси приходится атомов кислорода на один атом фосфора?
- Число атомов водорода, равное числу Авогадро, содержится в 21,9 г кристаллогидрата ацетата цинка. Установите формулу кристаллогидрата.
- В некоторой порции пентагидрата сульфата меди содержится 0,25 моль воды. Вычислите массу этой порции кристаллогидрата.
- В какой массе дигидрата сульфата кальция содержится число электронов, равное числу Авогадро?
- Вычислите число атомов и число электронов 14г гептагидрата сульфата никеля (II).

- Рассчитайте массу атомов водорода, содержащихся в 143 моногидрата ацетата меди.
- В некоторой порции кристаллогидрата сульфата желез (III) число атомов кислорода в 15 раз больше числа Авогадро, а число атомов железа точно соответствует числу Авогадро. Выведите формулу кристаллогидрата.
- В 0,250 моль кристаллогидрата разница между массой кристаллизационной воды и массой беводной соли равна 59,5. Массовая доля кристаллизационной воды составляет 28,83%. Вычислите относительную молекулярную массу кристаллогидрата.
- В кристаллогидрате, образованном средней солью металла, массовая доля кристаллизационной воды равна 50,0%. Вычислите массу водорода, содержащегося в 100 г этого кристаллогидрата.
- В кристаллогидрате, образованном солью бескислородной кислоты, массовая доля соли равна 0,755. Вычислите массу кислорода, содержащегося в 1.00 г этого кристаллогидрата.
- В некоторой порции кристаллогидрата ацетата магния находится 9,632∙1023 атомов углерода и 3,371∙1024 атомов водорода.
 Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата.
Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата. - В некоторой порции кристаллогидрата ацетата бария находится 4,816∙1023 атомов углерода и 8,428∙1023 атомов кислорода. Вычислите число атомов водорода, находящихся в этой порции кристаллогидрата.
14. В 0,250 моль дигидрата ацетата металла 2А-группы содержится 1,535∙1025 электронов. Установите, какой металл входит в состав кристаллогидрата.
Задачи на реакции с участием кристаллогидратов:
- Оксид меди (II) массой 16 г обработали 40 мл 5,0 %-го раствора серной кислоты (ρ=1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
- Декагидрат карбоната натрия обработали раствором азотной кислоты массой 150 г, при этом выделилось 2,67 л углекислого газа (н.у.). Вычислите массовую долю азотной кислоты в исходном растворе.
- К сульфиду калия массой 3,30 г, находящемуся в водном растворе, добавили 0,02 моль гексагидрата хлорида меди.
 Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка. - При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
- Какую массу медного купороса необходимо добавить к 150 г 12%-ного раствора гидроксида натрия, чтобы щёлочь полностью прореагировала?
- 7,5 г медного купороса (пентагидрат сульфата меди) растворили в 142,5 воды. К полученному раствору добавили 150 мл 10 %-ного раствора гидроксида калия (плотность 1,1 г/мл). Определить состав полученного раствора в массовых процентах.
- Какую массу декагидрата карбоната натрия необходимо растворить в 130 г 10%-ного раствора хлорида алюминия, чтобы полностью осадить гидроксид алюминия? Определить состав раствора (в массовых процентах) после отделения осадка.
8. В 1 л воды растворили 57,2 г кристаллической соды (декагидрат карбоната натрия). Через полученный раствор пропустили 1,12 л углекислого газа. Найти массовые доли веществ в полученном растворе.
Найти массовые доли веществ в полученном растворе.
Задачи на материальный баланс и растворы с участием кристаллогидратов:
- Медный купорос массой 12,5 г; растворили в 87,5 мл воды. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 200 г раствора сульфата меди (II) с массовой долей соли 4% растворили 50 г медного купороса. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 5 л воды растворили дигидрат хлорида бария массой 250 г. Вычислите массовую долю (в %) безводной соли в полученном растворе.
- В 135,6 г воды растворили глауберову соль массой 64,4 г. Рассчитайте массовую долю (в %) безводной соли в полученном растворе.
- Необходимо приготовить 2 л 0,1 М водного раствора сульфата меди (II). Какая масса медного купороса потребуется для этого?
- Выпарили досуха 0,5 л 15-процентного раствора сульфата натрия (плотность 1,14 г/см3). Вычислите массу полученных кристаллов, учитывая, что соль выделяется в виде кристаллогидрата — декагидрата сульфата натрия.

- До какого объема надо разбавить 500 мл 20-процентного раствора хлорида натрия (плотность 1,152 г/мл), чтобы получить 4,5-процентный раствор плотностью 1,029 г/мл?
- Смешали 500 мл 32 — процентного раствора азотной кислоты плотностью 1,2 г/мл и один литр воды. Вычислите массовую долю (в %) азотной кислоты в полученном растворе.
- Рассчитайте объем 25% раствора сульфата цинка (плотность 1,3 г/мл), который необходимо разбавить водой для получения 0,5 М раствора этой соли объемом 4л.
- Декагидрат карбоната натрия массой 0,05 кг растворили в воде объемом 0,15 л. Вычислите массовую долю безводной соли в полученном растворе.
- В воде объемом 0,157 м3 растворили медный купорос массой 43 кг. Вычислите массовую долю безводной соли в полученном растворе.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Массовая доля безводной соли в кристаллогидрате равна 64%. Какую массу кристаллогидрата нужно взять для приготовления 150 г 50%-го раствора соли?
- В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- В каком объеме воды следует растворить 0,3 моль пентагидрата сульфата меди (II) для получения 12%-го раствора?
- Рассчитайте, сколько г FeSO4×7H2O и воды потребуется для приготовления 200 мл 18 мас % раствора сульфата железа (II) с плотностью 1,19 г/мл.

- Кристаллогидрат фосфата натрия Nа3РО4×12Н2О количеством вещества 1 моль растворили в 75 моль воды. Плотность получившегося раствора оказалась равной 1,098 г/мл. Вычислите молярную концентрацию ионов натрия в этом растворе.
- В 225 г 25,5%-го раствора бромида кальция растворили гексагидрат бромида кальция массой 50,0 г. Вычислите массовые доли веществ в получившемся растворе.
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- К 2% раствору хлорида алюминия добавили 100 г кристаллогидрата АlСl3∙6Н2О.
 Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл.
Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл. - Сколько граммов кристаллогидрата СuSО4∙5Н2О и какой объем раствора сульфата меди, содержащего 5 мас.% СuSО4 и имеющего плотность 1,045 г/мл, надо взять для приготовления 400 мл раствора сульфата меди, содержащего 7 мас.% СuSО4 и имеющего плотность 1,06 г/см3?
- Сколько граммов кристаллогидрата Nа2СО3∙10 Н2О надо добавить к 400 мл раствора карбоната натрия, содержащего 5 мас.% Na2СО3 и имеющего плотность 1,05 г/см , чтобы получить 16 мас.% раствор, плотность которого 1,17 г/см ?
- Какой объем 5% раствора сульфата натрия надо взять, чтобы растворение в нем 150 г кристаллогидрата Nа2SO4∙10Н2О привело к образованию 14% раствора? Плотности растворов Nа2SО4 равны, соответственно, 1,044 и 1,131 г/мл.
- Алюмокалиевые квасцы КАl(SО4)2∙12Н2О количеством вещества 10 ммоль растворили в 10 моль воды.
 Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе. - В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Какую массу кристаллогидрата сульфата хрома (III), кристаллизующегося с 18 молекулами воды, можно получить из 80 мл раствора с концентрацией сульфата хрома 0,8 моль/л?
Понравилось это:
Нравится Загрузка. ..
..
Сколько будет 5 разделить на 0?
Дата последнего обновления: 15 апреля 2023 г.
Подсказка: Нам нужно найти значение 5 разделить на 0. Начнем выполнять деление, считая число 1 делимым и число 0 делителем. Затем выписываем все случаи, встречающиеся при делении, чтобы получить желаемый результат.
Полное пошаговое решение:
Деление действительного числа P на действительное число Q дается следующим образом.
$\Rightarrow \dfrac{P}{Q}$
Здесь
P — делимое от деления
Q — делитель от деления
Предположим, что действительное число R является результатом вышеупомянутого деления.
Записав выражение для того же, получим
$\Rightarrow \dfrac{P}{Q}=R$
Перемножив число Q с другой частью уравнения
$\Rightarrow P=Q\times R$
Теперь,
Согласно нашему вопросу,
Предположим, что значение Q равно 0
$\Rightarrow Q=0$
Если P ненулевое действительное число, не существует такого значения R, что если его умножить на число $Q=0$, дает ненулевое действительное число P, так как произведение любого числа на число 0 всегда равно 0.
Даже если мы рассмотрим значение $P=0$, действительное число R может принимать любое число, умноженное на $Q=0$, даст в результате число 0.
Из приведенных выше случаев
Мы можем сказать, что деление на число 0 неопределенно среди множества действительных чисел. Следовательно, результат деления 5 на 0 не определен.
Примечание: Мы должны помнить, что значение 5, деленное на 0, равно бесконечности только в случае Пределов. Слово бесконечность означает длину числа. В случае пределов мы только предполагаем, что значение предела x стремится к чему-то и не равно чему-то, поэтому мы считаем его бесконечным. В обычных случаях значение любого числа, деленного на 0, не определено.
Недавно обновленные страницы
Если ab и c единичные векторы, то левое ab2 правое+bc2+ca2 математика класса 12 JEE_Main
Стержень AB длиной 4 единицы движется горизонтально, когда математика класса 11 JEE_Main
Оценить значение intlimits0pi cos 3xdx A 0 B 1 математика класса 12 JEE_Main
Что из следующего верно 1 nleft S cup T right класс 10 математики JEE_Main
Чему равна площадь треугольника с вершинами? +ca2 класс 12 математика JEE_Main
Стержень AB длиной 4 единицы движется горизонтально, когда математика класса 11 JEE_Main
Оценить значение intlimits0pi cos 3xdx A 0 B 1 математика класса 12 JEE_Main
Что из следующего верно 1 nleft S cup T right класс 10 математики JEE_Main
Чему равна площадь треугольника с вершинами?0003
Учащиеся также читают
Почему деление на ноль неопределенно
Почему деление на ноль неопределенно Перейти к основному содержанию Перейти к основной навигации Перейти к нижнему колонтитулу В этом видео мы рассмотрим, почему деление на ноль не определено. Но сначала нам нужно ознакомиться с определением деления. Определение деления гласит, что если «а», деленное на «b», равно «с», а «с» уникально, то «b», умноженное на «с», равно «а». Итак, давайте что-нибудь сделаем — разделим два известных нам числа. Итак, допустим, что 6 разделить на 2 равно 3. Мы все можем с этим согласиться. Обратите внимание, мы можем сказать, что «c» уникален. Число 3 уникально, потому что мы знаем, что 3 — это единственное число, равное 6, деленному на 2. Мы также можем выяснить, что означает вторая часть. Если мы умножим наше «b» на «с», то мы должны получить «а». Таким образом, наше «b» равно 2, умноженному на «c», что равно 3, равно «a», что равно нашим 6. Оба эти условия выполняются. Итак, это означает, что 6, деленное на 2, действительно равно 3. И мы также можем сказать, что это «определено», потому что оно удовлетворяет полному определению деления. Точно так же, если он удовлетворяет только одной части определения, это будет означать, что он «не определен».
Но сначала нам нужно ознакомиться с определением деления. Определение деления гласит, что если «а», деленное на «b», равно «с», а «с» уникально, то «b», умноженное на «с», равно «а». Итак, давайте что-нибудь сделаем — разделим два известных нам числа. Итак, допустим, что 6 разделить на 2 равно 3. Мы все можем с этим согласиться. Обратите внимание, мы можем сказать, что «c» уникален. Число 3 уникально, потому что мы знаем, что 3 — это единственное число, равное 6, деленному на 2. Мы также можем выяснить, что означает вторая часть. Если мы умножим наше «b» на «с», то мы должны получить «а». Таким образом, наше «b» равно 2, умноженному на «c», что равно 3, равно «a», что равно нашим 6. Оба эти условия выполняются. Итак, это означает, что 6, деленное на 2, действительно равно 3. И мы также можем сказать, что это «определено», потому что оно удовлетворяет полному определению деления. Точно так же, если он удовлетворяет только одной части определения, это будет означать, что он «не определен». Давайте посмотрим на примеры с нулем в них и посмотрим, что с ними происходит. Итак, позвольте мне прояснить это, и давайте начнем с нуля, деленного на 1. Я собираюсь сказать, что это равно нулю, потому что 1, умноженный на ноль, равно нулю. Это удовлетворяет этой второй части определения. И эта первая часть, если вы подставите, скажем, 1, 2 или любое другое число, тогда оно не будет равно этому, поэтому мы можем фактически сказать, что «с» уникален. Таким образом, это удовлетворяет тому, что это на самом деле единственное число, которое вы можете положить туда, чтобы фактически равняться нулю. Мы можем сказать, что ноль, деленный на 1, равен нулю, и мы также можем сказать, что это также «определено». Наш следующий пример будет делением 1 на ноль. И многим нравится гадать, что это будет ноль. Итак, давайте попробуем это. Мы берем наше «b», которое равно нулю, и умножаем его на наше «c», которое равно нулю. Мы не понимаем, что такое «а», потому что, конечно, ноль, умноженный на ноль, не равен 1.
Давайте посмотрим на примеры с нулем в них и посмотрим, что с ними происходит. Итак, позвольте мне прояснить это, и давайте начнем с нуля, деленного на 1. Я собираюсь сказать, что это равно нулю, потому что 1, умноженный на ноль, равно нулю. Это удовлетворяет этой второй части определения. И эта первая часть, если вы подставите, скажем, 1, 2 или любое другое число, тогда оно не будет равно этому, поэтому мы можем фактически сказать, что «с» уникален. Таким образом, это удовлетворяет тому, что это на самом деле единственное число, которое вы можете положить туда, чтобы фактически равняться нулю. Мы можем сказать, что ноль, деленный на 1, равен нулю, и мы также можем сказать, что это также «определено». Наш следующий пример будет делением 1 на ноль. И многим нравится гадать, что это будет ноль. Итак, давайте попробуем это. Мы берем наше «b», которое равно нулю, и умножаем его на наше «c», которое равно нулю. Мы не понимаем, что такое «а», потому что, конечно, ноль, умноженный на ноль, не равен 1. Так что это не удовлетворяет этой части уравнения. Поскольку он не удовлетворяет хотя бы одной части этого определения, это означает, что он считается «неопределенным». Так что это не работает, и это означает, что он будет «неопределенным». Теперь, для нашего следующего примера, иногда мы сталкиваемся с этой идеей, когда у нас на самом деле ноль делится на ноль. Что ж, я думаю, все мы можем согласиться с тем, что мы, очевидно, можем поставить там ноль, и вторая часть будет определена. Поскольку у нас есть ноль, который представляет собой наше «b», умноженное на ноль, что является нашим «с», это равно нашему «а», которое равно нулю. Итак, эта часть работает. Ну, мы также можем поставить 5, если захотим, потому что ноль умножить на 5 равно нулю, так что это все еще работает для второй части. Мы действительно можем подключить туда что угодно. Мы можем сказать, что ноль над нулем равен х. У нас все еще есть нуль, умноженный на x, равный нулю. Но я имею в виду, что это первая часть, которая не удовлетворена.
Так что это не удовлетворяет этой части уравнения. Поскольку он не удовлетворяет хотя бы одной части этого определения, это означает, что он считается «неопределенным». Так что это не работает, и это означает, что он будет «неопределенным». Теперь, для нашего следующего примера, иногда мы сталкиваемся с этой идеей, когда у нас на самом деле ноль делится на ноль. Что ж, я думаю, все мы можем согласиться с тем, что мы, очевидно, можем поставить там ноль, и вторая часть будет определена. Поскольку у нас есть ноль, который представляет собой наше «b», умноженное на ноль, что является нашим «с», это равно нашему «а», которое равно нулю. Итак, эта часть работает. Ну, мы также можем поставить 5, если захотим, потому что ноль умножить на 5 равно нулю, так что это все еще работает для второй части. Мы действительно можем подключить туда что угодно. Мы можем сказать, что ноль над нулем равен х. У нас все еще есть нуль, умноженный на x, равный нулю. Но я имею в виду, что это первая часть, которая не удовлетворена.


 Если результат указан в МоМ, то нормы одинаковы для всех лабораторий и для всех анализов: от 0,5 до 2 МоМ.
Если результат указан в МоМ, то нормы одинаковы для всех лабораторий и для всех анализов: от 0,5 до 2 МоМ.
 Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата.
Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.

 Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл.
Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл. Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.