Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
смесь азота с водородом при нагревании пропустили над катализатором. В результате реакции с выходом 60% был получен аммиак, а содержание водорода в…
В результате реакции с выходом 60% был получен аммиак, а содержание водорода в…
Навеска KOH массой 1,2046 г…
Решено
Школьный курс, кинематика
11 кл химия
Решено
Al+HCl=AlCl3+h3 Li+O2=Li2O нужно доделать) поставить + и — спасибо)
Амфотерные гидроксиды 11 класс онлайн-подготовка на Ростелеком Лицей
Понятие «амфотерность»
С греческого языка слово «amphoteros» переводится как «тот и другой». Амфотерность – это двойственность кислотно-основных свойств вещества. Амфотерными называют гидроксиды, которые в зависимости от условий могут проявлять как кислотные, так и основные свойства.
Состав и свойства амфотерных гидроксидов
Примером амфотерного гидроксида может служить гидроксид цинка. Формула этого гидроксида в основной форме – Zn(OH)2. Но можно записать формулу гидроксида цинка в кислотной форме, поставив на первое место атомы водорода, как в формулах неорганических кислот: H2ZnO2 (рис. 1). Тогда ZnO22- будет кислотным остатком с зарядом 2-.
1). Тогда ZnO22- будет кислотным остатком с зарядом 2-.
Рис. 1. Формулы гидроксида цинка
Особенностью амфотерного гидроксида является то, что в нем мало различаются по прочности связи О-Н и Zn-O. Отсюда и двойственность свойств. В реакциях с кислотами, готовыми отдать катионы водорода, гидроксиду цинка выгодно разрывать связь Zn-O, отдавая ОН-группу и выступая в роли основания. В результате таких реакций образуются соли, в которых цинк является катионом, поэтому их называют солями катионного типа:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
(основание)
В реакциях со щелочами гидроксид цинка выступает в роли кислоты, отдавая водород. При этом образуются соли анионного типа (цинк входит в состав кислотного остатка – аниона цинката). Например, при сплавлении гидроксида цинка с твердым гидроксидом натрия образуется Na2ZnO2 – средняя соль анионного типа цинкат натрия:
H2ZnO2 + 2NaOH(ТВ. ) = Na2ZnO2 + 2H2O
) = Na2ZnO2 + 2H2O
(кислота)
При взаимодействии с растворами щелочей амфотерные гидроксиды образуют растворимые комплексные соли. Например, при взаимодействии гидроксида цинка с раствором гидроксида натрия образуется тетрагидроксоцинкат натрия:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
[Zn(OH)4]2- – сложный анион, который принято заключать в квадратные скобки.
Таким образом, амфотерность гидроксида цинка обусловлена возможностью существования ионов цинка в водном растворе в составе как катионов, так и анионов. Состав этих ионов зависит от кислотности среды. В щелочной среде устойчивы анионы ZnO22-, а в кислотной среде устойчивы катионы Zn2+.
Амфотерные гидроксиды – нерастворимые в воде вещества, и при нагревании они разлагаются на оксид металла и воду:
Zn(OH)2 = ZnO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
Степень окисления металла в гидроксиде и оксиде должна быть одинаковой.
Получение амфотерных гидроксидов
Амфотерные гидроксиды – нерастворимые в воде соединения, поэтому их можно получить по реакции обмена между раствором соли переходного металла и щелочью. Например, гидроксид алюминия образуется при взаимодействии растворов хлорида алюминия и гидроксида натрия:
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
При сливании данных растворов образуется белый желеподобный осадок гидроксида алюминия (рис. 2).
Но при этом нельзя допустить избытка щелочи, ведь амфотерные гидроксиды растворяются в щелочах. Поэтому вместо щелочи лучше использовать водный раствор аммиака. Это слабое основание, в котором гидроксид алюминия не растворяется. При взаимодействии хлорида алюминия с водным раствором аммиака образуется гидроксид алюминия и хлорид аммония:
AlCl3 + 3NH3 • H2O = Al(OH)3↓ + 3NH4Cl
Рис. 2. Образование осадка гидроксида алюминия
Список литературы
- Новошинский И.
 И., Новошинская Н. С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008 (§54).
И., Новошинская Н. С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008 (§54). - Кузнецова Н. Е., Литвинова Т. Н., Лёвкин А. Н. Химия: 11 класс: Учебник для учащихся общеобраз. учрежд. (профильный уровень): в 2-х ч. Ч. 2. М.: Вентана-Граф, 2008 (с. 110-111).
- Радецкий А. М. Химия. Дидактический материал. 10-11 классы. – М.: Просвещение, 2011.
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «Алхимик» (Источник)
- Интернет-портал «Алхимик» (Источник)
- Интернет-портал «chemport» (Источник)
- Сайт преподавателя химии и биологии Коноваловой Лидии (Источник)
Домашнее задание
- с. 27-29 №№ 5.1, 5.
 15, 5.25 из Сборника задач и упражнений по химии для средней школы (Хомченко И. Д.), 2008.
15, 5.25 из Сборника задач и упражнений по химии для средней школы (Хомченко И. Д.), 2008.
Al(OH)3 + 3HCl = AlCl3 + 3h3O
| Поиск |
гидроксид алюминия + хлороводород = хлорид алюминия + вода |
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Реакция двойной замены
| + | |||||||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении Al(OH)
3 + 3HCl → AlCl 3 + 3H 2 OВ каких условиях Al(OH)3 (гидроксид алюминия) реагирует с HCl (хлороводородом)?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием AlCl3 (хлорид алюминия) и h3O (вода)?
Гидроксид алюминия реагирует с раствором соляной кислоты
В полном предложении вы также можете сказать, что Al(OH)3 (гидроксид алюминия) реагирует с HCl (хлороводородом) и производит AlCl3 (хлорид алюминия) и h3O (вода)
Явление после Al(OH)3 (гидроксид алюминия) реагирует с HCl (хлороводородом)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Другие вопросы, связанные с химическими реакциями Al(OH)
3 + 3HCl → AlCl 3 + 3H 2 OВопросы, связанные с реагентом Al(OH)3 (гидроксид алюминия)
Какие химические и физические характеристики Al(OH)3 (гидроксид алюминия)? В каких химических реакциях используется Al(OH)3 (гидроксид алюминия) в качестве реагента?
Вопросы, связанные с реагентом HCl (хлороводород)
Каковы химические и физические характеристики HCl (хлороводород)? В каких химических реакциях используется HCl (хлороводород) в качестве реагента?
Вопросы, связанные с продуктом AlCl3 (хлорид алюминия)
Каковы химические и физические характеристики AlCl3 (хлороводород)? Каковы химические реакции, в которых AlCl3 (хлорид алюминия) является продуктом?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (хлористого водорода)? В каких химических реакциях образуется h3O (вода)?
Уравнения с Al(OH)3 в качестве реагента
гидроксид алюминия
2AL (OH) 3 → AL 2 O 3 + 3H 2 O AL (OH) 3 + 3HCL → ALCL 3 + 3H 2 O AL (OH) 3 3 3 3 3H 2 O Al (OH) 3 3 3 3H 3H + HBr → H 2 O + AlBr 3 Просмотреть все уравнения с Al(OH)3 в качестве реагента
Уравнения с HCl в качестве реагента
хлористый водород
HCl + NaOH → H 2 O + NaCl Fe + 2HCl → FeCl 2 + H 2 2HCl + Zn → H 2 + ZnCl 2 Просмотреть все уравнения с HCl в качестве реагента
Рекламное объявление
Уравнения с HCl в качестве продукта
хлористый водород
CL 2 + C 3 H 8 → HCL + C 3 H 7 CL CO + H 2 O + PDCL 2 → 2HCL + CO 2 4 + PD C C 33333333333 гг. 2 H 5 Cl → C 2 H 4 + HCl
Просмотреть все уравнения с HCl в качестве продукта
2 H 5 Cl → C 2 H 4 + HCl
Просмотреть все уравнения с HCl в качестве продукта
Уравнения с HCl в качестве продукта
хлористый водород
CL 2 + C 3 H 8 → HCL + C 3 H 7 CL CO + H 2 O + PDCL 2 → 2HCL + CO 2 4 + PD CL CL CL CL 3333333333 гг. 2 + H 2 O → HCl + HClO Просмотреть все уравнения с HCl в качестве продукта
6.5: Классификация химических реакций (окислительно-восстановительные) (проблемы)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 111356
Некоторые из этих проблем представляют собой кульминацию всех типов реакций, которые мы рассмотрели в Блоке 6!
ПРОБЛЕМА \(\PageIndex{1}\)
Укажите, какой тип или типы реакции представляет каждое из следующих действий:
- \(\ce{Ca}(s)+\ce{Br2}(l)\rightarrow \ce{CaBr2}(s)\)
- \(\ce{Ca(OH)2}(водн.
 )+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\)
)+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\) - \(\ce{C6h22}(л)+\ce{9O2}(г)\rightarrow \ce{6CO2}(г)+\ce{6h3O}(г)\)
- Ответить на
окислительно-восстановительные (присоединение)
- Ответ б
кислотно-щелочной (нейтрализация)
- Ответ c
окисление-восстановление (сгорание)
ПРОБЛЕМА \(\PageIndex{2}\)
Укажите, какой тип или типы реакции представляет каждый из следующих:
- \(\ce{h3O}(g)+\ce{C}(s) \rightarrow \ce{CO}(g)+\ce{h3}(g)\)
- \(\ce{2KClO3}(s)\rightarrow \ce{2KCl}(s)+\ce{3O2}(g)\)
- \(\ce{Al(OH)3}(водн.)+\ce{3HCl}(водн.)\rightarrow \ce{AlBr3}(водн.)+\ce{3h3O}(l)\)
- \(\ce{Pb(NO3)2}(водн.)+\ce{h3SO4}(водн.)\rightarrow \ce{PbSO4}(s)+\ce{2HNO3}(водн.)\)
- Ответить на
окислительно-восстановительный (односместный)
- Ответ б
окисление-восстановление (диссоциация)
- Ответ c
кислотно-щелочной (нейтрализация)
- Ответ г
осадки (двойная замена)
ПРОБЛЕМА \(\PageIndex{3}\)
Серебро можно отделить от золота, поскольку серебро растворяется в азотной кислоте, а золото — нет. Является ли растворение серебра в азотной кислоте кислотно-основной или окислительно-восстановительной реакцией? Поясните свой ответ.
Является ли растворение серебра в азотной кислоте кислотно-основной или окислительно-восстановительной реакцией? Поясните свой ответ.
- Ответить
Это окислительно-восстановительная реакция, поскольку степень окисления серебра изменяется во время реакции.
ЗАДАЧА \(\PageIndex{4}\)
Определите степени окисления элементов в следующих соединениях:
- NaI
- GdCl 3
- LiNO 3
- Н 2 Се
- мг 2 кремний
- RbO 2 (супероксид рубидия)
- ВЧ
- Ответить на
На +1, И -1
903:50
- Ответ б
Gd +3, Cl-1
- Ответ c
Ли +1, Н +5, О -2
- Ответ d
Н+1, Се-2
- Ответ e
Mg+2, Si-4
- Ответ f
Руб +1, О -1/2
- Ответ г
Ч +1, Ж -1
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/RhFJDetBevk?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ЗАДАЧА \(\PageIndex{5}\)
Определите степени окисления элементов в перечисленных соединениях. Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
- Н 3 ПО 4
- Ал(ОН) 3
- СеО 2
- КНО 2
- В 2 С 3
- Р 4 О 6
- Ответить на
Н+1, Р+5, О-2
- Ответ б
Алюминий +3, Н +1, О-2
- Ответ c
Se +4, O-2
- Ответ d
К +1, Н +3, О -2
- Ответ e
В +3, С -2
- Ответ f
Р +3, О -2
ЗАДАЧА \(\PageIndex{6}\)
Определите степени окисления элементов в перечисленных соединениях. Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
- Н 2 SO 4
- Са(ОН) 2
- БроОН
- ClNO 2
- TiCl 4
- NaH
- Ответить на
Ч +1, О -2, С +6
- Ответ б
Н +1, О -2, Са +2
- Ответ c
Н+1, О-2, Вг+1,
- Ответ d
О-2, Кл-1, Н+5
- Ответ e
Кл-1, Ти +4
- Ответ f
Н +1, На -1
ЗАДАЧА \(\PageIndex{7}\)
Классифицируйте следующие реакции как кислотно-основные или окислительно-восстановительные:
- \(\ce{Na2S}(водн.
 )+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\)
)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\) - \(\ce{2Na}(т)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3}(г)\)
- \(\ce{Mg}(s)+\ce{Cl2}(g)\rightarrow \ce{MgCl2}(s)\)
- \(\ce{MgO}(s)+\ce{2HCl}(водн.)\rightarrow \ce{MgCl2}(водн.)+\ce{h3O}(l)\)
- \(\ce{K3P}(s)+\ce{2O2}(g)\rightarrow \ce{K3PO4}(s)\)
- \(\ce{3KOH}(водн.)+\ce{h4PO4}(водн.)\rightarrow \ce{K3PO4}(водн.)+\ce{3h3O}(l)\)
- Ответить на
кислотно-щелочной
- Ответ б
окисление-восстановление: Na окисляется, H + восстанавливается
- Ответ c
окисление-восстановление: Mg окисляется, Cl 2 восстанавливается
- Ответ d
кислотно-щелочной
903:50
- Ответ e
окислительно-восстановительный: P 3− окисляется, O 2 восстанавливается
- Ответ f
кислотно-щелочной
ЗАДАЧА \(\PageIndex{8}\)
Определите атомы, которые окисляются и восстанавливаются, изменение степени окисления для каждого из них, а также окислители и восстановители в каждом из следующих уравнений:
- \(\ce{Mg}(s)+\ce{NiCl2}(водн.
 )\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\)
)\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\) - \(\ce{PCl3}(l)+\ce{Cl2}(g)\rightarrow \ce{PCl5}(s)\)
- \(\ce{C2h5}(г)+\ce{3O2}(г)\rightarrow \ce{2CO2}(г)+\ce{2h3O}(г)\)
- \(\ce{Zn}(s)+\ce{h3SO4}(водный раствор)\rightarrow \ce{ZnSO4}(водный раствор)+\ce{h3}(g)\)
- \(\ce{2K2S2O3}(s)+\ce{I2}(s)\rightarrow \ce{K2S4O6}(s)+\ce{2KI}(s)\)
- \(\ce{3Cu}(т)+\ce{8HNO3}(водн.)\rightarrow \ce{3Cu(NO3)2}(водн.)+\ce{2NO}(г)+\ce{4h3O}( л)\)
- Ответить на
мг: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Ni: +2 \(\стрелка вправо\) 0; получает электроны; уменьшенный; окислитель
- Ответ б
П: +3 \(\стрелка вправо\) +5; теряет электроны; окисленный; восстановитель
Кл: 0 \(\стрелка вправо\) -1; получает электроны; уменьшенный; окислитель
- Ответ c
К: -2 \(\стрелка вправо\) +4; теряет электроны; окисленный; восстановитель
О: 0 \(\стрелка вправо\) -2; получает электроны; уменьшенный; окислитель
- Ответ d
Zn: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Ч: +1 \(\стрелка вправо\) 0; получает электроны; уменьшенный; окислитель
- Ответить по электронной почте
С: +2 \(\стрелка вправо\) +5/2; теряет электроны; окисленный; восстановитель
I: 0 \(\стрелка вправо\) -1; получает электроны; уменьшенный; окислитель
- Ответ f
Cu: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Н: +5 \(\стрелка вправо\) +2; получает электроны; уменьшенный; окислитель
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/CrCW_3j1jnI?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ЗАДАЧА \(\PageIndex{10}\)
При нагревании до 700–800 °C алмазы, представляющие собой чистый углерод, окисляются кислородом воздуха. (Они горят!) Напишите уравнение этой реакции.
- Ответить
\(\ce{C_{diamond}}(s)+\ce{O2}(g)\rightarrow \ce{CO2}(g)\)
ПРОБЛЕМА \(\PageIndex{11}\)
Военные экспериментировали с лазерами, излучающими очень интенсивный свет при взрывном соединении фтора с водородом. Каково сбалансированное уравнение этой реакции?
- Ответить
\(\ce{h3}(g)+\ce{F2}(g)\стрелка вправо \ce{2HF}(g)\)
ЗАДАЧА \(\PageIndex{12}\)
В обычном эксперименте в лаборатории общей химии (который вы проведете, если еще не сделали), металлический магний нагревают на воздухе для получения MgO. MgO представляет собой белое твердое вещество, но в этих экспериментах он часто выглядит серым из-за небольшого количества Mg9.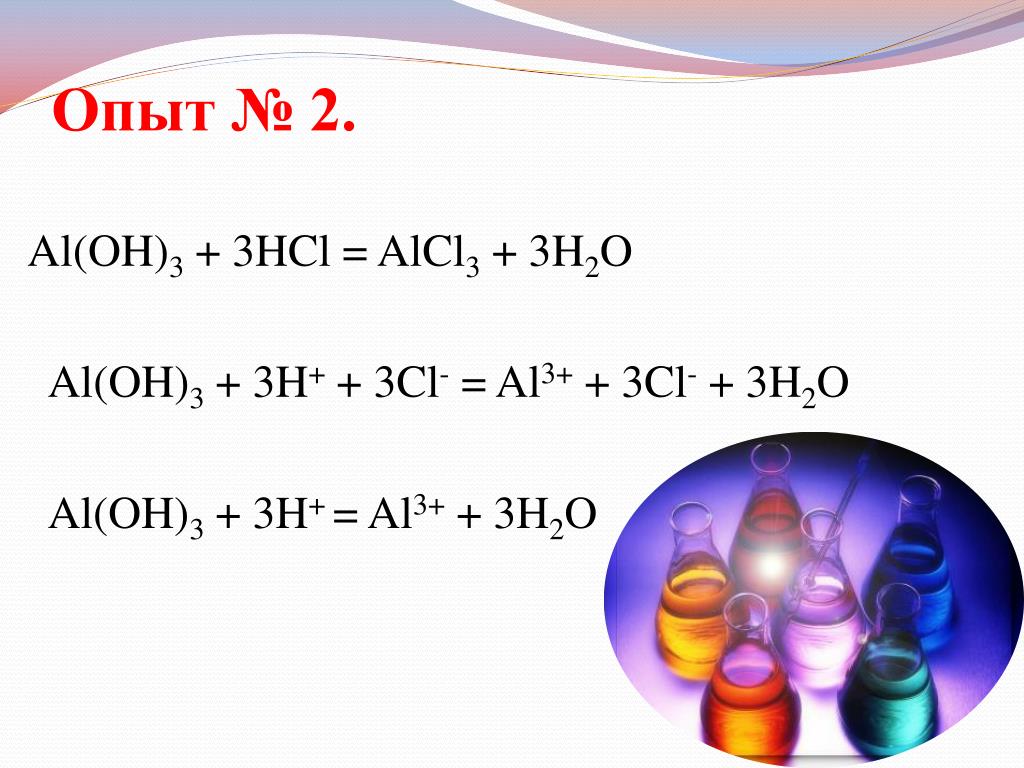 0033 3 N 2 , соединение, образующееся в результате реакции некоторого количества магния с азотом. Напишите сбалансированное уравнение для каждой реакции.
0033 3 N 2 , соединение, образующееся в результате реакции некоторого количества магния с азотом. Напишите сбалансированное уравнение для каждой реакции.
- Ответить
\(\ce{2Mg}(s)+\ce{O2}(g)\rightarrow \ce{2MgO}(s)\)
\(\ce{3Mg}(s)+\ce{N2}(g)\rightarrow \ce{Mg3N2}(s)\)
ЗАДАЧА \(\PageIndex{13}\)
Сульфид меди(II) окисляется молекулярным кислородом с образованием газообразного триоксида серы и твердого оксида меди(II). Затем газообразный продукт реагирует с жидкой водой с образованием жидкого гидросульфата в качестве единственного продукта. Напишите два сбалансированных уравнения, которые представляют эти реакции.
- Ответить
\(\ce{CuS}(s)+\ce{2O2}(g)\rightarrow \ce{SO3}(g)+\ce{CuO}(s)\)
\(\ce{SO3}(g)+\ce{h3O}(l)\rightarrow \ce{h3SO4}(l)\)
Авторы
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.


 04.14
04.14
 15, 5.25 из Сборника задач и упражнений по химии для средней школы (Хомченко И. Д.), 2008.
15, 5.25 из Сборника задач и упражнений по химии для средней школы (Хомченко И. Д.), 2008. )+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\)
)+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\) )+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\)
)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\) )\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\)
)\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(s)\)