ЕГЭ 2018 по химии: задания 30 и 31
Эти задания повышенного уровня сложности были введены в ЕГЭ только в 2018 году. Из пяти предложенных веществ предлагается выбрать такие, с которыми возможна окислительно-восстановительная реакция и реакция ионного обмена. Обычно вещества подобраны таким образом, что ученик может записать несколько вариантов реакции, но нужно выбрать и записать только одно уравнение из возможных.
Уместно рассмотреть задания 30 и 31 в комплексе, чтобы определить алгоритм действий и отметить типичные ошибки учащихся.
Подробно о задании № 30
Что должны уметь учащиеся?
- определять степень окисления химических элементов;
- определять окислитель и восстановитель;
- прогнозировать продукты реакции с учетом характера среды;
- составлять уравнения реакции и уравнения электронного баланса;
- расставлять коэффициенты в уравнении реакции.

ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы. Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тренировочных заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к заданиям, которые помогут объективно оценить уровень своих знаний и степень подготовленности к аттестационному экзамену. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьЧто нужно повторить? Важнейшие окислители и восстановители (обязательно связать со степенью окисления элементов), особое внимание уделить веществам, которые могут быть либо восстановителями, либо окислителями. Не забывать о двойственности процесса: окисление всегда сопровождается восстановлением! Еще раз повторить свойства окислителей:
- Азотная кислота.Чем активнее восстановитель и меньше концентрация кислоты, тем глубже протекает восстановление азота. Вспомнить, что азотная кислота окисляет неметаллы до оксокислот.
- Серная кислота. Обратная зависимость: чем выше концентрация кислоты, тем глубже протекает процесс восстановления серы. Образуется SO2, S, h3S.
- Соединения марганца. Здесь все зависит от среды — при этом встретиться на задании может не только KMnO4, но и другие соединения, с менее выраженными свойствами окислителя. В кислой среде продуктами реакции чаще всего бывают марганец и соли: сульфаты, нитраты, хлориды и т.д. в нейтральной — восстановление до оксида марганца (бурый осадок). В сильной щелочной среде происходит восстановление до манганата калия (ярко-зеленый раствор).
- Соединения хрома. Полезно помнить окраску продуктов реакции при взаимодействии веществ с хроматами и бихроматами. Запоминаем, что хроматы существуют в щелочной среде, а бихроматы — в кислой.
- Кислородсодержащие кислоты галогенов (хлора, брома, йода). Восстановление происходит до отрицательно заряженных ионов хлора и брома, в случае с йодом — обычно до свободного йода, при действии более сильных восстановителей — до отрицательно заряженного. Повторите названия кислот и солей хлора, йода и брома — ведь в названии представлены не формулы, а названия.
- Катионы металлов в высшей степени окисления. Прежде всего, медь и железо, которые восстанавливаются до невысоких степеней окисления. Такая реакция проходит с сильными восстановителями. Не путать эти реакции с обменными!
Полезно еще раз вспомнить свойства веществ с окислительно-восстановительной двойственностью, таких как пероксид водорода, азотистая кислота, оксид серы IV, сернистая кислота, сульфиты, нитриты. Из восстановителей, вероятнее всего, вам встретятся на ЕГЭ бескислородные кислоты и их соли, гидриды щелочных и щелочноземельных металлов. Их анионы окисляются до нейтральных атомов или молекул, которые могут быть способны к дальнейшему окислению.
При выполнении задания можно описывать различные типы реакции: межмолекулярные, конпропорционирования, диспропорционирования (самоокисления и самовосстановления). А вот реакцию разложения использовать нельзя, так как в задании есть ключевые слова: «составить уравнение между реагирующими веществами».
Как оценивается задание? Раньше за указание окислителя и восстановителя и за запись электронного баланса давалось по 1 баллу, теперь — за сумму этих элементов дается максимум 1 балл. Максимум за задание — 2 балла, при условиях правильной записи уравнения реакции.
Подробно о задании 31
Что нужно повторить?
- Правило составления реакции. Формулы сильных электролитов (сильных кислот, щелочей, растворимых средних солей) записываются в виде ионов, а формулы нерастворимых кислот, оснований, солей, слабых электролитов — в недиссоциированной форме.
- Условия протекания.
- Правила записи.Если записываем ион, то сначала указываем величину заряда, потом знак: обратить на это внимание. Степень окисления записывается наоборот: сначала знак, потом величина. Важно, что данная реакция протекает не просто в сторону связывания ионов, а наиболее полного связывания ионов. Это важно, потому что некоторые сульфиды, например, взаимодействуют со слабыми кислотами, а с некоторыми нет, и это связано со степенью прочности связей между элементами внутри соединений.

ЕГЭ. Химия. Большой сборник тематических заданий по химии для подготовки к ЕГЭ
Вниманию школьников и абитуриентов впервые предлагается учебное пособие для подготовки к ЕГЭ по химии, которое содержит тренировочные задания, собранные по темам. В книге представлены задания разных типов и уровней сложности по всем проверяемым темам курса химии. Каждый из разделов пособия включает не менее 50 заданий. Задания соответствуют современному образовательному стандарту и положению о проведении единого государственного экзамена по химии для выпускников средних общеобразовательных учебных учреждений. Выполнение предлагаемых тренировочных заданий по темам позволит качественно подготовиться к сдаче ЕГЭ по химии. Пособие адресовано старшим школьникам, абитуриентам и учителям.
Примеры заданий
Пример 1. Даны: сульфат хрома (III), нитрат бария, гидроксид калия, пероксид водорода, хлорид серебра.
Задание 30. Лучше всего сразу составить формулы веществ: так будет нагляднее. Затем — внимательно их рассмотреть. Вспоминаем, что сульфат хрома в щелочной среде окисляется до хромата — и пишем уравнение реакции. Сульфат хрома является восстановителем, пероксид водорода — окислителем. Степень окисления записывается как +3.
Задание 31. Здесь возможно несколько вариантов: например, взаимодействие сульфата хрома (III) со щелочью с образованием нерастворимого осадка. Или — образование комплексной соли в избытке щелочи. Или — взаимодействие нитрата бария с сульфатом хрома. Важно выбрать один вариант, который будет для ученика наиболее безопасным и прозрачным.
Пример 2. Даны: сульфид меди (II), нитрат серебра, азотная кислота, хлороводородная кислота, фосфат калия.
Задание 30. Вероятный выбор — взаимодействие сульфида меди и азотной кислоты. Обратите внимание, что это реакция не ионного обмена, а именно окислительно-восстановительная. Сульфиды окисляются до сульфатов, в результате получается сульфат меди (II). Поскольку кислота концентрированная, наиболее вероятно протекание реакции с образованием оксида азота (IV).
Задание 31. Здесь могут возникнуть сложности. Во-первых, есть риск в качестве уравнения ионного обмена выбрать взаимодействие между сульфидом меди и хлороводородной кислотой: это неверно. А вот что можно взять, так это образование хлорида серебра при взаимодействии нитрата серебра и хлороводородной кислоты. Можно взять и взаимодействие фосфата калия и нитрата серебра (не забудьте об образовании ярко-желтого осадка).
Пример 3. Даны: перманганат калия, хлорид калия, сульфат натрия, нитрат цинка, гидроксид калия.
Задание 31. Снова возможны варианты: образование гидроксида цинка или комплексной соли.
Пример 4. Даны: гидрокарбонат кальция, железная окалина, азотная кислота, соляная кислота, оксид кремния (IV).
Задание 30. Первая сложность — вспомнить, что такое железная окалина и как этот оксид железа будет себя вести. В процессе взаимодействия с азотной кислотой железо окисляется до трехвалентного, продуктом реакции становится нитрат железа (III). Если кислоту взять концентрированную, то продуктом также будет оксид азота (IV). Можно поступить иначе: представить взаимодействие концентрированных кислот, соляной и азотной. Иногда в заданиях обговаривается концентрация кислоты; если уточнений нет — можно выбрать любую концентрацию.
Задание 31. Здесь самый простой вариант — реакция гидрокарбоната кальция с соляной кислотой с выделением углекислого газа. Главное —записать формулу именно гидрокарбоната.

ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы. Теоретический материал изложен в краткой и доступной форме. Каждая тема сопровождается примерами тестовых заданий. Практические задания соответствуют формату ЕГЭ. В конце пособия приведены ответы к тестам. Пособие адресовано школьникам, абитуриентам и учителям.
Пример 5. Даны: гидроксид магния, хлорид железа (III), серная кислота, сульфид натрия, нитрат цинка.
Задание 30. Проблемное задание: при взаимодействии между хлоридом железа и сульфидом натрия происходит не обменный, а именно окислительно-восстановительный процесс. Если в реакции участвует соль сульфид, то образуется не хлорид, а сульфид железа (II). А при реакции с сероводородом — хлорид железа (II).
Задание 31. Например, можно взять сульфид натрия с разбавленной кислотой, с выделением сероводорода. Можно также написать уравнение между гидроксидом магния и серной кислотой.
rosuchebnik.ru
Реальный ЕГЭ по химии 2018. Задание 30
Задания 30 из реальных КИМов ЕГЭ 2018 по химии
Для выполнения задания используйте следующий перечень веществ: дихромат калия, серная кислота, карбонат аммония, кремнезём, нитрит калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: йодид калия, серная кислота, гидроксид алюминия, оксид марганца (IV), нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, оксид фосфора (V), оксид марганца (IV), фторид аммония, нитрат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: дихромат натрия, серная кислота, йодид натрия, силикат натрия, нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, углекислый газ, перманганат калия, фторид аммония, нитрат железа. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сульфат аммония, гидроксид калия, перманганат калия, нитрит калия, оксид меди (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, азотная кислота концентрированная, сульфат алюминия, оксид фосфора (V), нитрат меди (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, фтороводород, карбонат аммония, сульфат железа (II), дихромат калия, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома (III), оксид магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, сульфит калия, дихромат калия, серная кислота, гидроксид хрома (III), кремнезём. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, бром, нитрат бария, сульфат аммония, соляная кислота концентрированная, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, сера, азотная кислота концентрированная, углекислый газ, фторид серебра, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома (III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Ответы:
K2Cr2O7 + 3KNO2 + 4H2SO4→Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
2Cr6++6e → 2Cr3+ – окислитель, восстановился
N3+–2e → N5+ – восстановитель, окислился
K2Cr2O7 + 3K2S + 7H2SO4→Cr2(SO4)3 + 3S + 4K2SO4 + 7H2O
2Cr6+ +6e → 2Cr3+ – окислитель, восстановился
S2- –2e → S0 – восстановитель, окислился
Ответ (доп.): 3K2S + 4H2SO4→ 4S + 3K2SO4 + 4H2O(сопропорционирование)
2KI + MnO2 + 2H2SO4→ I2 + MnSO4 + K2SO4 + 2H2O
2I— –2e → I2– восстановитель, окислился
Mn4+ +2e → Mn2+ – окислитель, восстановился
Ответ (доп.): 8KI + 5H2SO4→4I2 + H2S + 4K2SO4 + 4H2O
MnO2 + 4HCl → MnCl2 + Cl2 +2H2O
2Cl— –2e → Cl2 – восстановитель, окислился
Mn4+ +2e → Mn2+ – окислитель, восстановился
Na2Cr2O7 + 6NaI + 7H2SO4→ Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
2Cr6+ +6e → 2Cr3+ – окислитель, восстановился
2I— –2e → I2 – восстановитель, окислился
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Mn7+ +5e → Mn2+ – окислитель, восстановился
2Cl— –2e → Cl2 – восстановитель, окислился
2KMnO4 + KNO2 + 2KOH → 2K2MnO4 + KNO3 + H2O
Mn7+ +1e → Mn6+ – окислитель, восстановился
N3+ –2e → N5+ – восстановитель, окислился
H2S + 8HNO3(конц)→ H2SO4 + 8NO2 + 4H2O
S2- –8e → S6+ – восстановитель, окислился
N5+ +1e → N4+ – окислитель, восстановился
Na2Cr2O7 + 3H2S + 4H2SO4→Cr2(SO4)3 + 3S + Na2SO4 + 7H2O
2Cr6+ +6e → 2Cr3+ – окислитель, восстановился
S2- –2e → S0 – восстановитель, окислился
Ответ (доп.): H2S + H2SO4→ S + SO2 + 2H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4→Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
2Cr6+ +6e → 2Cr3+ – окислитель, восстановился
Fe2+ –1e → Fe3+ – восстановитель, окислился
KClO3 + Cr2O3 + 4NaOH → KCl + 2Na2CrO4 + 2H2O
Cl5+ +6e →Cl— – окислитель, восстановился
2Cr3+ –6e → 2Cr6+ – восстановитель, окислился
K2Cr2O7 + 3K2SO3 + 4H2SO4→Cr2(SO4)3 + 4K2SO4 + 4H2O
2Cr6+ +6e → 2Cr3+ – окислитель, восстановился
S4+ –2e → S6+ – восстановитель, окислился
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Mn7+ +5e → Mn2+ – окислитель, восстановился
2Cl— –2e → Cl2 – восстановитель, окислился
Na2SO3 + Br2 + H2O →Na2SO4 +2HBr
Br2 + 2e → 2Br— – окислитель, восстановился
S4+ –2e → S6+ – восстановитель, окислился
Ответ (доп.): Br2 + 2KOH →KBr + KBrO + H2O (или KBrO3если нагреваем)
Na2SO3 + Br2 + 2KOH→Na2SO4 +2KBr + h3O
S + 6HNO3(конц)→H2SO4 + 6NO2 + 2H2O
S0 –6e → S6+ – восстановитель, окислился
N5+ +1e → N4+ – окислитель, восстановился
2H2O2 + Cr2O3 + 4KOH → 2K2CrO4 + 5H2O (при нагревании)
2O— +2e → 2O2- – окислитель, восстановился
2Cr3+ –6e → 2Cr6+ – восстановитель, окислился
2Na2CrO4 + 6NaBr + 8H2SO4→ Cr2(SO4)3 + 3Br2 + 5Na2SO4 + 8H2O
2Cr6+ +6e → 2Cr3+ – окислитель, восстановился
2Br— –2e → Br2 – восстановитель, окислился
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
www.yoursystemeducation.com
Задание 30 ЕГЭ по химии 2019: теория и практика
Блок «Химическая реакция. Методы познания в химии. Химия и жизнь. Расчеты по химическим формулам и уравнениям реакций»
Усвоение элементов содержания этого блока проверяется заданиями различного уровня сложности, в их числе 4 задания базового уровня сложности, 4 задания повышенного уровня сложности и 2 задания высокого уровня сложности.
Элементы содержания блока имеют прикладной и практико-ориентированный характер, что обусловливает некоторую особенность заданий, ориентированных на проверку усвоения этого материала.
Выполнение заданий этого блока предусматривает проверку сформированности следующих умений: использовать в конкретных ситуациях знания о применении изученных веществ и химических процессов, промышленных методах получения некоторых веществ и способах их переработки; планировать проведение эксперимента по получению и распознаванию важнейших неорганических и органических веществ на основе приобретённых знаний о правилах безопасной работы с веществами в быту; проводить вычисления по химическим формулам и уравнениям.
Некоторые из элементов содержания данного блока, такие как определение характера среды водных растворов веществ, индикаторы, расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного, расчёты массовой доли (массы) химического соединения в смеси, проверялись в рамках одного задания в комплексе с другими элементами содержания.
Рассмотрим задания этого блока из демонстрационного варианта.
#ADVERTISING_INSERT#
Задания высокого уровня сложности по темам «Реакции окислительно-восстановительные» и «Реакции ионного обмена» связаны единым контекстом. Для выполнения задания 30 экзаменуемым необходимо самостоятельно выбрать из предложенного перечня веществ те, между которыми может протекать окислительно-восстановительная реакция, а не работать с уже готовой схемой реакции, как было в прошлые годы. Далее следует составить уравнение реакции, привести электронный баланс и указать вещество-окислитель и вещество-восстановитель. Для выполнения задания 31 необходимо выбрать из предложенного перечня веществ те, между которыми возможна реакция ионного обмена, а затем записать уравнения в молекулярной, полной и сокращенной ионной формах. Оба задания максимально оцениваются в 2 балла каждое. При выполнении этого задания обучающимся необходимы также умения составлять уравнения реакций ионного обмена в молекулярном, полном и сокращенном ионном виде.
Рассмотрим задания 30 и 31 с единым контекстом из демонстрационного варианта.
|
Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ. |
Задание 30
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения этого задания необходимо проанализировать окислительно-восстановительные свойства предложенных веществ. Среди предложенных веществ правильным окислителем является перманганат калия, который будет проявлять окислительные свойства за счет атомов марганца в высшей степени окисления +7.
Сульфит натрия за счет атомов серы в промежуточной степени окисления +4 способен проявлять как окислительные, так и восстановительные свойства. При взаимодействии с перманганатом калия – сильным окислителем – сульфит натрия будет являться восстановителем, окисляясь до сульфата натрия.
Реакция может протекать в различных средах, в контексте данного перечня веществ – в нейтральной или в щелочной. Обратим внимание на то, что в ответе следует записать только одно уравнение окислительно-восстановительной реакции.
Вариант ответа:
Сульфит натрия или сера в степени окисления +4 является восстановителем.
Перманганат калия или марганец в степени окисления +7 – окислителем.
ЕГЭ-2020. Химия. Сборник заданий: 600 заданий с ответами
Пособие содержит тренировочные задания базового и повышенного уровней сложности, сгруппированные по темам и типам. Задания расположены в такой же последовательности, как предлагается в экзаменационном варианте ЕГЭ. В начале каждого типа задания указаны проверяемые элементы содержания – темы, которые следует изучить, прежде чем приступать к выполнению. Пособие будет полезно учителям химии, так как дает возможность эффективно организовать учебный процесс на уроке, проведение текущего контроля знаний, а также подготовку учащихся к ЕГЭ.
Купить
rosuchebnik.ru
Разбор задания №30 ЕГЭ по географии
Климатическая задача
Тридцатое задание ЕГЭ по географии во многом схоже с предыдущим – также нужно приводить два компонента ответа, основываясь на данный материал. Но в нем условия чаще даются не в таблице, а в графиках температуры и осадков, профиле рельефа, схематической карте или климатограмме.
Также разница заключается в том, что в предыдущем задании прямо указывается положение, к которому нужно приводить два компонента ответа, а в этом нужно самому делать вывод по данному иллюстративному материалу и писать подтверждения. Различаются и проверяемые аспекты географии: в 30 задании упор делается на темы о климате – климатических зонах, эрозии, годовом ходе осадков и температуры, стихийных бедствиях, солнечной радиации, муссонах и пассатах, загрязнении атмосферы.
Получается, что всего в ответе должно быть три элемента: одно предложение, содержащее ваш собственный вывод (например, в каком пункте солнечная радиация больше), и два обоснования-аргумента. Если все три элемента написаны верно и их смысл аналогичен тому, что указано в критериях у эксперта – ставится 2 балла. При наличии двух любых верных элементов ответа ставится 1 балл. Во всех остальных ситуациях баллы за задание не ставятся.
Разбор типовых вариантов задания №30 ЕГЭ по географии
Первый вариант задания
Определите, на каком из участков, обозначенных цифрами 1, 2 и 3 наиболее вероятно развитие водной эрозии почвы. Для обоснования ответа укажите два довода; в случае, если приведено более двух доводов, оцениваются только первый и второй.
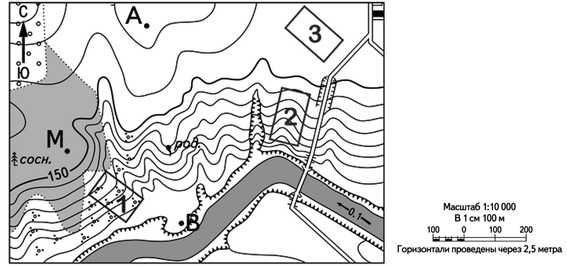 Как известно, возникновение эрозии наиболее вероятно на крутых склонах. Те почвы, которые покрыты многолетней травой и кустарниками, подвержены эрозии меньше всего. На карте видно, что участок под номером 1 покрыт кустарниками – значит, водная эрозия на нем маловероятна. Участок 3 располагается на равнинной местности, поэтому водная эрозия на нем также не очень вероятна. А вот участок под номером 2 находится на крутом склоне и растительности на нем нет – поэтому там наиболее вероятно возникновение эрозии.
Как известно, возникновение эрозии наиболее вероятно на крутых склонах. Те почвы, которые покрыты многолетней травой и кустарниками, подвержены эрозии меньше всего. На карте видно, что участок под номером 1 покрыт кустарниками – значит, водная эрозия на нем маловероятна. Участок 3 располагается на равнинной местности, поэтому водная эрозия на нем также не очень вероятна. А вот участок под номером 2 находится на крутом склоне и растительности на нем нет – поэтому там наиболее вероятно возникновение эрозии.
Запишем ответ:
Опасность развития водной эрозии наиболее вероятна на участке под номером 2 – он расположен на крутом склоне, где нет растительности. Участок 1 покрыт кустарниками, что снижает риск возникновения эрозии. Участок 3 находится на пологой поверхности – отсутствие крутых склонов также уменьшает вероятность начала эрозии.
Второй вариант задания
Определите, в каком из промышленных центров, которые обозначены на карте буквами А и В, наблюдается большее загрязнение атмосферы. Приведите два аргумента, обосновывающих ваш ответ.
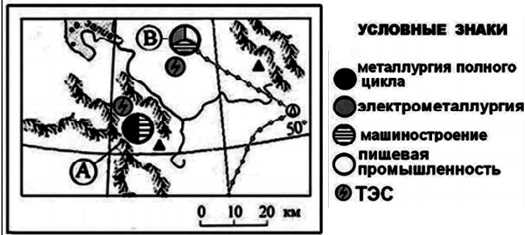
В пункте А находятся предприятия со специализациями «металлургия полного цикла» и «машиностроение», а в пункте В – «пищевая промышленность», «электрометаллургия» и «машиностроение». Известно, что больший урон окружающей среде наносит металлургия полного цикла – ведь она включает в себя все стадии производства. Также мы видим, что около пункта А находится ТЭС и ведется добыча железной руды – все это сильно загрязняет атмосферу. Еще один фактор – расположение пункта А в межгорной котловине; зимой там застаивается холодный воздух из-за инверсии температур (их повышения в зависимости от высоты).
Наш ответ – пункт А. Пишем ответ:
Большее загрязнение окружающей среды характерно для пункта А, потому что:
- Металлургия полного цикла по сравнению с электрометаллургией сильнее загрязняет атмосферу, потому что она включает в себя все производственные стадии – даже такие «грязные», как обогащение руды, выплавка чугуна.
- Около пункта А добывают железную руду, тогда как пункт В находится на некотором отдалении от места добычи. В дополнение, около пункта А располагается ТЭС, которая является мощным загрязнителем атмосферы.
Третий вариант задания
Планы построения ГЭС на реке Шилка, которая находится в Забайкальском крае, часто становятся объектом для споров. Противники этого проекта считают, что в результате возведения ГЭС и создания водохранилища могут произойти значительные изменения в климате расположенных рядом территорий. Укажите два изменения, которые могут быть вызваны созданием водохранилища.
С поверхности водохранилища активно испаряется вода, из-за чего возрастает влажность воздуха и, как следствие, увеличивается количество атмосферных осадков. Также водохранилища приводят к тому, что зимние температуры становятся выше, а летние – ниже, из-за чего могут возникать бризы. Это и нужно записать в ответе.
spadilo.ru
Задание 30 — Подготовка к ЕГЭ по химии
1. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) нитрат натрия
Б) фосфат натрия
В) сульфид калия
Г) нитрат алюминия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
2. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) NaNO3
Б) HgF2
В) Fe(NO3)3
Г) Ca(CH3COO)2
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
3. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) KNO3
Б) CuF2
В) CrBr3
Г) CH3COOK
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
4. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) карбонат аммония
Б) нитрат алюминия
В) сульфид натрия
Г) иодид калия
ОТНОШЕНИЕ СОЛИ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
5. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) FeCl2
Б) Al2S3
В) (CH3COO)2Cu
Г) (CH3COO)2Ba
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
6. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) нитрат алюминия
Б) сульфат калия
В) сульфид калия
Г) карбонат аммония
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
7. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) нитрат натрия
Б) нитрат меди (II)
В) сульфит калия
Г) карбонат аммония
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
8. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) CH3COOK
Б) NH4Cl
В) Na2CO3
Г) NH4NO2
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
9. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) фосфат аммония
Б) нитрат цинка
В) карбонат калия
Г) сульфат натрия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
10. Установите соответствие между формулой соли и средой водного раствора этой соли.
ФОРМУЛА СОЛИ
А) Pb(NO3)2
Б) K2CO3
В) NaNO3
Г) Li2S
СРЕДА РАСТВОРА
1) нейтральная 2) кислая 3) щелочная
11. Установите соответствие между названием соединения и средой его водного раствора.
НАЗВАНИЕ ВЕЩЕСТВА
А) фосфат калия
Б) ацетат бария
В) нитрат хрома (III)
Г) нитрат натрия
СРЕДА РАСТВОРА
1) нейтральная 2) кислая 3) щелочная
12. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) нитрат калия
Б) сульфид бария
В) хлорид алюминия
Г) карбонат натрия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
13. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) хлорид цинка
Б) сульфид калия
В) нитрат натрия
Г) нитрат меди (II)
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
14. Установите соответствие между формулой соли и средой водного раствора этой соли.
ФОРМУЛА СОЛИ
А) NH4NO3
Б) ZnSO4
В) CH3COONa
Г) NaBr
СРЕДА РАСТВОРА
1) щелочная 2) кислая 3) нейтральная
15. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) сульфид натрия
Б) бромид цезия
В) сульфид алюминия
Г) сульфид бария
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается 2) гидролиз по катиону
3) гидролиз по аниону 4) гидролиз по катиону и аниону
16. Установите соответствие между формулой соли и средой водного раствора этой соли.
ФОРМУЛА СОЛИ
А) Na2S
Б) K2SO3
В) Cs2SO4
Г) Al2(SO4)3
СРЕДА РАСТВОРА
1) кислая 2) нейтральная 3) щелочная
17. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) карбонат натрия
Б) хлорид аммония
В) сульфат калия
Г) сульфид алюминия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
18. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) карбонат калия
Б) иодид кальция
В) сульфид аммония
Г) фосфат натрия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается 2) гидролиз по катиону
3) гидролиз по аниону 4) гидролиз по катиону и аниону
19. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) пропионат аммония
Б) сульфид цезия
В) сульфид алюминия
Г) карбонат натрия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) не гидролизуется 2) гидролизуется по катиону
3) гидролизуется по аниону 4) гидролизуется по катиону и аниону
20. Установите соответствие между формулой соли и средой водного раствора этой соли.
ФОРМУЛА СОЛИ
А) Cu(NO3)2
Б) K2S
В) LiCl
Г) Na2SO3
СРЕДА РАСТВОРА
1) нейтральная 2) кислая 3) щелочная
21. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) BaBr2
Б) CuCO3
В) Pb(NO3)2
Г) Ca(CH3COO)2
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролиз по катиону 2) гидролиз по аниону
3) гидролиз по катиону и аниону 4) гидролизу не подвергается
22. Установите соответствие между названием соли и способностью этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) ацетат натрия
Б) иодид кальция
В) сульфид цинка
Г) карбонат калия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается 2) гидролиз по катиону
3) гидролиз по аниону 4) гидролиз по катиону и аниону
23. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) хлорид кальция
Б) сульфит калия
В) хлорид хрома (III)
Г) нитрат лития
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
24. Установите соответствие между названием соли и способностью этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) карбонат калия
Б) иодид лития
В) сульфид аммония
Г) пропионат бария
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается 2) гидролиз по катиону
3) гидролиз по аниону 4) гидролиз по катиону и аниону
25. Установите соответствие между названием соли и способностью этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) ацетат калия
Б) хлорид лития
В) сульфид алюминия
Г) нитрит кальция
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается 2) гидролиз по катиону
3) гидролиз по аниону 4) гидролиз по катиону и аниону
26. Установите соответствие между названием соли и отношением этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) карбонат аммония
Б) нитрат свинца (II)
В) сульфит натрия
Г) иодид калия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролиз по катиону 2) гидролиз по аниону
3) гидролиз по катиону и аниону 4) гидролизу не подвергается
27. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) (NH4)2CO3
Б) NH4Cl
В) Na2SO3
Г) NaNO2
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролиз по катиону 2) гидролиз по аниону
3) гидролиз по катиону и аниону 4) гидролизу не подвергается
28. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) KCl
Б) HgF2
В) Cr(NO3)3
Г) Sr(CH3COO)2
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролиз по катиону 2) гидролиз по аниону
3) гидролиз по катиону и аниону 4) гидролизу не подвергается
29. Установите соответствие между названием соли и способностью этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) нитрит калия
Б) сульфат натрия
В) сульфит аммония
Г) ацетат кальция
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается 2) гидролиз по катиону
3) гидролиз по аниону 4) гидролиз по катиону и аниону
30. Установите соответствие между названием соли и способностью этой соли к гидролизу.
НАЗВАНИЕ СОЛИ
А) ацетат натрия
Б) бромид цезия
В) сульфид хрома (III)
Г) сульфид бария
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизу не подвергается 2) гидролиз по катиону
3) гидролиз по аниону 4) гидролиз по катиону и аниону
school4eg.jimdo.com
Задача 1 3 5 7 9 11 от UPSC — и отношение людей к релевантности информации
Скрытый текст — нажмите для просмотра вариантов
Вариант решения 2: составить новые сущности из уже существующих (заменить стариков молодыми:)
А давайте просто исходить из того, что число — понятие гибкое, и мы можем взять как число что-то после запятой. Составить новое число из существующих с помощью каких-то операций. Например, было в условии 3, а мы возьмем 3,5 — они ведь стоят рядом, но нигде не сказано, что этого делать нельзя. Решение тогда на поверхности:
- 7,9+9,1+13 = 30
- 1+1,3+5,7+7+15=30
В маркетинге это называют элементом стратегии дифференциации при создании новой категории как УТП 🙂 К чему это приводит, я также писал в статье про поисковой шум.
Вопрос в связи с этим простой: почему кто-то решил, что допускается взять 9,1 вместо 9,11? Ведь рядом стоят именно 7,9 и 9,11. Какое-то избирательное право получается) И если задача из теста UPSC-2013 заключалась в том, чтобы обмануть пользователя, замаскировав дробные числа под запятыми — это не задача на математику, не задача на сообразительность, а просто чушь.
В задачи национального теста не вводятся сознательные искажения с целью обмануть пользователя — хотя бы потому, что в реальной жизни мошенничество наказывается по закону:)
Если же реально решение подразумевало дробные числа, то условие некорректно, потому что 7,9 — это ОДНО число, а не «два числа через запятую» (или «два числа через точку»). Тогда мы снова приходим к тому, что задача поставлена неверно и пользователей хотят обмануть… И еще, тест ведь изначально был на английском языке, а в английском для чисел вообще-то используют не запятые, а точки. Поэтому такое использование запятых в этом решении — явно незаконная манипуляция, искажающая условие в пользу решающего, но не воспроизводящая релевантный процесс.
Вариант решения 2.1: найти мнимую сущность
К чему еще ищущий решение человек может придраться в условии задачи, чтобы найти «правильный» ответ? Например, к тому, что все числа не имеют между собой пробелов. Уау!
«А почему вы делите числа ровно по запятой? Все числа не имеют между собой пробелов. Это что говорит? Что я могу их брать из всего ряда и делить сам».
Или:
«В условии явная ошибка, после запятых нет пробелов, это лазейка для любого подтасованного решения».
По факту такие объяснения — это оправдание наличием мнимой сущности (т.е. не мы создали искажение, а кто-то другой это сделал сознательно). Ведь отсутствие пробелов понимается как нарушение стандарта, т.е. каких-то договоренностей, соблюдаемых всеми сторонами для обеспечения понимания, т.е. создания релевантности. Но это притянуто за уши — ведь ряд чисел здесь длинный, и пробел — это абсолютно незначительная категория, сути она не меняет. Почему бы не убрать тогда запятые вообще и не выхватывать любые подходящие числа?
Поэтому очень понятным становится возмущение профессионального математика, который просто приходит в небольшой шок от такого допущения:)
«Я извиняюсь, а вы в школе систему записи чисел арабскими цифрами проходили? Есть же какие-то конвенции, в конце концов! В любой нормальной задаче, если вас просят что-то сделать, используя числа 12, 15 и 23 это не значит, что вы можете использовать числа 2 и 3 только потому, что вам захотелось разделить 23»
Ну, потому что это факт, это договоренность о стандартах, а кто-то их хочет нарушить и использовать по своему усмотрению.
Проблема с нашей задачей в том, что в условии сказано использовать данные числа, а не составить из данных чисел новые.
Вариант решения 3: создать новые отношения
Другие варианты из того же разряда — это ввести в использование дополнительные знаки и операции. Например, вставить в пустые квадраты плюс, минус, скобки, корень, дроби, умножение, деление, степени, факториал, и т.д., и т.п. То есть создать какие-то новые отношения, исходя из своего опыта и контекста. Например:
- 15+5+(11-1)=30
- sqrt(9)+13+15=30
- 15+15-30=0
Еще более крутое, но в то же время элегантное искажение:
Здесь мы видим не только добавление новой сущности, но и сознательное изменение условия задачи, т.е. изменение результата, для которого мы ищем наиболее релевантный процесс! А что: изменили результат и создали новый процесс, и добились результата! Ничего не напоминает? Такой метод очень часто использует пропаганда…

[adguru adid=»3″]
Вариант решения 4: изменяем систему
Еще один умный и распространенный вариант — изменить систему счисления (хотя нам и не сказано, что это можно сделать, как и п.2). Но зато результаты достигаются легко и довольно быстро:
- в 2-ичной системе 30 — 11110, а 15 — 1111 (2 раза по 11) — может быть, в задачке экзамена UPSC намек на двоичную систему счисления?
Как пошутил один пользователь, «все люди делятся на 10 типов: те, кто знает, что такое двоичная система счисления, и те, кто не знает».
- или в 5-ричной системе: 13+11+1=30
- или в 11-ричной системе: 15(16)+11(12)+5(5) =30(33)
- или в 15-ричной системе: 15+13+7=30
- или в 17-ричной системе: 15+15+7=30
О проблеме такого подхода в следующем пункте. И кстати, почему тогда заявляется, что так мало людей решили эту задачу в Индии на тестировании, если на форумах это одно из самых распространенных решений?))
Вариант решения 4.1: изменяем элементы системы
Некоторые идут еще дальше. Ведь можно не менять систему счисления, а лишь одно число перевести в другую систему. Скажем, приравнять одиннадцать к двум:
В жизни так часто и происходит: вроде бы все об одном, но каждый говорит на своем языке))) И вообще, кто сказал, что равенство должно оказаться верным?

Бред, конечно, но люди пишут об этом на полном серьезе. Интересно, в магазине они тоже подбирают новую систему счисления на кассе перед оплатой?))
Очевидно, что и процесс, и результат получаются в таком случае абсолютно нерелевантны.
Вам ничего это не напоминает? Из области seo мне лично приходят на ум блоги начинающих сеошников — ну просто абсолютные параллели))))
Вариант решения 4.2: изменить смысл элемента
Здесь все видно на скриншоте — кто-то даже не поленился нарисовать процесс в динамике, это так умиляет! Просто начинаешь представлять себе, как это непослушное число само кувыркается и приобретает нужную нам форму!..
Или как вариант давайте считать, что:
- 11 — это просто римское 2. А что?
Вариант решения 5: «я не такая, я жду трамвая»
Тут сразу несколько вариантов, которые можно описать как «наивно супер» или «сделаем вид, что не заметили». Например:
- оставить 1 поле пустым — но ведь в условии сказано заполнить поля тем, что есть!
- ввести в одно поле 0 — но ведь в условии не сказано, что можно разбивать числа, числа идут через запятую;
- создать в уме пустой квадрат за границами задачи — ведь в условии написано «заполните пустые места», а как бы про «пустые квадраты» ничего не сказано, поэтому после числа «30» довольно таки пусто! Вот и результат: 15+15+15=30+15
Вариант решения 6: украсть чужую сущность
Кстати, а ведь можно тогда для решения взять 0 из 30!
Или посчитать, что «0» — это ваще ничего, поэтому его можно пристраивать куда угодно, например, просто добавить его к единице:
[adguru adid=»3″]
Вариант решения 7: уплотнить сущности
Ну, то есть вписать 2 или больше чисел в клетку — на самом деле не сказано, что нельзя это сделать. Вот только не помогает, похоже — решений с таким подходом не находится. По факту этот вариант ближе к решению из пункта 2, т.к. тоже пытается создать новую сущность из уже существующих.
Вариант решения 8: изменить масштаб
Мне лично этот вариант очень нравится. Но работать он будет только в контексте, и это становится абсолютно не математической задачей! 🙂 А решения такие:
- 1 сутки + 5 часов + 1 час = 30 часов
- аналогично можно перевести в сантиметры
- или «взять 1 год до нашей эры, прибавить 15 лет, и еще 15 лет — получится 30 год нашей эры»
- и т.п.
Вариант решения 9: отказаться от решения
Ведь в задаче спрашивают «можете ли» — не проще ли ответить «не можем, потому что сложение 3 нечетных чисел не может в сумме дать четное»? Ну ок, не сдали тест?))
Но смысл в этом ответе есть и очень серьезный. Ведь на самом деле к этой задаче огромный интерес, я нашел больше 170 сообщений с разными вариантами решений только на одном форуме! Как написал один из пользователей «я думаю, так же ее решил и победитель, а вы хорошо продемонстрировали, почему все остальные с ней не справились — вы ищете лишние сущности там, где их нет.»

geoseo.by
Разбор задания №30 ОГЭ по обществознанию
Объяснение фактов
В задании С5 или №30 ОГЭ по обществознанию нам требуется объяснить ситуацию или социальный факт, приведенный в примере текста.
Теория к заданию №30 ОГЭ по обществознанию
Пятое задание – задача, имеющая, как правило, самостоятельное развернутое условие, – проверяет умение применять знания, почерпнутые из источника социальной информации, для решения конкретной проблемы.
По сути, данное задание предполагает перенос содержащейся в тексте информации в совершенно иной контекст, использование ее для осмысления и объяснения актуальных фактов и процессов реальной жизни, практических жизненных ситуаций.
Задачи, используемые в экзаменационной работе, имеют два уровня требований:
- первое относится непосредственно к ситуации, сформулированной в условии
- второе – ориентирует на поиск информации для решения проблемы в предложенном источнике
В вариантах используются разные модели условия: проблемная ситуация, социальный факт, статистические данные, проблемное высказывание и другие.
Разбор типовых вариантов задания №30 ОГЭ по обществознанию
Разберем следующий пример, текст тот же — средний класс:
Средний класс – часть общества, которая занимает по статусным позициям среднее положение между высшим и низшим классами. В начале XX века к среднему классу относили мелких собственников и независимых предпринимателей. Но по мере развития «общества массового благосостояния» в развитых странах произошло повышение жизненного уровня квалифицированных работников наёмного труда (менеджеры, юристы, бухгалтеры и банковские работники, преподаватели школ и вузов, врачи и др.), которые существенно пополнили ряды представителей среднего класса.
Среди учёных постоянно идут дебаты по поводу критериев выделения среднего класса. Чаще всего в качестве основных объективных критериев называют уровень образования и доходов, стандарты потребления, владение материальной или интеллектуальной собственностью, а также способность к высококвалифицированному труду. Кроме этих объективных критериев большую роль играет субъективное восприятие человеком своего положения, то есть его самоидентификация как представителя «социальной середины».
Являясь основной социальной группой, средний класс развитых стран выполняет ряд очень важных социальных функций. Основной среди них является функция социального стабилизатора: добившись определённого места в социальной структуре общества, представители среднего класса склонны поддерживать существующее государственное устройство, которое позволило им достигнуть их положения. Следует учитывать, что средний класс играет ведущую роль в процессах социальной мобильности, и это также укрепляет существующий социальный строй, предохраняя его от социальных катаклизмов: недовольство низшего класса своим положением уравновешивается представленными им вполне реальными возможностями для повышения статуса в обществе.
В сфере экономических отношений средний класс играет роль экономического донора – не только как производитель огромной части доходов общества, но и как крупный потребитель, инвестор и налогоплательщик.
В культурной сфере средний класс является хранителем и распространителем ценностей, норм, традиций и законов общества.
Именно средний класс поставляет кадры чиновников и управленцев разного ранга – как для государственного аппарата, так и для бизнеса. Деятельность гражданского общества также основана на активности представителей среднего класса.
Автор отмечает ведущую роль среднего класса в деятельности гражданского общества. Выскажите два предположения о причинах подобной активности среднего класса.
Можно привести следующие предположения:
- представители среднего класса достаточно образованны, чтобы понимать значение гражданского общества
- представителям среднего класса необходимо защищать свою собственность и положение в обществе
- представители среднего класса много путешествуют, могут сравнивать жизнь в разных странах, хотят привнести лучшее, что достигнуто другими странами
spadilo.ru
