что, как сбалансировать и часто задаваемые вопросы —
By Сания Джакати
AgNO3 является продуктом реакции между азотной кислотой и Ag (элементарным), поэтому легко реагирует с HCl. Рассмотрим некоторые факты о том, когда AgNO3 реагирует с HCl.
Соляная кислота, будучи сильной кислотой, обладает способностью полностью диссоциировать. Следовательно, он легко реагирует со многими соединениями. Нитрат серебра — это соль серебра, которая используется в качестве прекурсора для получения различных других соединений серебра (поскольку она довольно экономична).
Соляная кислота бесцветна и имеет характерный резкий запах. Он имеет pH 2. Нитрат серебра считается негигроскопичным соединением; следовательно, его можно легко использовать, и он очень устойчив к свету. В следующих разделах мы изучим множество фактов на основе HCl + AgNO.3 реакция.
Что является продуктом HCl и AgNO3?Когда HCl взаимодействует с AgNO3, полученные продукты — хлорид серебра и азотная кислота. Наблюдается, что образовавшийся продукт хлорид серебра нерастворим в воде.
Наблюдается, что образовавшийся продукт хлорид серебра нерастворим в воде.
HCl (водн.) + AgNO3(водн.) → AgCl(s) + HNO3(водный)
Какой тип реакции HCl + AgNO?3?Реакция между HCl и AgNO3 является простой формой кислотно-щелочной реакции. Его также можно назвать нейтрализация реакция, так как HCl действует как кислота, а AgNO3 выступает в качестве базы.
Как сбалансировать HCl + AgNO3?Мы можем сбалансировать HCl + AgNO3 легко реагировать, выполнив следующие шаги:
HCl + AgNO3 → AgCl + HNO3
- Первый шаг включает подсчет количества атомов каждого типа на стороне реагента и на стороне продукта.
- Следующий предполагает выравнивание количества атомов с обеих сторон (можно использовать любой метод).
- В приведенной выше реакции со стороны реагентов мы видим по одному атому водорода, хлора, серебра и азота.
 Элемент кислорода имеет 3 атома.
Элемент кислорода имеет 3 атома. - Со стороны продукта также водород, хлор, азот и серебро имеют по одному атому каждый, а кислород имеет 3 атома.
- Это означает, что уравнение уже находится в сбалансированной форме.
Для определения количества Ag можно провести титрование между Ag и HCl. Поскольку продуктом реакции является осадок, проводить ее следует очень осторожно.
Требуется аппаратБюретка (50 мл), подставка для бюретки, белая плитка, колба Эрленмейера и мерная колба.
ИндикаторныеФенолфталеин индикатор, может быть эффективно использован для проведения титрования между HCl и AgNO3 так как относится к классу кислотно-щелочных реакций. Индикатор дает розовый цвет в щелочной среде и становится от розового до бесцветного в кислой среде.
Пункт, который следует отметитьТитрантом при титровании является HCl, так как он добавляется в бюретку. AgNO3 раствор добавляют в колбу Эрленмейера.
AgNO3 раствор добавляют в колбу Эрленмейера.
- Аппарат необходимо правильно чистить и промывать соответствующими химикатами, используя очень меньшее количество химикатов.
- Бюретка заполнена стандартизированной HCl, а AgNO3 раствор отбирают в колбу Эрленмейера.
- В реакционную смесь добавляют индикатор фенолфталеин и тщательно перемешивают (при необходимости следует добавить буферный раствор).
- Титрование следует проводить очень осторожно, выпуская HCl по каплям из бюретки до тех пор, пока не будет наблюдаться изменение цвета.
- Когда видно характерное изменение цвета, мы можем сказать, что конечная точка реакции достигнута.
- Описанную выше процедуру следует повторить трижды, чтобы получить точные результаты.
- Используя формулу N1V1=N2V2, мы можем узнать желаемое количество.

Суммарное ионное уравнение реакции между HCl и AgNO3 обсуждается ниже:Чистое ионное уравнение
HCl + AgNO3 сопряженные парыСоль азотнокислого серебра и соответствующее сопряженное основание представляют собой сопряженную пару реакции между HCl и AgNO.3. Обратите внимание на следующую реакцию.
HCl + AgNO3 → Кл– + НАГНО3+
HCl и AgNO3 межмолекулярные силыМежмолекулярная сила, наблюдаемая в молекуле HCl, представляет собой взаимодействие ионного типа, при котором хлор (отрицательно заряженный) легко принимает электроны от водорода. Межмолекулярное взаимодействие, наблюдаемое в AgNO3 также ионное взаимодействие между катионом Ag и анионом нитрата.
HCl + AgNO3 энтальпия реакцииЭнтальпия реакции между HCl и AgNO3 составляет 22. 61 кДж/моль.
61 кДж/моль.
Реакция между HCl и AgNO3 не дает буферного раствора, так как образующиеся продукты представляют собой осадок (AgCl) и кислоту с pH 3 (HNO3).
HCl + AgNO3 полная реакция?Реакция между HCl и AgNO3 является полной реакцией, так как хлорид серебра и азотная кислота образуются почти в одинаковом соотношении.
HCl + AgNO3 экзотермическая или эндотермическая реакция?Реакция между HCl и AgNO3 есть эндотермическая реакция так как это реакция нейтрализации, а значение энтальпии положительное.
HCl + AgNO3 окислительно-восстановительная реакция?Реакция между HCl и AgNO3 не окислительно-восстановительный потенциал реакция. Причина обсуждается ниже.
- В окислительно-восстановительной реакции происходит как восстановление, так и окисление, и происходит изменение степени окисления веществ.

- В приведенном выше уравнении мы видим, что степени окисления видов не изменились. (Со стороны реагента и продукта степень окисления остается одинаковой). Это подтверждает, что это не окислительно-восстановительная реакция.
Реакция между HCl и AgNO3 является реакцией осаждения, так как образующийся продукт AgCl представляет собой осадок, нерастворимый в воде и оседающий на дне емкости.
HCl + AgNO3 обратимая или необратимая реакция?Реакция HCl + AgNO3 является необратимой реакцией, так как это реакция осаждения с образованием нерастворимого осадка.
HCl + AgNO3 реакция смещения?Реакция между HCl и AgNO3 представляет собой реакцию двойного замещения, поскольку два вещества взаимозаменяются с образованием продуктов.
Как сбалансировать NaOH + AgNO3 + HCl = AgCl + NaNO3 + H2OСледуя приведенным ниже шагам, мы можем легко сбалансировать уравнение:
- Сначала подсчитайте количество атомов каждого типа с обеих сторон.
 И уравнять количество атомов с обеих сторон.
И уравнять количество атомов с обеих сторон. - NaOH + AgNO3 + HCl = AgCl + NaNO3 + H2O
- Здесь, на стороне реагентов, у нас есть по одному атому натрия, серебра, хлора и азота. Два атома водорода и четыре атома кислорода.
- Со стороны продукта также имеется такое же количество атомов, по одному для азота, хлора, серебра и натрия. Два атома водорода и три кислорода. Следовательно, уравнение находится в сбалансированной форме.
- AgNO3 + HCl + NH3 = (Ag(NH3)2)Cl + HNO3
- Мы можем сбалансировать уравнение, выяснив каждый тип и количество атомов с обеих сторон. На следующем этапе их следует уравнять, как описано ниже.
- AgNO3 + HCl + 2NH3 = (Ag(NH3)2)Cl + HNO3
- Что мы сделали, так это умножили NH3 молекулы на 2.
 Таким образом, уравнение уравновешивается.
Таким образом, уравнение уравновешивается.
- FeCl2 + HCl + AgNO3 = Fe (НЕТ3)3 + AgCl + NO + H2O
- Приведенное выше уравнение может быть уравновешено путем уравнивания побочных частиц реагента и побочных частиц продукта, можно использовать метод проб и ошибок.
- Это означает, что количество атомов с обеих сторон должно быть одинаковым.
- Чтобы уравнять, мы умножили FeCl2 с 3, HCl с 4 и AgNO3 с 10 на стороне реагента.
- Что касается продукта, мы умножили Fe (NO3)3 с 3 и Н2О с 3.
- 3FeCl2 + 4HCl + 10AgNO3 = 3Fe(НЕТ3)3 + 10AgCl + NO + 2H2O
Реакция между HCl и AgNO3 представляет собой кислотно-щелочную реакцию, реакцию нейтрализации и двойного замещения. Поскольку значение энтальпии положительно, это эндотермическая реакция, необратимая, так как это реакция осаждения.
Поскольку значение энтальпии положительно, это эндотермическая реакция, необратимая, так как это реакция осаждения.
ГДЗ Хімія 8 клас Григорович §36 2021 / §38 2016 ХІМІЧНІ ВЛАСТИВОСТІ СОЛЕЙ відповіді » Допомога учням
Інші завдання дивись тут…
Контрольні запитання
Запитання 1
Речовини яких класів сполук утворюються під час взаємодії:
а) солі з кислотою; Солі, кислоти, причому нестійкі кислоти розкладаються на оксид і воду.
б) солі з основою; Основи і солі.
в) двох солей? Солі.
Запитання 2
Сформулюйте умови, за яких можливі реакції обміну у водних розчинах. Наведіть приклади реакцій.
а) між сіллю та кислотою;
За умови, якщо випадає осад або виділяється нестійка або летка кислота.
AgNO3 + HCl = AgCl↓ + HNO3
K2CO3 + 2HNO3 = 2KNO3 + H2O + CO2↑
б) між сіллю та основою;
Розчинна сіль взаємодіє з лугом за умови, якщо один із продуктів реакції випадає в осад.
FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
в) між двома солями.
За умови, якщо обидві початкові солі розчинні у воді й хоча б один із продуктів реакції випадає в осад.
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Запитання 3
Які кислоти є нестійкими? Карбонатна і сульфітна кислоти.
Наведіть рівняння реакцій їх розкладу.
H2CO3 = H2O + CO2↑
H2SO3 = H2O + SO2↑
Завдання для засвоєння матеріалу
Вправа 1
Яка речовина випаде в осад, якщо змішати розчини кальцій нітрату й сульфатної кислоти? У осад випаде малорозчинна сіль CaSO4↓.
Складіть рівняння реакції.
Ca(NO3)2 + H2SO4 = CaSO4↓ + HNO3
біла каламуть
Чи можна очікувати випадання осаду, якщо замість сульфатної кислоти взяти хлоридну? Ні, бо СaCl2 – розчинна сіль.
Чи можна очікувати випадання осаду, якщо замість сульфатної кислоти взяти сульфітну? Так, бо CaSO3 – малорозчинна сіль.
Ca(NO3)2 + H2SO3 = CaSO3↓ + HNO3
біла каламуть
Вправа 2
Складіть рівняння реакції добування вуглекислого газу з мармуру (кальцій карбонату) взаємодією з бромідною кислотою.
СaCO3 + 2HBr = CaBr2 + H2O + CO2↑
Вправа 3
Як добути з барій хлориду:
а) барій карбонат;
BaCl2 + Na2CO3 = 2NaCl + BaCO3↓
Реакцією обміну між двома солями.
б) аргентум хлорид?
BaCl2 + 2AgNO3 = Ba(NO3)2 + 2AgCl↓
Реакцією обміну між двома солями.
Вправа 4
У разі зливанні яких розчинів утворяться осади:
а) купрум (II) гідроксиду;
Розчинної солі з лугом:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
б) плюмбум (II) сульфату;
Розчинної солі з кислотою:
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3
Двох розчинних солей:
Pb(NO3)2 + Na2SO4 = PbSO4↓ + 2NaNO3
в) кальцій карбонату?
Двох розчинних солей:
CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl
Розчинної солі і лугу:
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
Зверніть увагу: Сa(OH)2 – сильна основа, виявляє всі властивості лугів.
Вправа 5
У пробірках містяться речовини: магній оксид, калій хлорид, залізо, плюмбум (II) нітрат, купрум (II) сульфат, сульфатна кислота, ферум (II) гідроксид, сульфур (VІ) оксид. З якими з речовин (MgO, KCl, Fe, Pb(NO3)2, CuSO4, H2SO4, Fe(OH)2, SO3) взаємодіятимуть:
а) хлоридна кислота;
Хлоридна кислота реагує з основним оксидом MgO, з металом Fe (що стоїть у ряді активності металів до водню), з сіллю Pb(NO3)2, з основою Fe(OH)2.
2HCl + MgO = MgCl2 + H2O
2HCl + Fe = FeCl2 + H2↑
2HCl + Pb(NO3)2 = PbCl2↓ + 2HNO3
2HCl + Fe(OH)2↓= FeCl2 + 2H2O
б) калій гідроксид;
Луг калій гідроксид реагує з солями Pb(NO3)2 i CuSO4, кислотою H2SO4, кислотними оксидом SO3.
2KOH + Pb(NO3)2 = Pb(OH)2↓ + 2KNO3
2KOH + CuSO4 = Cu(OH)2↓ + K2SO4
2KOH + H2SO4 = K2SO4 + 2H2O
2KOH + SO3 = K2SO4 + H2O
в) аргентум (I) нітрат;
Аргентум (І) нітрат реагує з металом Fe (бо розміщується у ряді активності металів лівіше від металу Ag, що є у складі солі), з солями KCl i CuSO4, кислотою H2SO4.
2AgNO3 + Fe = Fe(NO3)2 + 2Ag↓
AgNO3 + KCl = AgCl↓ +KNO3
2AgNO3 + CuSO4 = Ag2SO4↓ + Cu(NO3)2
2AgNO3 + H2SO4 = Ag2SO4↓ + 2HNO3
г) барій нітрат?
Барій нітрат реагує з сіллю CuSO4, кислотою H2SO4.
Ba(NO3)2 + CuSO4 = BaSO4↓ + Cu(NO3)2
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
Вправа 6
Визначте, які з речовин взаємодіятимуть між собою: кальцій гідроксид, хлоридна кислота, сульфур (ІV) оксид, вода, купрум (II) оксид. Складіть рівняння реакцій.
Ca(OH)2 +2HCl = CaCl2 + 2H2O
Ca(OH)2 + SO2 = CaSO3 + H2O
2HCl + CuO = CuCl2 + H2O
SO2 + H2O = H2SO3
SO2 + CuO = CuSO3
Вправа 7
Запишіть рівняння реакцій, які можуть відбуватися. Поясніть, чому деякі реакції не відбуваються:
а) Cu + ZnSO4 → не відбувається, бо мідь у ряді активності металів стоїть правіше від цинку
б) CaCO3↓+ NaOH → не відбувається, бо вихідна сіль CaCO3 є нерозчинною
в) Zn + CuSO4 = ZnSO4 + Cu↓;
г) NaBr + AgNO3 = AgBr↓ + NaNO3;
д) CaCO3 + 2HCl = CaCl2 + H2O + CO2↑;
е) BaSO4↓+ KNO3 → не відбувається, бо вихідна сіль BaSO4 є нерозчинною
Вправа 8
Допишіть рівняння реакцій обміну і вкажіть, з якої причини відбувається кожна з них:
а) CaO + 2HNO3 = Сa(NO3)2 + H2O
Кислота реагує з основним оксидом
б) Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑
Сіль реагуює з кислотою, бо утворюється нестійка кислота, що розкладається на воду і газ
в) KOH + HCl = KCl + H2O
Основа (луг) реагує з кислотою
г) Fe(OH)3+ 3HNO3 = Fe(NO3)3 + 3H2O
Основа реагує з кислотою
д) K2SO3 + CaCl2 = 2KCl + CaSO3↓
Розчинні солі реагують між собою, бо утворюється осад
е) 2KOH + SO2 = K2SO3 + H2O
Луг реагує з кислотним оксидом
є) Na2S + CuCl2 = 2NaCl + CuS↓
Розчинні солі реагують між собою, бо утворюється осад
ж) CuSO4 + Ba(OH)2 = BaSO4↓ + Cu(OH)2↓
Сіль реагує з лугом, бо утворюється осад
з) Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3↓
Сіль реагує з кислотою, бо утворюється осад
и) Ca(OH)2 + K2CO3 = CaCO3↓+ 2KOH
Основа, що проявляє всі властивості лугів, реагує з сіллю, бо утворюється осад
Вправа 9
З якими з наведених речовин взаємодіє купрум (II) хлорид: NaOH, H2SO4, AgNO3, Fe2O3, CO2, Zn, NaCl, Cu? Складіть рівняння реакцій.
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
CuCl2 + H2SO4 → не взаємодіють, бо жоден з продуктів реакції не випадає в осад
CuCl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl↓
CuCl2 + Fe2O3 → не взаємодіють, бо солі не реагують з оксидами
CuCl2 + СO2 → не взаємодіють, бо солі не реагують з оксидами
CuCl2 + Zn = ZnCl2 + Cu↓
CuCl2+ NaCl → не взаємодіють, бо є солями одної кислоти
CuCl2 + Cu → не взаємодіють, бо однаковий метал
Вправа 10
Складіть рівняння реакцій, що відповідають таким перетворенням:
а) BaO → BaCl2 → BaSO4;
BaO + 2HCl = BaCl2 + H2O
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
б) Ca → Ca(OH)2 → CaCO3 → CaO → CaCl2 → CaCO3;
Ca + 2H2O = Ca(OH)2↓ + H2↑
Ca(OH)2 + CO2 = CaCO3↓ + Н2О
CaCO3↓= CaO + СО2↑
CaO + 2HCl = CaCl2 + H2O
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
в) CuO → CuSO4 → Cu(OH)2 → CuO → CuCl2.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu(OH)2↓ = CuO + H2O
CuO + 2HCl = CuCl2 + H2O
Вправа 11
Безводну нітратну кислоту в лабораторії добувають дією на калійну селітру (калій нітрат) концентрованої сульфатної кислоти. Складіть рівняння реакції.
KNO3 + H2SO4 (конц.) = HNO3 + KHSO4
Як ви вважаєте, чому ця реакція можлива? Реакція можлива, бо концентрована сульфатна кислота H2SO4 сильніша за нітратну кислоту HNO3.
Вправа 12
Обчисліть масу осаду, що утворюється внаслідок взаємодії натрій сульфату з барій хлоридом масою 41,6 г.
Відомо: m(BaCl2)=41,6 г
Знайти m(ВаSO4)-?
Розв’язування
І спосіб
1. Обчислюємо кількість речовини BaCl2 масою 41,6 г за формулою n=m/M, де M=Mrг/моль
Обчислюємо кількість речовини BaCl2 масою 41,6 г за формулою n=m/M, де M=Mrг/моль
Mr(BaCl2)=Ar(Ba)+2•Ar(Cl)=137+2•35,5=208, М(BaCl2)=208 г/моль
n(BaCl2)=m(BaCl2)/M(BaCl2)=41,6 г : 208 г/моль=0,2 моль
2. Записуємо рівняння реакції: BaCl2+Na2SO4=BaSO4↓+2NaCl
За рівнянням реакції n(BaCl2):n(BaSO4)=1:1, кількість речовини однакова, тому
n(BaSO4)=n(BaCl2)=0,2 моль
3. Обчислюємо масу BaSO4 кількістю речовини 0,2 моль за формулою m=n•M
Mr(BaSО4)=Ar(Ba)+Ar(S)+4•Ar(O)=137+32+4•16=233, М(BaSО4)=233 г/моль
m(BaSО4)=n(BaSО4)•M(BaSО4)=0,2 моль•233 г/моль=46,6 г
ІІ спосіб
Записуємо рівняння реакції: BaCl2+Na2SO4=BaSO4↓+2NaCl
За рівнянням реакції n(ВаCl2)/1=n(BaSO4)/1
У цьому співвідношенні замінюємо кількість речовини барій хлориду і барій сульфату на співвідношення мас.
m(BaCl2)/М(BaCl2)=m(BaSO4)/M(BaSO4)
Звідси виражаємо масу барій сульфату:
m(BaSО4)•М(BaCl2)=М(BaSO4)•m(BaCl2), тому
m(BaSO4)=М(BaSO4)•m(BaCl2):M(BaCl2)
Обчислюємо молярні маси речовин і підставляємо значення у формулу.
Mr(BaCl2)=Ar(Ba)+2•Ar(Cl)=137+2•35,5=208, М(BaCl2)=208 г/моль,
Mr(BaSO4)=Ar(Ba)+Ar(S)+4•Ar(O)=137+32+4•16=233, М(BaSO4)=233 г/моль
m(BaSO4)=233 г/моль • 41,6 г : 208 г/моль=46,6 г
Відповідь: 46,6 г
Вправа 13
Обчисліть об’єм вуглекислого газу (н.у.), що виділяється внаслідок взаємодії магній карбонату масою 126 г із хлоридною кислотою.
Відомо: m(MgCO3)=126 г
Знайти: V(CO2)-?
Розв’язування
І спосіб
1. Обчислюємо кількість речовини MgCO3 масою 126 г за формулою n=m/M, де
Обчислюємо кількість речовини MgCO3 масою 126 г за формулою n=m/M, де
M=Mr г/ моль
Mr(MgCO3)=Ar(Mg)+Ar(C)+3•Ar(O)=24+12+3•16=84, M(MgCO3)=84 г/моль
n(MgCO3)=m(MgCO3)/M(MgCO3)=126 г : 84 г/моль=1,5 моль
2. Записуємо рівняння реакції: MgCO3+2HCl=MgCl2+H2O+CO2↑
За рівнянням реакції n(MgCO3):n(CO2)=1:1, кількість речовини однакова, тому
n(CO2)=n(MgCO3)=1,5 моль
3. Обчислюємо об’єм CО2 кількістю речовини 1,5 моль за формулою V=n•VM, де VM-постійна величина і за н.у. чисельно дорівнює 22,4 л/моль
V(CO2)=n(CO2)•VM=1,5 моль•22,4 л/моль=33,6 л
ІІ спосіб
Записуємо рівняння реакції: MgCO3+2HCl=MgCl2+H2O+CO2↑
За рівнянням реакції n(MgCО3)/1=n(CO2)/1
У цьому співвідношенні замінюємо кількість речовини вуглекислого газу на співвідношення об’ємів, а кількість речовини cолі — на співвідношення мас.
V(CO2)/VM=m(MgCO3)/M(MgCO3)
Звідси виражаємо об’єм вуглекислого газу:
V(СO2)•М(MgCO3)=m(MgCO3)•VM, тому
V(CO2)=m(MgCO3)•VM:M(MgCO3)
Обчислюємо молярну масу MgCO3 і підставляємо значення у формулу.
Mr(MgCO3)=Ar(Mg)+Ar(C)+3•Ar(O)=24+12+3•16=84, M(MgCO3)=84 г/моль
V(CO2)=126 г•22,4 л/моль:84 г/моль=33,6 л
Відповідь: 33,6 л
Інші завдання дивись тут…
What, How to Balance & FAQs —
By Sania Jakati
AgNO 3 является продуктом реакции между азотной кислотой и Ag (элементарным), поэтому легко реагирует с HCl. Рассмотрим некоторые факты о реакции AgNO 3 с HCl.
Соляная кислота, будучи сильной кислотой, обладает способностью полностью диссоциировать. Следовательно, он легко реагирует со многими соединениями. Нитрат серебра — это соль серебра, которая используется в качестве прекурсора для получения различных других соединений серебра (поскольку она довольно экономична).
Следовательно, он легко реагирует со многими соединениями. Нитрат серебра — это соль серебра, которая используется в качестве прекурсора для получения различных других соединений серебра (поскольку она довольно экономична).
Соляная кислота бесцветна и обладает характерным резким запахом. Он имеет pH 2. Нитрат серебра считается негигроскопичным соединением; следовательно, его можно легко использовать, и он очень устойчив к свету. В следующих разделах мы изучим многие факты, основанные на реакции HCl + AgNO 3 .
Что является продуктом HCl и AgNO 3 ?При взаимодействии HCl с AgNO 3 получаются хлорид серебра и азотная кислота. Наблюдается, что образовавшийся продукт хлорид серебра нерастворим в воде.
HCl(водн.) + AgNO 3 (водн.) → AgCl(т) + HNO 3 (водн. )
Какой тип реакции HCl + AgNO 3 ? Реакция между HCl и AgNO 3 представляет собой простую форму кислотно-щелочной реакции. Ее также можно назвать реакцией нейтрализации, поскольку HCl действует как кислота, а AgNO 3 действует как основание.
Ее также можно назвать реакцией нейтрализации, поскольку HCl действует как кислота, а AgNO 3 действует как основание.
Мы можем сбалансировать HCl + AgNO 3 легко вступает в реакцию, выполнив следующие шаги:
HCl + AgNO 3 → AgCl + HNO 3
- Первый шаг включает подсчет количества атомов на стороне каждого типа и сторона продукта.
- Следующий предполагает выравнивание количества атомов с обеих сторон (можно использовать любой способ).
- В приведенной выше реакции со стороны реагентов мы видим по одному атому водорода, хлора, серебра и азота. Элемент кислорода имеет 3 атома.
- Что касается продукта, то водород, хлор, азот и серебро имеют по одному атому каждый, а кислород имеет 3 атома.
- Это означает, что уравнение уже находится в сбалансированной форме.

Чтобы определить количество Ag, мы можем провести титрование между Ag и HCl. Поскольку продуктом реакции является осадок, проводить ее следует очень осторожно.
Необходимый аппаратБюретка (50 мл), подставка для бюретки, белая плитка, колба Эрленмейера и мерная колба.
ИндикаторИндикатор фенолфталеин можно эффективно использовать для титрования между HCl и AgNO 3 , так как он относится к классу кислотно-основных реакций. Индикатор дает розовый цвет в щелочной среде и становится от розового до бесцветного в кислой среде.
Обратите вниманиеТитрантом при титровании является HCl, так как он добавляется в бюретку. Раствор AgNO 3 добавляют в колбу Эрленмейера.
Процедура- Прибор необходимо правильно чистить и промывать соответствующими химикатами, используя очень меньшее количество химикатов.

- Бюретку наполняют стандартизированной HCl, раствор AgNO 3 переносят в колбу Эрленмейера.
- В реакционную смесь добавляют индикатор фенолфталеин и тщательно перемешивают (при необходимости следует добавить буферный раствор).
- Титрование следует проводить очень осторожно, выпуская HCl по каплям из бюретки до изменения цвета.
- Когда видно характерное изменение цвета, можно сказать, что конечная точка реакции достигнута.
- Описанную выше процедуру следует повторить трижды, чтобы получить точные результаты.
- Используя формулу N 1 V 1 =N 2 V 2 , мы можем узнать искомое количество.
результирующее ионное уравнение для реакции между HCl и AgNO 3 обсуждается ниже:
Нитрат серебра и соответствующее сопряженное основание представляют собой сопряженную пару реакции между HCl и AgNO 3 .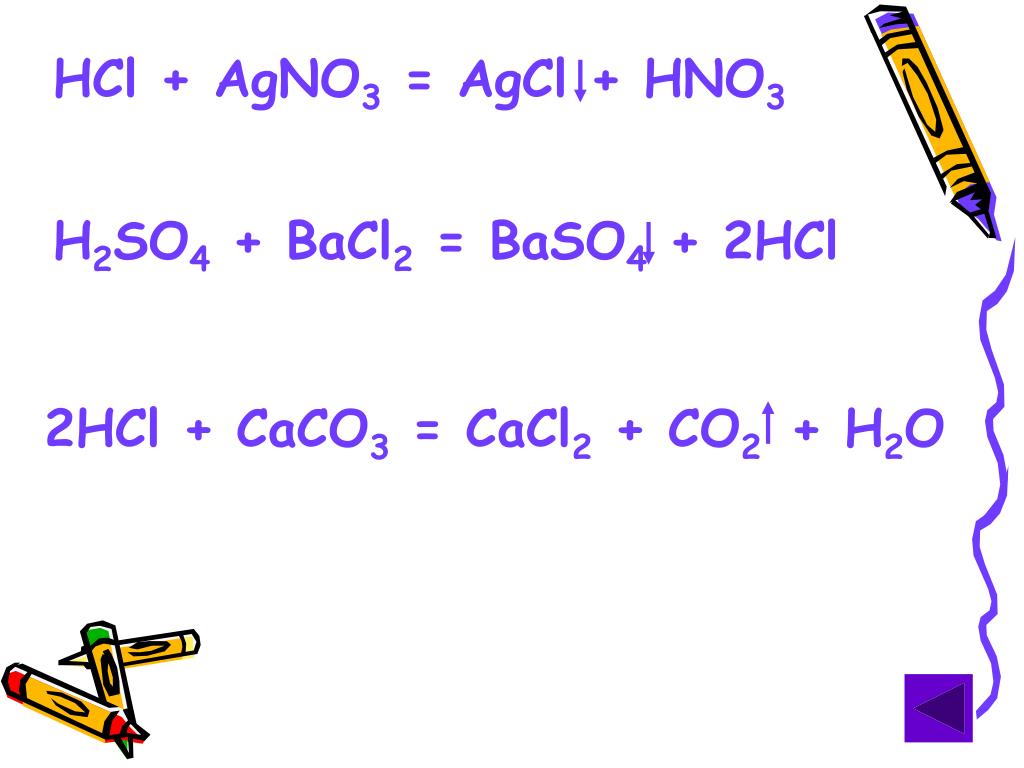 Обратите внимание на следующую реакцию.
Обратите внимание на следующую реакцию.
HCl + AgNO 3 → Cl – + HAgNO 3 +
HCl и AgNO 0 межмолекулярные силы 109009 3 0023Межмолекулярная сила, наблюдаемая в молекуле HCl, является ионной тип взаимодействия, при котором хлор (отрицательно заряженный) легко принимает электроны от водорода. Межмолекулярное взаимодействие, наблюдаемое в AgNO 3 , также является ионным взаимодействием между катионом Ag и анионом нитрата.
HCl + AgNO 3 энтальпия реакцииЭнтальпия реакции между HCl и AgNO 3 составляет 22,61 кДж/моль.
Является ли HCl + AgNO 3 буферным раствором? Реакция между HCl и AgNO3 не дает буферного раствора, так как образующиеся продукты представляют собой осадок (AgCl) и кислоту с pH 3 (HNO 3 ).
Реакция между HCl и AgNO 3 является полной реакцией, так как хлорид серебра и азотная кислота образуются почти в одинаковом соотношении.
Является ли реакция HCl + AgNO 3 экзотермической или эндотермической?Реакция между HCl и AgNO 3 является эндотермической реакцией, так как это реакция нейтрализации, а значение энтальпии положительное.
Is HCl + AgNO 3 окислительно-восстановительная реакция?Реакция между HCl и AgNO 3 не является окислительно-восстановительной реакцией. Причина обсуждается ниже.
- В окислительно-восстановительной реакции происходит как восстановление, так и окисление, и происходит изменение степени окисления веществ.
- В приведенном выше уравнении мы видим, что степени окисления видов не изменяются.
 (Со стороны реагента и продукта степень окисления остается одинаковой). Это подтверждает, что это не окислительно-восстановительная реакция.
(Со стороны реагента и продукта степень окисления остается одинаковой). Это подтверждает, что это не окислительно-восстановительная реакция.
Реакция между HCl и AgNO 3 является реакцией осаждения, так как образующийся продукт AgCl представляет собой осадок, который не растворяется в воде и оседает на дне контейнера.
HCl + AgNO 3 обратимая или необратимая реакция?Реакция между HCl + AgNO 3 является необратимой реакцией, так как это реакция осаждения с образованием нерастворимого осадка.
Является ли HCl + AgNO 3 реакцией замещения?Реакция между HCl и AgNO3 представляет собой реакцию двойного замещения, поскольку два вещества взаимозаменяются с образованием продуктов.
Как сбалансировать NaOH + AgNO 3 + HCl = AgCl + NaNO 3 + H 2 O Следуя приведенным ниже шагам, мы можем легко сбалансировать1 уравнение: 2 7 2 9000 073 Сначала подсчитайте количество атомов каждого типа с обеих сторон. И уравнять количество атомов с обеих сторон.
И уравнять количество атомов с обеих сторон. 
6 молекула NH
3 2. Таким образом, уравнение уравновешивается. 0?- FeCl 2 + HCl + AgNO 3 = Fe(NO 3 ) 3 + AgCl + NO + H 2 O
- Приведенное выше уравнение может быть уравновешено путем уравнивания побочных компонентов реагентов и побочных компонентов продукта методом проб и ошибок. можно использовать метод.
- Это означает, что количество атомов с обеих сторон должно быть одинаковым.
- Чтобы уравнять, мы умножили FeCl 2 на 3, HCl на 4 и AgNO 3 на 10 на стороне реагента.
- Со стороны продукта мы умножили Fe(NO 3 ) 3 на 3 и H 2 O на 3. 3 = 3Fe( NO 3 ) 3 + 10AgCl + NO + 2H 2 O
реакции . Поскольку значение энтальпии положительно, это эндотермическая реакция, необратимая, так как это реакция осаждения.
Поскольку значение энтальпии положительно, это эндотермическая реакция, необратимая, так как это реакция осаждения.
неорганическая химия. Реакция нитрата серебра и соляной кислоты
Одна из самых сложных частей химии — научиться распознавать тип реакции, основанный исключительно на ее реагентах. Это необходимо сделать до того, как вы сможете применить шаблон реакции к проблеме, поэтому очень важно сделать этот шаг правильно в самом начале.
В этом случае вы смотрите на реакцию:
$$ \ce{AgNO3 + HCl -> AgCl + HNO3} $$
Вы уже знаете продукты, но задаетесь вопросом, как эти продукты могут образовываться, поскольку активность H больше, чем Ag, а это означает, что Ag легче окисляется, чем H. Это верно, но взгляните на окисление количество каждого вида в этой реакции:
$\ce{Ag: +1 -> +1}$
$\ce{NO3: -1 -> -1}$
$\ce{H: +1 -> +1}$
$\ce{Cl: -1 -> -1}$
Поскольку общего переноса электронов нет, это не может быть окислительно-восстановительной реакцией, а значит, активность здесь не имеет значения.
Это означает, что для этой реакции должна быть другая движущая сила — другая модель реакции, которая лучше подходит.
Я не хочу давать вам прямой ответ, но я дам вам несколько советов, которые должны помочь:
Напишите полное уравнение — , включая фазы.
$$ \ce{AgNO3(водн.) + HCl(водн.) -> AgCl(s) + HNO3(водн.)} $$
Посмотрите, сможете ли вы найти другую модель реакции, которая лучше соответствует этому уравнению. Позже я обновлю этот ответ, чтобы показать, как вы можете определить правильную схему водных реакций, используя только реагенты.
Обновление
Как я уже упоминал, одна из самых сложных частей химии — научиться идентифицировать модели реакций, основанные только на реагентах. Это реакция двойного замещения (или метатезиса, или осаждения). Теперь это легко увидеть, учитывая, что реагенты водные и по крайней мере один из продуктов твердый (осадок). Образование твердого вещества является движущей силой этой реакции — быстрое объяснение состоит в том, что силы, притягивающие ионы серебра и хлорида вместе, сильнее, чем силы сольватации между этими ионами и водой, а также силы, удерживающие их с ионами натрия и нитрата.
Это хорошо, но как заранее предсказать, что это реакция осаждения?
Ключ в том, чтобы иметь хорошее представление о трех распространенных типах реакций соли/кислоты/основы, происходящих в водном растворе, и научиться распознавать подсказки в реагентах.
Вкратце, наиболее часто встречаются следующие три типа:
- Осадки
- Кислота/основание (определение Аррениуса)
- Окислительно-восстановительный потенциал (одинарный рабочий объем)
Вы можете распознать каждый из них по реагентам, если знаете, что искать.
Осаждение — Две растворимые соли (ионогенные соединения) или соли с кислотой или основанием.
Кислота/основание — Кислота Аррениуса и основание (соединение, содержащее гидроксид)
Окислительно-восстановительный потенциал — соль или кислота и элементный металл
Существует много других типов реакций, которые происходят в водном растворе, множество вариаций кислотно-щелочной и окислительно-восстановительной категорий, но эти три охватывают случаи, наиболее часто встречающиеся в классе.

 Элемент кислорода имеет 3 атома.
Элемент кислорода имеет 3 атома.
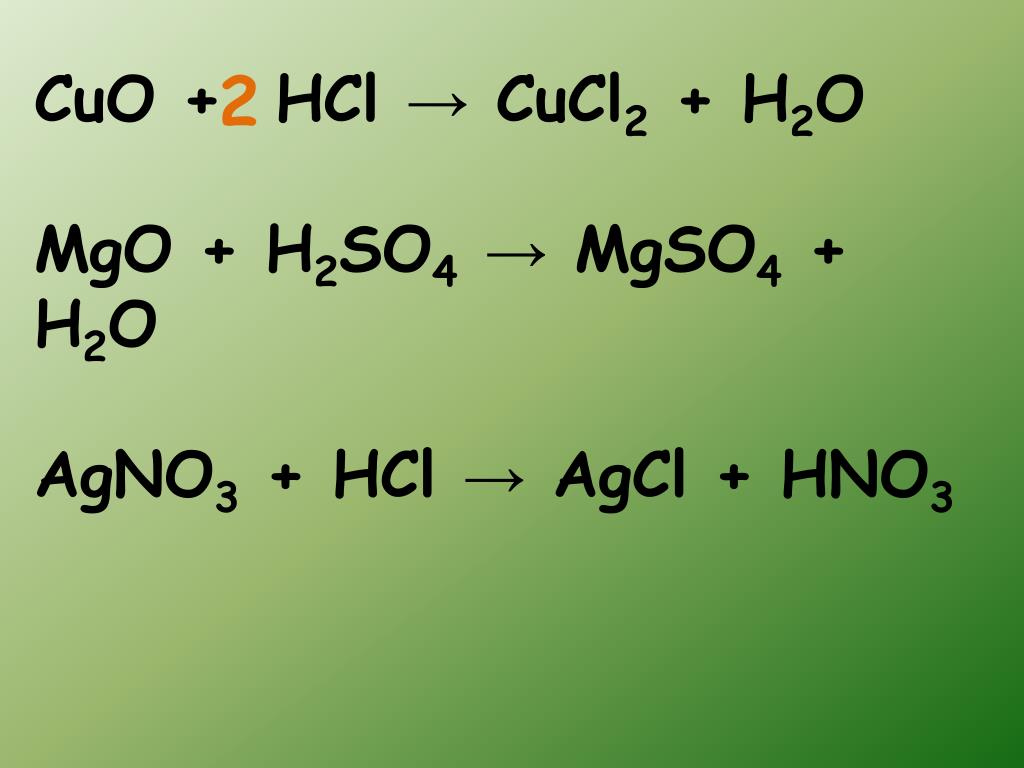
 И уравнять количество атомов с обеих сторон.
И уравнять количество атомов с обеих сторон. Таким образом, уравнение уравновешивается.
Таким образом, уравнение уравновешивается.

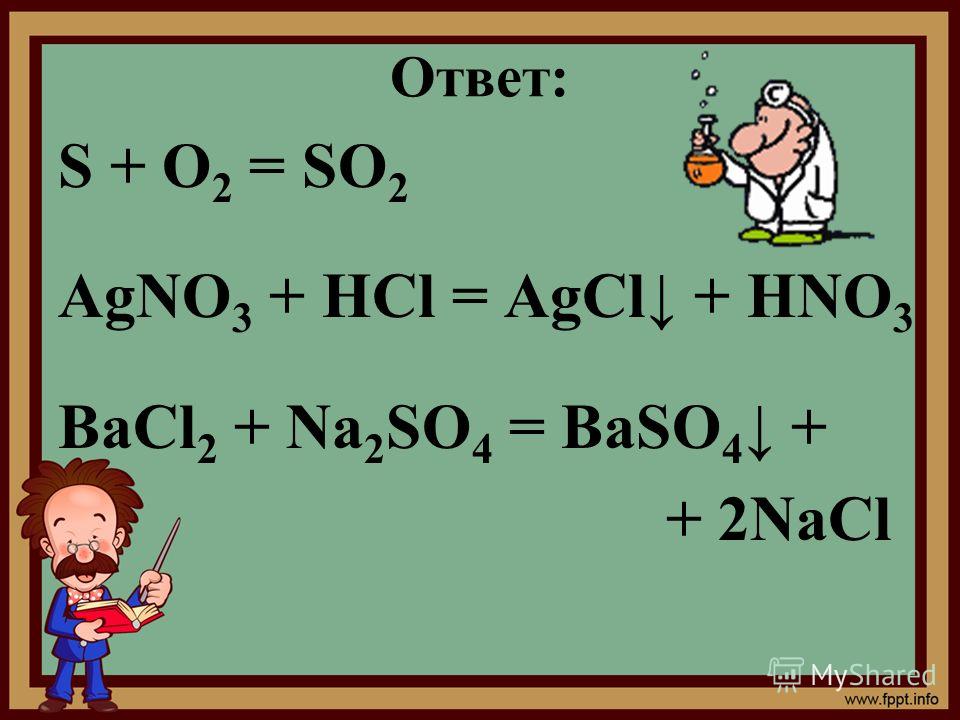 (Со стороны реагента и продукта степень окисления остается одинаковой). Это подтверждает, что это не окислительно-восстановительная реакция.
(Со стороны реагента и продукта степень окисления остается одинаковой). Это подтверждает, что это не окислительно-восстановительная реакция.