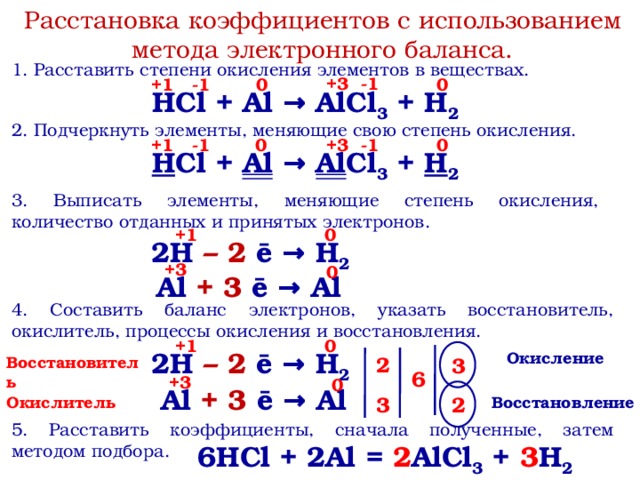
Реакции алюминия
Химические свойства алюминия
Химические свойства алюминия определяются его положением в периодической системе химических элементов.
Ниже представлены основные химические реакции алюминия с другими химическими элементами. Эти реакции определяют основные химические свойства алюминия.
С чем реагирует алюминий
Простые вещества:
- галогены (фтор, хлор, бром и иодин)
- сера
- фосфор
- азот
- углерод
- кислород (горение)
Сложные вещества:
- вода
- минеральные кислоты (соляная, фосфорная)
- серная кислота
- азотная кислота
- щелочи
- окислители
- оксиды менее активных металлов (алюмотермия)
С чем не реагирует алюминий
Алюминий не реагирует:
- с водородом
- в обычных условиях – с концентрированной серной кислотой (из-за пассивации – образования плотной оксидной пленки)
- в обычных условиях – с концентрированной азотной кислотой (также из-за пассивации)
См. подробнее по химии алюминия
подробнее по химии алюминия
Алюминий и воздух
Обычно поверхность алюминия всегда покрыта тонким слоем оксида алюминия, который защищает ее от воздействия воздуха, точнее, кислорода. Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Реакция алюминия с кислородом:
- 4Al + 3O2 —> 2Al2O3
Алюминий и вода
Алюминий реагирует с водой по следующим реакциям [2]:
- 2Al + 6H2O = 2Al(OH)3 + 3H2 (1)
- 2Al + 4H2O = 2AlO(OH) + 3H2 (2)
- 2Al + 3H2O = Al2O3 + 3H2 (3)
В результате этих реакций образуются, соответственно, следующие соединения алюминия:
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
Эти реакции, кстати, представляют большой интерес при разработке компактных установок для получения водорода для транспортных средств, которые работают на водороде [2].
Все эти реакции являются термодинамически возможными при температуре от комнатной до температуры плавления алюминия 660 ºС. Все они являются также экзотермическими, то есть происходят с выделением тепла [2]:
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Таким образом, оксид алюминия Al2O3 становится термодинамически более устойчивым, чем Al(OH)3 при повышенной температуре. Продуктом реакции алюминия с водой при комнатной температуре будет гидроксид алюминия Al(OH)3.
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на практике кусок алюминия, опущенный в воду, не реагирует с водой в условиях комнатной температуры и даже в кипящей воде.
Алюминий и галогены
Алюминий бурно реагирует со всем галогенами – это:
- фтор F
- хлор Cl
- бром Br и
- иодин (йод) I,
с образованием соответственно:
- фторида AlF3
- хлорида AlCl3
- бромида Al2Br6 и
- иодида Al2Br6.
Реакции водорода со фтором, хлором, бромом и иодином:
- 2Al + 3F2 → 2AlF3
- 2Al + 3Cl2 → 2AlCl3
- 2Al + 3Br2 → Al2Br6
- 2Al + 3l2 → Al2I6
Алюминий и кислоты
Алюминий активно вступает в реакцию с разбавленными кислотами: серной, соляной и азотной, с образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.
Реакции алюминия с разбавленными кислотами:
- 2Al + 3H2SO4 —> Al2(SO4)3 + 3H2
- 2Al + 6HCl —> 2AlCl3 + 3H2
- 2Al + 6HNO3 —> 2Al(NO3)3
С концентрированными серной и соляной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли, окислов и воды.
Алюминий и щелочи
Алюминий в водном растворе щелочи – гидроксида натрия – реагирует с образованием алюмината натрия.
Реакция алюминия с гидроксидом натрия имеет вид:
- 2Al + 2NaOH + 10H2O —> 2Na[Al(H2O)2(OH)4] + 3H2
Все важнейшие реакции с алюминием
Для полноты информации приводим перечень основных реакций с участием алюминия из фундаментальной книги про алюминий [3]:
Важнейшие реакции с участием алюминия [3]
Источники:
1. Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
2. Reaction of Aluminum with Water to Produce Hydrogen /John Petrovic and George Thomas, U.S. Department of Energy, 2008
3. Тринадцатый элемент: Энциклопедия / А. Дроздов – Библиотека РУСАЛа, 2007.
Страница не найдена
Страница не найдена404
К сожалению, запрашиваемая вами страница не найдена.
Воспользуйтесь меню навигации или начните обзор с главной страницы
|
|
Алюминий (Al) и вода
- Дом
- Периодическая таблица
- Элементы и вода
- Алюминий в воде (AL + h3O)
| Известно, что Атлантический океан содержит больше алюминия, чем Тихий океан. Речная вода обычно содержит около 400 частей на миллиард алюминия. Алюминий в основном встречается в виде Al 3+ (водн.) в кислых условиях и в виде Al(OH) 4 — (водный) в условиях от нейтрального до щелочного. Другие формы включают AlOH 2 + (водн.) и Al(OH) 3 (водн.). Металлический алюминий быстро образует тонкий слой оксида алюминия толщиной в несколько миллиметров, который препятствует реакции металла с водой. Al 3+ (водн.) + 6H 2 O(ж) <-> [Al(H 2 O) 6 ] 3+ ( aq) Наиболее распространенными соединениями алюминия являются оксид алюминия и гидроксид алюминия, которые не растворяются в воде. Алюминий образуется при выветривании минералов полевых шпатов, таких как ортоклаз, анортит, альбит, слюда и боксит, и впоследствии попадает в глинистые минералы. Некоторые драгоценные камни содержат алюминий, например, рубин и сапфир. Алюминий может по-разному негативно влиять на наземную и водную жизнь. Обычные концентрации алюминия в грунтовых водах составляют около 0,4 частей на миллион, потому что он присутствует в почвах в виде нерастворимого в воде гидроксида. При значениях pH ниже 4,5 растворимость быстро увеличивается, в результате чего концентрации алюминия превышают 5 частей на миллион. Это может происходить и при очень высоких значениях pH. Общая концентрация алюминия в организме человека составляет примерно 9 частей на миллион (сухая масса). В некоторых органах, особенно в селезенке, почках и легких, могут присутствовать концентрации до 100 ppm (сухая масса). Ежедневное потребление алюминия составляет примерно 5 мг, из которых усваивается лишь небольшая часть. Это приводит к относительно низкой острой токсичности. Абсорбция составляет около 10 мкг в сутки. Эти количества считаются безвредными для человека. Кремний может снизить поглощение алюминия. Однако, как только элемент попадает в организм, его нелегко удалить. Алюминий можно удалить из воды с помощью ионного обмена или коагуляции/флокуляции. Литература и другие элементы и их взаимодействие с водой |
Еще из «Элементы и вода»
Аргон в воде (Ar + h3O)
Мышьяк в воде (As + h3O) Бор в воде (B + h3O)
Кальций в воде (Ca + h3O)
Хром в воде (Cr + h3O)
Гелий в воде (He + h3O)
Йод в воде (I + h3O)
Железо в воде (Fe + h3O)
Свинец в воде (Pb + h3O)
Литий в воде (Li + h3O)
Магний в воде (Mg + h3O)
Никель в воде (Ni + h3O)
Азот в воде (N + h3O)
Кислород в воде (O2 + h3O)
Калий в воде (K + h3O)
Кремний в воде (Si + h3O)
Серебро в воде (Ag + h3O)
Натрий в воде (Na + h3O)
Стронций в воде (Sr + h3O)
Олово в воде (SN + h3O)
Титан в воде (Ti + h3O)
Цинк в воде (Zn + h3O)
Мышьяк в воде
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| png» substance-weight=»342.1509″> AL 2 (SO 4 ) 3 | + | 0626″> 3SO 4 2- | |||||
| сульфат алюминия | water | Sulfate | |||||
| (dung dịch pha loãng) | |||||||
| 1 | 12 | 2 | 3 | Хо Со | |||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении Al
2 (SO 4 ) 3 + 12H 2 O → 2[Al(H 2 O) 6 ] + 3SO 4Условия реакции Al2(SO4)3 (сульфат алюминия) (реагирует с h3O) вода) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием [Al(h3O)6] () и SO4 (сульфат) ?
Явление после реакции Al2(SO4)3 (сульфат алюминия) с h3O (вода)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта SO42- (Сульфат), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов h3O (вода), исчезающая
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Дальнейшие вопросы, связанные с химическими реакциями, AL
2 (SO 4 ) 3 + 12H 2 O → 2 [AL (H 2 O) 6 ] + 3SO 4 0505050505050505050505A . относительно реагента Al2(SO4)3 (сульфат алюминия)
относительно реагента Al2(SO4)3 (сульфат алюминия)Каковы химические и физические характеристики Al2(SO4)3 (сульфат алюминия)? В каких химических реакциях используется Al2(SO4)3 (сульфат алюминия) в качестве реагента?
Вопросы, связанные с реагентом h3O (вода)
Каковы химические и физические характеристики h3O (воды)? В каких химических реакциях используется h3O (вода) в качестве реагента?
Вопросы, связанные с продуктом [Al(h3O)6] ()
Каковы химические и физические характеристики [Al(h3O)6] (вода)? Какие химические реакции происходят с [Al(h3O)6] () как продукт?
Вопросы, связанные с продуктом SO4 (сульфат)
Каковы химические и физические характеристики SO4 (вода)? Какие химические реакции происходят с SO4 (сульфатом) в качестве продукта?
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция Al2(SO4)3 (Nhôm sunfat) реакция с h3O (nước) продукт [Al(h3O)6] (гексааквакомплексный ион алюминия)
Реакция, в результате которой образуется вещество AL2 (SO4) 3 (Nhôm Sunfat) (сульфат алюминия)
2AL + 3H 2 SO 4 → AL 2 (SO 4 ) 3 + 3H 2 2AL + 3FESO + 3FESO + 3FESO + 3FESO + 3FESO + 3FESO + 3FESO + 3FESO + 3FESO 3H + 3H 2 2AL + 3FESO 3 + 3H 2 2AL + 3FES. → AL 2 (SO 4 ) 3 + 3FE 2AL + 3H 2 SO 4 → AL 2 (SO 4 ) 3 + 3H 2
→ AL 2 (SO 4 ) 3 + 3FE 2AL + 3H 2 SO 4 → AL 2 (SO 4 ) 3 + 3H 2
2NaOH + NH 4 HSO 4 → 2H 2 O + Na 2 SO 4 + NH 3 2H 2 S + 3O 2 → 2H 2 O + 2SO 2 NH 4 NO 2 → 2H 2 O + N 2
Реакция с образованием вещества [Al(h3O)6] (Гексаквакомплексный ион алюминия) ()
6H 2 O + Al(NO 3 ) 3 → [AL (H 2 O) 6 ] + 3NO 3 ALCL 3 + 6H 2 O → [AL (H 2 O) 6 ] + 3CL 12. 2 O) 6 ] + 3CL 12 2 99.

 закупки
закупки Когда этот слой подвергается коррозии, развивается реакция с выделением легковоспламеняющегося газообразного водорода.
Когда этот слой подвергается коррозии, развивается реакция с выделением легковоспламеняющегося газообразного водорода.  )) и в кислой форме (2Al 2 O 3 (т) + 2OH — (водн.) -> AlO 2 — (водн.) + H 2 O (л)).
)) и в кислой форме (2Al 2 O 3 (т) + 2OH — (водн.) -> AlO 2 — (водн.) + H 2 O (л)).  Алюминий перерабатывается на банки, проводку и сплавы.
Алюминий перерабатывается на банки, проводку и сплавы.  Это связано с тем, что алюминиевая пыль попадает в воду. Частицы попадают в воду в результате поверхностного стока или атмосферного переноса.
Это связано с тем, что алюминиевая пыль попадает в воду. Частицы попадают в воду в результате поверхностного стока или атмосферного переноса.  При увеличении осаждения нитратов количество алюминия увеличивается, тогда как под большими вересковыми и сельскохозяйственными угодьями оно уменьшается. В лесных почвах увеличивается.
При увеличении осаждения нитратов количество алюминия увеличивается, тогда как под большими вересковыми и сельскохозяйственными угодьями оно уменьшается. В лесных почвах увеличивается.  Алюминий в основном токсичен для рыб при значениях рН 5,0-5,5. Ионы алюминия накапливаются на чайках и закупоривают их слизистым слоем, что ограничивает дыхание. При снижении значений рН ионы алюминия влияют на кальциевую регуляцию проницаемости чайки. Это увеличивает потери натрия. Кальций и алюминий являются антагонистами, но добавление кальция не может ограничить потерю электролита. В основном это касается молодняка. Концентрация алюминия 1,5 мг/л оказалась смертельной для форели. Элемент также влияет на рост пресноводных костистых рыб.
Алюминий в основном токсичен для рыб при значениях рН 5,0-5,5. Ионы алюминия накапливаются на чайках и закупоривают их слизистым слоем, что ограничивает дыхание. При снижении значений рН ионы алюминия влияют на кальциевую регуляцию проницаемости чайки. Это увеличивает потери натрия. Кальций и алюминий являются антагонистами, но добавление кальция не может ограничить потерю электролита. В основном это касается молодняка. Концентрация алюминия 1,5 мг/л оказалась смертельной для форели. Элемент также влияет на рост пресноводных костистых рыб.  При пероральном приеме это составляет 420 мг/кг для хлорида алюминия и 3671 мг/кг для нонагидрата алюминия. Механизм токсичности в основном основан на ингибировании ферментов.
При пероральном приеме это составляет 420 мг/кг для хлорида алюминия и 3671 мг/кг для нонагидрата алюминия. Механизм токсичности в основном основан на ингибировании ферментов.  Это было связано с повреждением нерва. Особенно чувствительны к алюминиевой токсичности люди с поражением почек. Есть риск аллергии. Алюминий, вероятно, обладает мутагенными и канцерогенными свойствами. Подозревается корреляция между потреблением алюминия и увеличением числа случаев болезни Альцгеймера. Однако это неясно, поскольку концентрация алюминия всегда увеличивается с возрастом. Повышенное потребление алюминия также может вызвать остеомаляцию (дефицит витамина D и кальция).
Это было связано с повреждением нерва. Особенно чувствительны к алюминиевой токсичности люди с поражением почек. Есть риск аллергии. Алюминий, вероятно, обладает мутагенными и канцерогенными свойствами. Подозревается корреляция между потреблением алюминия и увеличением числа случаев болезни Альцгеймера. Однако это неясно, поскольку концентрация алюминия всегда увеличивается с возрастом. Повышенное потребление алюминия также может вызвать остеомаляцию (дефицит витамина D и кальция).  Соли алюминия применяются при очистке воды для реакций осаждения. Добавление в воду сульфата алюминия и извести вызывает образование гидроксида алюминия, что приводит к осаждению загрязняющих веществ. Гидроксид нерастворим в воде, поэтому остается только 0,05 ppm растворенного алюминия. Это ниже разрешенного Всемирной организацией здравоохранения (ВОЗ) предела содержания алюминия в питьевой воде, составляющего 0,2 промилле.
Соли алюминия применяются при очистке воды для реакций осаждения. Добавление в воду сульфата алюминия и извести вызывает образование гидроксида алюминия, что приводит к осаждению загрязняющих веществ. Гидроксид нерастворим в воде, поэтому остается только 0,05 ppm растворенного алюминия. Это ниже разрешенного Всемирной организацией здравоохранения (ВОЗ) предела содержания алюминия в питьевой воде, составляющего 0,2 промилле.