Ответов пока нет | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Al(OH)3->Al2O3->AlCl3->Al(NO3)3->Al2O3->Al… -reshimne.ru
Новые вопросы
Ответы
1)2Al(OH)3=>Al2O3+3h3O
2)Al2O3+6HCl=2AlCl3+3h3O
3)AlCl3+3AgNO3=Al(NO3)3+3AgCl
4)4Al(NO3)3=>2Al2O3+12NO2+3O2
5)Al2O3+6HCl=2AlCl3+3h3O
Похожие вопросы
Структурная формула 2-броманилина…
Помогите с Химией ОВР….
Решить ионные уравнения , в полном виде .
1)Mg + h3O
2)Al2O3 + h4PO4
3)BaO + CO2
4)N2O5 + h3O
5)SiO2 + NaOH…
Записать уравнения реакций для преобразования: этан — Бутан — Этилен — Этанол — Вода- пропанол….
Дано w=10% wсоли=14% масса раствора=500 грамм найти массу (h3O)…
К сильным электролитам относится:
2) карбонат меди
3) сульфид железа (ll)
4) гидроксид магния…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Разложение.
 Можно ли нагревать гидроксид алюминия (Al(OH)3) до температуры плавления перед разложением?
Можно ли нагревать гидроксид алюминия (Al(OH)3) до температуры плавления перед разложением?спросил
Изменено 2 года, 5 месяцев назад
Просмотрено 3к раз
$\begingroup$
На странице Википедии для гидроксида алюминия указанная температура плавления составляет 300 ° C (572 ° F), но на той же странице указано, что гидроксид алюминия разлагается только при 180 ° C (356 ° F). Можно ли расплавить гидроксид алюминия без разложения?
- температура плавления
- разложение
$\endgroup$
2
$\begingroup$
TL. DR: Оксид алюминия (иногда известный как оксид алюминия) получают путем нагревания гидроксида алюминия до температуры примерно 1100–1200°C. (Chemguide)
DR: Оксид алюминия (иногда известный как оксид алюминия) получают путем нагревания гидроксида алюминия до температуры примерно 1100–1200°C. (Chemguide)
$$\ce{Al(OH)3 ->[\Delta] Al2O3 + 3h3O}$$
Как сказал @andselisk, температура, упомянутая в Википедии, представляет собой смесь гидроксида алюминия в огнезащитном составе, который может иметь другие соединения. Разложение чистого гидроксида алюминия изучалось в различных работах, и его механизм реакции разложения, температура, кинетика реакции были исчерпывающе изучены. 9{[2]}}$ показывает нагревание гидроксида алюминия от комнатной температуры до 1200 K (926,85 °C), где указана точная температура продуктов разложения, т.е. $\ce{Al2O3}$:
[…] мы находим первый и самый маленький эндотермический пик при 519 K , что связано с частичным дегидроксилированием гиббсита. ($\ce{Al(OH)3}$) и образование бемита ($\ce{AlOOH}$). Эндотермический пик при 585 К соответствует двум процессам: (i) превращение гиббсита в фазу $\ce{χ-Al2O3}$ и (ii) дополнительную конверсию гиббсита в бемит.
Первый процесс осуществляется в соответствии с полученные результаты. Еще один эндотермический пик на 815 K связано с разложение бемита и образование глинозема $\ce{γ-Al2O3}$. полученные кривые ТГ ясно показывают три этапа потери массы тела. Вес потери на первом этапе (около 5 мас.%) связаны с частичной превращение гиббсита в бемит; второй шаг (около 25 мас.%) соответствует разложению гиббсита до бемита, в противном случае в $\ce{χ-Al2O3}$. Последняя ступень около 3 мас.% относится к образование $\ce{γ-Al2O3}$. Дальнейшие наблюдения показывают, что общий вес потери равны 33 мас.%. Все эти превращения гиббсита и химический состав подтвержден рентгеноструктурным анализом.
Ссылки
- Химическая кинетика и механизм реакции термического разложения гидроксида алюминия и гидроксида магния при высокой температуре (973-1123 K) Ienwhei Chen, Shuh Kwei Hwang, and Shyan Chen, Ind. Eng. хим. Рез. 1989 , 28, 6, 738–742 DOI: https://doi.
 org/10.1021/ie00090a015
org/10.1021/ie00090a015 - http://przyrbwn.icm.edu.pl/APP/PDF/131/a131z3p62.pdf
- Бхаттачарья, Индра и Дас, С. и Мукерджи, П. и Пол, Субир и Митра, П.. ( 2004 ). Термическое разложение осажденного мелкодисперсного тригидроксида алюминия. Скандинавский журнал металлургии. 33. 211 — 219. 10.1111/j.1600-0692.2004.00686.x.(DOI) (Здесь гидроксид алюминия подвергают дегидратации до температуры 1440 °С)
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Al (OH) 3 → Al2O3+H3OTất Cả phương trình điều chế từ al (OH) 3 ra al2o3+h3o
al (oh) 3 → al2o3+h3otất cả phương trình điều chế từ al (oh) 3 ra al2o3+h3o- Транг чо
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ Al(OH)3 (Nhôm hiroxit) ra al2o3+h3o. Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.

Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(версия 1.204.214, полная загрузка)
Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама
2Al(OH)
3 → Al 2 O 3 + 3H 2 OНиет До: > 575
Xem trạng thái chất và chi tiết của phương trình Al(OH)3 => Al2O3 + h3O
Có 1 kết quả được tìm thấy
— Hiển thị kết quả từ 1 đến 1
Транг 1
Стринги Тин Тхем Ву Пхонг Трин Хоа Хок
tạo thành Al2O3 (Nhôm oxit) ,trong điều kiện nhiệt độ > 575
Phương trình để tạo ra chất Al(OH)3 (Nhôm hiroxit) (гидроксид алюминия)
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl 2Al + 6H 2 O → 2Al(OH) 7 + 3 2 CO 2 + K[Al(OH) 4 ] → Al(OH) 3 + KHCO 3
Phương trình để tạo ra chất al2o3 (nhôm oxit) (оксид алюминия)
4al + 3o 2 → 2AL 2 O 3 2AL + 3CUO → AL 2 O 3AL + 3CUO → AL 2 O 3AL + 3CUO → AL 2 O 3 + 3 + 3 + 3 + 3 + 3 + 3 + 3 + 3 + 3 + 3 + 3 + 3.




 2-2x-8. Найдите с помощью графика :
a)Значение y при x = -1,5;
б) Значение х при которых у=3;
в) Нули функции;промежутки в которых у>0 и в которых у<0;
г)
2-2x-8. Найдите с помощью графика :
a)Значение y при x = -1,5;
б) Значение х при которых у=3;
в) Нули функции;промежутки в которых у>0 и в которых у<0;
г)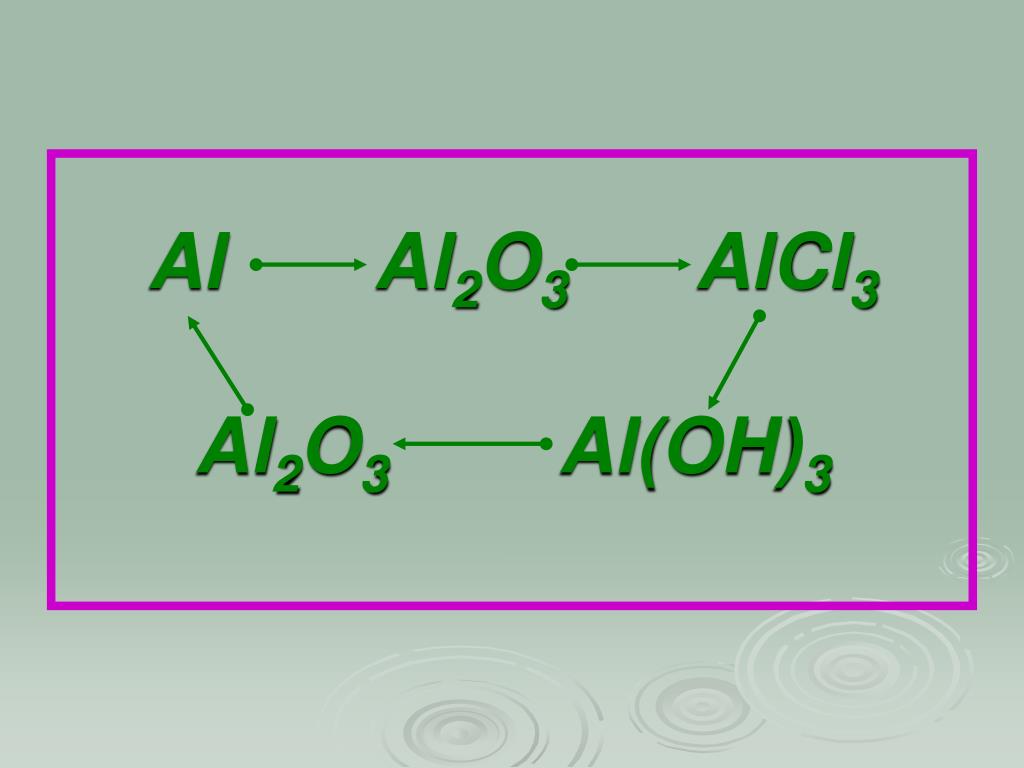 Первый процесс осуществляется в соответствии с
полученные результаты. Еще один эндотермический пик на 815 K связано с
разложение бемита и образование глинозема $\ce{γ-Al2O3}$.
полученные кривые ТГ ясно показывают три этапа потери массы тела. Вес
потери на первом этапе (около 5 мас.%) связаны с частичной
превращение гиббсита в бемит; второй шаг (около 25
мас.%) соответствует разложению гиббсита до бемита, в противном случае
в $\ce{χ-Al2O3}$. Последняя ступень около 3 мас.% относится к
образование $\ce{γ-Al2O3}$. Дальнейшие наблюдения показывают, что общий вес
потери равны 33 мас.%. Все эти превращения гиббсита и
химический состав подтвержден рентгеноструктурным анализом.
Первый процесс осуществляется в соответствии с
полученные результаты. Еще один эндотермический пик на 815 K связано с
разложение бемита и образование глинозема $\ce{γ-Al2O3}$.
полученные кривые ТГ ясно показывают три этапа потери массы тела. Вес
потери на первом этапе (около 5 мас.%) связаны с частичной
превращение гиббсита в бемит; второй шаг (около 25
мас.%) соответствует разложению гиббсита до бемита, в противном случае
в $\ce{χ-Al2O3}$. Последняя ступень около 3 мас.% относится к
образование $\ce{γ-Al2O3}$. Дальнейшие наблюдения показывают, что общий вес
потери равны 33 мас.%. Все эти превращения гиббсита и
химический состав подтвержден рентгеноструктурным анализом. org/10.1021/ie00090a015
org/10.1021/ie00090a015