Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Плотность газообразного органического вещества такая же , как и плотность этана, а массовые доли углерода и кислорода в нем составляют соответственно.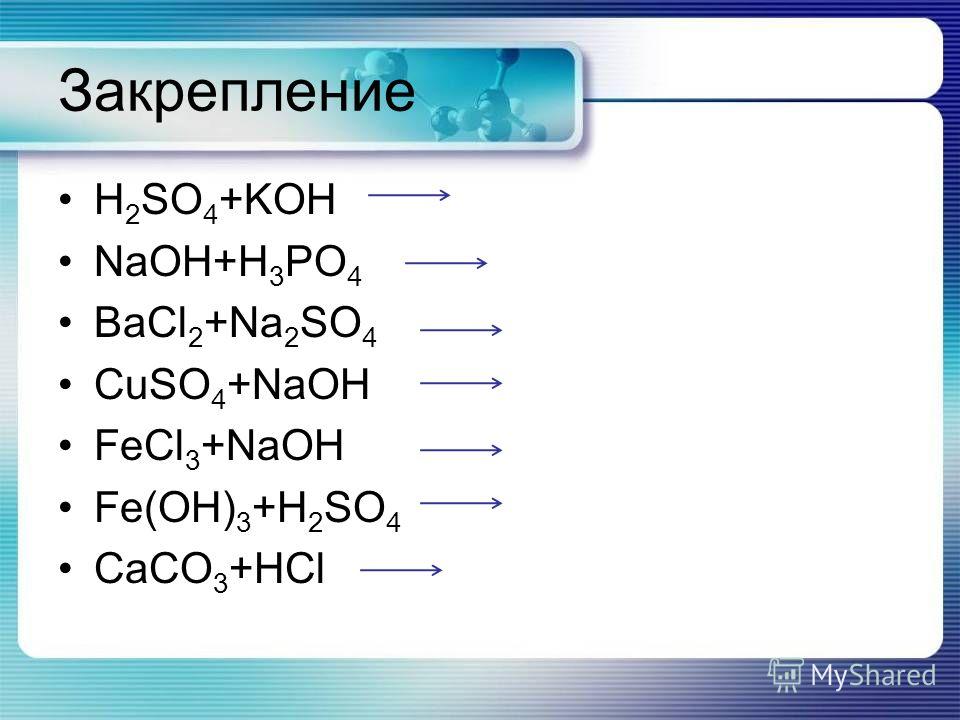 ..
..
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
гидролиз sbcl3+h3o
Решено
Помогите пожалуйста. Электроны баланс: K2Cr2O7+FeSO4+h3SO4=Cr(SO4)3+Fe2(SO4)3+K2SO4+h3O
Пользуйтесь нашим приложением
Гидроксид алюминия: получение и свойства
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na[Al(OH)4] + СО2 = Al(OH)3 + NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl3 + 3KOH(недост) = Al(OH)3↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + CO2↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HBr → AlBr3 + 3H2O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
2KOH + Al(OH)3 → 2KAlO2 + 2H2O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH)3 + KOH → K[Al(OH)4]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Понравилось это:
Нравится Загрузка…
Aloh4+naoh полное ионное молекулярное уравнение… -reshimne.ru
Новые вопросы
Ответы
Al(OH)₃ + NaOH = Na[Al(OH)₄]
Похожие вопросы
При помощи каких реакций можно осуществить следующие превращения: а) FeS=>h3S=>SO2=>S=>h3S;б) ZnS=>h3S=>K2S=>PbS…
Вычислите массу феррум(III) оксида, необходимую для получения
феррум(III) нитрата массой 36,3 г….
Почему сульфид Cr2S3 нельзя синтезировать реакцией обмена в водном растворе? Как получить Cr2S3?…
определите количество вещества соли которая образуется при взаимодействии 100 грамм серной кислоты и 100%гидроксида натрия
ПОЖАЛУЙСТА ПОМОГИТЕ ! РЕШИЛА НО НЕ ЗНАЮ ПРАВИЛЬНО ИЛИ НЕТ (. ..
..
Дам 57 баллов!!!!Какая масса осадка будет получаться при взаимодействие сульфата алюминия с 33,6г гидроксида калия?…
Как правильно писать соединение в химии , исходя лишь на название этой реакции: например: гидроксид аллюминия….
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
ЭкономикаМузыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Разница между гидроксидом натрия и гидроксидом алюминия
31 января 2018 г.
Мадхуша
Чтение через 4 мин.
Основное отличие — гидроксид натрия по сравнению с гидроксидом алюминия
Гидроксид натрия и гидроксид алюминия являются гидроксидами металлов. Химическая формула гидроксида натрия: NaOH . Общепринятое название гидроксида натрия — едкий натр . Это ионное соединение. Гидроксид алюминия представляет собой амфотерный гидроксид, обладающий как кислотными, так и основными свойствами. Химическая формула гидроксида алюминия: Al(OH) 3 . Основное различие между гидроксидом натрия и гидроксидом алюминия заключается в том, что гидроксид натрия является основным соединением, тогда как гидроксид алюминия является амфотерным соединением.
Ключевые области, охватываемые
1. Что представляет собой гидроксид натрия
— Определение, химические свойства, применения
2. Что такое гидроксид алюминия
— определение, химические свойства, применения
— определение, химические свойства, приложения
— определение, химические свойства, приложения
— определение, химические свойства, применения
— определение, химические свойства. в чем разница между гидроксидом натрия и гидроксидом алюминия
в чем разница между гидроксидом натрия и гидроксидом алюминия
– Сравнение ключевых различий
Ключевые термины: гидроксид алюминия (Al(OH) 3 ), амфотерный, основание Бренстеда-Лоури, каустическая сода, экзотермический, гигроскопический, кислота Льюиса, гидроксид натрия 90 (Na02OH)
Что такое гидроксид натрия
Гидроксид натрия представляет собой гидроксид металла, имеющий химическую формулу NaOH . Общепринятое название гидроксида натрия — едкий натр . Гидроксид натрия представляет собой ионное соединение, состоящее из катионов натрия (Na + ) и гидроксидные (ОН – ) анионы. Это сильная база.
Молярная масса гидроксида натрия 39,99 г/моль. Гидроксид натрия представляет собой твердое вещество при комнатной температуре и выглядит как белые воскообразные кристаллы, непрозрачные. Он без запаха. Температура плавления гидроксида натрия составляет 318 °С, а температура кипения – 1388 °С.
Рисунок 1: Твердое соединение гидроксида натрия
Поскольку гидроксид натрия является сильнощелочным соединением, он может вызвать сильные ожоги. Он хорошо растворяется в воде. При растворении в воде это ионное соединение диссоциирует на свои ионы. Это растворение в воде сильно экзотермическое. Гидроксид натрия гигроскопичен. Это означает, что гидроксид натрия может поглощать водяной пар и углекислый газ из воздуха при контакте с обычным воздухом.
Применение гидроксида натрия включает его использование в производстве многих мыл и моющих средств, производстве лекарств, таких как аспирин, контроле кислотности воды, растворении нежелательных материалов в древесине при производстве изделий из дерева и бумаги и т. д.
Что такое алюминий Гидроксид
Гидроксид алюминия представляет собой амфотерный гидроксид, имеющий химическую формулу Al(OH) 3 . Амфотерность означает, что это соединение проявляет как кислотные, так и основные свойства. Гидроксид алюминия встречается в природе в виде минерала, известного как 9.0011 гиббсайт .
Гидроксид алюминия встречается в природе в виде минерала, известного как 9.0011 гиббсайт .
Молярная масса гидроксида алюминия 78 г/моль. Температура плавления составляет 300 °C. Гидроксид алюминия выглядит как аморфный порошок белого цвета. Когда гидроксид алюминия реагирует с кислотой, он действует как основание Бренстеда-Лоури и принимает протоны. При взаимодействии с основаниями он действует как кислота Льюиса, принимая пару электронов от гидроксильного аниона.
Рисунок 2: Химическая структура гидроксида алюминия
Применение гидроксида алюминия включает:
- сырье для производства прочих соединений алюминия
- огнезащитный наполнитель для полимеров
- антацид для людей и животных и т. д.
Разница между гидроксидом натрия и гидроксидом алюминия
Определение
Гидроксид натрия: Гидроксид натрия представляет собой гидроксид металла, имеющий химическую формулу NaOH.
Гидроксид алюминия: Гидроксид алюминия представляет собой амфотерный гидроксид, имеющий химическую формулу Al(OH) 3 .
Анионы гидроксида
Гидроксид натрия: На один катион натрия в гидроксиде натрия приходится один анион гидроксида.
Гидроксид алюминия: На один катион алюминия в гидроксиде алюминия приходится три аниона гидроксида.
Nature
Гидроксид натрия: Гидроксид натрия является основным соединением.
Гидроксид алюминия: Гидроксид алюминия представляет собой амфотерное соединение.
Молярная масса
Гидроксид натрия: Молярная масса гидроксида натрия составляет 39,99 г/моль.
Гидроксид алюминия: Молярная масса гидроксида алюминия 78 г/моль.
Температура плавления
Гидроксид натрия: Температура плавления гидроксида натрия: 318 °C
Гидроксид алюминия: Температура плавления гидроксида алюминия: 300 °C.
Реакция с кислотами
Гидроксид натрия: Гидроксид натрия реагирует с кислотами, образуя натриевую соль.
Гидроксид алюминия: Когда гидроксид алюминия реагирует с кислотой, он действует как основание Бренстеда-Лоури и принимает протоны.
Реакция с основаниями
Гидроксид натрия: Гидроксид натрия не реагирует с основаниями.
Гидроксид алюминия: При взаимодействии с основаниями он действует как кислота Льюиса, принимая пару электронов от гидроксильного аниона.
Заключение
Как гидроксид натрия, так и гидроксид алюминия являются ионными соединениями, состоящими из катионов металлов и анионов гидроксидов. Основное различие между гидроксидом натрия и гидроксидом алюминия заключается в том, что гидроксид натрия является основным соединением, тогда как гидроксид алюминия является амфотерным соединением.
Артикул:
1. «ГИДРОКСИД НАТРИЯ». Национальный центр биотехнологической информации. База данных соединений PubChem, Национальная медицинская библиотека США, доступна здесь.
Национальный центр биотехнологической информации. База данных соединений PubChem, Национальная медицинская библиотека США, доступна здесь.
Изображение предоставлено:
1. «Изображение гидроксида натрия» Хари Винаяк Сантош — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
2. «Гидроксид алюминия» Copsi (Public Domain) через Commons Wikimedia
Об авторе: Мадхуша
Мадхуша имеет степень бакалавра (с отличием) в области биологических наук и в настоящее время получает степень магистра в области промышленной и экологической химии. Области ее интересов для написания и исследований включают биохимию и химию окружающей среды.
Просмотреть все сообщения
Вам также могут понравиться эти
Гидроксид алюминия и гидроксид магния: информация о лекарствах MedlinePlus
произносится как (a loo’ mi num) (hye drox’ ide) (mag nee’ zhum) (hye drox’ ide)
Чтобы использовать функции обмена на этой странице, включите JavaScript.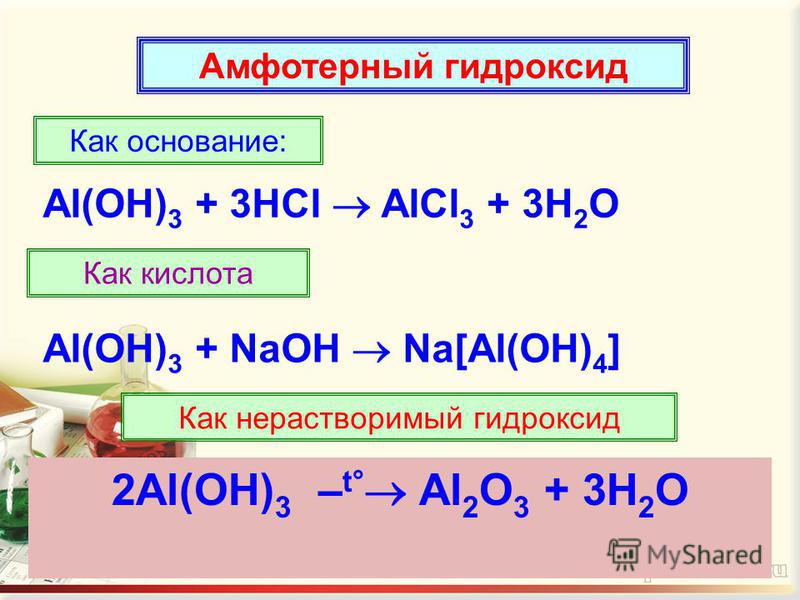
Гидроксид алюминия, Гидроксид магния — это антациды, используемые вместе для облегчения изжоги, кислотного несварения желудка и расстройства желудка. Их можно использовать для лечения этих симптомов у пациентов с язвенной болезнью, гастритом, эзофагитом, грыжей пищеводного отверстия диафрагмы или повышенным содержанием кислоты в желудке (повышенная кислотность желудка). Они соединяются с желудочной кислотой и нейтрализуют ее. Гидроксид алюминия, гидроксид магния доступны без рецепта.
Это лекарство иногда назначают для других целей; попросите вашего врача или фармацевта для получения дополнительной информации.
Это лекарство выпускается в виде жевательных таблеток и жидкости для приема внутрь. Тщательно разжевывайте таблетки; не глотайте их целиком. Выпейте полный стакан воды после приема таблеток. Хорошо встряхните жидкость для приема внутрь перед каждым использованием, чтобы равномерно смешать лекарство. Жидкость можно смешивать с водой или молоком.
Внимательно следуйте указаниям на этикетке на упаковке или на этикетке с рецептом и попросите своего врача или фармацевта объяснить любую часть, которую вы не понимаете. Принимайте антациды гидроксида алюминия, гидроксида магния точно в соответствии с указаниями. Не принимайте больше или меньше и не принимайте чаще, чем предписано врачом. Не принимайте антациды более 1–2 недель, если это не предписано врачом.
Перед приемом антацидов на основе гидроксида алюминия, антацидов на основе гидроксида магния,
- сообщите своему врачу и фармацевту, если у вас аллергия на антациды на основе гидроксида алюминия, антациды на основе гидроксида магния или какие-либо другие препараты.

- сообщите своему врачу и фармацевту, какие рецептурные и безрецептурные лекарства вы принимаете, особенно аспирин, хиноксацин (Cinobac), ципрофлоксацин (Cipro), дигоксин (ланоксин), диазепам (валиум), эноксацин (Penetrex), сульфат железа (железо), флуконазол (дифлюкан), индометацин, изониазид (INH), итраконазол (споранокс), кетоконазол (низорал), левофлоксацин (левахин), ломефлоксацин (максакин), налидиксовая кислота (негграм), норфлоксацин (нороксин), офлоксацин (флоксин), спарфлоксацин ( Загам), тетрациклин (Ахромицин, Сумицин) и витамины. Если ваш врач рекомендует вам принимать антациды во время приема этих лекарств, не принимайте их в течение 2 часов после приема антацида.
- Сообщите своему врачу, если у вас есть или когда-либо было заболевание почек.
- Сообщите своему врачу, если вы беременны, планируете забеременеть или кормите грудью. Если вы забеременели при приеме антацидов гидроксида алюминия, гидроксида магния, позвоните своему врачу.
Если вы принимаете это лекарство от язвы, тщательно соблюдайте диету, назначенную врачом.
Если вы принимаете запланированные дозы гидроксида алюминия, гидроксида магния, примите пропущенную дозу, как только вспомните об этом. Однако, если почти пришло время для следующей дозы, пропустите пропущенную дозу и продолжайте свой обычный график дозирования. Не принимайте двойную дозу, чтобы компенсировать пропущенную.
Побочные эффекты от гидроксида алюминия, гидроксида магния встречаются редко. Чтобы избежать мелового вкуса, принимайте с водой или молоком. Сообщите своему врачу, если какой-либо из этих симптомов является серьезным или не проходит:
- диарея
- запор
- потеря аппетита
- необычная усталость
- мышечная слабость
Храните это лекарство в контейнере, в котором он пришел, плотно закрытым и в недоступном для детей месте. Храните его при комнатной температуре и вдали от избыточного тепла и влаги (не в ванной).
Ненужные лекарства следует утилизировать особым образом, чтобы домашние животные, дети и другие люди не могли их употребить. Однако не следует смывать это лекарство в унитаз. Вместо этого лучший способ избавиться от ваших лекарств — это воспользоваться программой возврата лекарств. Поговорите со своим фармацевтом или обратитесь в местный отдел мусора/переработки, чтобы узнать о программах возврата в вашем районе. Посетите веб-сайт FDA по безопасной утилизации лекарств (http://goo.gl/c4Rm4p) для получения дополнительной информации, если у вас нет доступа к программе возврата.
Однако не следует смывать это лекарство в унитаз. Вместо этого лучший способ избавиться от ваших лекарств — это воспользоваться программой возврата лекарств. Поговорите со своим фармацевтом или обратитесь в местный отдел мусора/переработки, чтобы узнать о программах возврата в вашем районе. Посетите веб-сайт FDA по безопасной утилизации лекарств (http://goo.gl/c4Rm4p) для получения дополнительной информации, если у вас нет доступа к программе возврата.
Важно хранить все лекарства вне поля зрения и в недоступном для детей месте, так как многие контейнеры (например, контейнеры для еженедельных таблеток и контейнеры для глазных капель, кремов, пластырей и ингаляторов) не защищены от детей, и маленькие дети могут легко их открыть . Чтобы защитить маленьких детей от отравления, всегда запирайте защитные колпачки и немедленно кладите лекарство в безопасное место — то, которое находится наверху и далеко, вне поля их зрения и досягаемости. http://www.upandaway.org
- Аламаг ®
- Alumina and Magnesia ®
- Antacid (aluminum-magnesium) ®
- Antacid M ®
- Antacid Suspension ®
- Gen-Alox ®
- Kudrox ®
- M.
 A.H. ®
A.H. ® - Маалокс HRF ®
- Маалокс Т.С. ®
- Магагель ®
- Магналокс ®
- Мальдроксал ®
- Миланта ® Ultimate
- Ri-Mox ®
- Rulox ®
Browse Drugs and Medicines
Al(OH)3 + NaOH → NaAlO2 + h3O
Al(OH) 3 + NaOH → NaAlO 2 + H 2 O là phản ứng hóa học chứng minh khả năng lưỡng tính Của nhôm hidroxit, ược thpt sóc trăng biên soạn, phương trình này sẽ xuất hiện trong nội dung các bài học hóa 12 bài 27: nhôm và hợp chất của nhôm,…. cũng như cac dạng bài tập liên quan.
Hy vọng tài liệu này có thể giup cac bạn viết và cân bằng phương trình một cách nhanh và chính xac hơn.
Related Articles
Nội dung
- 1 1. Phương trình phản ứng Al(OH)3 tác dụng với NaOH
- 1.1 Al(OH)3 + NaOH → NaAlO2 + 2h3O
- 2 2.
 Điều kiện Phản ứng al (OH) 3 ra naalo2
Điều kiện Phản ứng al (OH) 3 ra naalo2 - 3 3. cách tiến hành phản ứng al (OH) 3 tác dụng với naoh
- 4 4. . Tính chất hóa học của Al(OH)3
- 6 6. Bài tập vận dụng liên quan
1. Phương trình phản ứng al (OH)
3 Tác dụng với naohal (OH)
3 + naohAl (OH)
3 + naOHAL (OH)
3 + naOH → naOHAl (OH)
3 + naohAL (OH)
2 O2. Điều kiện phản ứng Al(OH)
3 ra NaAlO 2Nhiệt °C.
Bạn đang xem: Al(OH)3 + NaOH → NaAlO2 + h3O
0015 3
từ từ và ng nghiệm chứa sẵn dung dịch NaOH.4. Hiện tượng phản ứng Al(OH)
3 tác dụng với NaOHSản phẩm thu được chất rắn màu tr.
5. Tính Chất Hóa học của al (OH) 3 Kém bền với nhiệt: khi đun nóng al (OH) 3 Phân hủy Thành al 2 3 Phân hủy Thành Al 2 3 .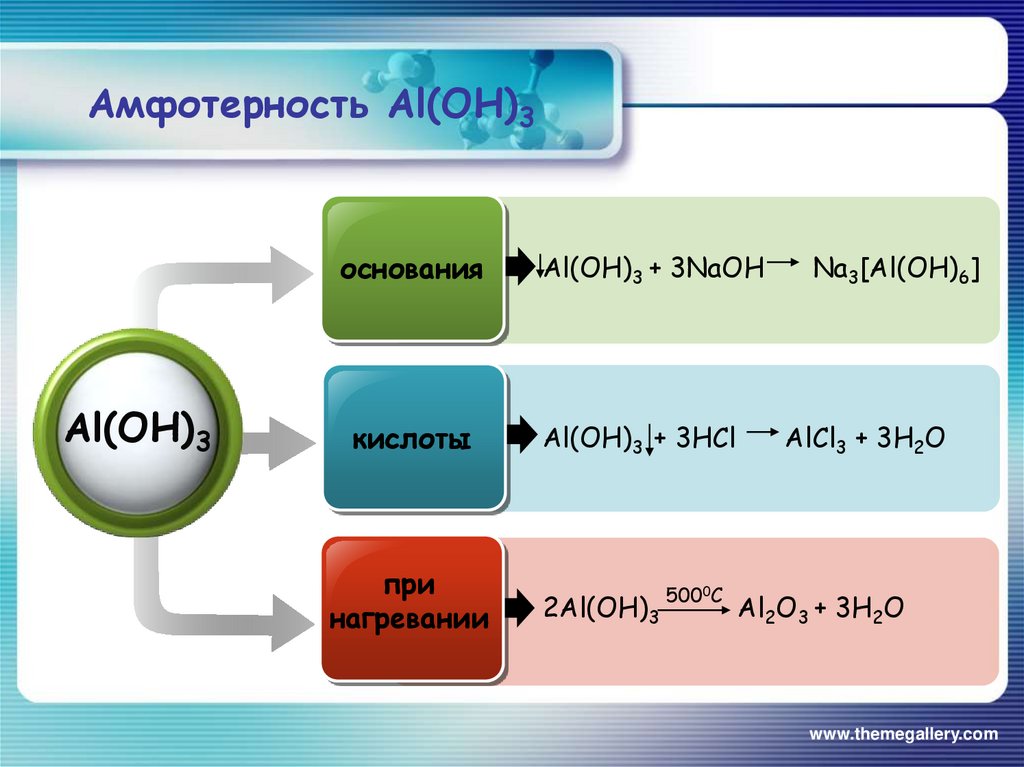
2Al(OH) 3 Al 2 O 3 + 3H 2 O
- Ла hiđroxit lưỡng 9 tính0012
Tác dụng với axit mạnh:
Al(OH) 3 + 3HCl → AlCl 3 + 3H 2 O
Tác dụng với dung dịch kiềm mạnh:
Al(OH) 3 + KOH → Kalo 3 + 2H 3 O
AL (OH) 3 + KOH → K [AL (OH) 4 ]
điều CHế
KếT TủA it Al Al 7 7+67 7+67 7+67 7+67 7+67 7+67 Al Al 7 7+67 7+67 Al 7 7+67 7+67 7+67 7+67 3+67 7+67 7+67 3+67 7+67 7+67 7+67 7+67 7+67 3+67 3+67 3+67 3+67 3+67 3+67 3+67 3+67 3+67 3+67. :
Al 3+ + 3OH- (vừa đủ) → Al(OH) 3
Al 3+ + 3NH 3 + 3H 2 O → AL (OH) 3 + 3NH 4 +
Ví Dụ: 3NAOH + ALCL 3 → 3NACL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + AL + Al + Al + Al + Al + Al + Al + Al + Al + Al.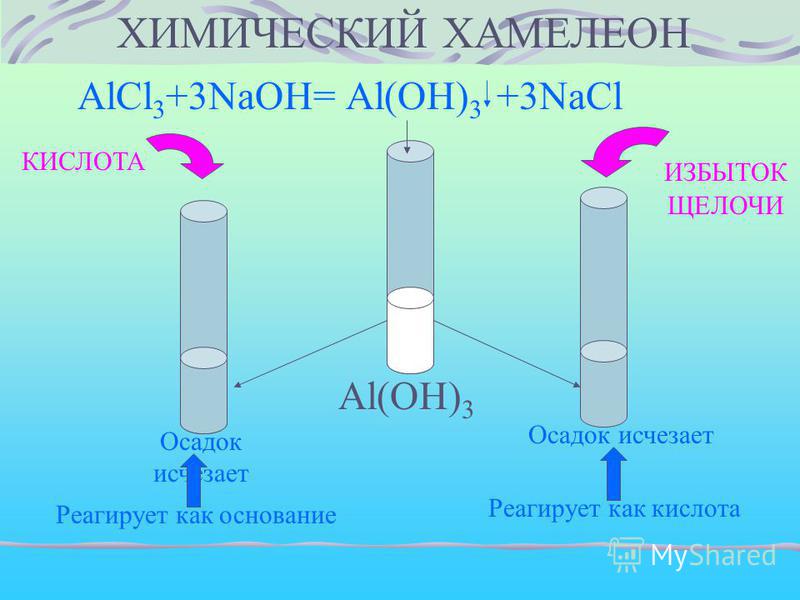 3
3
KếT TủA ALO 2 -:
ALO 2 — + CO 2 + 2H 2 O → AL (OH) 3 + HCO 3 — AL AL — — — — — — — — — — — — — — — — — — — — — — — — — — — — — —. 2- + H+ (vừa đủ) + H 2 O → Al(OH) 3
Ví dụ:
NaAlO 2 + CO 2 + 2H 2 O → AL (OH) 3 + NAHCO 3
6. Bài tập Vận dụng liên QuanCân Cân Dụng Liên Quan 1111111112 Crấ I. Có Thể tác dụng ược với hcl và dung dịch naoh
A. cuo
B. Fe (OH) 3
C. Al (OH) 3
D. Al (№ 3 ) 916
Al (№ 3 ) 916
Đáp án C
Al(OH) 3 + NaOH → NaAlO 2 + 2H 2 O
AL (OH) 3 + 3HCL → ALCL 3 + 3H 2 O
Câu 2. TRONG Các KIM LOạI DướI -nàI -nàI -nàI -nàI .
А. Ал.
Б. Зн.
С. Аг.
D. Cu
Đáp án C
Câu 3. Dãy chất nào dưới đây phản ứng được NaOH
А. Ал 2 О 3 ; Al(OH) 3 ; NaNO 3
Б. А1 2 О 3 ; Fe, Al (OH) 3
C. Al (№ 3 ) 3 , HCL, CO 2
D. FECL 3 , AG, CO 2
đP á 2
. C
C
AL (NO 3 ) 3 + 3NAOH → AL (OH) 3 + 3NANO 3
NAOH + HCL → NACL + H 2 O
CO 2 6 2 6 2 2 6 2 2 2 2 2 2 O
COLS 2 . → Na 2 CO 3 + H 2 O
Câu 4. Thổi V lít khí CO 2 (đktc) vào 100ml dd Ca(OH) 2 1M thu được 6 gam kết tủa. Lọc kết tủa đun Nóng dd lại thấy có kết tủa nữa. Тим Ви?
A. 1,08 Lít
B. 3136 Lít
C. 2,24 Lít
D. 3,36 Lít
đAP án B
N KếT TủA = 6.100 = 00003
N KếT TủA = 6.012 = 00003
N KếT TủA = 0100 = 00003
N ,06 моль
Vì đun nóng lại thu được kết tủa nên dd thu được 2 muối: CaCO 3 ; Ca(HCO 3 ) 2 .
Phương trình hóa học
CO 2 + Ca(OH) 2 → CaCO 3 + H 2 O
0,06
2CO 2 + Ca(OH) 2 → Ca(HCO 3 ) 2 .
0,08 0,04
→ n(CO 2 ) = 0,06 + 0,08 = 0,14. → V = 3 136 л.
Câu 5. Phát biểu nào dưới đây la sai ?
A. Dung dịch Al(OH) 3 và Al 2 (SO 3 ) 3 làm Quỳ tím hóa hồng
B. al (OH) 3 , Al 2 O 3 , Al ều là Các chất lưỡng, tính
C. nhôm là kim loai nhẹ nhẹ nhẹ nhẹ nhẹn hẫn hẫn hẫ nhẹn hẫ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹ nhẹn Iot
D. Từ Al 2 O 3 có thế điều chế được Al.
Đáp án B
Câu 6. Cho sơ đồ phản ng sau: Al → X → Y → Al(OH) 3 . Trong sơ đồ trên, mỗi mũi tên là một phản ung, các chất X, Y lần lượt là
A. NaAlO 2 Và Al (OH) 3
B. AL 2 O 3 Và Al (№ 3 ) 3
C. Al (OH) 3 Và Al 2 C. C. O 3 D. Al(OH) 3 và Al(NO 3 ) 3 Đáp án B 4Al + 3O 2 → 2Al 2 O 3 Al 2 O 3 + 6HNO 3 → 2Al(NO 3 ) 3 + 3H 2 O AL (NO 3 ) 3 + 3NH 3 + 3H 2 O → AL (OH) 3 + 3NH 4 NO 3 A. Нхом ла ким лои лунг тинх. B. Al(OH) 3 là một bazo lưỡng tính có thể tác dụng HCl và NaOH C. Al(OH) 3 là một hidroxit lưỡng tính có thể tác dụng HCl và NaOH D. đap án C Câu 8. Nhôm Bị Thụ ộng Trong Dung Dịch Nào Sau đ đ đ đ đ đc na Al (OH) 3 Và Al 2
Al (OH) 3 Và Al 2 Ал 2 O 3 là oxit trung tính.
Ал 2 O 3 là oxit trung tính.
D. HNO 3 ặC Nóng
đAP áAN B
CâU 9. CRIOLIT (CòN Gọ LA LA -BăAG THHG THHG THHG THHG THHG THHG THAGG). 3
Альф 6 , ược thêm vào al 2 O 3 Trong Quárnh điện phân al 2 O 3 Nóng Chảy ể Sản xuất nhôm. Cho các tác dụng sau:(1) Bảo vệ điện cực khỏi bị ăn mòn.
(2) làm tăng ộ dẫn điện của al 2 o 3 nóng chảy
(3) làm giảm nhiệt ộ nóng chảy của al 2 ngiệt ộ nóng chảy của al 2 .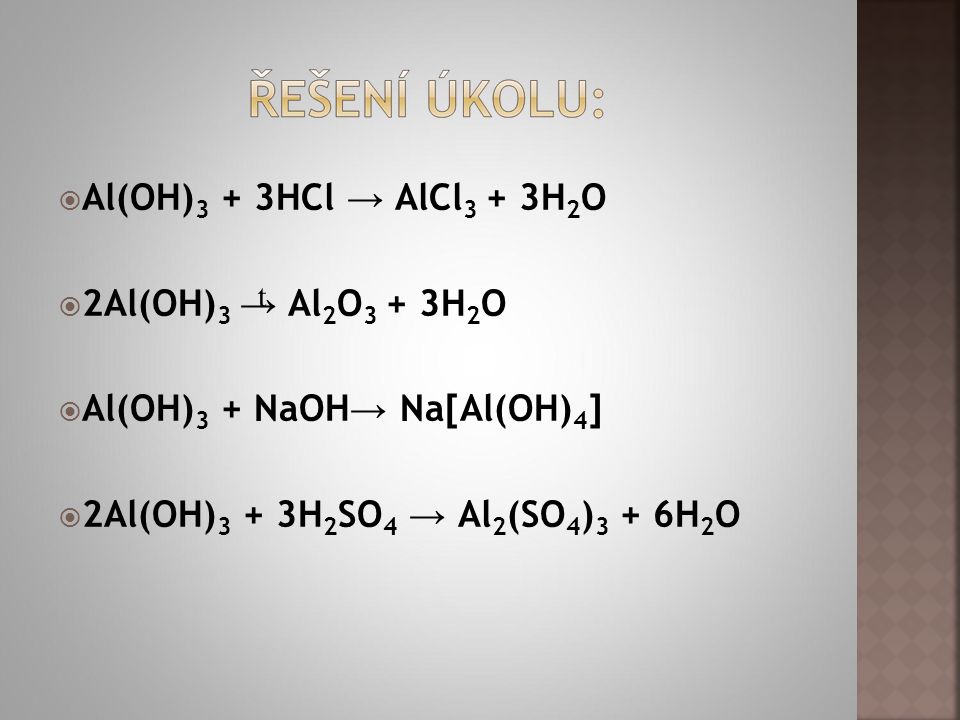 để bảo vệ Al Nóng Chảy
để bảo vệ Al Nóng Chảy
Tác dụng của Criolit la đúng
A. (1), (2), (3), (4)
B. (1), (2), (3)
C. (2), (3), (4)
D. (1), (2), (4)
Đápán C
(2) làm tăng ộ dẫn điện của al 2 o 3 nóng chảy
(3) làm giảm nhiệt ộ nóng chảy của al 2 3
3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 . ngăn cách ể bảo vệ al nóng chảyCâu 10. ở nhiệt ộ thường, kim loại x tác dụng trong nước nhưng tác dụng trong dung dịch kiềm. Kim loại X là
A. Na
B. MG
C. CA
D. AL
đAP áAN A : 2AL + 2NAOH + 2H 2 O → 2NAALO 2 + 3H 2
1111.A. 1116 + 3H 2 1111.19. 116. vừa tác dụng với dd hcl vừa tác dụng với dung dịch koh là: A. fe
fe
B. Mg
C. Na
D. Al
đAp án D
đAP án D
Al VừA -DGI -DGIG D.GIG D.GIG D.GN D
. HCl vừa tác dụng với dung dịch NaOHPhương trình hóa học
2Al + 6HCl → 2AlCl 3 + 3H 2 ↑
Al + NaOH + H 2 O → NaAlO 2 + 3/2 H 2 ↑
9000 3 ———0—PT Sóc trăng đ gửi tới bạn phương trình hóa học al (oh) 3 + naoh → naalo 2 + h 2 O. với phương trình hóa học ể ể chứng al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. al (o. h) có thể phản ng được vơi axit cũng như với cả bazo. Nên cac em học sinh lưu ý. Hy vọng với tài liệu này sẽ cung cấp cac thong tin cần thiết cho cac bạn.Mời các bạn tham khảo một số tài liệu liên quan:
Trên đây THPT Sóc Trăng vừa giới thiệu tới các bạn phương trình hóa học Al(OH) 3 + NaOH → NaAlO 2 + H 2 o, mong rằng qua bài viết này các bạn có thể học tập tốt hơn cũng như giải tốt các dạng bài tập môn hóa lớp 12.

 11.16
11.16
 A.H. ®
A.H. ®  Điều kiện Phản ứng al (OH) 3 ra naalo2
Điều kiện Phản ứng al (OH) 3 ra naalo2