Алюминий, подготовка к ЕГЭ по химии
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой — Al2O3)
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + HCl → AlCl3 + H2
Al + H2SO4(разб.) → Al2(SO4)3 + H2↑
Al + H2SO4(конц.) → (t) Al2(SO4)3 + SO2↑ + H2O
Al + HNO3(разб.) → (t) Al(NO3)3 + N2O + H2O
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется — вместо них образуются (в рамках ЕГЭ) средние соли — алюминаты (академически — сложные окиселы):
Na[Al(OH)4] → (t) NaAlO2 + H2O
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку
нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.
Если разрушить оксидную пленку
нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.
Al + H2O → (t) Al(OH)3 + H2↑
Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Fe2O3 + Al → (t) Al2O3 + Fe
Cr2O3 + Al → (t) Al2O3 + Cr
MnO2 + Al → (t) Al2O3 + Mn
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой.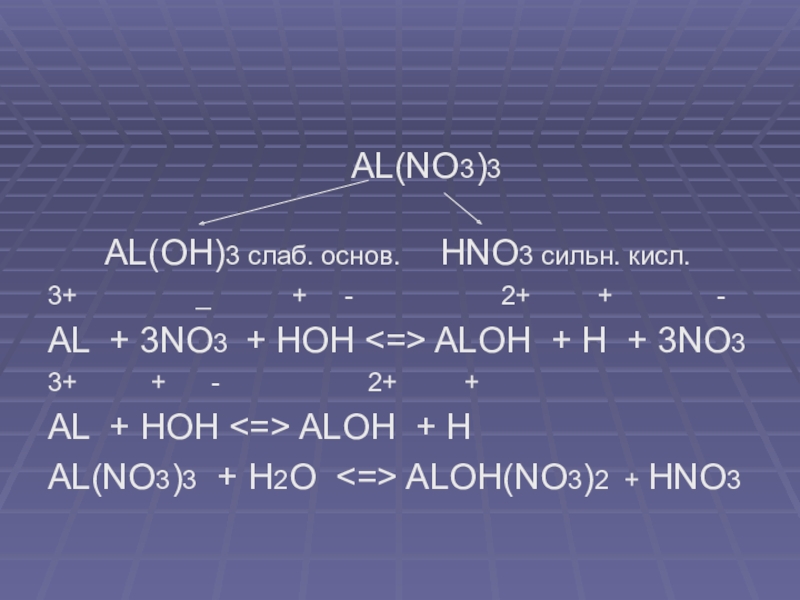 При нагревании гидроксид
алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
При нагревании гидроксид
алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Al + O2 → Al2
Al(OH)3 → (t) Al2O3 + H2O↑
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)
Al2O3 + Na2O → (t) NaAlO2
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами.
AlBr3 + LiOH → Al(OH)3↓ + LiBr
Al(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 — по аниону)
Al2S3 + H2O → Al(OH)3↓ + H2S↑
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + H2SO4 → Al2
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химия — 8
- Определите ряд возрастания относительных атомных масс метал m3>m1>m2 если X, Y, Z. Mr(H2SO4)=98
Основания Масса (в граммах) Масса H2SO4, вступившей в реакцию
нейтрализации
(в граммах)X(OH)2 a m1 Y(OH)2 a m2 Z(OH)2 a m3 a) X<Y<Z
- Определите основания X, Y, Z и T.

Основания Цвет X белый Y голубой Z бурый T желтый 1) CuOH 2) NaOH 3) Fe(OH)3
4) Cu(OH)2 5) Ca(OH)2
6) Fe(OH)2 - Определите основания X и Y.
Основания Образование бесцветного
раствора при
взаимодействии с водойX + Y — 1) Al(OH)3 2) NaOH 3) Fe(OH)3
4) KOH 5) Zn(OH)2 -
Выберите основания, вступающие в реакцию нейтрализации а моль с а моль НСl.

1) Cu(OH)2 2) NaOH 3) Mg(OH)2 4) KOH 5) Аl(ОН)3 - Определите основания X, Y, Z.
Основания Количество моль H2SO4 вступившей в реакцию нейтрализации X; a моль a Y; 2a моль a Z; 2a моль 3a 1) Ca(OH)2 2) KOH
3) Al(OH)3 4) Fe(OH)2
5) NaOH 6) Fe(OH)3 - Определите основания X и Y.
Основания Вступившие в реакцию
веществакислота щелочь X + — Y + + 1) Zn(OH)2 2) NaOH
3) Al(OH)3 4) Ca(OH)2
5) Mg(OH)2 6) Fe(OH)3
Tính chất hóa học của Nhôm Hidroxit Al(OH)3
Trang trước
Trang sau
Bài viết về tín h chất hóa học của Nhôm Hidroxit Al(OH) 3 gồm đầy đủ thong tin cơ bản về Al(OH) 3 trong bảng tuần hoàn,
тинь чат хоа хок, тинь чат вут ли, кач джиу чо ва унг дунг.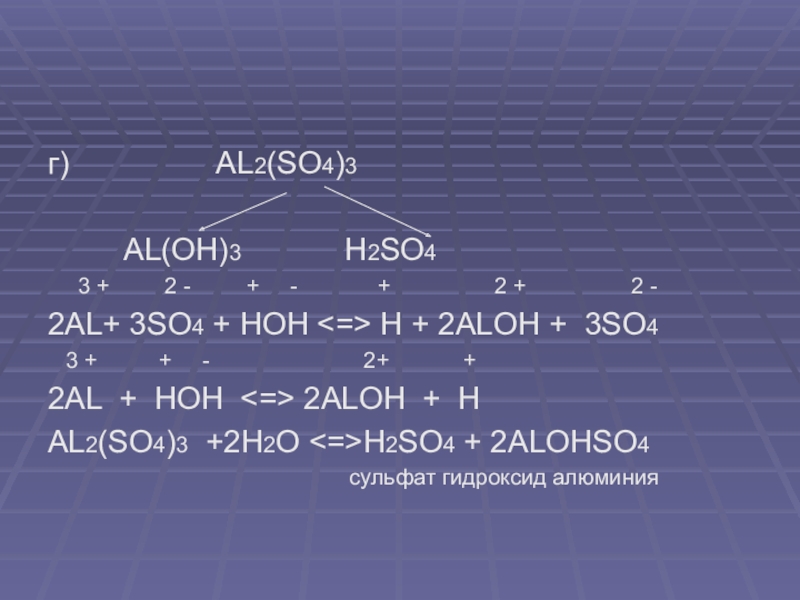
- И. Энх Нгха
- II. Тинь чот вет ли ва нхан бит
- III. Тинь Чот Хоа Хок
- IV. Điều chế
- В. Онг Зунг
Quang cáo
— Nhôm hiđroxit được tìm thấy trong tự nhiên d ưới dạng khoang gibbsit (còn gọi làhydrargillit) và ba chất đa hình hiếm hơn nhiều của nó: bayerit, doyleite và nordstrandite.
— Конг Тхок Фан Ту: Al(OH) 3
— Конг Тхок Ку Ту:
II. Tính chất vật lí & nhận biết— Tính chất vật lí: Là chất rắn, mau trắng, không tan trong nước.
III. Tính chất hóa học— Kém bền với nhiệt: Khi đun nóng Al(OH) 3 phân hủy thành Al 2 O 3 .
2Al(OH) 3 Al 2 O 3 + 3H 2 O
— Là hiđroxit lưỡng tính :
Quảng cáo
— Tác dụng với axit mạnh:
Al(OH) 3 + 3HCl → AlCl 3 + 3H 2 O
— Tác dụng với dung dịch kiềm mỡnh:
Al(OH) 3 + KOH → KAlO 3 + 2H 3 O
Al(OH) 3 + KOH → K[Al (OH) 4 ]
IV. Điều chế
Điều chế — Kết tủa ion Al 3+ :
Al 3+ + 3OH — (vừa đủ) → Al(OH) 3
Al 3+ + 3NH 3 + 3H 2 O → Al(OH) 3 + 3NH 4 +
Ví dụ: 3NaOH + AlCl 3 → 3NaCl + Al(OH) 3
— Kết tủa AlO 2 — :
AlO 2 — + CO 2 + 2H 2 O → Al(OH ) 3 + HCO 3 —
AlO 2 — + H + (vừa đủ ) + H 2 O → Al(OH) 3
Ví dụ: NaAlO 2 + CO 2 + 2H 2 O → Al(OH) 3 + NaHCO 3
Quảng cáo
V. Ứng dụng yên liệu để sản xuất các hợp chất nhom khac: nhom sunfat, полиалюминий clorua, nhom clorua, цеолит, алюминат натрия, нхом кич хот, нхом нитрат.
— Nhôm mới kết tủa dạng hydroxit gel, đó là cơ sở cho việc áp dụng cac muối nhôm như kết tủa trong xử lý nư ок. гель này kết tinh với thời gian. гель нхом гидроксит có thể được khử nước (ví dụ sử dụng nước có thể trộn với dung môi khong chứa nước như этанол) đ ể tạo thành một dạng bột nhôm hydroxit vô định hinh, đó là dễ dễ dàng hòa tan trong axit.
— Bột nhôm hydroxit đã được đun Nóng đến nhiệt độ cao trong điều kiện kiem soát cẩn thận được gọi ла глинозема кич хот ва được sử зунг như một chất лам хо, như một chất hấp phụ trong thanh lọc khí, như một sự hỗ trợ xuc tac Claus để lọc nước, và như một chất hấp phụ cho chất xuc tác trong khi sản xuất полиэтилен bởi quá trình Sclairtech.
— Нхом гидроксит Чунг Тим Тхой Сой Зунг Нхонг Мут Чет Чон Чонг Чай Чо Чак Унг Донг Полимер Тронг Мут Ках Тунг Тун hư magiê гидроксид và hỗn hợp của huntite và гидромагнезит.
Xem thêm tính chất hóa học của cac chất khac:
- Tính chất của Nhom (Al)
- Tính chất của Nhom Oxit Al 2 O 3
- Tính chất của Nhom Clorua AlCl 3
- Tính chất của Nhôm Sunfat Al 2 (SO 4 ) 3
- Tính chất của Nhom Hidrua AlH 3
- Tính chất của Nhom Nitrua AlN
- Tính chất của Nhom Cacbua Al 4 C 3
- Tính chất của Nhom Sunfua Al 2 S 3
- Tính chất của Natri Aluminat NaAlO 2
- Tính chất của Criolit Na 3 AlF 6
- Tính chất của Phèn chua K 2 SO 4 .
 Al 2 (SO 4 ) 3 .24H 2 О сено KAl(SO 4 ) 2 .12H 2 О
Al 2 (SO 4 ) 3 .24H 2 О сено KAl(SO 4 ) 2 .12H 2 О
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Van mẫu, Thi online, Bài giảng….miễn phí. Tải ngay ứng dụng trên Android và iOS.
Тео Дои Чунг Той Мьен Пхи Трен Мунг Кса Хой facebook và youtube:
Loạt bài Wiki tính chất hoa học trình bay toàn bộ tính chất hoa học, vật lí, nhận biet, điều chế và ứng dụng của tất cả cac đơn chất, hợp chất hóa học đã học trong chương trình Hóa học cấp 2, 3.
Nếu thấy hay, hay động viên và chia sẻ nhé! Cac binh luận khong phù hợp với nội quy binh luận trang web sẽ bị cấm binh luận vĩnh viễn.
Транг трук Trang sau
tinh-chat-cua-nhom-al-va-hop-chat-cua-nhom.jsp
Cho sơ đồ phản ứng sau: (1) X + Y Al(OH)3 + Z; (2) Х + Т Z + AlCl3. (3) AlCl3 + Y Al(OH)3 + T Cac chất X, Y, Z và T tươ?
Cho sơ đồ phản ứng sau:
(1) X + Y Al(OH) 3 + Z;
(2) Х + Т Z + AlCl 3 .
(3) AlCl 3 + Y Al(OH) 3 + T
Các chất X, Y, Z và T tương ứng là:
A. Al 2 9 0010 (СО 4 ) 3 , Ba(OH) 2 , BaCO 3 và BaCl 2 .
B. Al 2 (SO 4 ) 3 , NaOH, Na 2 SO 4 và H 2 90 010 СО 4 .
С. Ал 2 (СО 4 ) 3 , Ba(OH) 2 , BaSO 4 và BaCl 2 .
D. Al(NO 3 ) 3 , NaNO 3 , BaCl 2 và khí Cl 2 .
| Трэн Тхо Хоай Май Чан . 23.03.2018 |
Форсефоронлитаржет Чан Вай Лои. 06.13.2017 06.13.2017. 06.13.2017 |
| Чонг Тон Тан команда С. 06.08.2017 . 06.08.2017 |
| Кхонг Тон Туи чан луна. 06.06.2017 . 06.06.2017 |
| Трэн Транг С . 06.05.2017 . 06.05.2017 |
| NHẬT ПЕСНЯ чан чо . 06.04.2017 |
Команда#SMT получить луну. 06.04.2017 06.04.2017. 06.04.2017 |
| Нгуен Транг +0,25 . 06.04.2017 . 06.04.2017 |
| Нгуен Вьет Чонг sai 4 cau thì 3 cau sai ключ. 06.04.2017 . 06.04.2017 |
| Фан Хонг Ок đề bữa nay sai nhiều cậu nhỉ, toán lí hóa j cung thế 🙁 06.04.2017 . 06.04.2017 |
| Хоанг Док Ань С -__- 06.04.2017 . 06.04.2017 |
Фан Хонг Ок хо хо С. |



 Al 2 (SO 4 ) 3 .24H 2 О сено KAl(SO 4 ) 2 .12H 2 О
Al 2 (SO 4 ) 3 .24H 2 О сено KAl(SO 4 ) 2 .12H 2 О