pravila_opredeleniya_stepeni_okisleniya
Политова С.В.
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ. |
Правило № 1 | Правило № 2 | Правило № 3 | Правило № 4 | Правило № 5 | Правило № 6 | Правило № 7 | Правило № 8 |
Изолированные
атомы химических элементов имеют
степень окисления, =0. | Простые вещества имеют степень окисления, =0. | Водород имеет степень окисления, = +1. | Кислород имеет степень окисления, = -2. | Фтор в соединениях имеет степень окисления, равную= -1. | Щелочные металлы (гл. подгруппа I группа) имеют степень окисления, =+1 | Щелочно-земельные металлы (гл. подгруппа II группа, Са-Ra) и Mg имеют степень окисления +2. | Алюминий имеет в соединениях степень окисления +3. |
Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. |
0 Cl | 0 N2 | h3O | SrO | -1 HF | Na2S | CaF2 | Al2O3 |
0 Na | 0 Cu | h4N | Cr2O3 | CaF2 | K2O | MgO | Al(OH)3 |
0 He | 0 O3 | h3Se | SeO2 | SiF4 | LiOH | Ba(OH)2 | Al2S3 |
0 O | 0 Cl2 | h4AsO4 | Rb2O | XeF6 | NaOH | ||
0 Cu | 0 Na | Ra(OH)2 | RbOH | ClF3 | CsOH | ||
Nah3PO4 | HPO3 | CCl2F2 | |||||
Fe(OH)2Cl | Al(OH)3=HAlO2 | ||||||
[Ag(Nh4)2]Cl | Li2SO3 | ||||||
Be(OH)2=h3BeO2 | Ca(HSO4)2 | ||||||
h5C | BaOHCl | ||||||
Ch5O | KCr(SO4)2 | ||||||
Ch4-Ch3-OH | |||||||
H-C=O I H | |||||||
Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. |
Гидриды металлов: | +2 OF2-фторид кислорода | ||||||
Н | Н | +1 -1 MH (KH) | -1 Н2О2 -пероксид водорода | ||||
Е | Е | +2 -1 Mh3(Bah3) | -1 -1 M2O2(Na2O2) -перолсиды щелочных металлов | ||||
Т | Т | +3 -1 Mh4(Alh4) | -1 -1 MO2(CaO2, -1 BaO2 ) — пероксиды щелочноземельных металлов | ||||
-1/2 -1/2 MO2 (NaO2, -1/2 KO2) -надпероксиды щелочных металлов |
Выводы:
высшая положительная степень окисления
большинства
элементов численно равна номеру группы
таблицы элементов, в которой он находится.
Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя.
АЛГОРИТМ определения степени окисления химического элемента в бинарных соединениях. |
1 | 2 | 3 | 4 |
Находим, какой из двух элементов в соединении является более электроотрицательным. | Определяем
числовое значение степени окисления
для более электроотрицательного
элемента. | Определяем общее число отрицательных зарядов в соединении. | Находим степень окисления менее электроотрицательного элемента. |
Над символом более электроотрицательного элемента ставим знак «минус» (-). | Для этого степень окисления более электроотрицательного элемента умножаем на его индекс. | Для этого общее число положительных зарядов делим на индекс у данного элемента. | |
Над символом менее электроотрицательного элемента ставим знак «плюс» (+). | Помним,
что алгебраическая
сумма степеней окисления химических
элементов в соединении должна быть
равна =0. |
Закрепление: определите степени окисления элементов в заданных формулах бинарных соединений.
SiF4, P2O5, As2O5, Cah3, Li3N, OsF8, SiCl4, h4P, SCl4, PCL3, h5C, h4As, SF6, SnBr4, AlN,
Sb2O5, CuO, FeO.
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ. |
Правило № 1 | Правило № 2 | Правило № 3 | Правило № 4 | Правило № 5 | Правило № 6 | Правило № 7 | Правило № 8 |
Изолированные
атомы химических элементов имеют
степень окисления, =0. | Простые вещества имеют степень окисления, =0. | Водород имеет степень окисления, =+1. | Кислород имеет степень окисления, =-2. | Фтор в соединениях имеет степень окисления, равную -1. | Щелочные металлы (гл. подгруппа I группа) имеют степень окисления, =+1 | Щелочно-земельные металлы (гл. подгруппа II группа, Са-Ra) и Mg имеют степень окисления +2. | Алюминий имеет в соединениях степень окисления +3. |
Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. |
0 Cl | 0 N2 | h3O | SrO | -1 HF | Na2S | CaF2 | Al2O3 |
0 Na | 0 Cu | h4N | Cr2O3 | CaF2 | K2O | MgO | Al(OH)3 |
0 He | 0 O3 | h3Se | SeO2 | SiF4 | LiOH | Ba(OH)2 | Al2S3 |
0 O | 0 Cl2 | h4AsO4 | Rb2O | XeF6 | NaOH | ||
0 Cu | 0 Na | Ra(OH)2 | RbOH | ClF3 | CsOH | ||
Nah3PO4 | HPO3 | CCl2F2 | |||||
Fe(OH)2Cl | Al(OH)3=HAlO2 | ||||||
[Ag(Nh4)2]Cl | Li2SO3 | ||||||
Be(OH)2=h3BeO2 | Ca(HSO4)2 | ||||||
h5C | BaOHCl | ||||||
Ch5O | KCr(SO4)2 | ||||||
Ch4-Ch3-OH | |||||||
H-C=O I H | |||||||
Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. |
Гидриды металлов: | +2 OF2-фторид кислорода | ||||||
Н | Н | +1 -1 MH (KH) | -1 Н2О2 -пероксид водорода | ||||
Е | Е | +2 -1 Mh3(Bah3) | -1 -1 M2O2(Na2O2) -перолсиды щелочных металлов | ||||
Т | Т | +3 -1 Mh4(Alh4) | -1 -1 MO2(CaO2, -1 BaO2 ) — пероксиды щелочноземельных металлов | ||||
-1/2 -1/2 MO2 (NaO2, -1/2 KO2) -надпероксиды щелочных металлов |
Выводы:
высшая положительная степень окисления
большинства
элементов численно равна номеру группы
таблицы элементов, в которой он находится.
Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя.
Составьте эмпирические формулы оксидов мышьяка (V). Бесплатный доступ к решению задач
Составьте эмпирические формулы оксидов мышьяка (V).docЗарегистрируйся в два клика и получи неограниченный доступ к материалам, а также промокод на новый заказ в Автор24. Это бесплатно.
Условие
Составьте эмпирические формулы оксидов: мышьяка (V).
Решение
Оксид мышьяка (V) — As2O5. Степень окисления мышьяка +5. Степень окисления кислорода –2.
Зарегистрируйся, чтобы продолжить изучение работы
и получи доступ ко всей экосистеме Автор24
Больше решений задач по химии:
Все Решенные задачи по химии
Закажи решение задач
Наш проект является банком работ по всем школьным и студенческим предметам. Если вы не хотите
тратить
время на написание работ по ненужным предметам или ищете шаблон для своей работы —
он есть у нас.
Если вы не хотите
тратить
время на написание работ по ненужным предметам или ищете шаблон для своей работы —
он есть у нас.
Не нашел ответ на свой вопрос?
Опиши, с чем тебе нужна помощь. Эксперты Автор24 бесплатно ответят тебе в течение часа
Выбери предметАвиационная и ракетно-космическая техникаАвтоматизация технологических процессовАвтоматика и управлениеАгрохимия и агропочвоведениеАктерское мастерствоАнализ хозяйственной деятельностиАнглийский языкАнтикризисное управлениеАрхеологияАрхитектура и строительствоАстрономияБазы данныхБанковское делоБезопасность жизнедеятельностиБиблиотечно-информационная деятельностьБизнес-планированиеБиологияБиотехнологияБухгалтерский учет и аудитВетеринарияВнешнеэкономическая деятельностьВодные биоресурсы и аквакультураВоенное делоВоспроизводство и переработка лесных ресурсовВысшая математикаГеографияГеодезияГеологияГеометрияГидравликаГидрометеорологияГостиничное делоГосударственное и муниципальное управлениеДеловой этикетДеньгиДетали машинДизайнДокументоведение и архивоведениеЕстествознаниеЖелезнодорожный транспортЖурналистикаЗемлеустройство и кадастрИздательское делоИнвестицииИнженерные сети и оборудованиеИнновационный менеджментИнформатикаИнформационная безопасностьИнформационные технологииИскусствоИсторияКартография и геоинформатикаКитайский языкКонфликтологияКраеведениеКредитКриминалистикаКулинарияКультурологияЛитератураЛогикаЛогистикаМаркетингМатериаловедениеМашиностроениеМедицинаМеждународные отношенияМеждународные рынкиМенеджментМенеджмент организацииМеталлургияМетрологияМеханикаМикро-, макроэкономикаМикропроцессорная техникаМорская техникаМузыкаНалогиНаноинженерияНачертательная геометрияНемецкий языкНефтегазовое делоОрганизационное развитиеПарикмахерское искусствоПедагогикаПожарная безопасностьПолиграфияПолитологияПочвоведениеПраво и юриспруденцияПриборостроение и оптотехникаПриродообустройство и водопользованиеПрограммированиеПроизводственный маркетинг и менеджментПромышленный маркетинг и менеджментПроцессы и аппаратыПсихологияРабота на компьютереРадиофизикаРежиссураРеклама и PRРелигияРусский языкРынок ценных бумагСадоводствоСварка и сварочное производствоСвязи с общественностьюСельское и рыбное хозяйствоСервисСопротивление материаловСоциальная работаСоциологияСтандартизацияСтатистикаСтрановедениеСтратегический менеджментСтрахованиеТаможенное делоТеатроведениеТекстильная промышленностьТелевидениеТеоретическая механикаТеория вероятностейТеория игрТеория машин и механизмовТеория управленияТеплоэнергетика и теплотехникаТехнологические машины и оборудованиеТехнология продовольственных продуктов и товаровТовароведениеТорговое делоТранспортные средстваТуризмУправление качествомУправление персоналомУправление проектамиФармацияФизикаФизическая культураФилософияФинансовый менеджментФинансыФранцузский языкХимияХирургияХолодильная техникаЦенообразование и оценка бизнесаЧертежиЧерчениеЭкологияЭконометрикаЭкономикаЭкономика предприятияЭкономика трудаЭкономическая теорияЭкономический анализЭлектроника, электротехника, радиотехникаЭнергетическое машиностроениеЭтикаЯдерная энергетика и теплофизикаЯдерные физика и технологииЯзыки (переводы)Языкознание и филологияEVIEWSSPSSSTATAДругоеПрикрепить файл
Твой вопрос отправлен
Скоро мы пришлем ответ экпертов Автор24 тебе на почту
Помощь эксперта
Нужна помощь по теме или написание схожей работы?
Свяжись напрямую с автором и обсуди заказ.
5
JerryStar
Химия 775 заказов
Отправить письмо схожим авторам, которые сейчас на сайте
Регистрация прошла успешно!
Теперь вам доступен полный фрагмент работы, а также
открыт доступ ко всем сервисам
экосистемы
Введи почту
Зарегистрируйся через почту и получи неограниченный доступ к материалам. Это бесплатно.
Читать тексты на сайте можно без ограничений. Однако для копирования и использования работ нужно зарегистрироваться в экосистеме Автор24. Это бесплатно.
Классификация неорганических веществ презентация, доклад
Классификация неорганических веществ
Лекция №9
Подготовка к ЕГЭ
HI
h3SO4
LiOH
План
Классификация неорганических веществ.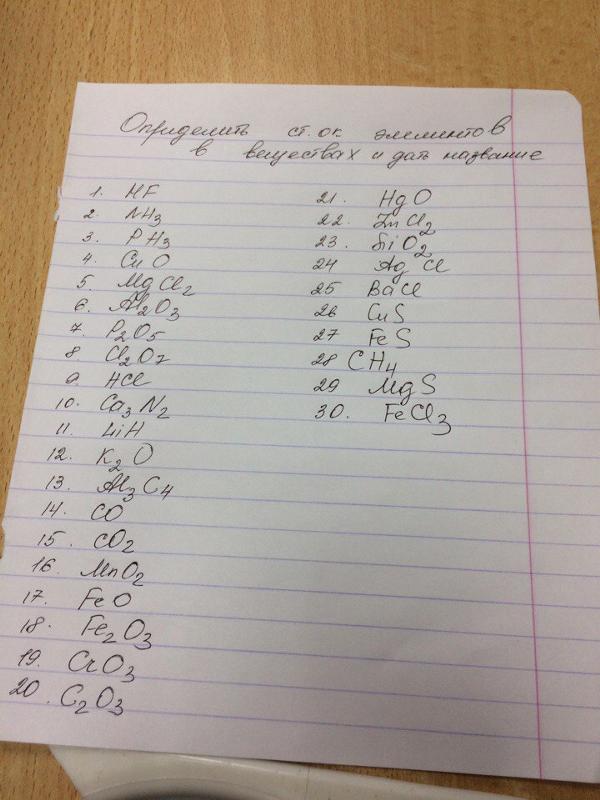
Металлы и неметаллы.
Оксиды. Их классификация.
Основания и их классификация.
Кислоты и их классификация.
Соли. Классификация солей. Номенклатура солей.
Бытовые названия некоторых солей.
Классификация неорганических веществ
К важнейшим классам неорганических веществ относят:
простые вещества (металлы и неметаллы),
оксиды (кислотные, основные и амфотерные),
гидроксиды (часть кислот, основания, амфотерные гидроксиды),
соли.
Простые вещества обычно делят на металлы и неметаллы.
Металлы – простые вещества, в которых атомы связаны между собой металлической связью.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
Металлы и неметаллы
Амфотерные металлы
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов.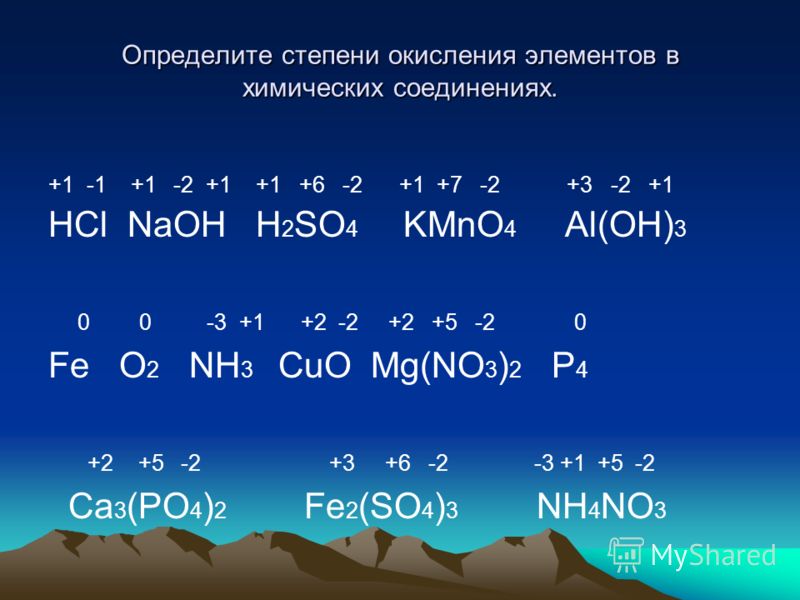
Это название отражает способность этих металлов, их оксидов и гидроксидов реагировать как с кислотами, так и со щелочами.
Цинк, алюминий, хром, марганец, железо.
Оксиды
Оксиды – бинарные соединения, одним из двух элементов в которых является кислород со степенью окисления -2.
Оксиды
Каждому солеобразующему оксиду соответствует гидроксид:
Основным оксидам соответствуют основания;
Амфотерным оксидам – амфотерные гидроксиды,
Кислотным оксидам – кислородсодержащие кислоты.
Гидроксиды
Гидроксиды – соединения, в состав которых входит группа Э–О-Н.
И основания, и кислородсодержащие кислоты, и амфотерные гидроксиды – относятся к ГИДРОКСИДАМ!
Связь между оксидом и гидроксидами.
КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
А. Если чётная степень окисления элемента в оксиде: ПРИБАВЛЯЕМ ВОДУ к оксиду. Пример: WO3 –(+h3O)? h3WO4
Б. Если нечетная степень окисления:
Мета-форма кислоты — ОДИН атом водорода: НЭОх
Орто-форма кислоты – отличается от МЕТА-формы на одну молекулу воды. Н3ЭОх+1
КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
Пример: Оксид As2O5, степень окисления мышьяка +5.
Составим формулу кислоты: Н+As+5O-2x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO3 Это МЕТА-форма кислоты — мета-мышьяковая кислота.
Но для фосфора и мышьяка существует и более устойчива ОРТО-форма. Прибавив к мета-форме Н2О, получим h4AsO4. Это орто- мышьяковая кислота.
Основания
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН- и при диссоциации образующие в качестве анионов только эти ионы.
Типы оснований
КИСЛОТНОСТЬ основания
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле:
однокислотные – содержащие только 1 гидроксогруппу
двухкислотные – имеющие 2 гидроксогруппу;
трёхкислотные – с тремя группами ОН.
Кислоты
Кислоты – сложные вещества, содержащие в своем составе ионы оксония Н+ или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Классификация кислот по составу
Классификация кислот по числу атомов водорода.
Классификация по силе и устойчивости
Соли
Соли – это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+) и одного (или нескольких)
Классификация солей
Номенклатура солей
В названиях солей используются латинские названия образующих кислоты неметаллов.
Построение названий солей
Построение названий солей
Построение названий солей
Построение названий солей
Кислые соли
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку «гидро»:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
Kh3PO4 – дигидрофосфат калия.
Основные соли
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо»:
Mg(OH)Cl — гидроксохлорид магния (основная соль)
Двойные соли
Двойные соли – имеют два разных катиона металла или аммония.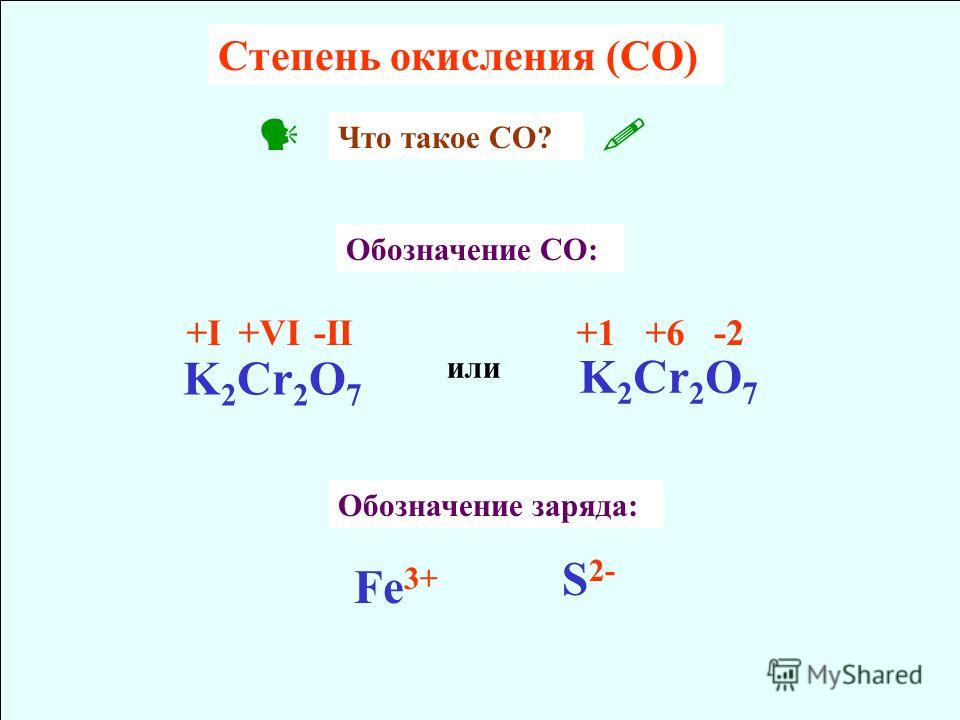
В названии их перечисляют через дефис:
(Nh5)Fe(SO4)2 – сульфат железа (III)-аммония.
Смешанные соли
Смешанные соли – имеют два разных аниона кислотных остатков. В названии их называют через дефис:
СаOCl2 или CaCl(OCl) — хлорид-гипохлорит кальция (традиционное название хлорная известь).
Комплексные соли
Комплексные соли – содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
Пример: K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(Nh4)4]Cl2 – хлорид тетраамминмеди (II)
Бытовые (тривиальные) названия некоторых солей
Источники
http://egeigia. ru/all-ege/materialy-ege/himiya/566-ege-him-2012-5
ru/all-ege/materialy-ege/himiya/566-ege-him-2012-5
Автор: Калитина Тамара Михайловна
Место работы: МБОУ СОШ №2 с.Александров-Гай Саратовской области
Должность: учитель химии
Дополнительные сведения: сайт http://kalitina.okis.ru/
Мини-сайт http://www.nsportal.ru/kalitina-tamara-mikhailovna
Скачать презентацию
как называется соединение с формулой as2o5?
Здравствуйте и добро пожаловать дорогие читатели на сайт negarinfo, в этом посте мы обсудим «как называется соединение с формулой as2o5?» .
Надеемся, вам понравится этот пост. Спасибо за выбор и за то, что вы с нами.
Как называется соединение с формулой As2O5?
Мышьяк
Все соединения, содержащие мышьяк (Ar), токсичны для человека. В высоких концентрациях мышьяк может вызывать поражение внутренних органов, сосудов и нервной системы. Более низкие концентрации в течение длительного периода времени могут вызывать различные виды рака.
Более низкие концентрации в течение длительного периода времени могут вызывать различные виды рака.
Формула ПЕНТОКСИДА МЫШЬЯКА (As2O5)
Молекула ПЕНТОКСИДА МЫШЬЯКА содержит всего 7 атомов. Есть 5 атомов кислорода. Таким образом, химическая формула ПЕНТОКСИДА МЫШЬЯКА может быть записана как:
As2O5
Химическая формула ПЕНТОКСИДА МЫШЬЯКА, показанная выше, основана на молекулярной формуле, показывающей количество атомов каждого типа в молекуле без структурной информации, т.е. отличается от эмпирической формулы, которая обеспечивает числовые пропорции атомов каждого типа.
Приведенная выше химическая формула является основой стехиометрии в химических уравнениях, т. е. расчета относительных количеств реагентов и продуктов в химических реакциях. Закон сохранения массы гласит, что количество каждого элемента, указанного в химической формуле, не изменяется в результате химической реакции. Таким образом, каждая сторона химического уравнения должна представлять одно и то же количество любого конкретного элемента на основе химической формулы.
Как называется соединение As2O5?
ПЕНТОКСИД МЫШЬЯКА
Пятиокись мышьяка
| PubChem CID | 14771 |
|---|---|
| Химическая безопасность | Лабораторная химическая безопасность (LCSS) Лист данных |
| Молекулярная формула | Ас2О5 |
| Синонимы | ПЕНТОКСИД МЫШЬЯКА Оксид мышьяка(V) 1303-28-2 Пентоксид мышьяка(V) Ангидрид мышьяковой кислоты Подробнее… |
| Молекулярный вес | 229.84 |
Какова молекулярная формула As2O5?
As2O5
Пятиокись мышьяка/Формула
ДОПОЛНИТЕЛЬНЫЕ ОБЪЯВЛЕНИЯ ДЛЯ ВАС:
- геотермальная энергия получена из солнца
- смещение — это изменение скорости объекта
- как называется соединение с формулой as2o5?
- какова величина чистого крутящего момента относительно оси?
- что из нижеперечисленного составляет более 10% массы атмосферы?
- Классические молочные крекеры для обеда Heritage Mills
как сбалансировать as2o5?
как сбалансировать as2o5? Шаг 1. Запишите неуравновешенное уравнение (‘каркасное уравнение’) химической реакции. Все реагенты и продукты должны быть известны. Для лучшего результата запишите реакцию в ионной форме.
Запишите неуравновешенное уравнение (‘каркасное уравнение’) химической реакции. Все реагенты и продукты должны быть известны. Для лучшего результата запишите реакцию в ионной форме.
As + NO 3 – → As 2 O 5 + NO
Этап 2. Разделить процесс на полуреакции. Окислительно-восстановительная реакция представляет собой не что иное, как одновременно протекающие реакции окисления и восстановления.
а) Назначьте степени окисления 90 100 для каждого атома в уравнении. Степень окисления (также называемая степенью окисления) является мерой степени окисления атома в веществе.
AS+N+5O-2 3 — → AS+5 2 O-2 5 +N+2-2-2
B) реакция. Определите, какие реагенты окисляются (степень окисления увеличивается, когда они вступают в реакцию), а какие восстанавливаются (степень окисления снижается). Запишите перенос электронов. Осторожно, если необходимо, вставьте коэффициенты, чтобы количество окисленных и восстановленных атомов было равным с двух сторон каждой окислительно-восстановительной пары.
Осторожно, если необходимо, вставьте коэффициенты, чтобы количество окисленных и восстановленных атомов было равным с двух сторон каждой окислительно-восстановительной пары.O:
2As → As+5 2 O-2 5 + 10e –
(As)
9 000802 R:0002 N+5O-2 3 – + 3e – → N+2O-2(N)
c) Объединить эти полуреакции окисления 9 в две окислительно-восстановительные пары: , и один для сокращения .
O:
2AS → AS+ 5 2 O-2 5 + 10E —
R:
N+ 5o-2 3 —+ 3E + 3E —————. → N+2O-2
Шаг 3. Уравновесьте атомы в каждой половине реакции. В химическом уравнении должно быть одинаковое количество атомов каждого элемента в обеих частях уравнения. Добавьте соответствующие коэффициенты (стехиометрические коэффициенты) перед химическими формулами, чтобы сбалансировать количество атомов. Никогда не меняйте никакие формулы.
Никогда не меняйте никакие формулы.
а) Уравновешивают все остальные атомы, кроме водорода и кислорода. Для этой цели мы можем использовать любой из видов, фигурирующих в уравнениях скелета. Имейте в виду, что реагенты следует добавлять только в левую часть уравнения, а продукты — в правую.
O:
2AS → AS+ 5 2 O-2 5 + 10E —
R:
N+ 5o-2 3 —+ 3E + 3E —————. → N+2O-2
б) Сбалансировать заряд. Для реакций в кислом растворе сбалансируйте заряд так, чтобы обе стороны имели одинаковый общий заряд, добавив ион H + к стороне с дефицитом положительного заряда.
О:
2As → As+5 2 O-2 5 + 10e – + 10H +
R:
N+5O-2 3 – + 3e – + 4H + → N+2O-2
c) Уравновешивают атомы кислорода. Проверьте, одинаково ли количество атомов кислорода слева и справа, не уравновешивают ли они эти атомы добавлением молекул воды.
Проверьте, одинаково ли количество атомов кислорода слева и справа, не уравновешивают ли они эти атомы добавлением молекул воды.
O:
2As + 5H 2 O → As+5 2 O-2 5 + 10e – + 10H +
R:
N+5O-2 3 – + 3e – + 4H + → N +2O-2 + 2H 2 O
как называется соединение с формулой as2o5?Сбалансированные полуреакции хорошо представлены в справочниках и в Интернете в «Таблицах стандартных электродных потенциалов». Эти таблицы условно содержат потенциалы полуклеток для восстановления. Чтобы запустить реакцию окисления, просто измените реакцию восстановления на противоположную и измените знак у E 9.0103 1/2 значение.
Шаг 4. Сделать прирост электронов равным потере электронов. Электроны, потерянные в полуреакции окисления, должны быть равны электронам, полученным в полуреакции восстановления. Чтобы сделать их равными, умножьте коэффициенты всех видов на целые числа, получив наименьшее общее кратное между полуреакциями.
Чтобы сделать их равными, умножьте коэффициенты всех видов на целые числа, получив наименьшее общее кратное между полуреакциями.
O:
2As + 5H 2 O → As+5 2 O-2 5 + 10e – + 10H +
| *3
R:
N+ 5o-2 3 —+ 3E —+ 4H + → N+ 2o-2+ 2H 2 O
| *10
O:
6As + 15H 2 O → 3As+5 2 O-2 5 + 30e – + 30H +
R:
10N +5O-2 3 – + 30e – + 40H + → 10N+2O-2 + 20H 2 O
Шаг 5. Сложите полуреакции вместе. Две полуреакции можно комбинировать так же, как два алгебраических уравнения, со стрелкой в качестве знака равенства. Соедините две полуреакции, соединив все реагенты с одной стороны и все продукты с другой стороны.
6As + 10N+5O-2 3 – + 15H 2 O + 30e – + 40H + 5 9 0 → 33As+5 2921030104 + 10N+2O-2 + 30e – + 20H 2 O + 30H +
Шаг 6. Упростите уравнение. Один и тот же вид на противоположных сторонах стрелки может быть отменен. Напишите уравнение так, чтобы коэффициенты были наименьшим возможным набором целых чисел.
6AS+ 10N+ 5O-2 3 —+ 10H + → 3AS+ 5 2 O-2 5 + 10n+ 2o-2+ 5H 2 O
902 2 O 9000 29+0097 Наконец , всегда проверяйте, чтобы уравнение было сбалансированным. Сначала убедитесь, что уравнение содержит одинаковый тип и количество атомов в обеих частях уравнения.as2o5 название соединения как правильно называется соединение с формулой как называется соединение с формулой as2o5 как называется соединение с формулой n2o5 как называется соединение с формулой p2o5 что как называется соединение с формулой как называется соединение с формулой al2o3 как называется соединение с формулой al2s3 как называется соединение с формулой so3
Предыдущий пост
Следующий пост
Присвойте степени окисления каждому атому в следующих соединениях: HI, PBr3, GeS2, KH,
Присвойте каждому атому степень окисления в следующих соединениях: HI, PBr3, GeS2, KH,Вопросы ООО
- 👤
- 🔎
Задать новый вопрос
Задавайте вопросы и получайте полезные ответы.
Задать новый вопрос
- 👍
- 👎
- 👁
- ℹ️
- 🚩
спросил Майкл
5 ответов
нужна помощь
- 👍
- 👎
- ℹ️
- 🚩
ответил Writeacher
У вас есть семь правил?
Я пройдусь по одному .
 .
.
h4PO4
Правило: H равно +1
Правило: O равно -2, кроме пероксидов. Правило
: Сумма степеней окисления в соединении равна нулю.
3+ P -8=0 что дает P + 5Попробуйте сами, запомните правила. Мы проверим вашу работу.
- 👍
- 👎
- ℹ️
- 🚩
👤
бобперсли
но я не понимаю как должен выглядеть ответ на эти проблемы
- 👍
- 👎
- ℹ️
- 🚩
ответил Михаил
и да это химия 10 класса
- 👍
- 👎
- ℹ️
- 🚩
ответил Михаил
Ответом будет число для каждого атома с соответствующим знаком.
 SO +1, -2 и т. д.
SO +1, -2 и т. д.- 👍
- 👎
- ℹ️
- 🚩
ответил Dr Russ
Ответить на этот вопрос
Ваше имя
Твой ответ
Похожие вопросы
Все еще нужна помощь?
Вы можете задать новый вопрос или просмотреть существующие вопросы.
Мышьяк является широко встречающимся токсичным элементом, и его воздействие на здоровье хорошо задокументировано
Стандарты мышьяка
В В начале 1990-х годов Всемирная организация здравоохранения рекомендовала текущий стандарт питьевой воды 50 микрограммов на литр (мкг/л) содержание мышьяка (As) должно быть снижено до новых стандартов 10 мкг/л на основе тестирование воздействия на здоровье, проводимое на протяжении многих лет. Агентство по охране окружающей среды США принял новый стандарт MCL 10 мкг/л для хозяйственно-питьевых вод 31 октября 2001 г. Министерство науки и технологий, правительство Пакистана заложило максимально допустимый уровень 10 частей на миллиард мышьяка в питьевая вода.
Формы мышьяка
В подземных водах мышьяк находится в неорганической форме. от растворения твердых фаз, таких как арсенолит (As2O5) и
реальгар (АсС). Мышьяк стабилен в четырех степенях окисления (+V, +III,
O,-III) в различных условиях восстановления/окисления (RedOx) в
воды, но обычно встречается в виде аниона быка в трехвалентном и
пятивалентные состояния в виде арсенита, AsO3-3(+III) и арсената, AsO4-3(+V
степень окисления) соответственно. Шкала токсичности мышьяка выглядит следующим образом:
следует:
от растворения твердых фаз, таких как арсенолит (As2O5) и
реальгар (АсС). Мышьяк стабилен в четырех степенях окисления (+V, +III,
O,-III) в различных условиях восстановления/окисления (RedOx) в
воды, но обычно встречается в виде аниона быка в трехвалентном и
пятивалентные состояния в виде арсенита, AsO3-3(+III) и арсената, AsO4-3(+V
степень окисления) соответственно. Шкала токсичности мышьяка выглядит следующим образом:
следует:
Арсин>Арсенит или As(III)>Арсенат или As(V)>Органический мышьяк.
Арсенит (III) больше вероятно, будет обнаружен в анаэробных водах, в то время как арсенат (V) обнаружен в больше аэробных вод.
Базовая схема удаления мышьяка
Дизайн системы EcoTech основан на обширных знаниях
Разработано самыми известными в мире именами в области водных технологий и
лучший продукт, специально разработанный для удаления мышьяка из источника.




 (См. правила)
(См. правила)



 .
.  SO +1, -2 и т. д.
SO +1, -2 и т. д.