Свойства гидроксида бария (Ba (OH) 2) (25 полных фактов) —
By Рахул Шарма
Гидроксид бария Ba(OH)2 является одним из основных соединений бария. Давайте узнаем о его важных свойствах.
Гидроксид бария представляет собой химическое соединение, используемое при титровании кислот. Гидроксид бария является важным промышленным предшественником многих соединений бария. Гидроксид бария также является катализатор во многих органических/неорганических реакциях.
Теперь давайте рассмотрим номенклатуру, важные свойства и структуру гидроксида бария в этой статье.
Гидроксид бария название IUPAC
Компания Название ИУАПК Гидроксид бария представляет собой дигидроксид бария (2+). (+2) указывает на степень окисления, а суффикс di указывает на присутствие двух ионов гидроксида.
Химическая формула гидроксида бария
Химическая формула гидроксида бария: Ba(OH).2.
Гидроксид бария номер CAS
Компания CAS номер гидроксида бария 17194-00-2.
Гидроксид бария ChemSpider ID
Компания Идентификатор ChemSpider of Ва (ОН)2 является 26408
Химическая классификация гидроксида бария
Ва (ОН)2 химически классифицируется как:
- Неорганическая металлическая основа
- Щелочная земля гидроксид.
Молярная масса гидроксида бария
Ва (ОН)2Молярная масса 171.343. Расчет показан ниже:
Молярная масса Ва (ОН)2=MBa+2*МOH
=137.327+2*17.008
= 171.343
Цвет гидроксида бария
Ва (ОН)2 белый.
Молярная плотность гидроксида бария
Гидроксид бария существует в 2 формах; плотности приведены ниже:
- Молярная плотность Ва (ОН)2 моногидрат 0.
 0197684 моль/см3 так как его плотность 3.743 г/см3.
0197684 моль/см3 так как его плотность 3.743 г/см3. - Молярная плотность Ва (ОН)2 октагидрат 0.00691311 моль/см3 так как его плотность 2.180 г/см3.
Температура плавления гидроксида бария
Температура плавления безводного Ва (ОН)2 составляет 407 °С
Температура кипения гидроксида бария
Точка кипения Ва (ОН)2 составляет 780 ° C.
Состояние гидроксида бария при комнатной температуре
Ва (ОН)2 представляет собой гранулированный твердый/прозрачный порошок при комнатной температуре (обе формы)
Ионно-ковалентная связь гидроксида бария
Ba2+ и ОН– ионы соединены ионными связями. Связь между O и H в OH– ион ковалентный, электроны общие.
Ионный радиус гидроксида бария
Ионный радиус для Ba(OH) не определен.2 поскольку ионный радиус определяется и измеряется только для атомов, а не для молекул.
Электронные конфигурации гидроксида бария
Электронные конфигурации показывают, как электроны распределены в атомное or молекулярная орбиталь. Давайте узнаем электронную конфигурацию гидроксида бария.
- Электронная конфигурация Ba2+ в гидроксиде бария составляет 1 с2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6, что также можно записать в терминах конфигурации благородных газов как [Xe] 6s0.
- МО конфигурация ОН– is 1s2 2s2 σ2pz2№2pX2№2py2
Степень окисления гидроксида бария
Атом Ba находится в степени окисления +2. Атом О находится в степени окисления -2.. Атом H находится в степени окисления +1.
Атом О находится в степени окисления -2.. Атом H находится в степени окисления +1.
Гидроксид бария щелочной
С Ва (ОН)2 представляет собой гидроксид щелочноземельный металл, он сильно щелочной и сильно основной.
Гидроксид бария без запаха
Ва (ОН)2 не имеет запаха; поэтому он без запаха.
Является ли гидроксид бария парамагнитным?
Вещества с неспаренным электроном на атомной/молекулярной орбитали, парамагнитные вещества, слабо притягиваются к магнитам. Выясним, является ли Ba(OH)2 является парамагнетиком.
Гидроксид бария не является парамагнитным. так как все электроны парные.
Гидроксид бария гидраты
Гидроксид бария имеет три наблюдаемые формы гидратов, перечисленные ниже, с уменьшающимся количеством воды гидратации.
- Октагидрат: Когда гидроксид бария находится в присутствии воды, он образует октагидрат.
- Тригидрат: он образуется, когда октагидрат гидроксида бария нагревается и сначала растворяется в собственных водах гидратации (78 ° C), а затем теряет четыре молекулы воды с образованием тригидрата при температуре около 125 ° C. Он нестабилен и, наконец, наблюдается моногидратная форма
- Моногидрат: он образуется после нагревания октагидрата гидроксида бария примерно до 180 ° C. Это еще одна стабильная форма гидроксида бария.
Кристаллическая структура гидроксида бария
- Ва (ОН)2 октагидрат образует моноклинные кристаллы, принадлежащие P21/n космическая группа. Он имеет четыре формульные единицы в ячейке размерами a = 9.35 Å, b = 9.28 Å, c = 11.87 Å при β = 99°.
- Ва (ОН)2 было определено, что тригидрат имеет орторомбический кристалл, принадлежащий пространственной группе Pnma, с a = 7.
 640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4.
640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4. - Ва (ОН)2 моногидрат принимает слоистую структуру с центрами Ba2+, имеющими квадратную антипризматическую геометрию.
Полярность и проводимость гидроксида бария
- Ва (ОН)2 полярный так как это ионное соединение.
- Ва (ОН)2 проводит электричество в водном растворе, так как он дает два гидроксид-иона на молекулу и катион Ba2+. Точно так же он также будет обеспечивать ионы для проведения электричества в расплавленном состоянии.
Реакция гидроксида бария с кислотой
Ва (ОН)2 например, будет реагировать с кислотами с образованием соответствующих солей.
Ва (ОН)2+2HCl→BaCl2+ 2H2O
Реакция гидроксида бария с основанием
Ва (ОН)2 не реагирует с основаниями.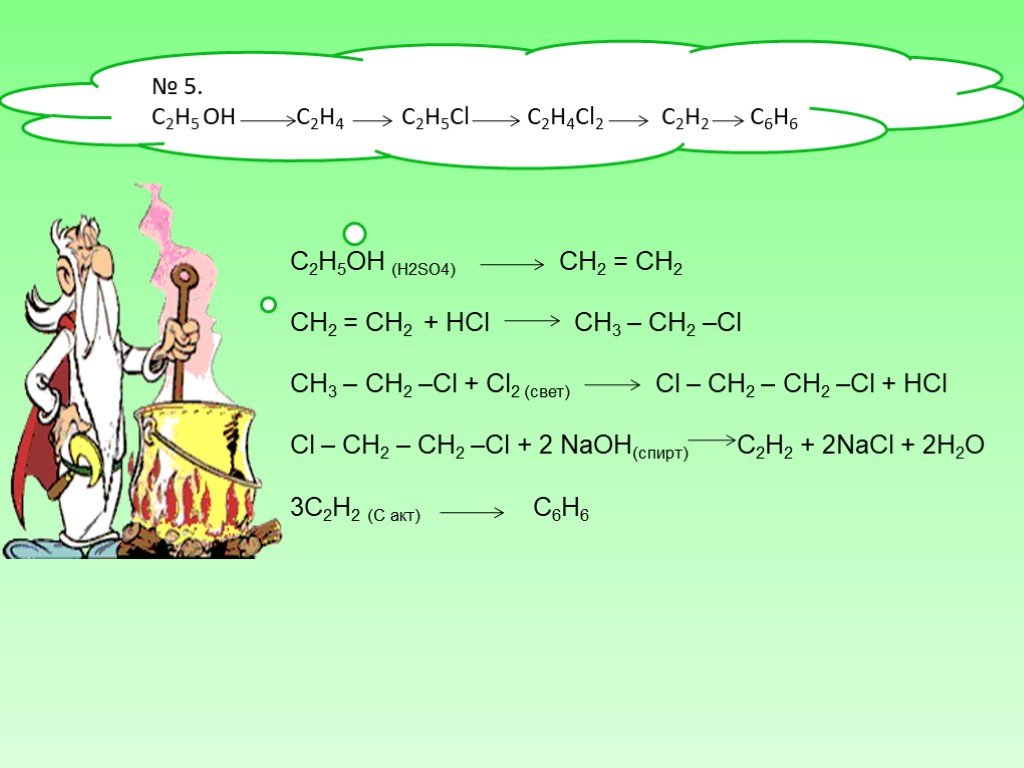
Реакция гидроксида бария с оксидом
Ва (ОН)2 реагирует с кислыми оксидами неметаллов с образованием, например, карбонатов.
Ва (ОН)2 + H2CO3 -> БаСО3 + 2H2O
Заключение
Мы узнали о Ba(OH)2, высокореактивное соединение, особенно полезное в лабораториях для аналитических и каталитических применений и различных процессов в нефтяной и водной промышленности.
Jérémie Broh — профиль игрока 22/23
Данные игрока
Точное амплуа
- Основное амплуа:
- Центр. полузащитник
- Дополнительное амплуа:
- Опорный полузащитник
Стоимость
Текущая стоимость:
500 тыс €
Максимальная стоимость:
800 тыс €
17 янв. 2019 г.
2019 г.
Последнее изменение: 22 дек. 2022 г.
К подробной информации о стоимости
Факты и цифры
Имя на родине:
Jérémie Delphin Broh Tonye
Дата рождения:
21 марта 1997 г.
Место рождения:
Parma
Возраст:
26
Рост:
1,80 м
Национальность:
Италия
Кот-д’Ивуар
Амплуа:
Полузащитник — Центр. полузащитник
Ударная нога:
правая
Агент игрока:
TMP SOCCER srl
Нынешний клуб:
Палермо
В команде с:
25 сент. 2020 г.
Контракт до:
30 июня 2025 г.
Продления контракта:
29 марта 2023 г.
полузащитник
Ударная нога:
правая
Агент игрока:
TMP SOCCER srl
Нынешний клуб:
Палермо
В команде с:
25 сент. 2020 г.
Контракт до:
30 июня 2025 г.
Продления контракта:
29 марта 2023 г.
Трансферная история
Сезон
Дата
Уходит из
Переходит в
РС
Сумма компенсации
21/22
30 июня 2022 г.
Зюдтироль
Палермо
450 тыс €
Окончание аренды
21/22
31 авг. 2021 г.
Палермо
Зюдтироль
350 тыс €
Аренда
20/21
25 сент. 2020 г.
Сассуоло
Палермо
500 тыс €
Свободный агент
19/20
31 авг. 2020 г.
Козенца
Сассуоло
500 тыс €
Окончание аренды
19/20
30 июля 2019 г.
Сассуоло
Козенца
700 тыс €
Аренда
18/19
30 июня 2019 г.
Padova
Сассуоло
700 тыс €
Окончание аренды
18/19
18 июля 2018 г.
Сассуоло
Padova
200 тыс €
Аренда
17/18
30 июня 2018 г.
Зюдтироль
Сассуоло
200 тыс €
Окончание аренды
16/17
10 янв. 2017 г.
2017 г.
Сассуоло
Südtirol125 тыс €
Аренда
16/17
09 янв. 2017 г.
Pordenone
Сассуоло
125 тыс €
Окончание аренды
16/17
20 июля 2016 г.
Sassuolo U19
Pordenone
175 тыс €
Аренда
15/16
15 июля 2015 г.
Parma U19
Sassuolo U19
125 тыс €
Свободный агент
14/15
01 июля 2014 г.
Parma Молодёжь
Parma U19
—
—
Общий трансферный доход:
молодежные команды
Coopnordest, Parma (2007-2015)
Статистика выступлений
Полная статистика выступлений
Данная реакция \\[Ba(OH){_2} + 2N{H_4}Cl\\] является эндотермической\/экзотермической.
Последняя обновленная дата: 06 -й апрель 2023
•
Общее представление: 193,8K
•
Просмотры сегодня: 3,81K
Ответ
Проверено
193.8K+ виды
HINT: . мы должны знать, что такое экзотермическая и эндотермическая реакция. Экзотермические реакции передают энергию окружающей среде, и температура окружающей среды увеличивается. Эндотермические реакции потребляют энергию, и температура окружающей среды снижается. Для дальнейшего объяснения обратитесь к решению.
Экзотермические реакции передают энергию окружающей среде, и температура окружающей среды увеличивается. Эндотермические реакции потребляют энергию, и температура окружающей среды снижается. Для дальнейшего объяснения обратитесь к решению.
Полный ответ:
Хлорид аммония реагирует с гидроксидом бария с образованием аммиака. Реакция между гидроксидом бария и хлоридом аммония представляет собой реакцию выделения газа с двойным замещением. Продуктами этой реакции являются хлорид бария, аммиак и вода.
\[Ba{(OH)_2} + 2N{H_4}Cl \to BaC{l_2} + 2N{H_3} + 2{H_2}O\]
Эта реакция является эндотермической реакцией. Эндотермические реакции — это химические реакции, в которых реагенты поглощают тепловую энергию из окружающей среды с образованием продуктов. Физические процессы также могут быть эндотермическими. Кубики льда поглощают тепловую энергию из окружающей среды и тают, образуя жидкую воду.
Хлорид аммония слабокислотный, а гидроксид бария очень щелочной. В эндотермической реакции $\Delta H$ положительна, что соответствует поглощенному теплу. Таким образом, это положительное значение $\Delta H$ должно компенсироваться достаточным увеличением энтропии.
Таким образом, это положительное значение $\Delta H$ должно компенсироваться достаточным увеличением энтропии.
Дополнительная информация:
Хлорид аммония – соль для системного и мочевого подкисления. Хлорид аммония помогает поддерживать рН и оказывает мягкое мочегонное действие. Эта кислотообразующая соль также оказывает отхаркивающее действие, раздражая слизистые оболочки, и используется для облегчения кашля. Хлорид аммония представляет собой белое кристаллическое вещество.
Примечание:
Данная реакция является реакцией двойного замещения. Реакции, в которых два соединения реагируют путем обмена ионами с образованием двух новых соединений, называются реакциями двойного замещения. В реакциях двойного замещения положительные ионы обмениваются партнерами с отрицательными ионами. Многие реакции двойного замещения происходят между ионными соединениями, растворенными в воде.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Что, как сбалансировать и часто задаваемые вопросы —
Альфия Шаджи
Бромид водорода представляет собой химическое соединение брома и Ba(OH) 2 является сильным основанием. Остановимся глубже на реакции между HBr + Ba(OH) 2 .
Остановимся глубже на реакции между HBr + Ba(OH) 2 .
HBr — сильнокислотный бесцветный газ, используемый в качестве восстановителя и катализатора в органической реакции. Молярная масса HBr составляет 80,9119 г/моль и классифицируется как минеральная кислота, растворимая в воде. Ва(ОН) 2 дает много гидроксид-ионов при взаимодействии с водой. Молярная масса Ba(OH) 2 составляет 171,344 г/моль.
В этой статье мы обсудим некоторые важные факты о реакции. Тип реакции, продукты реакции, равновесные и ионные уравнения, сопряженные пары, эндотермические и экзотермические реакции.
Что является продуктом HBr и Ba(OH) 2 Бромид водорода реагирует с BA (OH) 2 для формирования бромида бария (BABR 2 ) и вода (ч 2 9933333333333333333333333333333.
HBr + Ba(OH) 2 —–> BaBr 2 + H 2 O
What type of reaction is HBr + Ba (ОН) 2HBr + Ba(OH) 2 реакция является кислотно-основной реакция нейтрализации . В этой реакции HBr действует как сильная кислота, а Ba(OH) 2 — как сильное основание.
Как сбалансировать HBR + BA (OH) 2Сбалансированное уравнение HBR + BA (OH) 2 IS-
9003 9003 9008 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 9008 2 2 9008 2 2 . ) 2 —> BaBr 2 + 2H 2 O
) 2 —> BaBr 2 + 2H 2 O Выполните следующие шаги, чтобы сбалансировать химическое уравнение.
- Сначала напишите уравнение несбалансированности.
- HBr + Ba(OH) 2 ——> BaBr2 + H 2 O
- Count the number of atoms on either side of each element in the unbalanced equation .
| Элементы | No. of atoms in reactants | No. of atoms in products |
|---|---|---|
| Ba | 1 | 1 |
| Br | 1 | 2 |
| O | 2 | 1 |
| H | 3 | 2 |

Титрование возможно между HBr и Ba(OH) 2 , поскольку HBr является сильной кислотой, а Ba(OH) 2 является слабым основанием. Ниже приведены этапы титрования.
Ниже приведены этапы титрования.
АППАРАТ
- Pipette and Burette
- Объемная колба
- Измерительная колба и стеклянная воронка
- Стенд с зажимом .
ПРОЦЕДУРА
- Стандартное количество HBr заливается в бюретку и пипеткой пипетируется 20 мл Ba(OH) 2 в коническую колбу.
- При изменении цвета раствора в коническую колбу добавить две-три капли фенолфталеина.
- Затем в коническую колбу осторожно добавляют HBr и постоянно взбалтывают раствор.
- При изменении цвета раствора поток кислоты замедляют и добавляют по каплям.
- При постоянном изменении цвета указывает на конечную точку титрования и закрывает кран бюретки.
- Повторяйте титрование до тех пор, пока не будет получено согласованное значение, и рассчитывать нормальность титров Чистое ионное уравнение для реакции HBR + BA (OH) 2 IS-
2H + (AQ) + 2OH — 2
2-
—62-
.
 0463 (водн.)= 2H 2 O(l)
0463 (водн.)= 2H 2 O(l) Следующие шаги используются для получения результирующего ионного уравнения.
- Сначала правильно напишите сбалансированное молекулярное уравнение.
- 2HBr+ Ba(OH) 2 —–> BaBr 2 + 2H 2 O
- Then write the state or phase of каждое вещество в сбалансированном уравнении.
- BA (OH) 2 (AQ) + 2HBR (aq) -> BABR 2 (AQ) + 2H 29007 2 29007 2 29007 2 2 2 2 2 2 2 29007 29007 29007 2 29007 29007 29007 29007 2 (AQ) + 2H 29007 2 (AQ) + 2H 2 (AQ).

- Напишите данное сбалансированное уравнение в полном ионном уравнении
- BA 2+ (AQ) + 2OH — 4444444444444444444444444444. (водн.) + Br – (aq) —–> Ba 2+ (aq) + 2Br – (aq) + 2H 2 O(l)
- Удалите ионы-спектаторы Ba 2+ и Br – , которые встречаются в обеих частях полного результирующего ионного уравнения.
- Таким образом, результирующее ионное уравнение:
- 2OH – (aq) + H + (aq) —–> 2H 2 O(l)
HBR + BA (OH) 2 .
 кислота Ba(OH) 2 is Ba 2+
кислота Ba(OH) 2 is Ba 2+
Intermolecular forces of HBr + Ba(OH) 2 являются
- Диполь-дипольные взаимодействия демонстрируют молекулу HBr, поскольку HBr является полярной молекулой.
- Ba(OH) 2 имеет ионную природу.
Reaction enthalpy of HBr + Ba(OH) 2 is –118 kj/mol.
IS HBR + BA (OH) 2 Buffer RolidingHBR + BA (OH) 2 ОБ ОБЩЕСТВЕНСКИЙ ОБА BUFFER SOLIDE IF BASION AIDION реагируют с образованием сопряженной кислоты и основания, которые устойчивы к резким изменениям рН.
IS HBR + BA (OH) 2 Полная реакция
Реагенты, доступные в реакции HBR + BA (OH) 2 33333333333333333333333333333333333333333333333333333333333 годы. products BaBr 2 and H 2 O.
Is HBr + Ba(OH) 2 an exothermic or endothermic reactionHBr + Ba(OH) 2 реакция является экзотермической реакцией , так как значение энтальпии соответствующей реакции имеет отрицательное значение -118 кДж/моль, где в ходе реакции выделяется тепловая энергия.
Is HBr + Ba(OH) 2 a redox reactionHBr + Ba(OH) 2 reaction is a not redox reaction where the oxidation number of each атомов в этой реакции не изменились.

2H +1 Br -1 + Ba +2 (O -2 H +1 ) 2 —–> Ba +2 Br 2 -1 + 2H 2 +1 O -2
Is HBr + Ba(OH) 2 a precipitation reactionHBr + Ba(OH) 2 реакция не является реакцией осаждения, при которой после завершения реакции не образуется твердый продукт.


 0197684 моль/см3 так как его плотность 3.743 г/см3.
0197684 моль/см3 так как его плотность 3.743 г/см3. 640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4.
640 Å, b = 11.403 Å, c = 5.965 Å, V = 519.7 Å3, Z = 4. 0463 (водн.)= 2H 2 O(l)
0463 (водн.)= 2H 2 O(l) 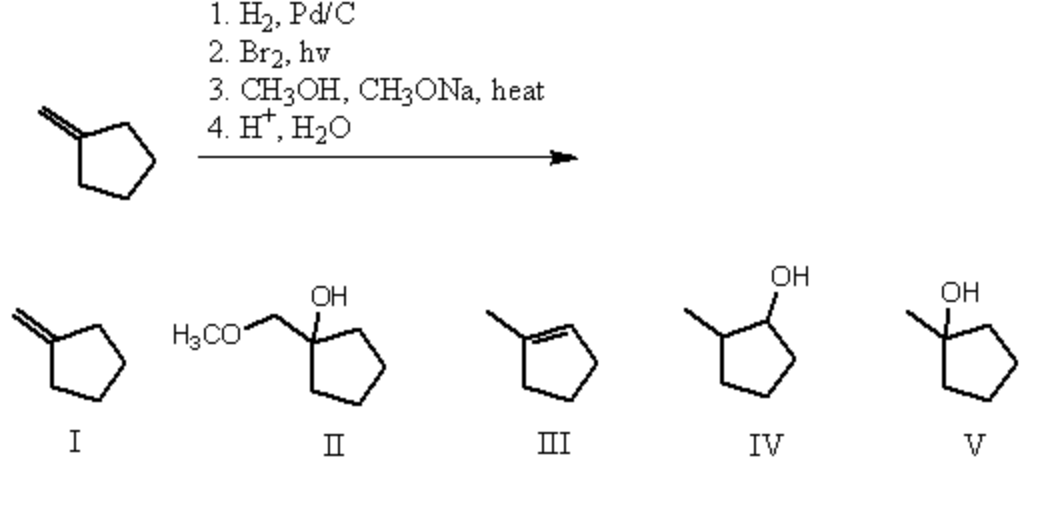
 кислота Ba(OH) 2 is Ba 2+
кислота Ba(OH) 2 is Ba 2+