C -> CO2 -> h3CO3 -> CaCO3 -> CaO… -reshimne.ru
Новые вопросы
Ответы
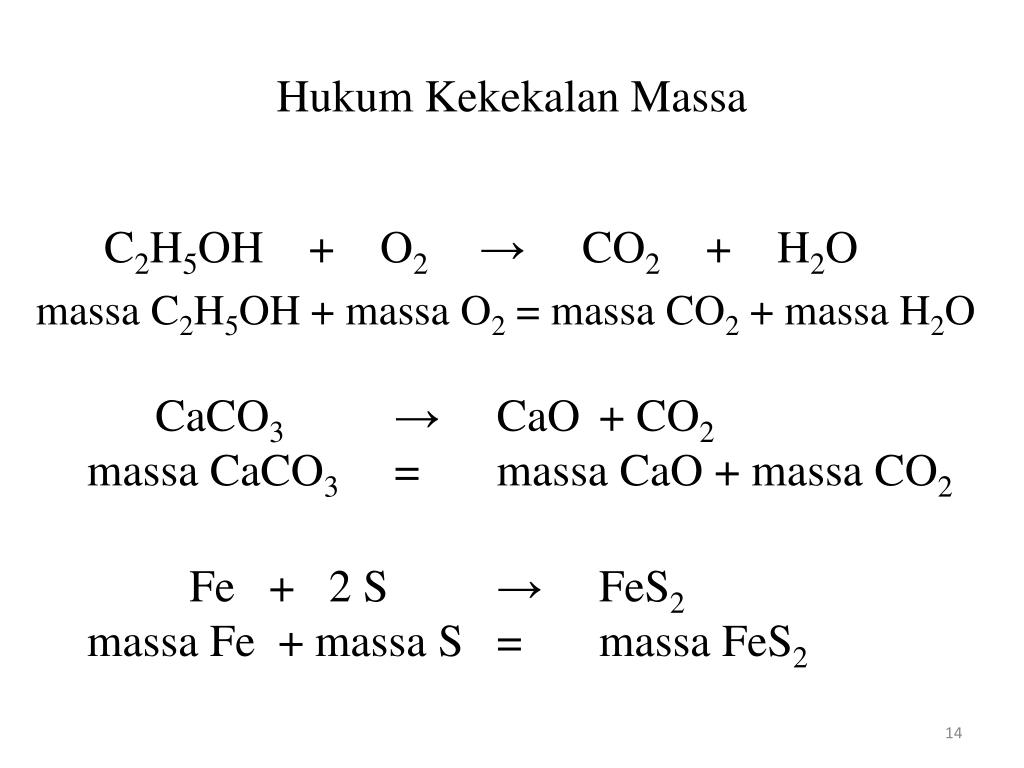
C+O2=CO2
CO2+h3O=h3CO3
h3CO3+CaO=CaCO3+h3O
CaCO3=CaO+CO2
Похожие вопросы
Напишите пожалуйста, цепочку реакций: метан-ацетилен-этанол-уксусная кислота-хлоруксусная кислота…
Чему равна массовая доля серы в K2SO4…
Гидроксид кальция реагирует с :
1)оксидом бария
2)сульфатьм бария
3)серной кислотой
4)магнием…
Какое количество соли образуется при взаимодействии 5.6 г оксида кальция с серной кислотой…
Отдаю все балы срочно составте молекулярные реакции ВаО и N2O5. ..
..
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
ХимияФизика
Биология
Другие предметы
История
Обществознание
Окружающий мир
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
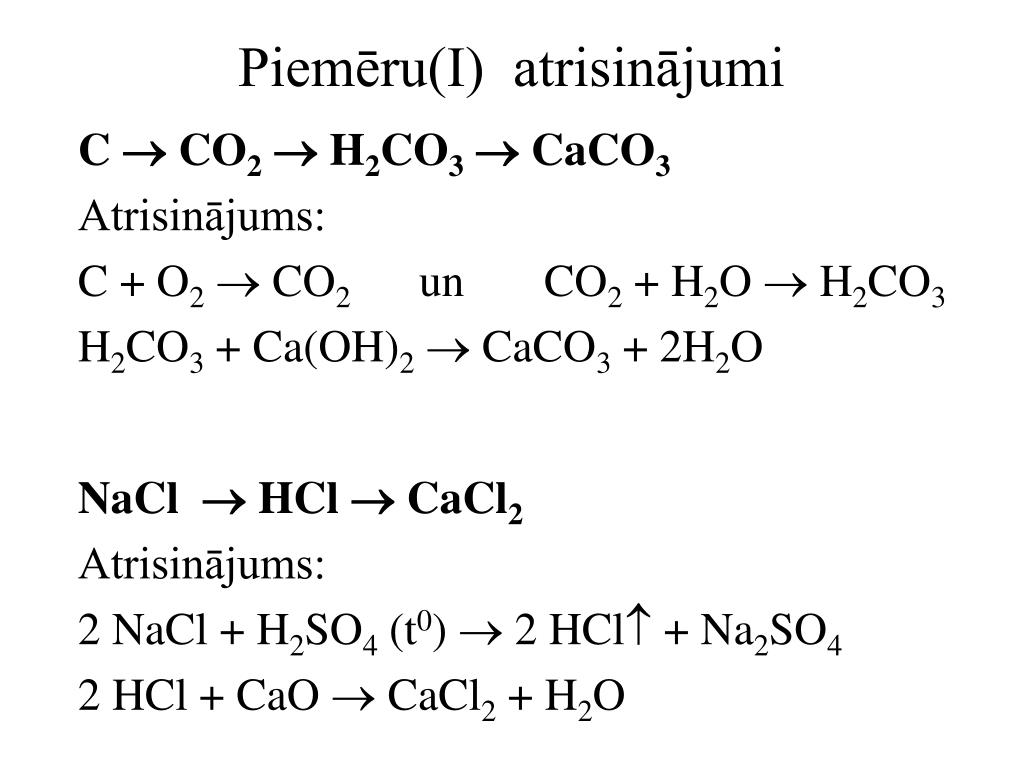
C-> co2-> h3co3-> caco3-co2-h3co3 по
C+O2->CO2 CO2+h3O->h3CO3 h3CO3+CaO->CaCO3+h3 CaCO3->CaO+CO2 CO2+h3O->h3CO3
1) CO + O2 = CO2
2) CO2 + h3O = h3CO3
3) h3CO3 + CaO = CaCO3 + h3O
4) CaCO3 = CaO + CO2
5) CO2 + BaO = BaCO3
Вот и всё 🙂
1)-4 Li+ O2=2Li2O;
Li2O+h3O=2LiOH+h3O;
LiOH+HNO3=LiNO3+h3O
6)- S + O2 = SO2
SO2 + h3O = h3SO3
h3SO3 + 2NaOH = Na2SO3
Na2SO3 + 2HCl = 2NaCl + h3O + SO2
SO2 + BaO = BaSO3
2)-C+O2=CO2
CO2 + Ca(OH)2 = h3O + CaCO3 (осадок)
СaCO3 (нагрев до 1000) > CaO + CO2
CO2 + h3O = h3CO3
3) — 2Cu + O2 = 2CuO
CuO + h3SO4 = CuSO4 + h3O
CuSO4 + 2NaOH(разб. ) = Cu(OH)2(гель) + Na2SO4
) = Cu(OH)2(гель) + Na2SO4
Cu(OH)2(суспензия) = CuO + h3O
4)4Al+3O2—> 2AL2O3
Al2O3 +3h3SO4= AL2(SO4)3 +3h3O
AL2(SO4)3 +6NaOH= 2AL(OH)3 +3Na2SO4
5)-SiO2 + 2C = Si + 2CO; Si + 2NaOH + h3O = 2h3 + Na2SiO3; Na2SiO3 + 2HCl = h3SiO3 + 2NaCl;
h3SiO3 = SiO2 + h3O; Ca(OH)2 + SiO2 = CaSiO3 +
1.
a) 2K + 2h3O = 2KOH + h3
b) Cu(OH)2 (t)= CuO + h3O
c) h3SO4 + Mg(OH)2 = MgSO4 + 2h3O
d) Na2O + SO3 = Na2SO4
2.
a) WO2 + 2h3 = W + 2h3O
b) CuSO4 + 2KOH = Cu(OH)2 + K2SO4
c) 2Al + 3h3SO4 = Al2(SO4)3 + 3h3
3.
4Fe + 3O2 = 2Fe2O3
Fe2O3 + 6HCl = 2FeCl3 + 3h3O
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Fe(OH)3 (t)= Fe2O3 + 3h3O
Fe2O3 + 3h3 = 2Fe + 3h3O
4.
CO2 + h3O = h3CO3
h3CO3 + Ca(OH)2 = CaCO3 + 2h3O
CaCO3 (t)= CaO + CO2
CO2 + K2O = K2CO3
1б, 2в,3б, 4в, 5б
6) C+ O2 =CO2
CO2 + h3O =h3CO3
h3CO3 + Ca(OH)2 =-CaCO3 + 2h3O
Ca CO3 =CO2 +h3O
7)BaCO3 + 2HCl = BaCl2 + h3O + CO2
1. Эта задача на избыток и недостаток. Находим количества в-в карбоната бария и соляной кислоты
Эта задача на избыток и недостаток. Находим количества в-в карбоната бария и соляной кислоты
n(BaCO3) = 4,92 /197 =0,02 моль
g(HCl) = 8,4 /36?5 =0,23 моль
2. Определяем какое вещество в недостатке, составляем пропорцию
0,02/1=х/2 отсюда х(HCl)= 2*0,02/1 = 0,04 моль, следовательно в недостатке карбонат бария
3. Количество газа = количеству карбоната бария, по реакции.
4. Находим oбъем газа = 0,02*22,4 =4,48л
а) С+02(t)→CO2;
CO2+h3O→h3CO3;
h3CO3 + CaO → CaCO3 + h3O;
CaCO3(t)→CaO+CO2;
CO2+NaO→NaCO3.
б)2Cu+O2(t)→2CuO;
CuO+2HCl→CuCl2+h30;
CuCl2+2HNO3→Cu(NO3)2+2HCl;
Cu(NO3)2+2NaOH→Cu(OH)2+2NaNO3;
Cu(OH)2(t)→CuO+h3O.
Объяснение:
Извини без уравнивания
C + O2 = CO2
CO2 + h3O = h3CO3
h3CO3 + CaCl2 = CaCO3 +2HCl
CaCO3(при разложении) = CO2 +CaO
вроде так..
C + O2 = CO2
CO2 + h3O = h3CO3
h3CO3 + CaO = CaCO3 + h3O
CaCO3 = CaO + CO2
C+O2=CO2 CO2+h3O=h3CO3 h3CO3+Ca(OH)2=CaCO3+2h3O CaCO3=(при t) CaO+CO2
Химия: новые вопросы
Химия, 02. 03.2019 21:20, 154904
03.2019 21:20, 154904
Расставьте коэффициенты методом электронного sncl2+kno3+hcl=sncl4+no+kcl+h3o so2+fecl3+h3o=h3so4+fecl2+hcl
Ответы:
Показать ответы
Химия, 07.03.2019 17:30, cefevupi
Составить уравнение рякций по схеме p+o2—> p2o5 zn+hci2+h3 caco3—> cao+co2 al+s—> al2s3 help
Ответы:
Показать ответы
Химия, 08.03.2019 05:50, ashklyarukovpp94
Сучетом того, что в результате реакции горения ацетилена( c2h3) образуются углекислый газ и вода, составьте уравнение реакции горения бензола(c6h6)
Ответы:
Показать ответы
Химия, 09.03.2019 22:10, kabdushevaaynash
Сколько л углекислого газа (н.у) выделится при сжигании 1 л ацетилена в 5 л кислорода?
Ответы:
Показать ответы
Математика, 07.10.2022 17:06
По заданию нужен желательно побыстрее…
Химия, 07.10.2022 13:05
Алюміній сульфат використовують у виробництві паперу. Його одержують у промисловості дією сульфатної кислоти на мінерал каолін.
Другие предметы, 06.10.2022 21:17
Каким правом регулируется Во время реконструкции театра археологи обнаружили золотые монеты, которые передали в Музей истории г. Москвы…
Биология, 06.10.2022 19:35
Окремі природні обєкти із заповідним режимом, що мають наукове, культурне, історичне або естетичне значення…
Другие предметы, 06.10.2022 18:27
Нужно начертить 3 вид, помогите пожалуйста, Сечение и аксонометрию
Қазақ тiлi, 23.12.2020 15:56
Жазылым: Жақша ішіндегі сөздерді қазақ тіліне аударып, сөйлемдерді толықтыр. Қазақстандағы (самый крупный) Ұлттық кітапхана 1931 жылы ашылған. Кітапхананың алғашқы директоры…
История, 23.12.2020 15:56
Осуществлявшаяся в 1918 – начале 1921 гг. коммунистическими властями продовольственная диктатура заключалась в: 1) национализации помещичьих имений; 2) поддержке фермерских х…
Английский язык, 23.12.2020 15:56
Питер пен перевод 6 глава. ..
..
Другие предметы, 23.12.2020 15:56
10 клас. Зарубіжна література Контрольна робота № 2(рівень стандарту) Проза й поезія пізнього романтизму та переходу до реалізму ХІХ століття Початковий рівень. Одна правильн…
Алгебра, 23.12.2020 15:56
1. Сумма квадратов двух последовательных натуральных чисел больше произведения этих чисел на 31. Найдите эти числа. 2. Разложите число 16 на два слагаемых так, чтобы произведение э…
Lebih banyak pertanyaan tentang hal ini: Химия Вопросы без ответов
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Высота правильной треугольной пирамиды равна a корень из 3 , радиус окружности, описанной около е основания, 2a. Найдите: а)0 апофему пирамиды; б)0 угол
Структурная формула всех изомеров С7Н16
Решено
Mg + HNO3(разб. ) = ?
Написать ОВР :
) = ?
Написать ОВР :
В каком году была сформулирована теория — предшественница кислородной теории горения.
Пользуйтесь нашим приложением
Углеродный цикл и климат Земли
Углеродный цикл и климат ЗемлиУглекислый газ является атмосферным компонентом, который играет несколько жизненно важные роли в окружающей среде. Это парниковый газ, который улавливает тепловое инфракрасное излучение в атмосфере. Он играет решающую роль в выветривание горных пород. Это источник углерода для растений. это хранится в биомассе, органических веществах в отложениях и в карбонатных породы, подобные известняку.
Круговорот углерода
Основным источником углерода/CO2 является
выделение газа из недр Земли на срединно-океанических хребтах, горячая точка
вулканы и вулканические дуги, связанные с субдукцией. Большая часть
CO2, выделяемый в зонах субдукции, получается
от метаморфизма карбонатных пород, субдуцирующих с океаном
корка. Большая часть общего выделения CO2,
особенно срединно-океанических хребтов и горячих вулканов, хранилась в
мантии при образовании Земли. Часть выделившегося углерода остается в виде
CO2 в атмосфере, часть растворена в
океанах, некоторое количество углерода удерживается в виде биомассы в живых или мертвых и
разлагающихся организмов, а часть связана с карбонатными породами. Углерод
вывозятся на длительное хранение путем захоронения осадочных толщ,
особенно уголь и черные сланцы, которые хранят органический углерод из
неразложившаяся биомасса и карбонатные породы, такие как известняк (кальций
карбонат).
Большая часть
CO2, выделяемый в зонах субдукции, получается
от метаморфизма карбонатных пород, субдуцирующих с океаном
корка. Большая часть общего выделения CO2,
особенно срединно-океанических хребтов и горячих вулканов, хранилась в
мантии при образовании Земли. Часть выделившегося углерода остается в виде
CO2 в атмосфере, часть растворена в
океанах, некоторое количество углерода удерживается в виде биомассы в живых или мертвых и
разлагающихся организмов, а часть связана с карбонатными породами. Углерод
вывозятся на длительное хранение путем захоронения осадочных толщ,
особенно уголь и черные сланцы, которые хранят органический углерод из
неразложившаяся биомасса и карбонатные породы, такие как известняк (кальций
карбонат).
Фотосинтез
Растения, фотосинтезирующие водоросли и бактерии используют энергию от
солнечного света, чтобы соединить углекислый газ (C02) из
атмосферу водой (h3O) с образованием
углеводы. Эти углеводы накапливают энергию. Кислород
(O2) является побочным продуктом, который выделяется в
атмосфера. Этот процесс известен как фотосинтез.
Кислород
(O2) является побочным продуктом, который выделяется в
атмосфера. Этот процесс известен как фотосинтез.
СО 2 + H 2 O + солнечный свет -> CH 2 O + О 2
Дыхание
Растения (а также фотосинтезирующие водоросли и бактерии) затем используют некоторые запасенные углеводы как источник энергии для жизнедеятельности функции. Часть углеводов остается в виде биомассы (основная часть завод и др.). Потребители, такие как животные, грибы и бактерии, получают свою энергию из этой избыточной биомассы либо при жизни, либо при смерти и разлагающийся. Кислород из атмосферы соединяется с углеводами освободить накопленную энергию. Вода и углекислый газ являются побочные продукты.
O 2 + CH 2 O -> энергия + H 2 O + CO 2
Обратите внимание, что фотосинтез и дыхание являются
напротив друг друга. Фотосинтез удаляет
CO2 из атмосферы и заменяет его
О2. Дыхание занимает
O2 из атмосферы и заменяет его
СО2. Однако эти процессы не в
остаток средств. Не все органические вещества окисляются. Некоторые похоронены в
осадочные породы. В результате за геологическое время
больше кислорода выбрасывается в атмосферу и удаляется углекислый газ
фотосинтезом, чем наоборот.
Фотосинтез удаляет
CO2 из атмосферы и заменяет его
О2. Дыхание занимает
O2 из атмосферы и заменяет его
СО2. Однако эти процессы не в
остаток средств. Не все органические вещества окисляются. Некоторые похоронены в
осадочные породы. В результате за геологическое время
больше кислорода выбрасывается в атмосферу и удаляется углекислый газ
фотосинтезом, чем наоборот.
Атмосферостойкость
Углекислый газ и другие атмосферные газы растворяются на поверхности
воды. Растворенные газы находятся в равновесии с газом в
атмосфера. Углекислый газ реагирует с водой в растворе с образованием
слабая кислота, угольная кислота. Угольная кислота диссоциирует на водород
ионы и бикарбонат-ионы. Ионы водорода и вода реагируют с
наиболее распространенные минералы (силикаты и карбонаты), изменяющие
минералы. Продуктами выветривания являются преимущественно глины (группа
силикатных минералов) и растворимых ионов, таких как кальций, железо, натрий,
и калий. Ионы бикарбоната также остаются в растворе; остаток
угольная кислота, которая использовалась для выветривания горных пород.
Карбонатные породы
1. Углекислый газ удаляют из атмосферы растворением в воды и образуя угольную кислоту
2. Углекислота используется для выветривания горных пород с получением бикарбоната. ионы, другие ионы и глины
3. Карбонат кальция осаждается из кальция и бикарбоната ионы в морской воде морскими организмами, такими как кораллы
- углерод теперь хранится на морском дне в слоях известняк
Метаморфизм карбонатов
Часть этого углерода возвращается в атмосферу в результате метаморфизма известняка на глубине в зонах субдукции или орогенных поясах
с последующим выделением газа на вулканической дуге.
Парниковый эффект
Большая часть солнечной энергии, попадающей на поверхность Земли, находится в
часть видимого света электромагнитного спектра. Это в
во многом потому, что атмосфера Земли прозрачна для этих
длин волн (мы все знаем, что при функционирующем озоновом слое
более высокие частоты, такие как ультрафиолет, в основном экранируются). Часть
солнечный свет отражается обратно в космос, в зависимости от альбедо или
отражающая способность поверхности. Часть солнечного света превращается в
инфракрасный (более низкая частота, чем видимый свет). В то время как доминирующее
газы атмосферы (азот и кислород) прозрачны для
инфракрасное излучение, так называемые парниковые газы, прежде всего водяной пар
(h3O), углекислый газ и метан
(Ch5), поглощают инфракрасное излучение. Они
собирать эту тепловую энергию и удерживать ее в атмосфере. В то время как мы
беспокоиться о возможном глобальном потеплении из-за дополнительного
CO2 мы выбрасываем в атмосферу, сжигая
ископаемое топливо, если бы не было СО2 в
атмосфере глобальный климат был бы значительно прохладнее.
Климатический буфер
Из-за роли CO2 в климате обратные связи в углеродном цикле поддерживают глобальные температуры в определенных пределах, чтобы климат никогда не становился слишком жарким или слишком холод для поддержания жизни на Земле. Процесс представляет собой крупномасштабный пример Принцип Ле-Шателье. Этот химический принцип гласит, что если реакция, находящаяся в равновесии, нарушается добавлением или удалением продукта или реагента, реакция будет регулироваться таким образом, чтобы попытаться вернуть этот химический вид к его первоначальной концентрации. За например, как угольная кислота удаляется из раствора выветриванием породы, реакция будет регулироваться, производя больше угольной кислоты. А также так как растворенный CO2 находится в равновесии с СО2 в атмосфере, не более CO2 удаляется из атмосферы, чтобы заменить которые удаляются из раствора выветриванием.
некоторые примеры:
Если концентрация CO2 увеличивается в
атмосферы из-за повышенной скорости дегазации, глобального
температура повысится. Повышение температуры и более растворенные
CO2 приведет к усилению выветривания
пород земной коры в результате более высоких скоростей реакции (температура
эффект) и повышение кислотности. Усиленное выветривание израсходует
избыток CO2, тем самым охлаждая климат.
Повышение температуры и более растворенные
CO2 приведет к усилению выветривания
пород земной коры в результате более высоких скоростей реакции (температура
эффект) и повышение кислотности. Усиленное выветривание израсходует
избыток CO2, тем самым охлаждая климат.
Если глобальная температура понизится в результате каких-то астрономических воздействие форсирования или тектонической/океанской циркуляции, более низкие температуры приведет к снижению скорости химического выветривания. Уменьшился выветривание означает, что из атмосферу в результате реакций выветривания, оставляя больше CO2 в атмосфере увеличится температуры.
Если больше горных пород становится доступным для быстрого выветривания в результате поднятие гор усиленное выветривание потянет атмосферные CO2 и снизить глобальную температуру. Но понижение температуры замедлит скорость реакции, тем самым используя меньше CO2, что позволяет снизить температуру.
угольная кислота | Формула, использование и факты
- Похожие темы:
- мочевина барбитуровая кислота дициклогексилкарбодиимид изоцианат карбамат
См. все связанные материалы →
все связанные материалы →
угольная кислота , (H 2 CO 3 ), соединение элементов водорода, углерода и кислорода. Он образуется в небольших количествах при растворении его ангидрида, двуокиси углерода (CO 2 ), в воде.
CO 2 + H 2 O ⇌ H 2 CO 3 Преобладающими видами являются просто свободно гидратированные молекулы CO 2 . Угольную кислоту можно рассматривать как двухосновную кислоту, из которой могут быть образованы два ряда солей, а именно гидрокарбонаты, содержащие HCO 3 − и карбонаты, содержащие CO 3 2− . H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 −
HCO 3 − + H 2 O ⇌ H 3 O + + CO 3 2− Однако кислотно-основное поведение угольной кислоты зависит от различных скоростей некоторых вовлеченных реакций, а также от их зависимости от pH системы. Например, при рН менее 8 основные реакции и их относительная скорость следующие: СО 2 + H 2 O ⇌ H 2 CO 3 (slow)
Например, при рН менее 8 основные реакции и их относительная скорость следующие: СО 2 + H 2 O ⇌ H 2 CO 3 (slow)
H 2 CO 3 + OH − ⇌ HCO 3 − + H 2 O ( Быстрый) выше рН 10. Следующие реакции важны: CO 2 + OH — ⇌ HCO 3 — (медленное)
HCO 3 — + OH — ⇌ CO 3
Подробнее по этой теме
оксикислота: угольная кислота и карбонатные соли
Угольная кислота (h3CO3) образуется в небольших количествах, когда ее ангидрид, диоксид углерода (CO2), растворяется в. ..
..
Углекислота играет роль в формировании пещер и пещерных образований, таких как сталактиты и сталагмиты. Самые большие и наиболее распространенные пещеры образуются в результате растворения известняка или доломита под действием воды, богатой углекислотой, полученной в результате недавних дождей. Кальцит в сталактитах и сталагмитах происходит из вышележащего известняка вблизи границы раздела коренной породы и почвы. Дождевая вода, просачивающаяся через почву, поглощает углекислый газ из богатой углекислым газом почвы и образует разбавленный раствор угольной кислоты. Когда эта кислая вода достигает основания почвы, она вступает в реакцию с кальцитом в известняковой породе и переводит часть его в раствор. Вода продолжает свой нисходящий поток через узкие трещины и трещины в ненасыщенной зоне с незначительной дальнейшей химической реакцией. Когда вода выходит из свода пещеры, углекислый газ теряется в атмосфере пещеры, а часть карбоната кальция выпадает в осадок. Проникающая вода действует как кальцитовый насос, удаляя его с верхней части коренной породы и повторно откладывая в пещере внизу.
Углекислота играет важную роль в переносе углекислого газа кровью. Углекислый газ поступает в кровь в тканях, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани. Когда углекислый газ попадает в кровь, он соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H + ) и ионы бикарбоната (HCO 3 — ). Высвобождаемые ионы водорода минимально влияют на кислотность крови, поскольку белки крови, особенно гемоглобин, являются эффективными буферными агентами. (Буферный раствор сопротивляется изменению кислотности за счет соединения с добавленными ионами водорода и, по существу, их инактивации.) Естественное превращение двуокиси углерода в угольную кислоту — относительно медленный процесс; однако карбоангидраза, белковый фермент, присутствующий внутри эритроцита, катализирует эту реакцию с достаточной скоростью, чтобы она выполнялась всего за доли секунды. Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в нем в гораздо большей степени, чем в плазме. Способность крови переносить углекислый газ в виде бикарбоната усиливается за счет системы переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида. Одновременный обмен этих двух ионов, известный как хлоридный сдвиг, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда ни плазмы, ни эритроцита. Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцита, а 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала образуется внутри клетки, а затем транспортируется в плазму. Обратная последовательность реакций возникает, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в нем в гораздо большей степени, чем в плазме. Способность крови переносить углекислый газ в виде бикарбоната усиливается за счет системы переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида. Одновременный обмен этих двух ионов, известный как хлоридный сдвиг, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда ни плазмы, ни эритроцита. Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцита, а 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала образуется внутри клетки, а затем транспортируется в плазму. Обратная последовательность реакций возникает, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
h3CO3 Структура Льюиса, молекулярная геометрия, гибридизация и диаграмма МО
h3CO3, известная как угольная кислота, представляет собой соединение углерода, водорода и кислорода. Это слабая кислота (с pH 4,18), образующаяся при растворении углекислого газа (CO2) в воде.
Однако, когда двуокись углерода представляет собой воду, в воде растворяется лишь небольшое количество газа. Это очень нестабильная кислота, которая остается в равновесии, так как раствор вскоре диссоциирует с образованием иона H+ и иона HCO3-.
Угольная кислота представляет собой двухосновную кислоту, из которой образуются два типа солей: гидрокарбонат (HCO3) и карбонат (CO3). Она также известна как дыхательная кислота, поскольку мы выдыхаем эту кислоту в газообразной форме.
h3CO3 способен растворять карбонат кальция (CaCO3). В результате образуется гидрокарбонатная соль кальция. При взаимодействии угольной кислоты с небольшим количеством основания образуется гидрокарбонатная соль.
Однако при реакции с большим количеством образуется карбонат. h3CO3 получается как побочный продукт сжигания ископаемого топлива в больших количествах.
Его также получают путем ферментации в промышленности. h3CO3 — очень важный промышленный химикат с большим количеством применений.
Используется для приготовления газированной воды и других газированных напитков.
В следующих разделах мы рассмотрим структуру Льюиса h3CO3, молекулярную геометрию, гибридизацию и МО-диаграмму.
Структура угольной кислоты по Льюису (h3CO3)
Формула угольной кислоты – h3CO3. Он имеет два атома H, один атом C и три атома O.
Чтобы понять молекулярную формулу h3CO3, мы должны наблюдать электронную конфигурацию участвующих атомов и сколько атомов они имеют во внешней оболочке.
Электронная конфигурация атомов, присутствующих в молекуле H3CO3, как ниже:
Hydrogen → 1S2
CABLE → 1S2 2S2 2P2
911214 OXY → 1S2 2S2 2P2
OXY → 1S2 2S2 2P2
91214141. 11.11.11.11.18 2
11.11.11.11.18 2
91214. конфигурации элементов, вы увидите, что водород имеет одинокий электрон, углерод имеет четыре электрона, а кислород имеет шесть электронов на валентной оболочке.
Будет полезно узнать, как эти элементы обмениваются электронами друг с другом и образуют химическую связь.
Давайте теперь рассмотрим различные шаги, чтобы узнать структуру Льюиса h3CO3.
Шаг первый : Найдите номер. электронов на внешней орбитали.
Два атома водорода имеют два валентных электрона, углерод — четыре, а три атома кислорода — 18 электронов.
Следовательно, общее количество электронов на самой внешней оболочке равно 2+4+18 = 24
Шаг второй : Найдите количество электронов, необходимое для октета.
Для двух атомов водорода требуется четыре электрона; в то время как одному атому углерода нужно восемь электронов, а трем атомам кислорода нужно 24 электрона.
Итак, общее количество электронов, необходимых для октета, равно 2*2+8+3*8 = 36.
Шаг третий : Найдите число. электронов, участвующих в соединении.
Чтобы найти количество связывающих электронов, мы должны вычесть количество электронов. электронов на внешней орбите от общего количества. электронов, необходимых для октета.
Итак, число связывающих электронов = 36-24 = 12.
Шаг четвертый : На этом шаге мы узнаем, сколько связей имеется в молекуле.
В h3CO3 12/2 = 6.
Шаг пятый : На этом шаге сначала нам нужно найти, сколько неподеленных пар (электронов, не образующих связи) имеется в молекуле.
Чтобы его найти, нужно от числа электронов, принимающих участие в образовании связи, отнять число электронов. электронов на внешней оболочке. В случае h3CO3 это 24 – 12 = 12, то есть шесть неподеленных пар.
Центральный атом
Теперь нам нужно сначала найти центральный атом, чтобы нарисовать структуру Льюиса. Здесь это углерод, так как он имеет самую низкую электроотрицательность.
Здесь это углерод, так как он имеет самую низкую электроотрицательность.
На следующем этапе мы размещаем другие атомы, и, наконец, мы должны нарисовать пары связей и неподеленные пары.
В структуре Льюиса HNO3 атом углерода образует связи с ионами ОН с двух сторон, а третий атом кислорода расположен с третьей стороны.
Атом углерода достигает стабильной электронной конфигурации с восемью электронами на самой внешней оболочке. Он образует две одинарные связи с двумя ионами ОН и двойную связь с оставшейся кислородной связью.
Два атома водорода из одинарных связей в ОН, таким образом, образуют октет. Атомы кислорода в ОН образуют одинарную связь с водородом и одинарную связь с углеродом.
Итак, у них две связи и две неподеленные пары. Третий атом кислорода образует двойную связь с атомом углерода. Он также имеет две неподеленные пары электронов.
Молекулярная геометрия h3CO3
Молекулярная геометрия соединения в значительной степени зависит от двух вещей; во-первых, структура Льюиса, а во-вторых, теория VSEPR (отталкивание электронных пар валентной оболочки).
Когда мы смотрим на структуру Льюиса h3CO3, мы видим, что у H один электрон, у C четыре, а у O шесть электронов на внешней оболочке.
Молекула h3CO3 имеет тригональную плоскую геометрическую форму.
Атомы углерода и 3 атома кислорода лежат в одной плоскости.
При образовании связи атом C соединяется с одним атомом O и двумя ионами OH. Каждый из трех атомов кислорода имеет по две неподеленные пары.
Согласно теории VSEPR, электронные пары от разных атомов или связей остаются на самом большом расстоянии из-за силы отталкивания.
Сильная сила отталкивания обеспечивает стабильную силу. Помимо этих факторов, структура молекулы зависит от количества ковалентных связей и неподеленных пар.
Еще одним важным фактором, помогающим найти молекулярную структуру, является стерическое число (SN).
Мы можем найти его, добавив номер. неподеленных пар на центральном атоме C и нет. атомов, связанных с центральным атомом.
У углерода нет неподеленной пары, а количество атомов, с которыми связан углерод, равно 3. Таким образом, стерическое число (S/N) равно 3,
Гибридизация молекулы h3CO3
Гибридизация — это процесс объединения двух орбиталей с одинаковыми энергетическими уровнями для получения новой. Чтобы понять форму молекулы, необходимо знать, как в ней расположены атомы.
Расположение атомов помогает нам узнать о структуре и свойствах вещества.
Углерод имеет стерическое число 3, а атом кислорода в ионе ОН имеет стерическое число 4.
Атом углерода в h3CO3 имеет гибридизацию SP2, а атом O имеет гибридизацию SP3.
После связывания h3CO3 имеет гибридизацию SP2.
Отсюда число пар связей = (1*2 + 4 + 6*3)/8 = 3.
Значит, молекула h3CO3 гибридизована SP2.
МО Диаграмма h3CO3
Сигма-связи между атомами С и О образованы 2sp2-орбиталью атомов С и О. Это приводит к образованию сигма-связывающих и разрыхляющих орбиталей.
Это приводит к образованию сигма-связывающих и разрыхляющих орбиталей.
Сигма-связь между кислородом и водородом использует 1s-орбиталь водорода и 2sp3-орбитали кислорода. Он образует сигма-связывающую и разрыхляющую орбиталь.
Другая 2sp2-орбиталь кислорода не участвует в связывании.
Полярность h3CO3
Термин «полярность» определяет свойство, согласно которому молекула проявляет поляризацию зарядов поперек атомов молекулы.
Полярность возрастает в молекуле, когда форма молекулы асимметрична и существует разность интенсивности заряда на атомах.
Следовательно, суммарный дипольный момент молекулы имеет некоторое ненулевое значение.
Точно так же в молекуле h3CO3 высокая интенсивность заряда на атоме кислорода приводит к поляризации молекулы.
Заключение
Углекислота (h3CO3) — очень интересное соединение, которое широко используется в различных отраслях промышленности, особенно при приготовлении напитков.

 04.18
04.18