Ацетилен, C2h3, химические свойства, получение, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
В каком году была сформулирована теория — предшественница кислородной теории горения.
Структурная формула всех изомеров С7Н16
Помогите написать уравнения реакций с помощью которых можно осуществить следующие превращения: SiO2-Si-Ca2Si-Sih5-SiO2-Si; б)…
h3SO4+Ba(OH)2=BaSO4+h3O
Пользуйтесь нашим приложением
Карбид кальция реагирует с водой с образованием газообразного ацетилена. CaC2(т) + 2h3O(ж)C2h3(г) + Ca(OH)2(aq) Газовый продукт, C2h3, собирают над водой при температура 25 °С и давление 759 мм рт. Если мокрый C2h3 образовавшийся газ занимает объем 8,74 л, количество молей CaC2 прореагировало мол. Давление паров воды составляет 23,8 мм рт. ст. при 25 °С.
Вопрос
Карбид кальция реагирует с водой с образованием газообразного ацетилена.
по следующему уравнению: CaC2(тв) + 2h3O(ж)C2h3(г) +
Ca(OH)2(aq) Газовый продукт, C2h3, собирают над водой при
температура 25°С и давление 759мм рт.ст. Если мокрый C2h3
образовавшийся газ занимает объем 8,74 л, количество молей CaC2
прореагировало мол. Давление паров воды составляет 23,8 мм рт. ст. при 25
°С.
Давление паров воды составляет 23,8 мм рт. ст. при 25
°С.
Мгновенный ответ:
Этап 1/8
CaC2(т) + 2h3O(ж)C2h3(г) + Ca(OH)2(водн.)
Этап 2/8
B: CaC2(т) + h3O(ж)
Этап 3/ 8
C: CaC2(s) + OH-
Видеорекомендация лучшего совпадения:
Решено проверенным экспертом
У нас нет запрошенного вами вопроса, но вот рекомендуемое видео, которое может помочь.
Вопрос о наилучшем совпадении
Пошаговые ответы
Ацетилен можно получить путем реакции карбида кальция с водой.
$$\mathrm{CaC}_{2}(\mathrm{~s})+2 \mathrm{H}_{2} \mathrm{O}(\ell) \longrightarrow \mathrm{C}_{2} \mathrm{H}_{2}(\mathrm{~g})+\mathrm{Ca}(\mathrm{OH})_{2}(\mathrm{aq})$$
Предположим, что вы поместили $2,65 \mathrm{~g} \mathrm{CaC}_{2}$ в избыток воды и собрали ацетилен над водой. Объем ацетилена и водяного пара $79.{\circ}\mathrm{C}$ составляет $23,8\mathrm{мм рт. ст.}$.
ст.}$.
Рекомендуемые видео
Стенограмма
Хорошо, давайте продолжим. Мы работаем с реакцией карбида кальция с водой и гидроксидом кальция. Газ — это поселение. Мы собираем газ после завершения реакции. У нас есть 795 мил C два H 2. Это при 25 C. Мы знаем барометрическое давление Меркурия. Если вы не знаете, это атмосферное давление или давление воздуха вокруг вас. Ладно ладно. Давление паров воды равно 23,8. Позвольте мне объяснить, как это работает, если вы еще не видели этого. Реакция проводится в контейнере. Когда вы проводите эксперимент, он обычно открыт для окружающего вас воздуха. Не ахти какое дело. Мы хотим получить газ. Газ вырвется, если на этом контейнере не будет крышки. Мы хотели бы знать, сколько у нас газа. Реакция в этом контейнере будет заключаться в объединении твердого карбида кальция в жидкую воду. Было бы жидко. Действительно большая пробирка обычно представляет собой перевернутую пробирку с крышкой. Ладно ладно. У тебя есть газ на этих девушек. Когда это происходит над водой, всегда испаряется небольшое количество воды. Там есть и C2H 2 , и вода, и она будет продолжать там собираться, и объем жидкости может немного подняться по трубке. Вода будет вытесняться туда до тех пор, пока не достигнет атмосферного давления. Давление в пробирке равно 7:35,2 мм ртутного столба. Чтобы получить процентную доходность, нам нужно сначала разобраться с этим. Нам нужны две вещи. Мы можем получить теоретический выход, если начнем с 2,65 г карбида кальция. Чтобы узнать количество граммов С два Н два. Мы должны быть в состоянии обойтись с 2,65. Начнем с 2,65 г. Когда у вас есть проблема, которая начинает делать граммы, идите к родинкам. Если не знаешь, что делать, иди в мечеть. В периодической таблице вы должны получить 64,1 или что-то подобное, если сложить молярную массу карбида кальция. Правильный? В зависимости от периодической таблицы. Это значит, что у нас две родинки. Мы можем использовать уравновешенную реакцию, чтобы получить кратное соотношение из реакции вверху.
Когда это происходит над водой, всегда испаряется небольшое количество воды. Там есть и C2H 2 , и вода, и она будет продолжать там собираться, и объем жидкости может немного подняться по трубке. Вода будет вытесняться туда до тех пор, пока не достигнет атмосферного давления. Давление в пробирке равно 7:35,2 мм ртутного столба. Чтобы получить процентную доходность, нам нужно сначала разобраться с этим. Нам нужны две вещи. Мы можем получить теоретический выход, если начнем с 2,65 г карбида кальция. Чтобы узнать количество граммов С два Н два. Мы должны быть в состоянии обойтись с 2,65. Начнем с 2,65 г. Когда у вас есть проблема, которая начинает делать граммы, идите к родинкам. Если не знаешь, что делать, иди в мечеть. В периодической таблице вы должны получить 64,1 или что-то подобное, если сложить молярную массу карбида кальция. Правильный? В зависимости от периодической таблицы. Это значит, что у нас две родинки. Мы можем использовать уравновешенную реакцию, чтобы получить кратное соотношение из реакции вверху.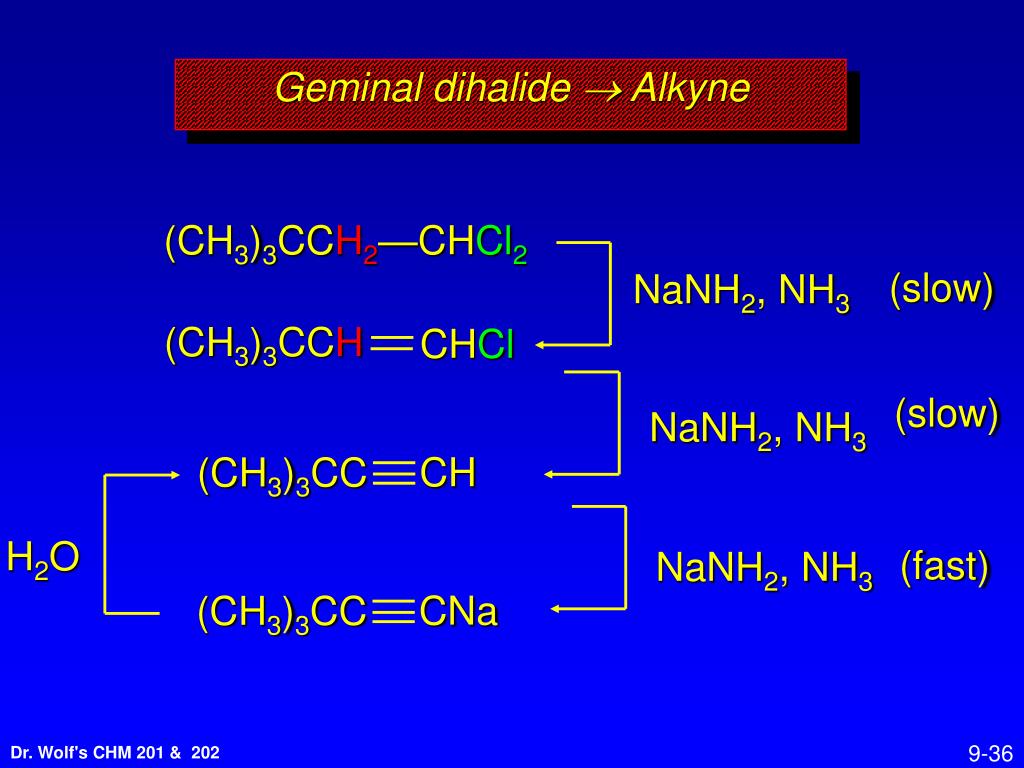 На каждый моль карбида кальция вы получите один моль C2H2. Вы счастливы. Ладно ладно. Еще один шаг отменен. Процент выхода традиционно измеряется в граммах. Мы собираемся сделать еще один шаг, чтобы вернуться к gramps. Сложите массы С двух Н 2 в периодической таблице. Вы должны получить 8 г на моль. Это C two H 2 . На последнем шаге я получил 1,076 г OC two H 2 . На данный момент не беспокойтесь о sig figs. Если ваш учитель беспокоится о значащих цифрах, держитесь за длинное число, потому что у нас уже будет еще одно вычисление. Вот сколько будет С2 Н два, если все пойдет по плану. Мы должны выйти из этого эксперимента. Так бывает не всегда. Это приведет нас к нашей фактической доходности. Ладно ладно. Наша реальная добыча — это то, что мы на самом деле получили, и это будет зависеть от температуры или давления. Они дали нам правильную информацию. Я запишу это здесь, чтобы оно было перед вами. Барометрическое давление ртутное. Давление воды 23,8. Это здорово. Наш газ — это C2H2 и вода, как мы говорили на этой картинке вверху справа.
На каждый моль карбида кальция вы получите один моль C2H2. Вы счастливы. Ладно ладно. Еще один шаг отменен. Процент выхода традиционно измеряется в граммах. Мы собираемся сделать еще один шаг, чтобы вернуться к gramps. Сложите массы С двух Н 2 в периодической таблице. Вы должны получить 8 г на моль. Это C two H 2 . На последнем шаге я получил 1,076 г OC two H 2 . На данный момент не беспокойтесь о sig figs. Если ваш учитель беспокоится о значащих цифрах, держитесь за длинное число, потому что у нас уже будет еще одно вычисление. Вот сколько будет С2 Н два, если все пойдет по плану. Мы должны выйти из этого эксперимента. Так бывает не всегда. Это приведет нас к нашей фактической доходности. Ладно ладно. Наша реальная добыча — это то, что мы на самом деле получили, и это будет зависеть от температуры или давления. Они дали нам правильную информацию. Я запишу это здесь, чтобы оно было перед вами. Барометрическое давление ртутное. Давление воды 23,8. Это здорово. Наш газ — это C2H2 и вода, как мы говорили на этой картинке вверху справа. Суммарное P — это давление воды и давление C2 H 2 . Если вы вычтете давление воды из вашего атмосферного давления, вы обнаружите, что это 735,2 мм ртутного столба. Для этого значения это 711,4. Не обязательно в граммах. Нам нужно выяснить, как перейти от давления к граммам, и самый простой способ сделать это — использовать НЗТ и моли, чтобы получить два g. Наши кроты должны решить это за нас. Команда тома R и R — это то, что нам нужно. Есть некоторые его формы. Я думаю, что тот, который вы видите чаще всего, это .08-1, и его атмосфера лидера делится на моли Кельвина. Единицы всего остального приведены в этом руководстве. Наша температура должна быть в градусах Кельвина, поэтому наша громкость должна быть в лидерах. Нам нужно преобразовать несколько вещей, прежде чем мы сможем подключиться. Мы можем иметь дело с лидерами. Что это был за номер, который нам сообщила проблема? Было 795 литров. Есть лидер и на 1000 литров. Имеем .795 л по объему. У нас много ртути. Это то, что мы хотим от атмосфер.
Суммарное P — это давление воды и давление C2 H 2 . Если вы вычтете давление воды из вашего атмосферного давления, вы обнаружите, что это 735,2 мм ртутного столба. Для этого значения это 711,4. Не обязательно в граммах. Нам нужно выяснить, как перейти от давления к граммам, и самый простой способ сделать это — использовать НЗТ и моли, чтобы получить два g. Наши кроты должны решить это за нас. Команда тома R и R — это то, что нам нужно. Есть некоторые его формы. Я думаю, что тот, который вы видите чаще всего, это .08-1, и его атмосфера лидера делится на моли Кельвина. Единицы всего остального приведены в этом руководстве. Наша температура должна быть в градусах Кельвина, поэтому наша громкость должна быть в лидерах. Нам нужно преобразовать несколько вещей, прежде чем мы сможем подключиться. Мы можем иметь дело с лидерами. Что это был за номер, который нам сообщила проблема? Было 795 литров. Есть лидер и на 1000 литров. Имеем .795 л по объему. У нас много ртути. Это то, что мы хотим от атмосфер. Коэффициент пересчета таков: в одной атмосфере 760 миллиметров ртутного столба. Что еще мы знаем? Какая у нас температура? Нам дали температуру по Цельсию. 25C плюс 2 73 говорят нам, что мы находимся на уровне 298 Келли. Это должно быть иначе. Нашими лидерами являются атмосферы и кельвины. Мы будем голодны. Это должно быть переставлено, чтобы получить родинки само по себе. Хотя и в другом цвете, у нас есть N и PV. Это не упирается в следующую вещь. Атмосферы над Кальвином были разделены на……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… которого была его температура, которая все это время была C два H два. Мы будем напоминать себе о том, как здорово там внизу. Мы почти там, чтобы получить полный урожай. Это должно быть в граммах. Вытащите свою периодическую таблицу и найдите массу C два H два. Вы должны получить 26,038, что составляет г на моль. Родинки отменили. У вас есть.792 г C2 H два. Вот сколько вы заработаете. Хорошо. У нас есть фактическая теоретическая информация, поэтому мы можем рассчитать доходность в процентах.
Коэффициент пересчета таков: в одной атмосфере 760 миллиметров ртутного столба. Что еще мы знаем? Какая у нас температура? Нам дали температуру по Цельсию. 25C плюс 2 73 говорят нам, что мы находимся на уровне 298 Келли. Это должно быть иначе. Нашими лидерами являются атмосферы и кельвины. Мы будем голодны. Это должно быть переставлено, чтобы получить родинки само по себе. Хотя и в другом цвете, у нас есть N и PV. Это не упирается в следующую вещь. Атмосферы над Кальвином были разделены на……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… которого была его температура, которая все это время была C два H два. Мы будем напоминать себе о том, как здорово там внизу. Мы почти там, чтобы получить полный урожай. Это должно быть в граммах. Вытащите свою периодическую таблицу и найдите массу C два H два. Вы должны получить 26,038, что составляет г на моль. Родинки отменили. У вас есть.792 г C2 H два. Вот сколько вы заработаете. Хорошо. У нас есть фактическая теоретическая информация, поэтому мы можем рассчитать доходность в процентах.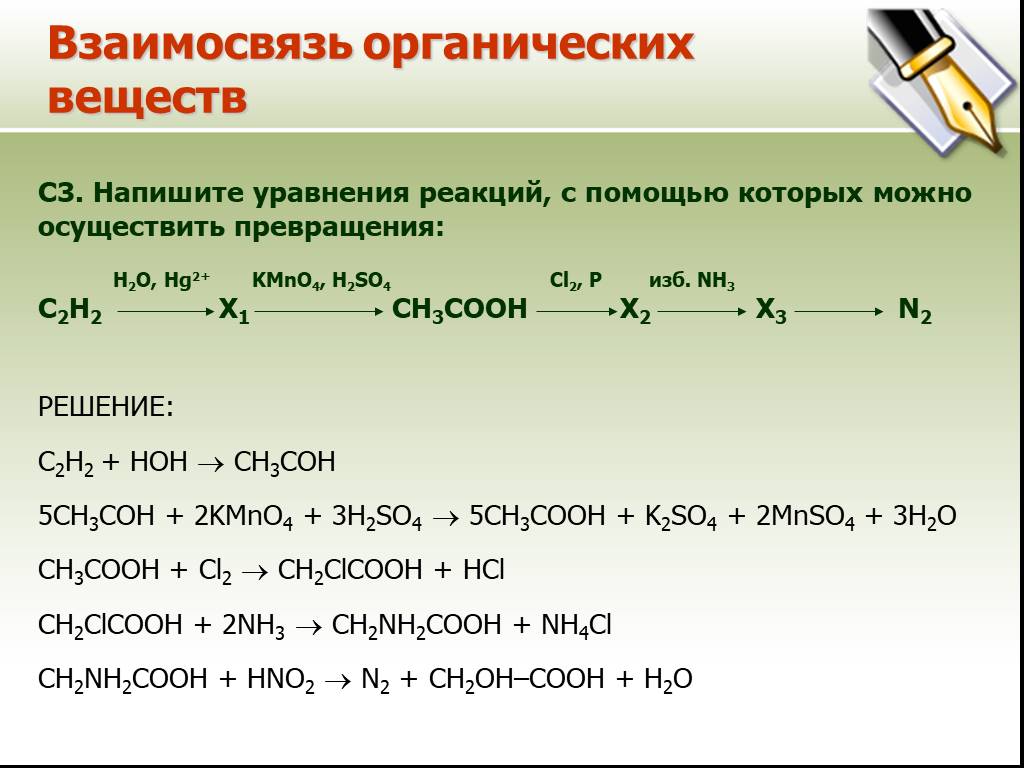 Ваша фактическая доходность делится на ваше теоретическое время на 100. Наше фактическое значение делится на теоретическое, которое мы получили ранее, на 100, что составляет 73,6 человека.
Ваша фактическая доходность делится на ваше теоретическое время на 100. Наше фактическое значение делится на теоретическое, которое мы получили ранее, на 100, что составляет 73,6 человека.
Поделиться вопросом
Добавить в плейлист
Хммм, кажется, у вас нет плейлистов. Пожалуйста, добавьте свой первый плейлист.
`
Реакция алкина с HgSO4 и h3SO4
HgSO 4 и водным разбавителем H 2 SO 4 используется для гидратации алкина. Гидратация алкинов гораздо сложнее, чем гидратация алкена.
Гидратация алкинов
Карбонильные соединения представлены как продукты. Карбонильные соединения группируются как альдегиды – это кетоны. Только гидратация этина дает альдегидное соединение этаналь. Этаналь — простейший альдегид.
HgSO
4 + H 2 SO4 HgSO 4 и H 2 SO 4 используются в качестве катализаторов и увеличивают скорость реакции.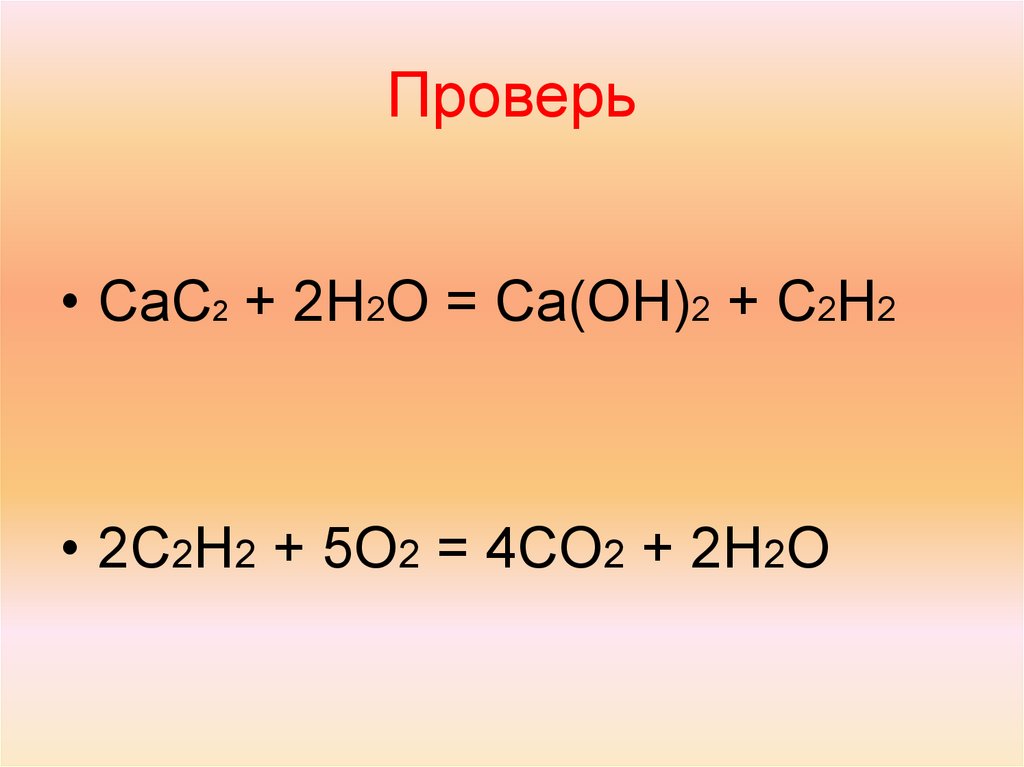
Почему сульфат ртути (HgSO
4 ) используется с серной кислотой?При гидратации алкена используется только разбавленный H 2 SO 4 . Но из-за низкой скорости реакции алкинов и H 2 SO 4 , мы должны использовать катализатор. Поэтому мы используем HgSO 4 в качестве катализатора для увеличения скорости реакции.
Продукты алкина с HgSO
4 и H 2 SO 4 реакцияВ случае несимметричных алкинов добавление воды происходит по правилу Морковникова . Атом кислорода присоединяется к одному атом углерода (в тройной связи) и два атома водорода присоединяются к другому атому углерода.
Два атома водорода добавляются к углероду, в котором больше атомов водорода.
Атом кислорода присоединен к другому углероду, который имеет меньше атомов водорода, образуя двойную связь.
Примеры гидратации алкинов
Примеры гидратации алкинов разбавленной серной кислотой и сульфатом ртути (HgSO 4 ) поясняются ниже.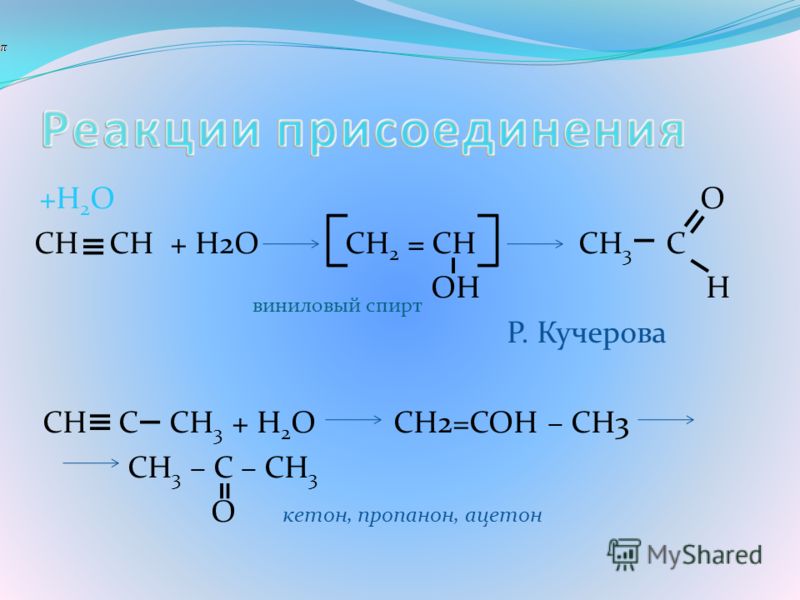
Реакционную смесь необходимо нагреть до 333К (60 0 С).
Ethyne с HGSO
4 и DILUTE H 2 SO 4ETHYNE, DILUTE H 2 SO 4 и HGSO 4 React для Ethanal. Это единственная реакция с образованием альдегида по реакции гидратации алкина. Этин симметричен и правило Морковникова нам не нужно. чтобы найти дополнительные места.
Пропин с HgSO
4 и разбавить H 2 SO 4Пропин, разбавить H 2 SO 4 и пропан HgSO 4. Пропанон представляет собой кетоновое соединение. Пропанон представляет собой несимметричную молекулу, и необходимо применить метод Морковника, чтобы решить, какие продукты дает пропин.
2-бутин с HgSO
4 и разбавленный H 2 SO 4 2-бутин, разбавленный H 2 SO 4 и HgSO 4 реагируют с образованием 2-бутанона.
Механизм гидратации алкинов
Сначала к тройной связи присоединяется молекула воды. Промежуточный продукт этой реакции очень нестабилен. Затем тройная связь превращается в двойную. Следовательно, как только это промежуточное соединение превращается в карбонильное соединение (альдегид или кетон). Увлажнение этин даст этаналь, который является альдегидным соединением. Все другие гидратации алкинов дадут кетоны.
Гидратация пропина дает пропанон — механизм
Вопросы гидролиза и алкина
Следующие вопросы были заданы студентами на нашем форуме вопросов. Мы лишь внесли небольшие изменения в вопросы, чтобы исправить грамматику или формулы химических соединений.
полное гидроксилирование этина в присутствии h3SO4 дает
Определение гидроксилирования: Гидроксилирование – это химический процесс, при котором гидроксильная группа (-ОН) вводится в органическое соединение.
Этин (C 2 H 2 ) представляет собой алкин.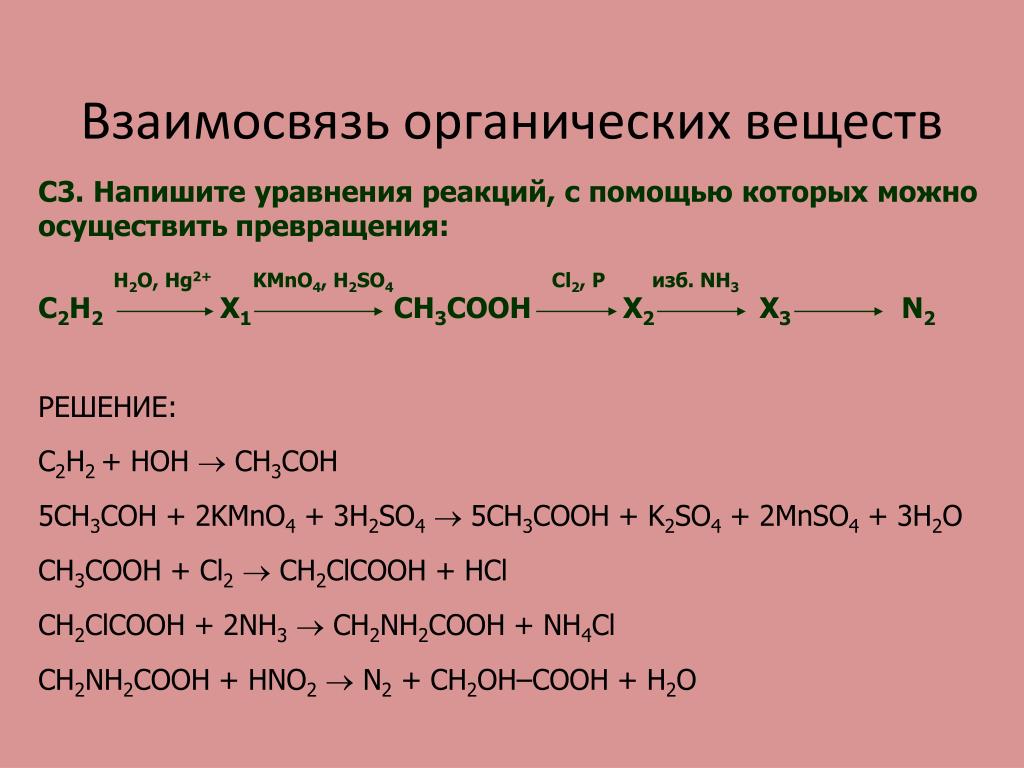 Я думаю, согласно вашему вопросу, вы собираетесь соединить группу -OH с молекулой этина, используя кислоту H 2 SO 4 .
Я думаю, согласно вашему вопросу, вы собираетесь соединить группу -OH с молекулой этина, используя кислоту H 2 SO 4 .
Но мы можем проделать подобные действия для гидроксилирования.
- Гидратация этина кислотой H 2 SO 4 и HgSO 4 . Этаналь дается как продукт.
- Этаналь восстанавливается до этанола с помощью LiAlH 4 .
Ch4CCH + разб.h3SO4/HgSO4 ?
Пропин, CH 3 CCH реагирует с разбавленным H 2 SO 4 / HgSO 4 с образованием CH 3 CH 3 , пропанона.
Могу ли я идентифицировать этен из этина по реакции с HgSO
4 и H 2 SO 4 ? Этен представляет собой алкен, а этин представляет собой алкин. Оба соединения могут гидролизоваться. Но разница в том, что для гидролиза
алкина, HgSO 4 требуется с H 2 SO 4 . Для гидролиза алкена разбавляют
H 2 SO 4 достаточно.
Для гидролиза алкена разбавляют
H 2 SO 4 достаточно.
Поскольку мы используем как gSO 4 , так и H 2 SO 4 , и этен, и этин гидролизуются и дают разные продукты этанол и этаналь. Так что нам нужно больше реакций для идентификации этанола и этаналя.
Идентификация этанола и этаналя
Этанол и этаналь представляют собой два разных органических соединения, спирт и альдегид соответственно. Они показывают разные реакции, и мы можем использовать их для их идентификации.
- Этанол и этаналь являются жидкостями при комнатной температуре.
- С натрием этанол реагирует с выделением газообразного водорода белый этаналь не реагирует. Так этанол идентифицируют от этаналя а также этен и этин.
Дадут ли 1-бутин и 2-бутин один и тот же продукт с HgSO
4 и H 2 SO 4 ? Да. И 1-бутин, и 2-бутин дают 2-бутанон в качестве продукта. 2-бутанон представляет собой кетон.
2-бутанон представляет собой кетон.
Что входит в состав смеси реагентов?
H 2 O, HGSO 4 , H 2 SO 4
Какова реакция HGSO
4 , H 2 SO 4 с Alkynes?Гидратирование алкенов осуществляется с помощью HgSO 4 , H 2 SO 4 и H 2 O. HgSO 4 используется, потому что гидролиз алкина труднее, чем гидролиз алкенов.
Что даст RCH двойной CHR в реакции с HgSO
4 \ H 2 SO 4RCH Double CHR (R 1 HC = CHR 2 R 1 , R 2 = Алкильные группы) — ALKENE и React с HGS 4. и разбавить H 2 SO 4 , чтобы получить спирты. Нет, при гидролизе алкена нам не нужна HgSO 4 в качестве катализатора.
Почему вместо концентрированной серной кислоты используется разбавленная серная кислота?
Концентрированный H 2 SO 4 используется для дегидратации спиртов с получением алкенов. Поэтому
разбавить Н 2 SO 4 используется с HgSO 4 для гидратации.
Поэтому
разбавить Н 2 SO 4 используется с HgSO 4 для гидратации.
Что происходит, когда пропин реагирует с водой в присутствии H
2 SO 4 /HgSO 4Пропин гидролизуется с образованием пропанона. H 2 SO 4 /HgSO 4 используются для катализа гидролиза потому что реакция алкина и воды протекает очень медленно.
Меры предосторожности, о которых следует помнить при проведении этой реакции
Следует соблюдать осторожность при работе с химическими веществами, используемыми в этой реакции. Прочтите MSDS (Паспорта безопасности материалов) прежде чем делать этот эксперимент.
Серная кислота
Серная кислота – сильная кислота, коррозионная, сильный дегидратор. Попадание серной кислоты на кожу вызывает сильные ожоги. и повреждение тканей. Носите лабораторный корт, чтобы предотвратить контакт с серной кислотой.
HgSO
4- Смертельно при проглатывании
- Смертельно при контакте с кожей
- Смертельно при вдыхании
- Может вызывать повреждение органов при длительном или многократном воздействии Alnes 7ky0003
- Пятели
- Не хорошо для вдыхания
Вопросы
CH4COCH4 с HGSO4 1% и H3SO4 42% дают
Мы используем HGSO 4 и H 5151551505150515051505150515051505150515051505150515051505150515051505150 4050515051505.

 03.16
03.16 03.16
03.16