Белорусский государственный университет транспорта — БелГУТ (БИИЖТ)
События
Все события
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
1 Дата : 2022-12-01 | 2 | 3 Дата : 2022-12-03 | 4 Дата : 2022-12-04 | |||
5 | 6 | 7 Дата : 2022-12-07 | 8 Дата : 2022-12-08 | 9 Дата : 2022-12-09 | 10 Дата : 2022-12-10 | 11 |
12 | 13 Дата : 2022-12-13 | 14 | 15 | 16 | 17 | 18 |
19 | 21 | 22 Дата : 2022-12-22 | 23 | 24 | 25 | |
26 | 27 | 28 | 29 | 30 | 31 | |
Все анонсы
- Приглашение на каток
- Выставка «Геноцид в Гомельской области во время В.
 ..
.. - Финал осенней серии игр «ЧТО? ГДЕ? КОГДА?» среди с…
- Смотр-конкурс на лучшее праздничное Новогоднее и Р…
- Регистрация до 12 декабря. I международная научно-…
- Билеты на детское новогоднее представление и спект…
- «Квартирник»
- 10 декабря — День открытых дверей ВТФ…
- V Международная научно-практическая конференция ст…
- Поступление на условиях целевой подготовки…
Анонсы
Университет
АбитуриентамСтудентам
Конференции
Приглашения
Приглашение на каток
Выставка «Геноцид в Гомельской области во время В…
Финал осенней серии игр «ЧТО? ГДЕ? КОГДА?» среди с…
Смотр-конкурс на лучшее праздничное Новогоднее и Р…
Новости
Университет
Международные связи
Спорт
Воспитательная работа
Жизнь студентов
Новости подразделений
- Университет
Выпуск группы повышения квалификации по теме «Современные технологии у. ..
..
12 декабря 2022
- Университет
К 160-летию белорусской магистрали
12 декабря 2022
- Университет
Торжественный Пленум Гомельской городской оргструктуры Белорусское об…
12 декабря 2022
- Университет
День открытых дверей военно-транспортного факультета…
12 декабря 2022
- Университет
Республиканский научно-исторический семинар «Гомельщина. Вехи истории»…
12 декабря 2022
- Воспитательная работа
Дети из Донбасса приехали в Гомель на оздоровление…
11 декабря 2022
- Университет
Финал евразийской лиги чемпионата мира по программированию. ..
..
11 декабря 2022
- Университет
Доступная среда – инклюзивная Беларусь…
10 декабря 2022
- Воспитательная работа
Старт акции «Чудеса на Рождество»
10 декабря 2022
Другие новости
- В Центре управления перевозками Белорусской железной дороги…
- V Международная научно-практическая конференция студентов, магистранто…
- «Караоке-баттл» в БелГУТе
- Поздравляем лауреатов Зонального тура «100 идей для Беларуси»…
- Победа в Международной олимпиаде по истории «Мировые войны в истории ч…
- Выездной семинар идеологов Гомельской области…
- Отборочный этап «100 идей для Беларуси»….
- Большие перспективы сотрудничества БелГУТа и ООО «Газпромтранс»…
- Соревнования по настольному теннису в рамках 70-й спартакиады студенто.
 ..
.. - Памяти Евгения Саблина
- В гостях у БелГУТа
КУДА ПОСТУПАТЬ
Все факультеты
БелГУТ на Доске почета
Достижения университета
Предложения
Все предложения
Видеотека
Все видео
Фотогалерея
Все фото
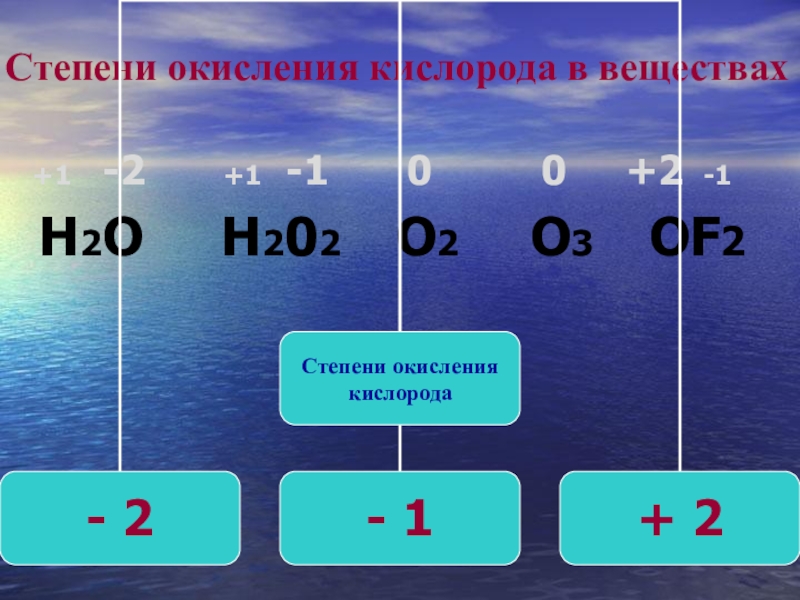
Второй период формирования атмосферы » Все о металлургии
13.01.2015
Кроме накопления ацетилена, характерным для этого периода является и образование сажи (углерода в дисперсном состоянии). Изменение же концентрации h3O, CO и CO2 в этот период замедляется. Содержание h3 увеличивается примерно с той же скоростью, что и в первом кислородном периоде окисления метана. Слабое изменение концентрации CO и CO2, а также рост содержания h3 свидетельствуют о том, что значительная часть непрореагировавшего метана в этот период переходит в ацетилен.
С повышением температуры возможность образования ацетилена из предельных углеводородов увеличивается. Константы равновесия реакции 2СН4=C2h3+3Н2 при 1000, 1250, 1500 и 1750 К соответственно составляют 1,366*10в-7, 2,291*10в-3, 1,492 и 1,444*10в2, а равновесная степень превращения метана в ацетилен (без учета последующего превращения ацетилена) — 0,0168; 0,1884; 0,6959 и 0,950, т.
Большинство исследователей имеют единое мнение о характере молекулярных промежуточных продуктов реакции и представляют процесс превращения несгоревшего метана по следующей обобщенной схеме:
При увеличении температуры выше 1000° С выход и концентрация ацетилена резко возрастают, концентрация же этана и этилена сокращается- Практически этан присутствует в продуктах реакции при температуре до 1150° С. Этилен образуется в значительных количествах и при более высоких температурах, однако с увеличением времени реакции его концентрация быстро снижается.
При температуре выше 1000° С, учитывая наиболее устойчивые продукты окислительного пиролиза метана (см. рис. 56), можно написать
В зависимости от времени процесса т и величин констант превращения Ch5 в C2H6 и C2h3 в продукты разложения и конверсии k1 и k2 степень превращения метана в ацетилен изменяется по экстремальной кривой:
Время реакции т, за которое концентрация C2h3 достигает максимального значения, зависит от температуры и наличия окисляющих C2h3 газов. В условиях окислительного пиролиза метана в смеси O2 : Ch5=0,6 при температуре 1400—1600° С оно составляет (2—5)*10в-3 с (рис. 59).
В условиях окислительного пиролиза метана в смеси O2 : Ch5=0,6 при температуре 1400—1600° С оно составляет (2—5)*10в-3 с (рис. 59).
При бескислородном пиролизе метана время накопления C2h3 существенно увеличивается и при 1340—1420° С составляет 0,7—4 с.
Чтобы показать относительное влияние температуры на превращение углеводородов в контролируемой атмосфере, на рис. 60 представлены ИК-спектры поглощения углеродсодержащих газов атмосферы из смеси природного газа с экзогазом, отобранной в различные периоды отжига стали Р6М5 из-под муфеля колпаковой печи (металлургический завод «Серп и молот»). Видно, что этан и пропан, содержащиеся в исходном природном газе, обнаруживаются лишь в период разогрева печи.

Имеющиеся результаты исследований по составу продуктов неполного горения метана не позволяют сделать окончательного вывода о механизме процесса пиролиза. Многие исследователи предполагают, что в бескислородной зоне, так же как и в присутствии свободного кислорода, определенное значение имеют радикалы типа Ch4, Ch3, CH и др., которые образуются при разрыве связей С—H и С—С. Например, разложение метана может протекать по следующему механизму: Ch5 → Ch4 + Н; Ch4 → Ch3 + Н; Ch3 → CH + Н.
Авторы расходятся в основном в оценке роли метиловых или метиленовых радикалов на начальной стадии процесса. Полагают, что реакция метана с метиленовым радикалом приводит к образованию этана Ch5 + Ch3 → C2H6.
Ацетилен же, кроме процессов дегидрирования этана, может образовываться непосредственно в результате димеризации метальных радикалов CH или реакции между атомарным углеродом и метиленовым радикалом.
Особую сложность представляет объяснение механизма образования новой фазы — углерода. Различные гипотезы и предположения по этому поводу особенно многочисленны. Пока можно говорить лишь о возможных качественных схемах процесса образования углерода. Особенно разноречивы мнения о начальных фазах образования сажевых частиц.
Размеры частиц сажи, образующиеся при неполном высокотемпературном сгорании смесей с n=0,3/0,5, обычно не превышают 50 нм.
Для образования сажевых частиц характерным является наличие пороговых концентраций углеводородов. В смесях C2h3 или Ch5 с азотом при различных температурах они соответственно равны 5 и 63% при 1000°C, 1,8 и 21% при 1100°C, 1,2 и 8% при 1200°С. Хотя приведенные пороговые концентрации C2h3 и Ch5 и не являются физическими константами, их наличие свидетельствует о возможном цепном характере образования зародышей сажи и значительно большей активности ацетилена по сравнению с Ch5 в процессах сажеобразования. В продуктах неполного сгорания пороговые концентрации C2h3 и Ch5 должны быть, видимо, несколько выше, чем в смесях этих газов с азотом.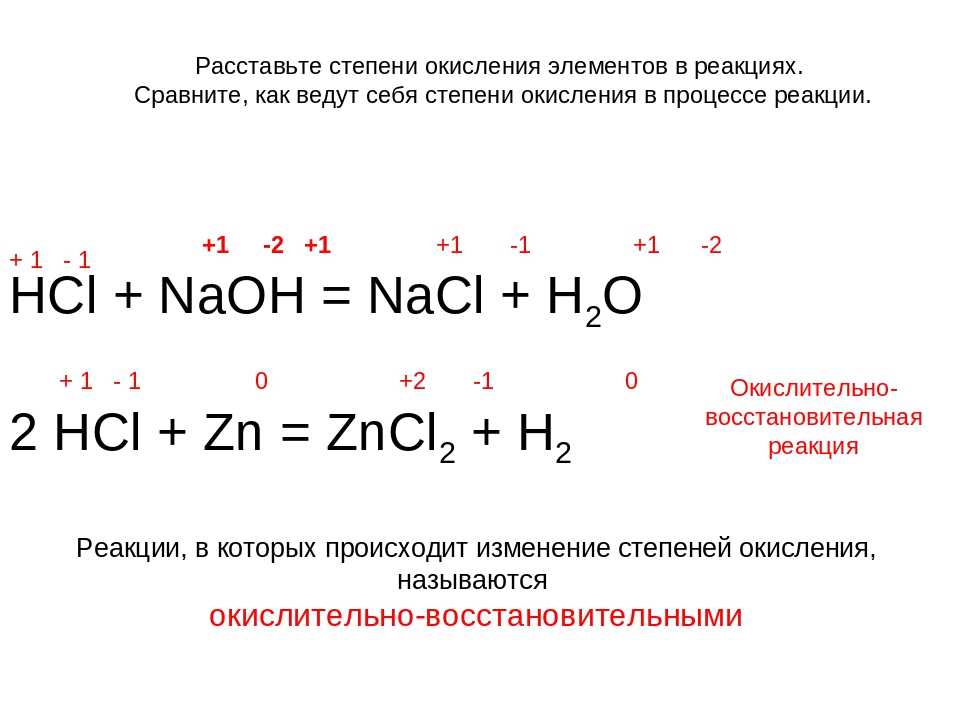
Авторами установлено, что при температурах выше 1000° С начало образования сажи в изотропной атмосфере свидетельствует о ее достаточно высоком восстановительном потенциале по отношению к железу. Высокая оптическая плотность взвеси частиц сажи легко позволяет даже визуально обнаружить их в промышленных печах при концентрации всего 0,01—0,001 г/м3, что может быть использовано в системах контроля и управления атмосферой в печах безокислительного нагрева стали с хорошим смешением компонентов горения.
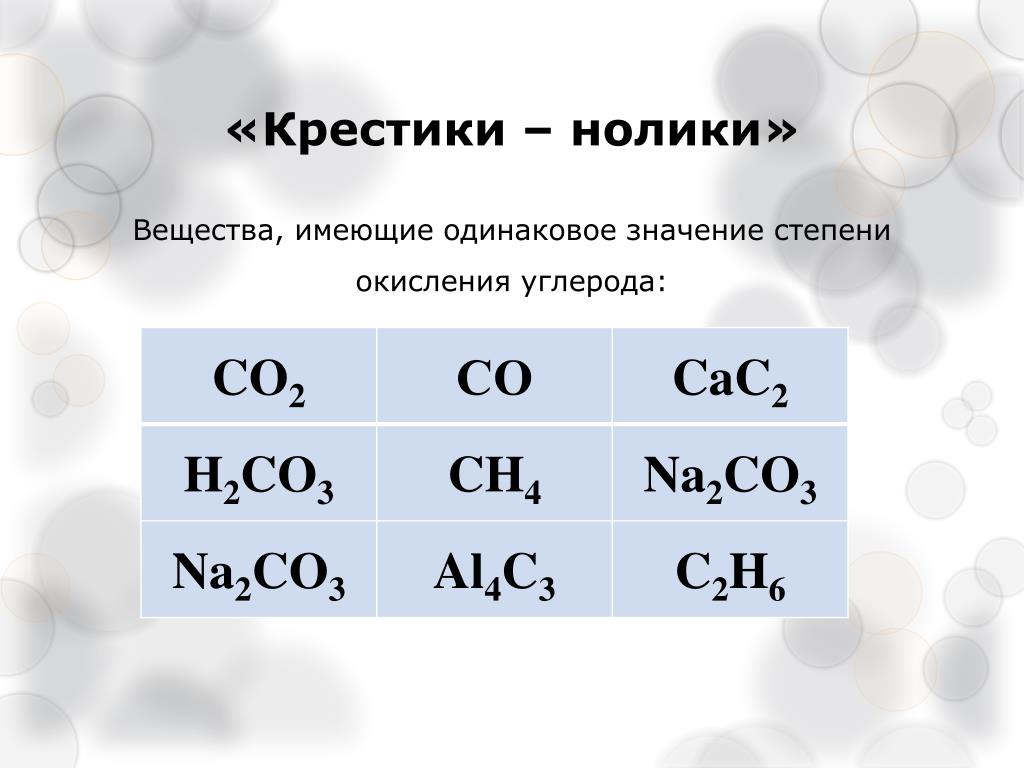
Максимальное количество сажи, образующейся при неполном сгорании смесей природного газа с воздухом, в зависимости от коэффициента расхода воздуха составляет ≤0,1 при n=0,5; 6—7 при n=0,4; 12/15 при n=0,32; 30—50 г/м3 при n=0,2. При дисперсии коэффициента расхода воздуха в зоне сажеобразования Δn=0,1/15, концентрация сажи увеличивается при n=0,5 в десять и более раз, при n=0,2 — в два-три раза. Выделение твердой фазы в таких количествах приводит к существенному снижению восстановительного и углеродного потенциалов атмосферы. При n=0,2/0,3 из-за выделения сажи (и пироуглерода) коэффициент расхода воздуха, пересчитанный на компоненты реакции водяного газа, повышается на Δn=0,05/0,1.
Образование сажи при n≥0,5 является наиболее «ярким» визуализированным показателем неравномерности смешения компонентов горения в промышленных печах. Авторами установлено, что при использовании горелок ГНП, инжекционных и многоструйного смешения сажа начинает интенсивно образовываться при n=0,58/0,65. Естественно, в этих случаях к моменту воcпламенения смеси дисперсия коэффициента расхода воздуха Δn в печи составляет не менее 0,1—0,15, что не может не повлиять на повышение окислительного потенциала и в зоне нагрева металла.

О качестве смешения, например, в инжекционной горелке, которую принято считать горелкой хорошего смешения, можно судить на основании следующих соотношений. По данным работы, относительная концентрация метана в центре сферического турбулентного вихря в атмосфере воздуха при комнатной температуре становится равной 5% при выдержке вихря τ (τ=R2/D, где D — коэффициент взаимной диффузии газов):
В смесителе инжекционной горелки смесь находится не более 0,1 с. За такое время молекулярного перемешивания можно достичь лишь при размере молей не более 0,5 мм. Фактически же средний радиус турбулентного вихря в трубе постоянного сечения R=0,01Dсм, что при диаметре смесителя Dсм=178 мм соответствует времени молекулярной диффузии около 0,4 с.
С подогревом газа и воздуха коэффициент взаимной диффузии газов увеличивается. Например, для пары Ch5—O2 с увеличением температуры с 20 до 500° С коэффициент диффузии повышается с 0,25 до 1,4 см2/с. При неизменном размере турбулентного вихря подогрев газа в рассматриваемом конкретном случае привел бы к сокращению времени молекулярной диффузии примерно в 5,5 раза.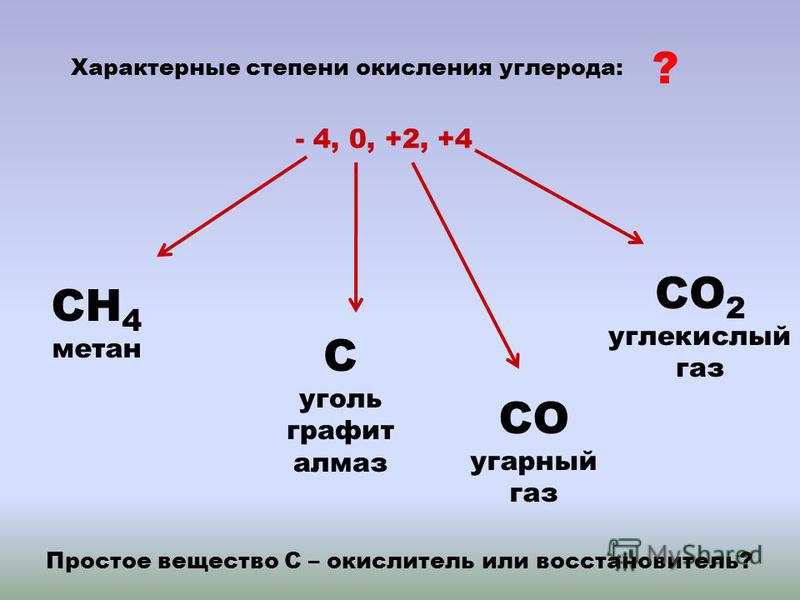 Однако, как показал опыт с подогревом газа, коэффициент расхода воздуха, с которого начинается образование сажи, изменяется мало. Видимо, одновременно с увеличением диффузии газа значительное влияние оказывают изменение его вязкости и увеличение объемной скорости движения.
Однако, как показал опыт с подогревом газа, коэффициент расхода воздуха, с которого начинается образование сажи, изменяется мало. Видимо, одновременно с увеличением диффузии газа значительное влияние оказывают изменение его вязкости и увеличение объемной скорости движения.
В результате увеличения времени молекулярного перемешивания за счет снижения скорости смеси, как правило, возрастает концентрация сажи, что можно объяснить ухудшением турбулентной стадии смешения.
В целом можно заключить, что для достижения молекулярного перемешивания газов в конструкциях горелок, выполненных по типу инжекционных, длина смесителя должна быть увеличена не менее чем в пять раз или должны быть приняты меры для улучшения турбулентного смешения (за счет многоструйного ввода газа, установки диафрагм или дополнительных насадок).
Снижение концентрации сажи при температуре в зоне горения выше 1300—1400° С связано как с условиями ее образования, так и с условиями газификации. На второй стадии окисления метана концентрация C2h3 с увеличением температуры процесса во всех случаях возрастает, т. е., казалось бы, это должно сопровождаться и увеличением концентрации сажи. Однако, если учесть последовательность образования C2h3 и углерода, а также температурный коэффициент скоростей реакций, становится очевидным, что с ростом температуры концентрация C2h3 должна возрасти с гораздо большей скоростью, чем содержание углерода.
е., казалось бы, это должно сопровождаться и увеличением концентрации сажи. Однако, если учесть последовательность образования C2h3 и углерода, а также температурный коэффициент скоростей реакций, становится очевидным, что с ростом температуры концентрация C2h3 должна возрасти с гораздо большей скоростью, чем содержание углерода.
Сравним изменение состава продуктов неполного горения природного газа при канальном (рис. 61, а—в) И струйном (рис. 61, г) движении смеси (по данным авторов). На рис. 61, а—в изображен состав газов на выходе из кварцевой трубки диаметром 8 мм (длина обогреваемой части трубки составляла 400 мм, расход смеси 0,75 м3/ч) в зависимости от максимальной температуры стенки. Из рисунка следует, что заметное количество C2h3 появляется при температуре стенки 1300 К. К этому моменту свободный кислород в смеси в значительной степени израсходован. При 1500 К и выше концентрация ацетилена превышает концентрацию Ch5 и достигает 4—5,5%.
Несколько иначе изменяется состав продуктов неполного горения по оси факела (струйное движение смеси). Опыт, данные которого изображены на рис. 61, г, проводили в электрообогреваемой карборундовой трубе диаметром 0,1 м при расходе смеси 6 м3/ч, dc=15 мм, средней температуре в трубе 1500 К, температуре смеси T=300 К, n=0,3. По сравнению с составом газов при сгорании природного газа в кварцевой трубке (см. рис. 61, а) ацетилена в условиях факельного процесса примерно в 1,5 раза меньше.. Отсутствует и какая-либо граница в образовании C2h3 в кислородной и бескислородной зонах. Обнаруженные значительные количества C2h3 в кислородной зоне факела можно объяснить подмешиванием к свежей смеси продуктов неполного сгорания из циркуляционных зон.
Опыт, данные которого изображены на рис. 61, г, проводили в электрообогреваемой карборундовой трубе диаметром 0,1 м при расходе смеси 6 м3/ч, dc=15 мм, средней температуре в трубе 1500 К, температуре смеси T=300 К, n=0,3. По сравнению с составом газов при сгорании природного газа в кварцевой трубке (см. рис. 61, а) ацетилена в условиях факельного процесса примерно в 1,5 раза меньше.. Отсутствует и какая-либо граница в образовании C2h3 в кислородной и бескислородной зонах. Обнаруженные значительные количества C2h3 в кислородной зоне факела можно объяснить подмешиванием к свежей смеси продуктов неполного сгорания из циркуляционных зон.
При подогреве смеси с n=0,3 до 800—850 К максимальная концентрация по оси факела (стесненность факела D/dc=7) C2h3 достигала 3,5—3,8%. При n=0,45/0,5 [концентрация C2h3 по оси факела не превышала 1,5%. В связи с трудностями достижения высоких температур при уменьшении п ниже 0,3 концентрация C2h3 снижалась.
Прекращение накопления C2h3 при факельном сгорании смеси наблюдается за кислородной зоной на расстоянии от нее не более 5dc.
Изменение состава газа в условиях канального сжигания холодной смеси в промышленной печи показано на рис. 62. Видно, что максимальная концентрация C2h3 при изменении n с 0,5 до 0,43 увеличилась с 1,0 до 2,5%. При молекулярном перемешивании газов сажа появилась в печи при n=0,48.
Глубина реакции к концу второго периода окисления метана при n=0,3/0,5 составляет 0,8—0,95. Она увеличивается с повышением температуры и коэффициента расхода воздуха.
Анализ экспериментальных данных, полученных авторами при n=0,3/0,5 и T=1300/1700К, позволил установить следующие зависимости, которые могут быть использованы в оценочных расчетах:
Пользуясь представленными формулами, нетрудно рассчитать, что, например, при 1500 К на завершение второго периода окисления метана потребуется около 0,1 с, время же «задержки» концентрации ацетилена на максимальном уровне при n=0,3 составит около 0,2 с, при n=0,5 оно равно 0,045 с. При тех же температурных условиях первый период окисления метана завершился бы за 10в-2 с.
- Первый период формирования атмосферы
- Формирование и состав контролируемой атмосферы
- Термодинамическое регулирование кислородного и углеродного потенциалов контролируемых атмосфер
- Термическая обработка с целью восстановления металлов из оксидов
- Обезуглероживающий отжиг
- Реставрационное науглероживание стали
- Газовые карбюризаторы
- Газовая цементация стали
- Особенности массообмена при наличии нескольких фаз в поверхностном слое обрабатываемого материала
- Внутреннее окисление сплавов
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Фе | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
c2h3 структура Льюиса домашнее задание Помощь на TutorEye
Структура Льюиса C2h3:
Центральным атомом в C2h3 является углерод, и он имеет 4 валентных электрона. Два атома углерода в C2h3 означают восемь валентных электронов для атомов углерода. Каждый атом водорода имеет один валентный электрон, 2 валентных электрона на 2 атома Н. Всего валентных электронов 10.
Два атома углерода в C2h3 означают восемь валентных электронов для атомов углерода. Каждый атом водорода имеет один валентный электрон, 2 валентных электрона на 2 атома Н. Всего валентных электронов 10.
Атомы углерода образуют тройную связь друг с другом, разделяя 6 электронов, и каждый атом C образует одинарную связь с атомами водорода и завершает свои соответствующие октеты.
H:C:::C:H
Тройная связь представлена 6 точками (каждая точка представляет один электрон) между двумя атомами C, а одинарная связь представлена двумя точками между C и Атомы Н.
Структура Льюиса C2h3 Примеры вопросов:
Вопрос 1: Сколько всего валентных электронов содержится в C2h3?
а) 2 б) 6
C) 8 D) 10
Ответ: Вариант D) 10
Объяснение: Центральный атом C2H3 в углероде и имеет 4 валентные электроны, два атома углерода в C2H3 означает восемь валентных электронов для углерода, и у него есть 4 валентные электроны, два атома углерода в C2H3 означает восемь валентных электронов для углерода. атомы. Каждый атом водорода имеет один валентный электрон, 2 валентных электрона на 2 атома Н. Всего валентных электронов 10.
атомы. Каждый атом водорода имеет один валентный электрон, 2 валентных электрона на 2 атома Н. Всего валентных электронов 10.
Получите полное решение!
Вопрос 2: Количество одинарных связей C2h3 в ис-
A) 1 B) 2
C) 3 D) 4
Ответ: Вариант B) 2
Обзор: . Каждый атом водорода имеет один валентный электрон. Оба C имеют 6 общих электронов, образуя тройную связь, и оба C имеют 2 общих электрона с одним из атомов H и образуют с ними одинарные связи.
Получите полное решение!
Вопрос 3: Количество несвязывающих электронов в молекуле этина?
A) 0 B) 1
C) 2 D) 4
Ответ: Вариант A) 0
Обзор: . Каждый атом водорода имеет один валентный электрон. Оба C имеют 6 общих электронов, образуя тройную связь, и оба C имеют 2 общих электрона с одним из атомов H и образуют с ними одинарные связи. Все валентные электроны используются для связывания, и несвязывающих электронов не осталось.
Все валентные электроны используются для связывания, и несвязывающих электронов не осталось.
Получите полное решение!
Вопрос 4: Какова молекулярная форма C2h3?
A) Бент B) Линейный
C) Pyramidal D) Trigonal Planar
Ответ: Вариант B) Linear
Expromation. является линейным.
Получите полное решение!
Вопрос 5: Сколько пар связей в молекуле C2h3?
A) 2 B) 3
C) 4 D) 5
Ответ: Вариант D) 5
Объяснение: Всего вала. друг с другом делят 6 электронов, и каждый атом C образует одинарную связь с атомами водорода, делящими два электрона на связь. Общее количество пар облигаций — 5,9.0915
Получите полное решение!
Вопрос 6: Сколько тройных связей в C2h3?
a) 0 B) 1
C) 2 D) 3
Ответ: Вариант B) 1
Объяснение: . Уболетные атомы образуют трибуны. Атом C образует одинарную связь с атомами водорода и завершает их соответствующие октеты.
Уболетные атомы образуют трибуны. Атом C образует одинарную связь с атомами водорода и завершает их соответствующие октеты.
Получите полное решение!
Вопрос 7: Какое из следующих утверждений о структуре Льюиса C2h3 верно?
A) Существует две тройные связи
B) Есть 5 пары связей
C) Существуют 2 одинокие пары
D) Геометрия молекулы согнута
Ответ: вариант B)
91919919919999999999915
9191999999999991999999999999999999999999999999999199919191991919191 гг. Объяснение: Общее количество валентных электронов в C2h3 равно 10. Атомы углерода образуют тройную связь, в которой друг с другом делится 6 электронов, и каждый атом C образует одинарную связь с атомами водорода, делящими по два электрона на связь. Общее количество пар облигаций — 5,9.0915
Получите полное решение!
Вопрос 8: Какое из следующих утверждений о структуре Льюиса C2h3 неверно?
а) Это линейная молекула.
б) Имеет тройную связь.
в) Имеет две двойные связи.
г) Не имеет неподеленных пар.
Ответ: Вариант в) Имеет две двойные связи.
Объяснение: Атомы углерода образуют тройную связь друг с другом, разделяя 6 электронов, и каждый атом C образует одинарную связь с атомами водорода и завершает свои соответствующие октеты. Нет никакой двойной связи.
Получите полное решение!
Вопрос 9: C2h3 следует правилу октетов?
а) Верно
б) Ложно
Ответ: Верно
Объяснение: Согласно правилу октетов каждый атом пытается достичь стабильного состояния, т.е. C и 2 электрона для H. O имеет 4 валентных электрона, а H имеет 1 валентный электрон, и им нужно 4 и 1 электрон соответственно, чтобы завершить свой октет. Оба атома C делят друг с другом по 6 электронов и образуют тройную связь, а два электрона с атомом H образуют одинарную связь с атомом H. Следовательно, в C2h3 каждый атом C окружен 8, а каждый атом H окружен 2 электронами.
Следовательно, в C2h3 каждый атом C окружен 8, а каждый атом H окружен 2 электронами.
Таким образом, C2h3 соответствует правилу октетов.
Получите полное решение!
Вопрос 10: Две точки на символе атома обозначают ?
A) Одинокая пара
B) Одиночная связь
C) Двойная связь
D) Неправый электрон
Ответ: Lone Pare
Aplaban. пара сплошных точек на атомном символе
Получите полное решение!
Часто задаваемые вопросыЧто такое структура Льюиса для C2h3?
Атом углерода является центральным атомом в C2h3 и имеет четыре валентных электрона, в C2h3 есть два атома углерода, мы умножим число на 2. Следовательно, у атомов углерода восемь валентных электронов. Атомы водорода имеют один валентный электрон, у двух атомов Н число валентных электронов равно 2. Всего валентных электронов 10,9.0919 Оба атома углерода образуют тройную связь друг с другом, разделяя 6 электронов и одинарную связь с одним атомом водорода, и завершают свои соответствующие октеты.
Всего валентных электронов 10,9.0919 Оба атома углерода образуют тройную связь друг с другом, разделяя 6 электронов и одинарную связь с одним атомом водорода, и завершают свои соответствующие октеты.
H:C:::C:H
Тройная связь представлена шестью точками (каждая точка представляет один электрон) между двумя атомами C, а одинарная связь представлена двумя точками между C и Атомы Н.
Какова структура точек Льюиса для C2h3?
Атом углерода является центральным атомом в C2h3 и имеет четыре валентных электрона, в C2h3 есть два атома углерода, мы умножим число на 2. Следовательно, у атомов углерода восемь валентных электронов. Атомы водорода имеют один валентный электрон, для двух атомов Н число валентных электронов равно 2. Всего валентных электронов 10.
Оба атома углерода образуют тройную связь друг с другом, разделяя 6 электронов и одинарную связь с одним атомом водорода и завершить соответствующие октеты.
H:C:::C:H
Тройная связь представлена шестью точками (каждая точка представляет один электрон) между двумя атомами C, а одинарная связь представлена двумя точками между C и Атомы Н.
Какова молекулярная форма C2h3?
C2h3 представляет собой четырехатомную молекулу, в которой все атомы симметрично лежат в одной плоскости. Углерод связан тройной связью с другим углеродом, что придает молекуле линейную форму с валентным углом = 180,9.0915
Соответствует ли C2h3 правилу октетов?
Правило октета гласит, что каждый атом пытается достичь стабильного состояния, стабилизируя количество валентных электронов, которое составляет восемь электронов для C и два электрона для H. O имеет 4 валентных электрона, а H имеет один валентный электрон и им нужно 4 и 1 электрон соответственно, чтобы завершить свой октет.

 ..
..