404 Cтраница не найдена
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Определите валентность и степень окисления атомов в веществах, формулы
Другие предметы, 17. 04.2019 03:10, вано138
04.2019 03:10, вано138
Определите валентность и степень окисления атомов в веществах, формулы которых Cl2, CO2, C2h5, C2H6
Посмотреть ответы
Другие вопросы по: Другие предметы
Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2…
Опубликовано: 17.04.2019 01:40
Ответов: 1
Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Nh4, Н2O2, OF2, O2F2…
Опубликовано: 17.04.2019 01:40
Ответов: 2
Какая связь называется s- и какая — p-связью? Какая из них менее прочная? Изобразите структурные формулы этана C2H6, этилена C2h5…
Опубликовано: 17.04.2019 07:40
Ответов: 1
Определите степени окисления элементов в веществах, формулы которых: Ch5, FE CL2, CaF2, Ph4, Na2S, SO2, Nh4,…
Опубликовано: 16. {2} — 3x + 5 ; найти сумму координат ( наименьшую )…
{2} — 3x + 5 ; найти сумму координат ( наименьшую )…
Опубликовано: 01.03.2019 02:20
Ответов: 2
Сколько среди слов горячий, обожженый, красный, сгоревший таких, которые сочетаются со словом огонь?…
Опубликовано: 02.03.2019 18:00
Ответов: 2
Царица клеопатра по совету придворного медика растворила в уксусе самую крупную из известных ювелирами жемчужину а затем принимала полученный раствор в течении некоторого времени….
Опубликовано: 02.03.2019 19:20
Ответов: 3
Концентрация водородных ионов в растворе равна [h+]=1,0 x10(-5)моль/ л. чему равен рн этого раствор? в какой цвет окрасится фенолфталеин в этом растворе? . заранее ….
Опубликовано: 03.03.2019 01:50
Ответов: 2
Обозревая разбор слова по составу я знаю, что это деепричастие, и у него не может быть окончания…
Опубликовано: 03.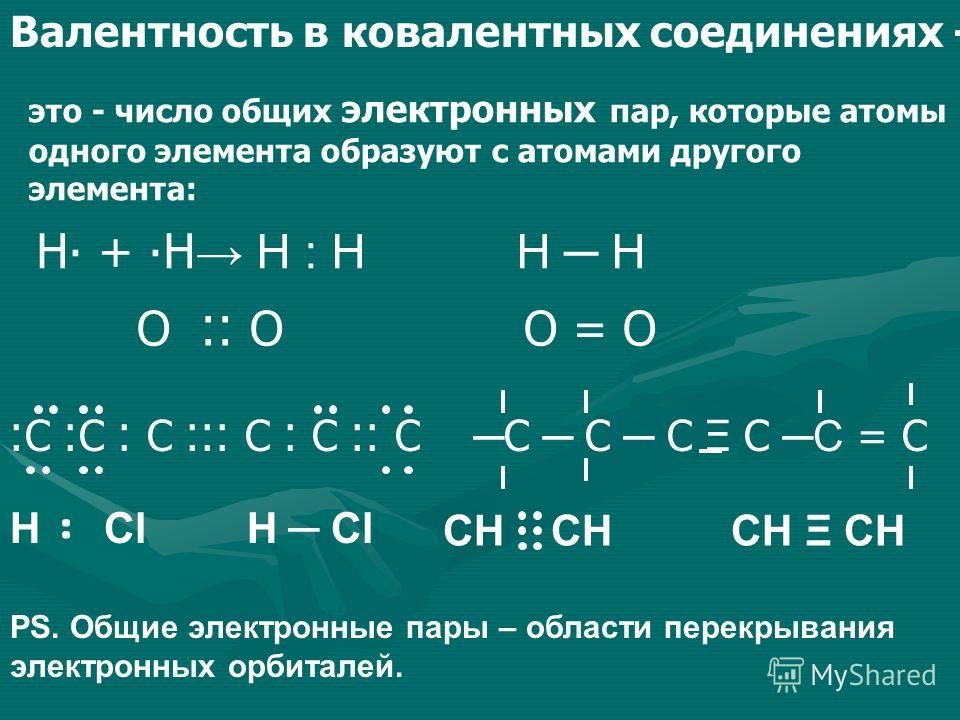 03.2019 02:50
03.2019 02:50
Ответов: 1
Зделать 1 предложение со словом впоследствии, надо!…
Опубликовано: 03.03.2019 05:20
Ответов: 2
Расположите слова, характеризующий процесс преобразования объектов природы в предметы потребления в правильной последовательности: обмен, ресурсы, технология, распределение, произ…
Опубликовано: 03.03.2019 07:10
Ответов: 3
Какие водоемы имеются в нашей местности? назовите главные из них. город спб…
Опубликовано: 03.03.2019 18:40
Ответов: 1
Рассчитайте количество водорода, который выделится в реакции металлического натрия с этанолом массой 12,88?…
Опубликовано: 03.03.2019 19:50
Ответов: 1
Больше вопросов по предмету: Другие предметы Случайные вопросы
19.1. Определение степени окисления углерода
- В связи C-H H рассматривается так, как если бы он имел степень окисления +1.
 Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1.
Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1. - Для углерода, связанного с более электроотрицательным неметаллом X, таким как азот, кислород, сера или галогены, каждая связь C-X будет увеличивать степень окисления углерода на 1. (Некоторые неметаллы менее электроотрицательны, чем углерод , такие как фосфор, кремний или бор, но связи углерода с этими элементами встречаются гораздо реже.)
- Для углерода, связанного с другим углеродом, степень окисления не изменяется. Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления.
Таким образом, в отличие от металлов, которые почти всегда находятся в положительной степени окисления, степень окисления углерода может варьироваться в широких пределах, от -4 (в Ch5) до +4 (например, в CO2). Вот несколько примеров.
(Не забывайте, что это называется «формализм» по какой-то причине. Заряд углерода не равен на самом деле +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Поняв, как рассчитать степень окисления углерода, мы готовы к следующему шагу: пониманию изменений степени окисления углерода посредством реакций, известных как окисления (где степень окисления увеличивается), и восстановления (где степень окисления снижена). Подробнее об этом в следующий раз.
Дополнительная литература
Лестница окисления
Ссылки
- http://www.masterorganicchemistry.co…e-of-a-carbon/
Авторы
- Джеймс Эшенхерст (MasterOrganicChemistry.com)
Окисление и восстановление органических соединений – обзор
Вы, несомненно, уже знакомы с общей идеей окисления и восстановления: из общей химии вы узнали, что при окислении соединение или атом теряет электроны, а при восстановлении приобретает электроны. Вы также знаете, что реакции окисления и восстановления протекают парами: если один вид окисляется, другой должен одновременно восстанавливаться — отсюда и термин «окислительно-восстановительная реакция». поток электронов от одного металла к другому, например, реакция между ионом меди в растворе и металлическим цинком: 9{+2}_{(водн.)} \тег{16.1.1}\]
Вы также знаете, что реакции окисления и восстановления протекают парами: если один вид окисляется, другой должен одновременно восстанавливаться — отсюда и термин «окислительно-восстановительная реакция». поток электронов от одного металла к другому, например, реакция между ионом меди в растворе и металлическим цинком: 9{+2}_{(водн.)} \тег{16.1.1}\]
В органической химии окислительно-восстановительные реакции выглядят несколько иначе. Электроны в органической окислительно-восстановительной реакции часто передаются в виде гидрид-иона – протона и двух электронов. Поскольку они происходят вместе с переносом протона, их обычно называют реакциями гидрирования и дегидрирования : гидрид плюс протон образуют молекулу водорода (H 2 ). Будьте осторожны – не перепутайте термины hyd водород ионизация и дегидрирование дроген ионизация с гидратацией и дегидратацией – последние относятся к приросту и отщеплению молекулы воды (и являются , а не окислительно-восстановительными реакциями), а первые относятся к приросту и потеря молекулы водорода .
Когда атом углерода в органическом соединении теряет связь с водородом и приобретает новую связь с гетероатомом (или с другим углеродом), мы говорим, что соединение дегидрировано или окислено. Очень распространенным биохимическим примером является окисление спирта в кетон или альдегид:
Когда атом углерода теряет связь с водородом и приобретает связь с гетероатомом (или с другим атомом углерода), это считается окислительным процессом, поскольку водород из всех элементов является наименее электроотрицательным. Таким образом, в процессе дегидрирования атом углерода претерпевает общую потерю электронной плотности – а потеря электронов есть окисление.
И наоборот, когда атом углерода в органическом соединении получает связь с водородом и теряет связь с гетероатомом (или с другим атомом углерода), мы говорим, что соединение гидрировано или восстановлено. Гидрирование кетона в спирт, например, в целом является обратным дегидрированию спирта, показанному выше. Ниже проиллюстрирована другая распространенная возможность — гидрирование (восстановление) алкена до алкана.
Гидрирование приводит к более высокой электронной плотности на атоме(ах) углерода, и, таким образом, мы считаем процесс восстановлением органической молекулы.
Обратите внимание, что ни гидрирование, ни дегидрирование не связаны с приобретением или потерей атома кислорода . Реакции, которые — включают приобретение или потерю одного или нескольких атомов кислорода, обычно называют «оксигеназными» и «редуктазными» реакциями.
По большей части, говоря об окислительно-восстановительных реакциях в органической химии, мы имеем дело с небольшим набором хорошо узнаваемых превращений функциональных групп. Поэтому очень полезно ознакомиться с идеей «степеней окисления» применительно к органическим функциональным группам. Сравнивая относительное количество связей с атомами водорода, мы можем упорядочить знакомые функциональные группы по степени окисления. В качестве примера возьмем ряд одноуглеродных соединений. Метан с четырьмя углеродно-водородными связями сильно восстановлен. Далее в ряду идет метанол (на одну связь углерод-водород меньше, на одну связь углерод-кислород больше), за ним следуют формальдегид, формиат и, наконец, диоксид углерода на сильно окисленном конце группы.
Далее в ряду идет метанол (на одну связь углерод-водород меньше, на одну связь углерод-кислород больше), за ним следуют формальдегид, формиат и, наконец, диоксид углерода на сильно окисленном конце группы.
Эта закономерность верна для соответствующих функциональных групп органических молекул с двумя или более атомами углерода:
Алканы сильно восстанавливаются, в то время как спирты, а также алкены, простые эфиры, амины, сульфиды и эфиры фосфорной кислоты находятся на одну ступень выше по шкале окисления, за ними следуют альдегиды/кетоны/имины и эпоксиды и, наконец, производные карбоновых кислот ( двуокись углерода, находящаяся в верхней части списка окисления, характерна для одного ряда углерода).
Обратите внимание, что в приведенном выше ряду двухуглеродных соединений этанол и этен считаются находящимися в одной и той же степени окисления. Вы уже знаете, что спирты и алкены взаимопревращаются путем присоединения или отщепления воды (например, в разделе 10. 4.). Когда спирт дегидратируется с образованием алкена, один из двух атомов углерода теряет связь С-Н и приобретает связь С-С и, таким образом, окисляется. Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не изменяется.
4.). Когда спирт дегидратируется с образованием алкена, один из двух атомов углерода теряет связь С-Н и приобретает связь С-С и, таким образом, окисляется. Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не изменяется.
Вы должны научиться распознавать, когда реакция включает изменение степени окисления атомов углерода в органическом реагенте. Глядя, например, на следующее превращение, вы сможете быстро распознать, что это окисление: функциональная группа спирта превращается в кетон, что является одной ступенью вверх по лестнице окисления.
Аналогично, следующая реакция включает превращение производного карбоновой кислоты (тиоэфира) сначала в альдегид, а затем в спирт: это двойное восстановление , так как субстрат теряет две связи с гетероатомами и приобретает две связи с атомами водорода.
Реакция переноса ацила (например, превращение ацилфосфата в амид) , а не считается окислительно-восстановительной реакцией – степень окисления органической молекулы не изменяется по мере превращения субстрата в продукт, потому что связь к одному гетероатому (кислороду) просто обменяли на связь с другим гетероатомом (азот).
Важно уметь распознавать, когда органическая молекула окисляется или восстанавливается, потому что эта информация говорит вам искать участие соответствующего окислительно-восстановительного агента, который восстанавливается или окисляется — помните, окисление и восстановление всегда происходят в тандеме ! Вскоре мы подробно узнаем о наиболее важных биохимических и лабораторных окислительно-восстановительных агентах.
- Органическая химия с биологическим акцентом Тим Содерберг (Университет Миннесоты, Моррис)
Окислительно-восстановительные реакции | Определение, примеры и факты
- Связанные темы:
- электрохимическая реакция горение степень окисления снижение внутрисферная реакция
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
окислительно-восстановительная реакция , также называемая окислительно-восстановительной реакцией , любая химическая реакция, в которой изменяется степень окисления участвующих химических соединений. Термин охватывает большой и разнообразный набор процессов. Многие окислительно-восстановительные реакции столь же распространены и знакомы, как огонь, ржавление и растворение металлов, потемнение фруктов, дыхание и фотосинтез — основные функции жизни.
Термин охватывает большой и разнообразный набор процессов. Многие окислительно-восстановительные реакции столь же распространены и знакомы, как огонь, ржавление и растворение металлов, потемнение фруктов, дыхание и фотосинтез — основные функции жизни.
Основные классификации
Большинство окислительно-восстановительных (окислительно-восстановительных) процессов включают перенос атомов кислорода, атомов водорода или электронов, при этом все три процесса имеют две общие важные характеристики: (1) они связаны, т. е. в любой реакции окисления происходит взаимное восстановление, и (2) они включают характерное чистое химическое изменение, т. е. атом или электрон переходит из одной единицы материи в другую. Как взаимность, так и чистое изменение проиллюстрированы ниже на примерах трех наиболее распространенных типов окислительно-восстановительных реакций.
Углерод реагирует с оксидом ртути(II) (соединением, в котором ртуть имеет связывающую способность, выраженную как +2; см. ниже Изменение степени окисления) с образованием диоксида углерода и металлической ртути. Эту реакцию можно записать в виде уравнения:
ниже Изменение степени окисления) с образованием диоксида углерода и металлической ртути. Эту реакцию можно записать в виде уравнения:
Углерод, получая кислород, окисляется; оксид ртути(II), теряя кислород, подвергается дополнительному восстановлению; и чистое изменение представляет собой перенос двух атомов кислорода из звеньев оксида ртути (II) на атом углерода.
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Атомы водорода переходят от гидразина, соединения азота и водорода, к кислороду в следующей реакции:
Гидразин, теряя водород, окисляется до молекулярного азота, а кислород, присоединяя водород, восстанавливается до воды.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Металлический цинк и ион меди(II) реагируют в водном растворе с образованием металлической меди и водного (обозначаемого водным) иона цинка в соответствии с уравнением
С переносом двух своих электронов металлический цинк окисляется, превращаясь водный ион цинка, в то время как ион меди (II), приобретая электроны, восстанавливается до металлической меди.

 Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1.
Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1.