Сложные эфиры.. — Химия — Уроки
Сложные эфиры
Сложные эфиры — производные кислот (карбоновых или минеральных, одноосновных или многоосновных), в которых атомы водорода гидроксильных групп -ОН замещены на углеводородные радикалы R.
Сложные эфиры карбоновых кислот обычно рассматривают как продукты реакции между кислотой и спиртом (реакция этерификации)
Общая формула сложных эфиров карбоновых кислот R-C(O)-O-R’
Номенклатура сложных эфиров (Название)
Существует несколько вариантов названий сложных эфиров, при этом могут использоваться как систематические, так и тривиальные названия радикалов и кислот.
1. Сокращенный вариант (по аналогии с названием солей). В соответствии с систематической номенклатурой, название сложного эфира образуется следующим образом: первым указывается название радикала R, присоединенного к кислоте, затем – название кислоты (корень слова) с суффиксом «оат» (по аналогии с суффиксом «ат» в названиях неорганических солей: карбонат натрия, нитрат хрома). Например, этилпропаноат, метилэтаноат.
Например, этилпропаноат, метилэтаноат.
По сокращенному варианту может быть образовано и тривиальное название: к названию радикала R добавляется тривиальное название остатка кислоты (используется суффикс «ат»):
формиат — эфир мураьвиной кислоты (HCOOR),
ацетат — эфир уксусной кислоты (Ch4COOR)
бутират — эфир масляной (бутановой) кислоты (Ch4Ch3Ch3COOR).
2. Полный вариант. К названию радикала R (по систематической номенклатуре) добавляется суффикс «овый», затем вставляется слово «эфир» и указывается название кислоты, например, этиловый эфир этановой кислоты или этиловый эфир уксусной кислоты. Название сложного эфира бутилпропионат в полном варианте будет выглядеть следующим образом: бутиловый эфир пропановой (пропионовой) кислоты.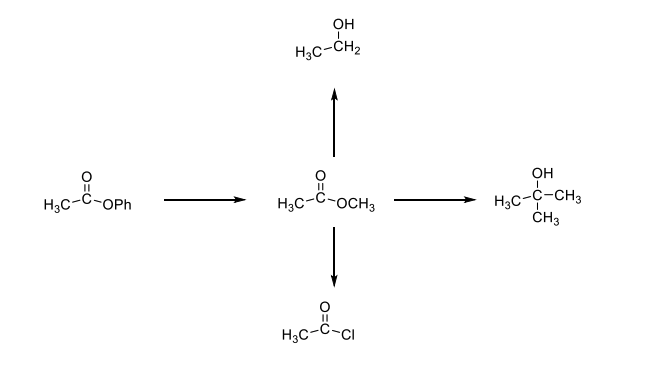
Таким образом, возможно четыре варианта названия одного и того же эфира:
Изомерия сложных эфиров одноосновных карбоновых кислот
Для сложных эфиров карбоновых кислот характерны следующие виды изомерии:
1. Изомерия углеродной цепи (углеродного скелета) начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —С(О)—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия с карбоновыми кислотами, например, изомером метилацетата является пропановая кислота:
Ch4COOCh4 метилацетат и Ch4−Ch3COOH пропановая кислота. Общая формула C3H6O2.
Общая формула C3H6O2.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и геометрическая (цис-, транс-) изомерия.
Физические свойства сложных эфиров карбоновых кислот
Сложные эфиры низших карбоновых кислот и простейших спиртов — бесцветные летучие жидкости, часто с приятным фруктовым запахом; сложные эфиры высших карбоновых кислот — твердые бесцветные воскообразные вещества, практически лишенные запаха, их температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
Химические свойства сложных эфиров карбоновых кислот
1. Гидролиз (омыление) сложных эфиров — основное химическое свойство. Гидролиз протекает с расщеплением сложных эфиров под действием воды. Эта обратная реакция для реакции этерификации. Реакция протекает как в кислой (катализаторы реакции – протоны Н+), так и в щелочной среде (катализаторы реакции – гидроксид-ионы ОН –).
Реакция протекает как в кислой (катализаторы реакции – протоны Н+), так и в щелочной среде (катализаторы реакции – гидроксид-ионы ОН –).
В присутствии щелочи реакция необратима, т.к. происходит омыление – образование солей карбоновых кислот.
2. Реакция восстановления. При восстановлении водородом сложных эфиров образуется смесь двух спиртов:
3. Взаимодействие с аммиаком. При взаимодействии сложных эфиров с аммиаком образуется амид соответствующей кислоты и спирт:
Сложные эфиры карбоновых кислот в природе
Сложные эфиры входят в состав эфирных масел многих растений и фруктов, придавая им специфический приятный запах:
В значительных количествах сложные эфиры представлены в природе восками. Основа природных восков — эфиры высших одноосновных кислот и высших одноатомных спиртов. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
Ch4(Ch3)14−C(O)−O−C31H63
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Многие сложные эфиры используются в качестве растворителей, например этилацетат, который используется в качестве растворителя лаков и красок, в органическом синтезе, а также при изготовлении лекарственных средств.
Сложные эфиры непредельных спиртов используются для изготовления лаков и красок, так как вступают в реакции присоединения по двойной связи и образуют полимеры. Например, винилацетат — сложный эфир уксусной кислоты и винилового спирта Ch4−C(O)−O−CH=Ch3 при полимеризации образует поливинилацетат, который используется для изготовления кожезаменителя, его еще называют винилкожей или дермантином.
Методы получения сложных эфиров карбоновых кислот
1. Реакция этерификации см. Хим. свойства карбоновых кислот
2. Получение из солей кислот и галогенпроизводных
Сложные эфиры могут быть получены из солей кислот при действии на них галогенпроизводных. Например, из ацетата серебра и хлористого этила можно получить этилацетат:
Ch4C(O)OAg+Ch4−Ch3Cl⟶Ch4C(O)−O−Ch3Ch4+AgCl↓
Данная реакция необратима и эфир получается с хорошим выходом. В этом заключается преимущество метода перед методом этерификации.
3. Получение из хлорангидридов кислот и алкоголятов
Метод аналогичен предыдущему:
Ch4C(O)Cl+Ch4−Ch3−ONa⟶Ch4C(O)−O−Ch3Ch4+NaCl
4. Получение из ангидридов кислот
При действии спиртов на ангидриды кислот также достигаются хорошие выходы сложных эфиров:
(Ch4CO)2O+Ch4OH⟶Ch4C(O)O−Ch4+Ch4C(O)OH
Жиры и масла
Жиры (триглицериды) — природные органические соединения, представляющие собой полные сложные эфиры трехатомного спирта глицерина и одноосновных высших или средних жирных (предельных) кислот.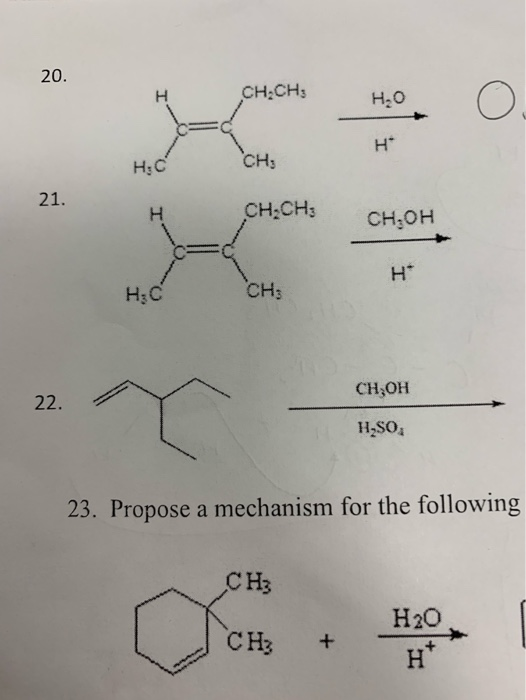
Жидкие жиры растительного происхождения называются маслами и представляют собой сложные эфиры глицерина и высших непредельных кислот .
Жиры являются главной составной частью животных жиров и растительных масел, присутствуют во всех животных и многих растительных тканях, особенно в семенах масличных культур (подсолнечника, оливы, всех орехов), входят в состав клеточных мембран и обеспечивают энергетический баланс в живых организмах. Для человека и многих животных являются одним из основных питательных компонентов.
Животные жиры при нормальных условиях — твердые вещества, имеющие невысокие температуры плавления. Животные жиры входят не только в состав жировой ткани, но также в больших количествах присутствуют в молоке и молочных продуктах (твороге, сметане, сыре, сливочном масле).
Строение жиров
Запомнить! Природные жиры содержат в своём составе три кислотных радикала (одинаковых или разных), имеющих неразветвлённую структуру и, как правило, чётное число атомов углерода.
Природные жиры чаще всего содержат следующие жирные кислоты:
1. Предельные (насыщенные):
стеариновая (C17h45COOH)
маргариновая (C16h43COOH)
пальмитиновая (C15h41COOH)
капроновая (C5h21COOH)
масляная (C3H7COOH)
2. Непредельные (ненасыщенные) алкеновые:
пальмитолеиновая (C15h39COOH),
олеиновая (CC17h43COOH)
3. Непредельные алкадиеновые кислоты:
Растительные масла, характеризующиеся большим содержанием полиненасыщенных жирных кислот (льняное, конопляное, маковое, тунговое масло), известны под названием высыхающих масел, так как под действием кислорода воздуха они полимеризуются и затвердевают.
Физические свойства
Жиры и масла хорошо растворяются в органических растворителях — бензоле, хлороформе, эфире, сероуглероде, петролейном эфире, горячем спирте (в холодном — труднее), ацетоне и не растворяются в воде. При опадании в воду они образуют два несмешивающихся слоя, причем поскольку плотность масел меньше плотности воды, то масло всегда будет в верхнем слое.
Жиры и масла гидрофобны, то есть не смачиваются водой, но при попадании на водную поверхность с неограниченной площадью (например, в реку или озеро), образуют на поверхности тонкую пленку, что обусловлено наличием сил поверхностного натяжения. При добавлении к жирам, находящимся в воде, поверхностно-активных веществ (ПАВ) — детергентов они способны образовывать стойкие гетерогенные системы — жировые эмульсии. Это свойство используется для приготовления мазей и кремов. Масла при взбивании с водой также способны образовывать эмульсии, примером такой гетерогенной системы является майонез.
Химические свойства жиров
Нейтральные жиры вступают во все химические реакции, свойственные сложным эфирам (продуктам замещения атомов водорода в ОН-группах минеральных или карбоновых кислот).
1. Жиры вступают в реакцию омыления (гидролиза), в результате которой из триглицеридов образуются глицерин и жирные кислоты. Омыление жиров может происходить как при каталитическом гидролизе, так и при действии на жиры кислот или щелочей. При щелочном гидролизе образуются мыла (подробно см. тему «Мыла»)
2. Присоединение по двойным связям. Для получения из растительных масел жиров более твердой консистенции, использующихся в качестве жировой основы при производстве маргаринов, применяется гидрогенизация (гидрирование), т.е. насыщение молекул этих масел водородом.
3. При хранении, особенно на свету и при свободном доступе воздуха, жиры приобретают неприятный вкус — прогоркают. Установлено, что в прогоркании жиров главную роль играет химический процесс — окисление ненасыщенных жирных кислот кислородом воздуха. Получающиеся при этом перекиси разлагаются с образованием альдегидов.
При хранении, особенно на свету и при свободном доступе воздуха, жиры приобретают неприятный вкус — прогоркают. Установлено, что в прогоркании жиров главную роль играет химический процесс — окисление ненасыщенных жирных кислот кислородом воздуха. Получающиеся при этом перекиси разлагаются с образованием альдегидов.
Прогоркание может быть обусловлено и биохимическими процессами, протекающими под воздействием содержащихся в белках ферментов (липаз), при этом происходит гидролиз жиров и образование свободных жирных и ненасыщенных жирных кислот, которые окисляются затем до β-кетокислот (так называемое кетонное прогоркание жиров).
Задание для самостоятельного выполнения:
Назвать сложные эфиры:
Пропионовая кислота, структурная формула, химические, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Видео с вопросами: Идентификация молекулы, не являющейся изомером функциональной группы
Стенограмма видео
Какая из следующих структур не является изомером функциональной группы C3H6O2? Ниже приведены пять структурных формул.
В этом вопросе нам представлены молекулярные структуры пяти различных молекул. И нам нужно определить, какая из молекул не является изомером функциональной группы C3H6O2. Прежде всего, функциональная группа — это часть молекулы, состоящей из определенных атомов с определенным расположением связей. Функциональные группы склонны вести себя определенным, предсказуемым образом. Например, молекулы с одной и той же функциональной группой могут иметь сходные физические и химические свойства. Изомеры функциональных групп представляют собой молекулы с одинаковой молекулярной формулой, но разными функциональными группами.
Чтобы решить эту проблему, мы должны изучить каждую структурную формулу, чтобы определить присутствующие функциональные группы и написать молекулярную формулу. Молекула, не имеющая указанной молекулярной формулы, не является функциональным изомером C3H6O2. Начнем с молекулы (А). Функциональной группой в этой молекуле является карбоксильная группа, что означает, что молекула представляет собой карбоновую кислоту. Название этой карбоновой кислоты — пропановая кислота. В этом видео мы не будем останавливаться на названиях карбоновых кислот, но мы можем понять, что стебель указывает на то, что в углеродной цепи присутствуют три атома углерода. Кроме того, в названиях всех карбоновых кислот используется суффикс -овая плюс слово кислота.
Молекула, не имеющая указанной молекулярной формулы, не является функциональным изомером C3H6O2. Начнем с молекулы (А). Функциональной группой в этой молекуле является карбоксильная группа, что означает, что молекула представляет собой карбоновую кислоту. Название этой карбоновой кислоты — пропановая кислота. В этом видео мы не будем останавливаться на названиях карбоновых кислот, но мы можем понять, что стебель указывает на то, что в углеродной цепи присутствуют три атома углерода. Кроме того, в названиях всех карбоновых кислот используется суффикс -овая плюс слово кислота.
Теперь определим молекулярную формулу этой молекулы. В этой молекуле три атома углерода, шесть атомов водорода и два атома кислорода. Следовательно, его молекулярная формула C3H6O2. Поскольку эта молекулярная формула такая же, как и в вопросе, эта молекула является изомером.
Молекула (B) содержит две функциональные группы: альдегидную функциональную группу и спиртовую функциональную группу, известную как гидроксильная группа. Название этой молекулы — 3-гидроксипропаналь. В этом названии гидрокси указывает на наличие гидроксильной группы, причем эта группа расположена на третьем атоме углерода в углеродной цепи, а окончание А-L означает наличие альдегидной группы. Молекула содержит три атома углерода, шесть атомов водорода и два атома кислорода. Следовательно, как и молекула (А), он имеет молекулярную формулу C3H6O2. Однако, поскольку эта молекула имеет другие функциональные группы, чем молекула (А), она является изомером функциональной группы.
Название этой молекулы — 3-гидроксипропаналь. В этом названии гидрокси указывает на наличие гидроксильной группы, причем эта группа расположена на третьем атоме углерода в углеродной цепи, а окончание А-L означает наличие альдегидной группы. Молекула содержит три атома углерода, шесть атомов водорода и два атома кислорода. Следовательно, как и молекула (А), он имеет молекулярную формулу C3H6O2. Однако, поскольку эта молекула имеет другие функциональные группы, чем молекула (А), она является изомером функциональной группы.
Молекула (C) также имеет две функциональные группы: карбоксильную группу и двойную углерод-углеродную связь. Название этой молекулы — 2-пропеновая кислота, хотя ее также часто записывают как проп-2-еновая кислота. В любом случае, E-N в названии указывает на наличие двойной связи углерод-углерод в углеродной цепи, а цифра два говорит нам о том, что двойная связь углерод-углерод начинается со второго атома углерода в углеродной цепи. . Мы также можем признать здесь, что суффикс -oic плюс слово кислота говорит нам, что молекула представляет собой карбоновую кислоту.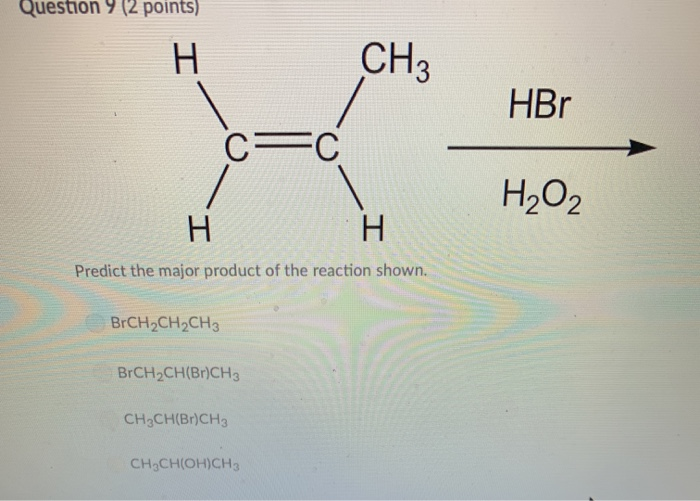 Молекула содержит три атома углерода, четыре атома водорода и два атома кислорода. Следовательно, его молекулярная формула C3h5O2. Эта молекулярная формула отличается от той, что указана в вопросе. Следовательно, эта молекула не может быть изомером функциональной группы C3H6O2.
Молекула содержит три атома углерода, четыре атома водорода и два атома кислорода. Следовательно, его молекулярная формула C3h5O2. Эта молекулярная формула отличается от той, что указана в вопросе. Следовательно, эта молекула не может быть изомером функциональной группы C3H6O2.
Давайте рассмотрим молекулы (D) и (E), чтобы выяснить, почему они являются изомерами функциональных групп C3H6O2. Молекула (D) имеет в общей сложности три функциональные группы, две гидроксигруппы и одну углерод-углеродную двойную связь. Название этой молекулы — пропен-1,1-диол, хотя его также часто записывают как проп-1-ен-1,1-диол. Молекула (Е) имеет сложноэфирную функциональную группу, и ее название можно записать как метилэтаноат или метилацетат. Правила именования этих молекул выходят за рамки этого видео. Более важно признать, что обе эти молекулы имеют молекулярную формулу, указанную в вопросе, поэтому они должны быть изомерами функциональных групп C3H6O2.
Таким образом, все молекулы в этом вопросе различаются типами присутствующих функциональных групп. Однако только молекула (C) не имеет молекулярной формулы C3H6O2. Поскольку молекула (C) имеет другую молекулярную формулу, она не является изомером функциональной группы C3H6O2.
Однако только молекула (C) не имеет молекулярной формулы C3H6O2. Поскольку молекула (C) имеет другую молекулярную формулу, она не является изомером функциональной группы C3H6O2.
C3H6O2 изомеры молекулярной формулы C3H6O2 структурные изомеры изомеры углеродной цепи структурная формула скелетная формула сложных эфиров карбоновых кислот Химия продвинутого уровня Doc Brown для AQA Edexcel OCR Salters IB Курсы с отличием США
C3H6O2 изомеры молекулярной формулы C3H6O2 структурные изомеры изомеры углеродной цепи структурная формула скелетная формула сложных эфиров карбоновых кислот Примечания к пересмотру химии продвинутого уровня Doc Brown для AQA Edexcel OCR Salters IB Курсы с отличием СШАГЛАВНАЯ СТРАНИЦА * KS3 НАУКИ * GCSE БИОЛОГИЯ ХИМИЯ ФИЗИКА* ПРОДВИНУТЫЙ УРОВЕНЬ ХИМИЯ
Расширенный уровень органической химии ЧАСТЬ 14.7: Структурные изомеры молекулярной формулы C 3 H 6 O 2
Прокрутите вниз и возьмите
время для изучения содержания и/или перехода по ссылкам или [Используйте поиск по сайту
коробка] 07. 13.2022
13.2022
| Дока Брауна Продвинутая химия: Часть 14.7 карбоновый кислотные и сложноэфирные структурные изомеры молекулярной формулы С 3 Н 6 О 2 электронный документ коричневый — комментарии — запрос? Используйте мобильный телефон или iPad и т. д. в альбомной ориентации это БОЛЬШОЕ веб-сайт, вам нужно потратить время, чтобы изучить его[ ПОИСК КОРОБКА]См. также Примеры влияния изомерии на сходство или различие в физико-химических свойствах структурных изомеров и Примеры сравнения физического и химические свойства R/S ( оптических ) изомеров (энантиомеров) 3 алифатические структурные изомеры карбоновых кислот и сложных эфиров молекулярной формулы С 3 Н 6 О 2 (М р = 74)
Ассоциированные ссылки Индекс наборов изомеров для данного молекулярная формула Молекулярная структура и названия КАРБОНОВЫХ КИСЛОТ и ПРОИЗВОДНЫХ, в том числе изомеры УКАЗАТЕЛЬ ВСЕХ примечаний к редакции химия КАРБОНОВЫХ КИСЛОТ и ПРОИЗВОДНЫХ Изомерия: введение, структурная изомерия — цепная, позиционная, функциональная группа, таутомерия Стереоизомерия: введение, определение, правила приоритета, E/Z-изомерия ( цис/транс-изомерия ) Стереоизомерия — изомерия R/S ( оптическая изомерия ) — определение — пояснение примеров Ключевые слова или фразы: сколько изомеров там молекулярной формулы C3H6O2? как назвать изомеры молекулярная формула C3H6O2? какова молекулярная структура изомеры C3H6O2, какой тип изомерии проявляют молекулы формулы C3H6O2, как вы определяете изомеры молекулярных формула C3H6O2, какие структурные изомеры C3H6O2, углеродная цепь изомеры C3H6O2 в гомологическом ряду алканов, сравнивая спектры изомеров молекулярной формулы C3H6O2 сколько структурных изомеров C3H6O2 умеешь рисовать? сколько структурных изомеров имеет C3H6O2? каковы возможные изомеры C3H6O2? примечания к редакции изомерия молекул C3H6O2, изомерия в алифатические карбоновые кислоты, изомерия в алифатических эфирах, карбоновая кислота изомеры C3H6O2, изомеры сложных эфиров C3H6O2, молекулярная структура изомеры C3H6O2 как нарисовать структурную формулу изомеров C3H6O2, как составить нарисуйте отображаемую формулу изомеров C3H6O2, как нарисовать скелетная формула изомеров C3H6O2, как назвать изомеры молекулярной формулы C3H6O2 Р/С оптические изомеры энантиомеры C3H6O2 E/Z-изомеры цис-транс-стереоизомеры C3H6O2, изомеры C3H6O с молекулярной массой 74 |
Дока Брауна Химия * |
| Введите химические слова, например. |

 3 -СН(ОН)-СН (имеет центральный хиральный углерод и проявляет изомерию R/S)
3 -СН(ОН)-СН (имеет центральный хиральный углерод и проявляет изомерию R/S) Фил Браун 2000+. Все авторские права защищены на примечания к редакции, изображения,
викторины, рабочие листы и т. д. Копирование материалов веб-сайта НЕ
разрешенный. Резюме пересмотренных экзаменов и ссылки на спецификации курса естественных наук
являются неофициальными.
Фил Браун 2000+. Все авторские права защищены на примечания к редакции, изображения,
викторины, рабочие листы и т. д. Копирование материалов веб-сайта НЕ
разрешенный. Резюме пересмотренных экзаменов и ссылки на спецификации курса естественных наук
являются неофициальными.