Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
ПОМОГИТЕ С ФИЗИКОЙ, СРОЧНО, ПОЖАЛУЙСТА!!! С ОБЪЯСНЕНИЯМИ, ПОЖАЛУЙСТА!
Решено
СРОЧНО! ПОЖАЛУЙСТА, ПОМОГИТЕ (С ОБЪЯСНЕНИЯМИ) 3 вопрос На рисунке FD = FB, FC = AF. В силу какого признака рав. треуг. baf = dcf?(см рис)
Пытаемся с другом добиться успеха в деле, но создается ощущение, что нас прокляли/навели порчу.
Решено
Помогите пожалуйста решить данные интегралы, очень срочно нужная помощь пожалуйста
Помогите пожалуйста решить
Пользуйтесь нашим приложением
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/FTtp-vAv3lI» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/7LD4euDcivY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ZfNUaigadEY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
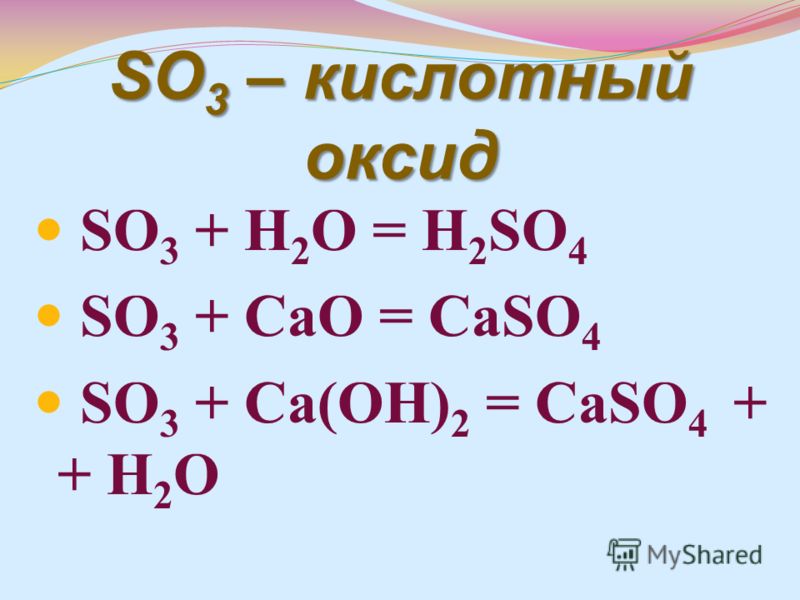
Здійсніть наступні перетворення: Ca-CaSo4-Ca(OH)2-CaO-Ca-… -reshimne.ru
Новые вопросы
Ответы
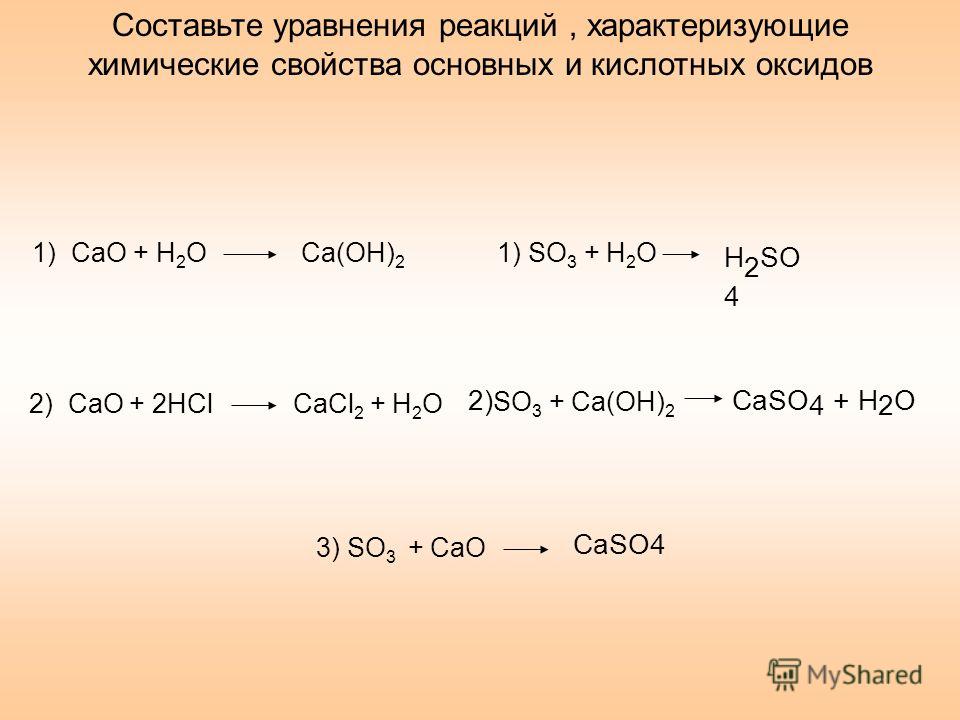
Ca+h3SO4=CaSO4+h3-замещение
CaSO4+Ba(OH)2=Ca(OH)2+BaSO4-обмен
Ca(oh)2=CaO+h3O-разложение
CaO+h3=Ca+h3О-замещение
Ca+Cl2=CaCl2-соединение
Похожие вопросы
Li2SIO3 какая соль кислая или средняя или какая. ..
..
1800 г глюкозы подвергли брожению. Сколько г этанола при этом образовалось?…
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl…
Составить уравнение реакции по схеме: неметалл->оксид неметалла->кислота…
Srohcl что это из химии за соль…
До розчину масою 500грам з масовою часткою солі 5%додпли 250грам води.Визначте масову частку речовин в отриманому розчині.Пожалуйста решите.Заранее огромное спасибо!…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
| Часть 1 1 В качественном анализе для обнаружения ионов стронция используют так называемую гипсовую воду. Гипсовая вода – это: A *насыщенный водный раствор CaSO4 B раствор Ca(ОН)2; C насыщенный раствор CO2 в воде; D раствор Ba(NO3)2 в воде E раствор Ва(ОН)2 2 В качественном анализе характерной реакцией на катионы серебра является: A *реакция образования сероватого осадка AgCl, растворяющегося в растворе аммиака, который разрушается НNО3. B реакция образования сероватого осадка АgCl, растворяющегося в кислотах C реакция образования комплекса, разрушающегося в растворе HNO3 D реакция образования осадка, растворяющегося в растворе щелочи E реакция образования желтого осадка, растворяющегося в избытке аммиака.. 21 Исследуемая смесь содержит катионы Mg2+, Ni2+, Со2+. A * Диметилглиоксима. B Аммиака. C 1-нитрозо-2-нафтола. D Магнезону-1. E Ализарина. 22 Как отделить PbSO4 от смеси сульфатов катионов ІІІ аналитической группы при систематическом анализе? A *обработкой осадка 30% раствором аммоний ацетата B перекристаллизацией осадка. C обработкой осадка концентрованной сульфатной кислотой D обработкой осадка раствором ацетатной кислоты E обработкой осадка раствором аммиака. 36 Какой катион находятся в растворе, если при нагревании со щелочью выделяется газ с резким запахом? A *Аммония B Серебра(І) C Ртути(II) D Ртути(I) E Свинца(ІІ) 37 Какой катион III аналитической группы (кислотно-основная классификация) находится в растворе, если при нагревании с гипсовой водой через некоторое время раствор мутнеет? A Стронция B Кальция C Магния D Свинца(II) E Ртути(II) 38 На раствор, полученный после обработки осадка хлоридов катионов II группы горячей водой, подействовали раствором калия дихромата. A Свинца(II) B Ртути(II) C Бария D Серебра(І) E Кальция 39 Какие катионы ІV аналитической группы (кислотно-основная классификация) при нагревании с избытком раствора щелочи и пероксидом водорода осадка не образуют, но раствор приобретает желтую окраску? A Хрома(III) B Олова(II) C Олова(IV) D Цинка E Алюминия 40 Какой катион V аналитической группы (кислотно-основная классификация) находится в растворе, если при действии раствора хлорида олова (II) в щелочной среде выпадает черный осадок? A *Висмут(III) B Железо(II) C Марганец(II) D Сурьма(III) E Железо(III) 41 Какие анионы с раствором серебра(І) нитрата образуют осадок, растворимый в 12%-ом растворе аммония карбоната ? A Хлорид-ионы B Бромид-ионы C Сульфид-ионы D Иодид-ионы E Тиоцианат-ионы 48 Катионы кальция входят в состав некоторых фармацевтических препаратов. A *Аммония оксалата B Кислоты хлороводородной C Калия йодида D Аммония гидроксида E Натрия гидроксида 54 В качественном анализе специфическим реагентом на катионы Fe2+ является: A *K3[Fe(CN)6] B K2Na[Co(NO2)6] C NaOH D K4[Fe(CN)6] E NH4OH 77 С какой целью, наряду с использованием группового реактива ІІІ аналитической группы, используют этиловый спирт? A * Для обеспечения полноты осаждения всех катионов этой группы B Для дальнейшего растворения образованных осадков. C Для дробного осаждения катионов D Для изменения рН среды E Для предупреждения комплексообразования. 80 Какой аналитический эффект необходимо ожидать от действия калий гексацианоферрата(ІІ) на катионы Са2+: A *Образование белого мелкокристаллического осадка B Образование желто-зеленых кристаллов C Коричневое окрашивание раствора D Образование комплексного соединения синего цвета E Образование белого аморфного осадка 81 К V аналитической группе катионов относятся ионы Mn2+. Качественной реакцией для этих катионов являются: A *Окисление в кислой среде B Взаимодействие с Fe3+ в кислой среде C Действие щелочей D Действие кислот E Образование нерастворимых комплексов 95 Для связывания ионов водорода при идентификации ионов калия с винной кислотой используют раствор A *Ацетата натрия B Гидроксида натрия C Аммиака D Серной кислоты E Соляной кислоты 104 Для отделения катионов 6 аналитической группы от катионов 5 аналитической группы (кислотно-основная классификация) используют: A * Избыток раствора аммиака B Избыток раствора гидроксида натрия C Избыток раствора серной кислоты D Раствор уксусной кислоты E Раствор аргентум нитрата 108 При добавлении к неизвестной смеси раствора натрий гидроксида и раствора пероксида водорода, появился осадок, который исчезает после прибавления избытка этих веществ. A *IV B V C VI D II E III 112 Укажите причину переосаждения сульфатов катионов ІІІ аналитической группы (кислотно-основная классификация) в карбонаты при систематическом анализе: A *Нерастворимость сульфатов в кислотах и щелочах B Нерастворимость сульфатов в воде C Растворимость сульфатов в воде D Растворимость сульфатов в кислотах E Растворимость сульфатов в щелочах 116 В водном растворе находятся катионы V аналитической группы (кислотно-основная классификация). При разбавлении раствора образовался белый аморфный осадок. Какие катионы легко образуют продукты гидролиза? A *Катионы бисмута и стибия B Катионы феррума(ІІІ) C Катионы магния D Катионы мангана E Катионы феррума(ІІ) 120 Укажите катионы в растворе, если при добавлении к нему реактива Чугаева и аммиачного буферного раствора образуется красно-малиновый осадок: A Катионы никола B Катионы алюминия C Катионы купрума D Катионы кобальта E Катионы феррума 121 С какой целью в систематическом ходе анализа катионов ІV группы вместе с групповым реагентом добавляют пероксид водорода: A *Для образования гидроксо- и оксоанионов этих элементов в высших степенях окисления B Для образования гидроксо- и оксоанионов этих элементов в низших степенях окисления C Для более полного осаждения этих катионов D Для образования пероксидных соединений этих катионов E Для разрушения гидратных комплексов 126 К III аналитической группе катионов по кислотно-основной классификацией относятся такие катионы: A *кальций, стронций, барий B алюминий, магний, цинк C калий, барий, бисмут D аргентум, плюмбум, никол E цинк, алюминий, хром 127 К II аналитической группе катионов по кислотно-основной классификацией относятся такие катионы: A *аргентум, плюмбум, меркурий(І) B кальций, стронций, барий C алюминий, магний, цинк D цинк, алюминий, хром E калий, барий, бисмут 128 К IV аналитической группе катионов по кислотно-основной классификацией относятся такие катионы: A * алюминий, цинк, хром(II),станум(ІІ), станум(IV), арсен(III), арсен(V) B кальций, стронций, барий, калий, барий, бисмут C магний, кальций, стронций, барий D аргентум, плюмбум, никол, калий, барий, бисмут E натрий, калий, аммоний, аргентум, плюмбум 129 Почему катионы I аналитической группы (кислотно-основная классификация) не имеют группового реагента? A * большинство их солей растворимы в воде B имеют близкие ионные радиусы C имеют большие ионные радиусы D имеют способность образовывать растворимые основания E относятся к биологически важным элементам 130 К первой аналитической группе анионов относятся анионы, которые образуют не растворимые в воде соли: A * барий B плюмбум C аммоний D бисмут E меркурий 42 Какие анионы с солями железа (II) в присутствии концентрированной серной кислоты образуют бурое кольцо? A *Нитрат-ионы B Ацетат-ионы C Бромат-ионы D Цитрат-ионы E Тиоцианат-ионы 43 Определение галогенид-ионов по методу Фольгарда следует проводить: A *В азотнокислой среде B В уксуснокислой среде C В нейтральной среде D В слабощелочной среде E В сильно щелочной среде 109 Фармакопейной реакцией определения бензоат-ионов является взаимодействие с раствором: A * феррум(III)хлорида B калий хлорида C резорцина D уксусного ангидрида E дифениламина 110 Раствором какого вещества можно определить наличие хлорид-ионов в питьевой воде? A * аргентум нитрата B йода C бромата калия D натрий гидроксида E аммиака 122 Фармакопейной реакцией на фосфат-ионы является действие магнезиальной смеси. A *MgCl2, NH3*H2O, NH4Cl B MgCl2, NaOH, NaCl C MnCl2, NH3*H2O, NaCl D MgCl2, MnSO4, NH4Cl E MgCl2, NH4Cl Часть 2 1 Групповым реактивом на катионы VI аналитической группы (кислотно-основная классификация) Со2+, Ni2+ Cd2+, Cu2+, Hg2+ является избыток концентрированного аммоний гидроксида. При этом наблюдается: A *Образование растворимых в воде аммиачных комлексных соединений. B Образование гидроксидов катионов, растворимых в кислотах. C Образование окрашенных, нерастворимых в воде веществ. D Образование гидроксидов катионов, растворимых в щелочах. E Образование гидроксидов катионов, не растворимых в избытке аммоний гидроксида. 6 Как общее свойство соединений катионов Al3+, Zn2+, Cr3+, Sn2+ объединяет их в IV аналитическую группу (кислотно-основная классификация)? A *Амфотерность гидроксидов. B Нерастворимость солей в воде. C Хорошая растворимость некоторых солей. D Растворимость гидроксидов в кислотах. E Растворимость гидроксидов в избытке раствора аммиака. 18 Для определения качественного состава препарата на образец исследуемого раствора подействовали раствором с С(HCl)=2 моль/л. Выпал белый осадок, растворимый в водном растворе аммиака. На присутствие каких катионов указывает этот аналитический эффект: A *Аргентума (І). B Плюмбума (ІІ). C Меркурия (І). D Меркурия (ІІ). E Станума (ІІ). 21 В растворе присутствуют катионы кальция, бария, алюминия, калия, натрия. К ратвору добавили небольшое количество гидроксида аммония и раствор ализарина. Образовался красный осадок. Какой ион обнаружили этой реакцией? A * Алюминия. B Кальция. C Бария. D Калия. E Натрия. 22 При действии диметилглиоксима на раствор, содержащего катионы VI аналитической группы (кислотно-основная классификация) наблюдали малиновое окрашивание осадка. Какой катион обусловил этот аналитический эффект? A * Катион никеля (II) B Катион меркурия (II) C Катион купрума (II) D Катион кадмия (II) E Катион кобальта (II) 23 При обнаружении анионов в растворе дробным методом провели реакцию с антипирином – появилось изумрудно-зеленое окрашивание раствора. A *Нитрит-ион B Хромат-ион C Нитрат-ион D Бромид-ион E Йодид-ион 25 В лаборатории необходимо идентифицировать катион аммония. Можно использовать раствор: A *Реактива Несслера B Калий хромата. C Цинк уранилацетата. D Реактива Чугаева. E Натрий сульфата 28 К исследуемому раствору добавили раствор калий хромата. Выпал осадок желтого цвета, Не растворяющийся в уксусной кислоте. Это свидетельствует о присутствии в растворе катионов: A *Барий B Кальций C Натрий D Кобальт E Магний 31 К исследуемому раствору добавили хлороформ и по каплям хлорную воду. Хлороформный слой окрасился в желто-горячий цвет. A *Бромид-ионов . B Сульфит-ионов . C Сульфат-ионов . D Нитрат-ионов . E Йодид-ионов 45 К исследуемому раствору добавили раствор с С(HCl)=2моль/л. При этом образовался белый осадок, который при обработке раствором аммиака почернел. Какой катион присутствует в растворе: A * Hg22+ B Ag+ C Pb2+ D Ba2+ E Mg2+ 48 Характерной реакцией обнаружения катионов ртути (II) является реакция с калия йодидом. При проведении реакции наблюдают: A *Ярко-красный осадок . B Ярко-красный раствор . C Грязно-зеленый осадок . D Черный осадок . E Белый осадок . 51 Какая из указанных реакций определения катионов аммония является специфической? A Реакция с гидроксидами щелочных металлов при нагревании . B Реакция с калия гексагидроксоcтибатом. C Реакция с натрия гексанитрокобальтом(III) . D Реакция с калия тетрайодогидраргиратом (II) в щелочной среде . E Реакция с натрия гексанитрокобальтом(III) в кислой среде. 55 Для определения нитрат-анионов к иследуемому раствору добавили дифениламин. Какой аналитический эффект при этом наблюдается: A *Раствор синего цвета B Осадок желтого цвета. C Осадок синего цвета. D Выделение бурого газа. E Появление характерного запаха. . 56 Исследуемый раствор лекарственного вещества содержит анионы йодида, бромида, хлорида и сульфида. A *Аргентум нитрат в 2М нитратной кислоте. B Барий хлорид. C Барый нитрат. D Групповой реагент отсутствует. E Аргентум нитрат в нейтральной среде. 57 К исследуемому раствору добавили концентрированной азотной кислоты и кристаллический диоксид плюмбума. Раствор приобрел малиновый цвет. На присутствие какого катиона указывает этот аналитический эффектфект: A * Мангана (ІІ) B Бисмута (ІІІ) C Ферума (ІІІ) D Хрома (ІІІ) E Станума (ІІ) 58 К исследуемому раствору добавили раствор аммоний тиоцианата. Раствор окрасился в красный цвет. На присутствие какого катиона указывает этот аналитиеский эффект: A * Ферума (ІІІ) . B Меркурия (ІІ). C Аргентума . D Меркуріия (І). E Плюмбума (ІІ). 66 В растворе присутствуют анионы Cl-и Br-. Назовите реагент для обнаружения Br-: A * Хлорная вода B Бромная вода C Гипсовая вода D Известковая вода E Баритовая вода 67 К анализируемому раствору прибавили хлороформ и по каплям хлорную воду. Хлороформный слой окрасился в оранжевый цвет. Это свидетельствует о присутствии в растворе: A * Бромид -ионов B Йодид- ионов C Сульфит-ионов D Сульфат-ионов E Нитрат-ионов 68 К подкисленному анализируемому раствору прибавили хлороформ и раствор натрия нитрита. Хлороформный слой окрасился в красно-фиолетовый цвет. свидетельствует о присутствии в растворе: A * Йодид -ионов B Карбонат -ионов C Хлорид-ионов D Сульфат-ионов E Фторид-ионов 69 Раствор арсената натрия можно отличить от раствора арсенита с помощью следующего реактива: A * Магнезиальная смесь B Калия сульфата C Калия нитрата D Натрия хлорида E Натрия фторида 73 Сухой остаток, полученный после упаривания анализируемого раствора окрашивает бесцветное пламя горелки в желтый цвет, а при рассмотрении через синее стекло – в фиолетовый. Какие катионы находились в сухом остатке? A Na+, K+ B Сa2+ K+ C Na+ , Sr2+ D Li+, Ba2+ E Na+, Ca2+ 74 В растворе присутствуют катионы цинка и алюминия . A *Раствор калий гексацианоферата (ІІ). B Раствор натрий гидроксида. C Кобальт нитрат Со(NO3)2. D Избыток гидроксида натрия с С(NaОН)=6моль/л в присутствии пероксида водорода. E Раствор сульфатной кислоты. 75 В растворе, содержащем катионы купрум (ІІ) и цинка, катионы купрума можно определить с помощью избытка реагента: A * Раствора аммиака с С(NН3)=6моль/л B Раствора серной кислоты с С(Н2SO4)=2моль/л C Раствора калий гидроксида с С(КОН)=6моль/л D Раствора хлороводородной кислоты с С(НCl)=2моль/л E Раствора аммоний карбоната с С(NН4CО3)=2моль/л 78 Исследуемый раствор с раствором бария хлорида образовал белый осадок не растворимый ни в кислотах, ни в щелочах. A Бария сульфат B Бария сульфит C Бария карбонат D Бария оксалат E Бария фосфат 79 Исследуемый раствор образовал с раствором нитрата серебра белый творожистый осадок, растворимый в аммиаке. Укажите состав полученного осадка. A Серебра хлорид B Серебра бромид C Серебра йодид D Серебра роданид E Серебра сульфид 80 При добавлении аммиачного буферного раствора и раствора натрия гидрофосфата к анализируемому раствору образовался белый осадок. Это свидетельствует о присутствии ионов: A Магния B Алюминия C Мышьяка(ІІІ) D Хрома(ІІІ) E Калия 86 Для отделения катионов 6 аналитической группы от катионов 5 аналитической группы (кислотно-основная классификация) используют: A * Избыток раствора аммиака B Избыток раствора гидроксида натрия C Избыток раствора сульфатной кислоты D Раствор уксусной кислоты E Раствор аргентум нитрата 88 Наиболее селективной реакцией для определения катионов никеля является реакция взаимодействия с: A * Реактивом Чугаева B Раствором натрий гидроксида C Раствором калий гидроксида D Раствором сульфатной кислоты E Реактивом Несслера A *IV B V C VI D II E III 91 Фармакопейной реакцией определения бензоат-ионов является взаимодействие с раствором: A * Феррум(III)хлорида B Калий хлорида C Резорцина D Уксусного ангидрида E Дифениламина 92 Раствором какого вещества можно обнаружить присутствие хлорид-ионов в питьевой воде? A * Аргентум нитрата B Йода C Бромата калия D Натрий гидроксида E Аммиака 94 На анализ взяли раствор, в котором находятся катионы V аналитической группы (кислотно-основная классификация). A *Bi3+ B Fe2+ C Sb3+ D Fe3+ E Mg2+ 95 В водном растворе находятся катионы V аналитической группы (кислотно-основная классификация). При разбавлении раствора образовался белый аморфный осадок. Какие катионы легко образуют продукты гидролиза? A *Катионы бисмута и стибия B Катионы феррума(ІІІ) C Катионы магния D Катионы мангану E Катионы феррума(ІІ 99 Укажите, какие катионы присутствуют в растворе, если при прибавлении к нему реактива Чугаева и аммиачного буферного раствора образуется красно – малиновый осадок: A Катионы никеля B Катионы алюминия C Катионы купрума D Катионы кобальта E Катионы феррума 100 С какой целью в систематическом ходе анализа катионов ІV группы вместе с групповым реагентом прибавляют пероксид водорода: A *Для образования гидроксо- и оксоанионов этих элементов в максимальных степенях окисления B Для образования гидроксо- и оксоанионов этих элементов в минимальных степенях окисления C Для более полного осаждения этих катионов D Для образования пероксидных соединений этих катионов E Для разрушения гидратных комплексов 101 Фармакопейной реакцией на фосфат-ионы является действие магнезиальной смеси. A *MgCl2, NH3·H2O, NH4Cl B MgCl2, NaOH, NaCl C MnCl2, NH3·H2O, NaCl D MgCl2, MnSO4, NH4Cl E MgCl2, NH4Cl 105 К III аналитической группе катионов по кислотно-основной классификации относятся такие катионы: A *Кальций, стронций, барий B Алюминий, магний, цинк C Калий, барий, бисмут D Аргентум, плюмбум, никол E Цинк, алюминий, хром 106 Ко II аналитической группе катионов по кислотно-основной классификации относятся следующие катионы: A *Аргентум, плюмбум, меркурий(І) B Кальций, стронций, барий C Алюминий, магний, цинк D Цинк, алюминий, хром E Калий, барий, бисмут 107 К I аналитической группе катионов по кислотно-основной классификации относятся следующие катионы: A * Натрий, калий, аммоний B Кальций, стронций, барий C Аргентум, плюмбум, никол D Алюминий, магний, цинк E Калий, барий, бисмут 108 К IV аналитической группе катионов по кислотно-основной классификацией относятся следующие катионы: A * Алюминий, цинк, хром (II),станум (ІІ), станум (IV), арсен (III), арсен (V) B Кальций, стронций, барий, калий, барий, бисмут C Магний, кальций, стронций, барий D Аргентум, плюмбум, никол, калий, барий, бисмут E Натрий, калий, аммоний, аргентум, плюмбум 109 Почему катионы I аналитической группы (кислотно-основная классификация) не имеют группового реагента? A * Большинство их солей растворимы в воде B Имеют близкие ионные радиусы C Имеют большие ионные радиусы D Имеют способность образовывать растворимые основания E Принадежат к биологически важным элементам 110 К первой аналитической группе анионов принадлежат анионы, которые образуют нерастворимые в воде соли: A * Бария B Плюмбума C Аммония D Бисмута E Меркурия 111 Ко второй аналитической группе анионов принадлежат анионы, которые образуют нерастворимые в азотной кислоте соли: A * Аргентума B Меркурия C Аммония D Бисмута E Плюмбума 112 Почему анионы третьей аналитической группы анионов не имеют группового реагента? A * Большинство катионов образуют растворимые в воде соли B Имеют большие ионные радиусы C Имеют близкие ионные радиусы D Имеют способность образовывать растворимые кислоты E Относятся к токсичным элементам 117 В ходе анализа катионов IV аналитической группы (кислотно-основная классификация) при действии группового реагента можно не только отделить,но и идентифицировать ионы: A *Сr(III) B Аs(III) C Zn(II) D Sn(IV) E Al(III) 119 В ходе анализа катионов VI аналитической группы (кислотно-основная классификация) при действии группового реагента можно не только выделить группу, но и идентифицировать ионы: A *Cu(II) B Co(II) C Ni(II) D Hg(II) E Cd(II) 122 В фармакопейном анализе для идентификации ионов натрия используют реакцию с: A *2-метокси-2-фенилуксусной кислотой B 8-оксихинолином C Дифениламином D Диацетилдиоксимом E Тетрафенилборатом 123 Одинаковый аналитический эффект наблюдается при взаимодействии нитрат- и нитрит-ионов с: A *Дифениламином и концентрированной серной кислотой B Калий перманганатом C Раствором йода в калий йодиде D Раствором аргентум натрата E Раствором барий хлорида 124 При анализе анионов I-III аналитических групп систематический ход анализа необходим при совместном присутствии: A * сульфат-, сульфит-, тиосульфат- и сульфид-ионов B сульфат-, ацетат-, фосфат-ионов C сульфат-, нитрат-, хлорид-ионов D сульфат-, оксалат-, ацетат-ионов E суьфат-, арсенат-, нитрат-ионов 125 Химик-аналитик для идентификации катионов цинка(ІІ) использовал раствор реагента гексацианоферата(ІІ) калия (реакция фармакопейная). A *Белого B Желтого C Черного D Зеленого E Красного Каталог: 210 -> RUS -> test-krok -> KRoK%201%20RUS -> Analit%20Chimiya -> Analit%20Chimiya%20Rus жүктеу/скачать 301.45 Kb. Достарыңызбен бөлісу: |
Калциев сулфат (CaSO4): Химична структура, свойства, приложения — Наука
Видео: TOP 6 ХИМИЧЕСКИХ СОЕДИНЕНИЙ В МАЙНКРАФТ ПЕ 1. 2.20.1
2.20.1Съдържание
- Химическа структура
- Имоти
- Молекулярна формула
- Безводно молекулно тегло
- Миризма
- Външен вид
- Плътност
- Точка на топене
- Разтворимост
- Стабилност
- Приложения
- В строителството и в изкуството
- Терапевтични средства
- Ветеринарни
- Лекарство
- одонтология
- При преработката на храни
- Като тор и балсам за култури
- При производството на други съединения
- Препратки
The калциев сулфат Това е тройна сол на калций, алкалоземни метали (г-н Becambara), сяра и кислород. Химичната му формула е CaSO4, което означава, че за всеки Ca катион2+ има анион SO42- взаимодействайки с него. Това е съединение с широко разпространение в природата.
Химичната му формула е CaSO4, което означава, че за всеки Ca катион2+ има анион SO42- взаимодействайки с него. Това е съединение с широко разпространение в природата.
Най-разпространените му форми са CaSO42Н2O (гипс) и безводната форма CaSO4 (анхидритът). Съществува и трета форма: мазилка от Париж, произведена чрез нагряване на мазилката (хемидратът, CaSO41 / 2Н2ИЛИ). Долното изображение показва солидна порция от тази тройна сол, с белезникавия си вид.
Химическа структураГорното изображение показва орторомбичната единична клетка за CaSO4. Тук се приема, че взаимодействията са чисто електростатични; т.е. катионите Ca2+ привличат тетраедрични аниони SO42–.
Въпреки това, Ca2+ той е силно склонен да се координира, образувайки около него многостранни структури. За какво е това? Към електронната наличност на калция за приемане на електрони от основни или отрицателни видове (като O атомите на SO42–).
Като се има предвид предишната точка, сега йони Ca2+ Те приемат дативни връзки (предоставени от O) и единичната клетка се трансформира, както е показано на изображението по-долу:
Следователно се образува многогранник CaO8 (зелената сфера на Ca2+ заобиколен от осем червени сфери на O от SO тетраедрите4 наблизо).Калциеви полиедри и сулфатни тетраедри; това е кристалната структура на CaSO4 безводен.
Освен това, когато кристалите хидратират — образувайки дихидратираната сол или хемидрата (CaSO41/2 Н2O) — структурата се разширява, за да включи водните молекули.
Тези молекули могат да се интеркалират и координират с калция; т.е. заместват една или две сулфатни групи.
От друга страна, не цялата вода става част от CaO полиедър.8. Някои, от друга страна, образуват водородни връзки със сулфати. Те служат като връзка за две зигзагообразни секции, продукти от подреждането на йони в кристала.
CaSO4 · nh3O.
Безводно молекулно тегло136,134 g / mol.
МиризмаБез мирис.
Външен видВ случай на анхидрит, той прилича на бял прах или твърди орторомбични или моноклинни кристали. Кристалите са с променлив цвят: те могат да бъдат бели или със синкав, сивкав или червеникав оттенък; може да бъде и тухлено червено.
Плътност2,96 g / cm3 (безводна форма). 2,32 g / cm3 (дихидратна форма).
Точка на топене1450 ° C (2840 ° F). Характерно за силните електростатични взаимодействия между двувалентни Ca йони2+ И така42-.
Разтворимост0,2-0,3% във вода при 25 ° C. Той е слабо разтворим във вода и неразтворим в етанол.
СтабилностСтабилен при стайна температура.
ПриложенияВ строителството и в изкуствотоИзползва се при изработването на мазилка за размразяване на стените на домовете и други конструкции, които допринасят за нейното разкрасяване. Освен това релефите се правят с помощта на форми по таваните и дограмата. Мазилката също е в таваните.
Освен това релефите се правят с помощта на форми по таваните и дограмата. Мазилката също е в таваните.
Калциевият сулфат се използва за решаване на проблема, който възниква при хидратацията на бетона, като по този начин си сътрудничи при изграждането на пътища, алеи и др.
С гипса се правят скулптури, особено религиозни фигури, а в гробищата те се използват върху надгробни камъни.
Терапевтични средстваВетеринарниЕкспериментално стерилни парчета калциев сулфат са били използвани във ветеринарната медицина за възстановяване на костни дефекти или кухини, като тези, оставени от рани или тумори.
Гипсът от Париж може да се използва за възстановяване на костни дефекти поради уникалната му способност да стимулира остеогенезата. Рентгеновите изследвания и технециумът (Tc99m) медронат подкрепят използването на мазилката на Париж като алопластика и нейния остеогенен капацитет при имплантиране във фронталния синус.
Костната регенерация е демонстрирана при шест кучета за период от 4 до 6 месеца. Калциевият сулфат започва да се използва в тази област през 1957 г. под формата на мазилка от парижки таблетки, като може да запълни дефектите в костите на кучетата.
Калциевият сулфат започва да се използва в тази област през 1957 г. под формата на мазилка от парижки таблетки, като може да запълни дефектите в костите на кучетата.
Костната субституция на калциев сулфат е сравнима с тази, наблюдавана при автогенна кост.
Ruhaimi (2001) прилага калциев сулфат върху наскоро унищожена заешка челюстна кост, наблюдавайки увеличаване на остеогенезата и калцификацията на костите.
ЛекарствоКалциевият сулфат се използва в медицината за обездвижване на ставите, които са претърпели дислокации и при фрактури на кости, както и като помощно вещество при производството на таблетки.
одонтологияВ стоматологията се използва като основа за изработване на зъбни протези, при реставрации и отпечатъци на зъби.
При преработката на храниИзползва се като коагулант при производството на тофу, храна, направена от соя и широко консумирана в източните страни като заместител на месото. В допълнение, той се използва като стягащо средство за храна и за лечение на брашна.
В допълнение, той се използва като стягащо средство за храна и за лечение на брашна.
Гипс (CaSO42Н2O) се използва като тор в Европа от 18-ти век, като има предимството пред използването на вар като източник на калций с по-голяма подвижност.
Калцият трябва да е на разположение в корените на растенията за адекватно снабдяване. Така че добавянето на калций подобрява градинарските и фъстъчените култури.
Гниенето на фъстъчено коренче, причинено от биологични патогени, както и крайното гниене на диня и домати, се контролира частично с апликации от селскостопански гипс.
Гипсът помага да се намали разсейването на глината, което причинява образуването на корички в почвата. Чрез намаляване на образуваните на земята корички, мазилката улеснява излизането на разсад. Той също така увеличава навлизането на въздух и вода в земята.
Гипсът помага за подобряване на почвата, като смекчава киселинността и токсичността на алуминия, като по този начин адаптира културата към натриеви почви.
Калциевият сулфат реагира с амониев бикарбонат, образувайки амониев сулфат. Използва се и в процеса на производство на сярна киселина.
Безводният калциев сулфат се смесва с шисти или постно и при нагряване на сместа серен триоксид се отделя в газообразна форма. Сярният оксид е предшественик на сярната киселина.
Препратки- Smokefoot. (26 декември 2015 г.). Структура на CaSO4. [Фигура]. Получено на 6 май 2018 г. от: commons.wikimedia.org
- Таканори Фуками и др. (2015). Синтез, кристална структура и топлинни свойства на CaSO42Н2Или монокристали. Международен вестник по химия; Том 7, No2; ISSN 1916-9698 E-ISSN 1916-9701 Издадено от Канадския център за наука и образование.
- PubChem. (2018). Калциев сулфат. Получено на 6 май 2018 г. от: pubchem.ncbi.nlm.nih.gov
- Уикипедия. (2018). Калциев сулфат. Получено на 06 май 2018 г. от: en.wikipedia.
 org
org - Elsevier. (2018). калциев сулфат. Получено на 6 май 2018 г. от: sciencedirect.com
- Kimberlitesoftwares. (2018). Калциев сулфат. Получено на 6 май 2018 г. от: worldofchemicals.com
- Интагри. (2017). Ръководство за използване на селскостопанския гипс като подобрител на почвата. Получено на 6 май 2018 г. от: intagri.com
КАЛЬЦИЯ СУЛЬФАТ | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
| никто | данные недоступны | никто |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| Сульфат кальция |
| ||
NFPA 704
нет данных
Общее описание
Белый порошок без запаха или бесцветное кристаллическое твердое вещество. Кристаллы иногда имеют синий, серый или красноватый оттенок или могут быть кирпично-красными. Плотность: 2,96 г см-3.
Кристаллы иногда имеют синий, серый или красноватый оттенок или могут быть кирпично-красными. Плотность: 2,96 г см-3.
Опасности
Что это за информация?
Опасные поля включают специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп а также потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
нет
Реакции с воздухом и водой
Нет быстрой реакции с воздухом. Нет быстрой реакции с водой.
Пожароопасность
Информация отсутствует.
Опасность для здоровья
Выдержка из Карманного справочника NIOSH по сульфату кальция:
Пути воздействия: Вдыхание, контакт с кожей и/или глазами
Симптомы: Раздражение глаз, кожи, верхних дыхательных путей; конъюнктивит; ринит, носовое кровотечение (носовое кровотечение)
Органы-мишени: глаза, кожа, дыхательная система (NIOSH, 2022)
Профиль реакционной способности
КАЛЬЦИЯ СУЛЬФАТ негорюч. Разлагается с образованием токсичных оксидов серы, но только при очень высокой температуре (>1500°C). Обычно имеет низкую реакционную способность, но может действовать как окислитель: несовместим с диазометаном, алюминием и фосфором. Некоторые формы сульфата кальция реагируют с водой; другие нет. НЕРАСТВОРИМЫЙ АНГИДРИТ или обожженный гипс получают путем обезвоживания дигидрата сульфата кальция (гипса) при высокой (> 600°С) температуре. При комнатной температуре нерастворимый ангидрит очень медленно растворяется в количестве 0,24 г на 100 г воды и не поглощает влагу из воздуха. РАСТВОРИМЫЙ АНГИДРИТ, который получают нагреванием дигидрата сульфата кальция при температуре ниже 300°С, обладает высоким сродством к воде и используется как осушитель. Растворимый ангидрит поглощает воду с образованием полугидрата сульфата кальция (гипс).
Разлагается с образованием токсичных оксидов серы, но только при очень высокой температуре (>1500°C). Обычно имеет низкую реакционную способность, но может действовать как окислитель: несовместим с диазометаном, алюминием и фосфором. Некоторые формы сульфата кальция реагируют с водой; другие нет. НЕРАСТВОРИМЫЙ АНГИДРИТ или обожженный гипс получают путем обезвоживания дигидрата сульфата кальция (гипса) при высокой (> 600°С) температуре. При комнатной температуре нерастворимый ангидрит очень медленно растворяется в количестве 0,24 г на 100 г воды и не поглощает влагу из воздуха. РАСТВОРИМЫЙ АНГИДРИТ, который получают нагреванием дигидрата сульфата кальция при температуре ниже 300°С, обладает высоким сродством к воде и используется как осушитель. Растворимый ангидрит поглощает воду с образованием полугидрата сульфата кальция (гипс).
Принадлежит к следующей реакционной группе (группам):
- Основные соли
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по реагированию
Что это за информация?
Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Информация отсутствует.
Пожаротушение
Информация отсутствует.
Non-Fire Response
Информация отсутствует.
Защитная одежда
Выдержка из Карманного справочника NIOSH по сульфату кальция:
Кожа: Нет рекомендаций, указывающих на необходимость использования средств индивидуальной защиты для тела.
Глаза: Нет рекомендаций, указывающих на необходимость защиты глаз.
Мытье кожи: Нет рекомендаций, указывающих на необходимость смывания вещества с кожи (немедленно или в конце рабочей смены).
Снять: Нет рекомендаций, указывающих на необходимость снятия влажной или загрязненной одежды.
Смена: Нет рекомендаций, указывающих на необходимость смены работником одежды после рабочей смены. (НИОСХ, 2022 г.)
Ткани для костюмов DuPont Tychem®
Информация отсутствует.
Первая помощь
Выдержка из Карманного справочника NIOSH по сульфату кальция:
Глаза: НЕМЕДЛЕННО ПРОРОШЬТЕ — Если это химическое вещество попало в глаза, немедленно промойте (промойте) глаза большим количеством воды, время от времени поднимая нижнее и верхнее веко. Немедленно обратитесь за медицинской помощью.
Кожа: ПРОМЫВКА С МЫЛОМ — Если это химическое вещество попало на кожу, промойте загрязненную кожу водой с мылом.
Дыхание: СВЕЖИЙ ВОЗДУХ — Если человек вдыхает большое количество этого химического вещества, немедленно выведите пострадавшего на свежий воздух. Другие меры обычно не нужны. (НИОСХ, 2022 г.)
Физические свойства
Что это за информация?
Поля физических свойств
включают в себя такие свойства, как давление пара и
температура кипения, а также пределы взрываемости и
пороги токсического воздействия
Информация в CAMEO Chemicals поступает из различных источников. источники данных.
источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: 2840°F (Разлагается) (NIOSH, 2022)
Давление паров: 0 мм рт.ст. (приблизительно) (NIOSH, 2022)
Плотность паров (относительно воздуха): данные недоступны
Удельный вес: 2,96 (NIOSH, 2022)
Температура кипения: Разлагается (NIOSH, 2022)
Молекулярный вес: 136,1 (NIOSH, 2022)
Растворимость в воде: 0,3 % (НИОСХ, 2022 г.)
Энергия/потенциал ионизации: данные недоступны
IDLH: данные недоступны
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.
PAC (критерии защитных действий)
Информация о PAC отсутствует.Нормативная информация
Что это за информация?
Поля нормативной информации включить информацию из Сводный список III Агентства по охране окружающей среды США списки, Химический завод Агентства кибербезопасности и безопасности инфраструктуры США антитеррористические стандарты, и Управление по охране труда и здоровья США Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами (подробнее об этих источники данных).
Сводный перечень списков EPA
Отсутствует нормативная информация.
Антитеррористические стандарты CISA Chemical Facility (CFATS)
Отсутствует нормативная информация.
Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе приводится список альтернативных названий этого химического вещества, включая торговые названия и синонимы.
- А 30
- А 30 (СУЛЬФАТ)
- АНГИДРИТ
- КАЛЬЦИЯ СУЛЬФАТ БЕЗВОДНЫЙ
- БЕЗВОДНЫЙ ГИПС
- БЕЗВОДНЫЙ СУЛЬФАТ ИЗВЕСТИ
- КАЛЬЦИЯ СУЛЬФАТ ОСНОВНОЙ
- СА 5
- CA 5 (СУЛЬФАТ)
- КАЛЬЦИЕВАЯ СОЛЬ СЕРНОЙ КИСЛОТЫ
- КАЛЬЦИЯ СУЛЬФАТ
- КАЛЬЦИЯ СУЛЬФАТ (1:1)
- КАЛЬЦИЯ СУЛЬФАТ (CASO4)
- КАЛЬЦИЯ СУЛЬФАТ
- КАС 20
- КАС 20-4
- КРИЗАЛЬБА
- Д 101А
- Д 101А (СУЛЬФАТ)
- ГИПС ОБЖОЖЕННЫЙ
- ДЕНКА СИГМА 1000
- ДРИЕРИТ
- FRANKLIN FIBER H 45
- КАРСТЕНИТ
- МУРИАЦИТ
- ОПАРЭКС 10
- ОСТЕОСЕТ
- ССС-А
- КАЛЬЦИЕВАЯ СОЛЬ СЕРНАЯ КИСЛОТА
- КАЛЬЦИЯ СЕРНАЯ КИСЛОТА(2+) СОЛЬ (1:1)
- ТИОЛИТ
? => CaSO4 (сульфат кальция)
| Поиск |
= сульфат кальция
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
39 результатов найдено
Отображение уравнения от 1 до 5 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Double-replacement reaction
| png» substance-weight=»74.0927″> Ca(OH) 2 | + | Рекламное объявлениеДополнительная информация об уравнении Ca(OH)2 + H 2 SO 4 → 2H 2 O + CaSO 4В каких условиях Ca(OH)2 (гидроксид кальция) реагирует с h3SO4 (серная кислота) ?Для этого химического уравнения не найдено информации Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Как могут происходить реакции с образованием h3O (вода) и CaSO4 (сульфат кальция)?Кислотный раствор h3SO4 реагирует с Ca(OH) 2 Явление после взаимодействия Ca(OH)2 (гидроксида кальция) с h3SO4 (серной кислотой)Нажмите, чтобы увидеть явление уравнения Какую другую важную информацию вы должны знать о реакцииУ нас нет дополнительной информации об этой химической реакции. Категории уравненияНажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Другие вопросы, связанные с химическими реакциями Ca(OH)2 + H 2 SO 4 → 2H 2 O + CaSO 4Вопросы, связанные с реагентом Ca(OH)2 (гидроксид кальция)Каковы химические и физические характеристики Ca(OH)2 (гидроксид кальция)? В каких химических реакциях используется Ca(OH)2 (гидроксид кальция) в качестве реагента? Вопросы, связанные с реагентом h3SO4 (серная кислота)Каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента? Вопросы, связанные с продуктом h3O (вода)Каковы химические и физические характеристики h3O (серная кислота)? Каковы химические реакции, в результате которых образуется h3O (вода)? Вопросы, связанные с продуктом CaSO4 (сульфат кальция)Каковы химические и физические характеристики CaSO4 (серная кислота)? Каковы химические реакции, в которых CaSO4 (сульфат кальция) является продуктом? Рекламное объявление Уравнение Результат #2 Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Double-replacement reaction
Рекламное объявление Further information about equation Ca3 (PO 4 ) 2 + 3H 2 SO 4 → 3CaSO 4 + 2H 3 PO 4What is reaction condition of Ca3 (PO4)2 (фосфат кальция) реагирует с h3SO4 (серная кислота) ?Температура: температура Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Как могут происходить реакции с образованием CaSO4 (сульфат кальция) и h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)?Реакция конденсированной серной кислоты h3SO4 с фосфоритовой или апатитовой рудой Явление после реакции Ca3(PO4)2 (фосфат кальция) с h3SO4 (серная кислота)Нажмите, чтобы увидеть явление уравнения Какую другую важную информацию вы должны знать о реакцииКислоту h4PO4 отделяют от осадка CaSO4 фильтрованием и концентрируют. Кислота h4PO4, полученная этим методом, не является чистой. Категории уравненийНажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> 3 (PO 4 ) 2 + 3H 2 SO 4 → 3CaSO 4 + 2H 3 PO 4Каковы химические и физические характеристики Ca3(PO4)2 (фосфат кальция)? В каких химических реакциях используется Ca3(PO4)2 (фосфат кальция) в качестве реагента? Вопросы, связанные с реагентом h3SO4 (серная кислота)Каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента? Вопросы, связанные с продуктом CaSO4 (сульфат кальция)Каковы химические и физические характеристики CaSO4 (серная кислота)? Каковы химические реакции, в которых CaSO4 (сульфат кальция) является продуктом? Вопросы, связанные с продуктом h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)Каковы химические и физические характеристики h4PO4 (серная кислота)? В каких химических реакциях образуется h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)? Рекламное объявление Уравнение Результат #3 Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Дополнительная информация об уравнении CaF2 + H 2 SO 4 → CaSO 4 + 2HFВ каких условиях CaF2 (фторид кальция) реагирует с h3SO4 (серной кислотой)?Температура: 250°C Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Как могут происходить реакции с образованием CaSO4 (сульфат кальция) и HF (фтористый водород)?Florit реагирует с концентрированным h3SO4 Явление после взаимодействия CaF2 (фторида кальция) с h3SO4 (серной кислотой)Нажмите, чтобы увидеть явление уравнения Какую другую важную информацию вы должны знать о реакцииЭто единственный метод приготовления HF Категории уравненийНажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Другие вопросы, связанные с химическими реакциями CaF2 + H 2 SO 4 → CaSO 4 + 2HFВопросы, связанные с реагентом CaF2 (фторид кальция)6 Каковы химические и физические характеристики CaF2 (фторид кальция)? В каких химических реакциях используется CaF2 (фторид кальция) в качестве реагента? Вопросы, связанные с реагентом h3SO4 (серная кислота)Каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента? Вопросы, связанные с продуктом CaSO4 (сульфат кальция)Каковы химические и физические характеристики CaSO4 (серная кислота)? Каковы химические реакции, в которых CaSO4 (сульфат кальция) является продуктом? Вопросы, связанные с продуктом HF (фтористый водород)Каковы химические и физические характеристики HF (серной кислоты)? Какие химические реакции происходят с HF (фтористым водородом) в качестве продукта? Уравнение Результат #4 Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Double-replacement reaction
CaSO4 Форма структуры ЛьюисаРасположение атомов в любой молекуле в соответствии с ее геометрией и связями известно как ее молекулярная форма. Взгляните на подробное объяснение молекулярной формы CaSO 4 . Структура Льюиса CaSO 4 имеет тетраэдрическую форму его иона SO 4 2-. Катион Ca 2+ представляет собой отдельный вид, который присоединен к аниону SO 4 2- ионной связью. Центральный атом S иона SO 4 2- связан со связанными атомами 4 O, которые находятся в углах правильного тетраэдра и образуют тетраэдрическую геометрию. CaSO4 гибридизацияПерекрытие двух разных атомных орбиталей одного и того же элемента и образование новой гибридной орбитали с той же энергией называется гибридизацией. Обсудим гибридизацию CaSO 4 . Структура Льюиса CaSO 4 имеет sp3-гибридизацию центрального атома S. Атом серы содержит стерическое число 4. Стерическое число атома S определяется как = число связей на атоме S + неподеленные пары на атоме S. Таким образом, атом S имеет стерическое число = 4 + 0 = 4,9.1561 Согласно теории ВСЕПР атомы со стерическим числом 4 имеют sp3-гибридизацию и тетраэдрическую геометрию. CaSO4 Структурный угол ЛьюисаВалентный угол – это угол между двумя непосредственными связями в молекуле. Давайте кратко обсудим объяснение CaSO 4 угол связи. Структура Льюиса CaSO 4 имеет валентный угол 109,5 градусов. В соединении CaSO 4 имеется центральный атом S, связанный тетраэдрически с четырьмя атомами кислорода. Таким образом, согласно модулю VSEPR, он имеет общую формулу AX4. Таким образом, он имеет валентный угол O – S – O 109,5 градусов CaSO 4 . Является ли CaSO4 твердым? Расположение атомов молекулы в определенной геометрической форме с плотной упаковкой атомов называется твердыми соединениями. Ниже мы обсуждаем, является ли CaSO 4 твердый или нет. CaSO 4 представляет собой твердое соединение. Это бесцветное или белое кристаллическое твердое соединение. Он имеет различные формы, такие как ангидрит CaSO 4 , дигидрат CaSO 4 или гипс с различной кристаллической структурой и цветом, например красный, черный, синий и т. д. Ca 2+ и SO 4 2- плотно упакованы в их кристаллическую структуру. Почему CaSO4 твердый?CaSO 4 представляет собой твердое и кристаллическое соединение, поскольку оно может образовывать орторомбическую кристаллическую структуру. Ионы Ca 2+ и SO 4 2- расположены в закрытой упаковке чередующихся слоев в орторомбической клетке. Каждый катион Ca 2+ имеет 8 координаций и окружен 8 тетраэдрическими анионами SO 4 2-. Каждый атом O тетраэдрического SO 4 2- окружен 3 Ca 2+ катионов. Растворяется ли CaSO4 в воде?Способность растворенного вещества диссоциировать в воде и образовывать водородные связи в воде показывает его растворимость в ней. Взгляните на краткую информацию о растворимости CaSO 4 в воде. CaSO 4 растворим в воде, но растворим в воде слабо или умеренно. CaSO 4 при добавлении в воду реагирует с водой и ионизируется в ней в виде ионов Ca 2+ и SO 4 2- . CaSO 4 не полностью ионизирует в воде и поэтому мало растворим в воде. Так, с водой он образует комплекс CaSO 4 .(H 2 O) 2 . CaSO 4 + 2 H 2 O → CaSO 4 . Почему CaSO4 мало растворим в воде?CaSO 4 мало растворим в воде, поскольку энергия гидратации CaSO 4 меньше энергии его решетки. Катионы Ca 2+ прочно удерживаются анионами SO 4 2-. Таким образом, он растворяется в воде в очень меньшем количестве. Около 2 г CaSO 4 может растворяться в воде и после этого предела становится насыщенным в воде. Является ли CaSO4 полярным или неполярным?Развитие диполей и частичных зарядов на атомах молекулы показывает полярность этой молекулы. Давайте обсудим, является ли CaSO 4 полярным или неполярным. Соединение CaSO 4 является полярным соединением. Это ионная молекула, содержащая многоатомный неполярный анион SO 4 2-. Эти SO 4 2- CaSO 4 в основном представляют собой неполярную часть. Почему CaSO4 полярный?CaSO 4 является полярным соединением из-за присутствия неполярных ионов SO 4 2-. Отрицательный анион SO 4 2- присоединен к положительному катиону Ca 2+ . Он имеет неравное распределение электронов на обоих ионах. Таким образом, диполи развиваются на обоих ионах из-за частичного положительного и отрицательного заряда на нем. Является ли CaSO4 молекулярным соединением?Молекулярные соединения содержат ковалентные связи внутри своих атомов и демонстрируют присутствие в своей структуре различных молекул. Давайте посмотрим, является ли CaSO 4 молекулярным или нет. CaSO 4 не является молекулярным соединением. Это ионное соединение. Является ли CaSO4 кислотой или основанием?Вещества, которые являются донорами ионов H+, являются кислотами, а соединения, которые являются акцепторами ионов H+, являются основаниями. Взгляните на обсуждение того, является ли CaSO 4 кислотой или основанием. CaSO 4 представляет собой некислотное и неосновное соединение. Это нейтральная молекула. Нейтральные соединения — это те, которые являются продуктом кислотно-основная реакция. Соединение CaSO 4 образуется в результате реакции сильной кислоты и сильного основания. Таким образом, это подтверждает, что это нейтральное соединение. Почему CaSO4 нейтрален?CaSO 4 является нейтральным, поскольку содержит ионы Ca 2+ и SO 4 2- , которые имеют заряды +2 и -2 . Оба этих заряда компенсируют друг друга и являются нейтральными соединениями. CaSO 4 образуется в результате реакции между серной кислотой (H 2 SO 4 ) и гидроксид кальция (Ca(OH) 2 ). Реакция приведена ниже. H 2 SO 4 (водн.) + Ca(OH) 2 (т) → CaSO 4 (т) + 2 H 2 O (л) 3 9 8 4 Ca(OH) 9090 электролит?Соединения, которые диссоциируют при добавлении в воду и обладают способностью проводить электричество, называются электролитами. Обсудим электролитическую природу CaSO 4 . CaSO 4 представляет собой электролит. Это слабый электролит из-за его низкой ионизации в воде. Почему CaSO4 является электролитом?CaSO 4 является электролитом, поскольку представляет собой ионное соединение и образуется из-за комбинации атомов металла и неметалла. При добавлении CaSO 4 для воды может диссоциировать на ионы Ca 2+ и SO 4 2- . Эти ионы могут свободно перемещаться в воде и проводить электричество при использовании внешнего электрического поля. CaSO 4 + H 2 O → Ca 2+ + SO 4 2- Является ли CaSO4 солью? Кислотные и основные соединения при реакции друг с другом образуют соли, которые являются нейтральными соединениями. CaSO 4 представляет собой соль. Это продукт реакции нейтрализации сильной кислоты и сильного основания с образованием солей. При взаимодействии H 2 SO 4 с Ca(OH) 2 происходит реакция нейтрализации с образованием кристаллического твердого соединения CaSO 4 белого цвета или бесцветного. Таким образом, он действует как соль. Является ли CaSO4 ионным или ковалентным?Ионные соединения образуются за счет электростатической силы притяжения, а ковалентные соединения — за счет сильных ковалентных сигма-связей. Давайте обсудим, как CaSO 4 является ионным или ковалентным. CaSO 4 представляет собой ионное соединение. Он образуется путем соединения металлических и неметаллических элементов. Он также содержит два противоположно заряженных иона, то есть катион и анион. Почему CaSO4 является ионным?CaSO 4 представляет собой ионную молекулу, поскольку катион Ca 2+ и анион SO 4 2- прочно удерживаются вместе из-за сильной электростатической силы притяжения и образования прочной ионной связи между ними. Он также ионизируется в ионы Ca 2+ и SO 4 2 при добавлении в воду, что подтверждает его ионный характер. Вывод: CaSO 4 Структура Льюиса имеет 32 валентных электрона и 12 неподеленных пар. Он имеет полные октеты атомов S и O иона SO 4 2 – . Он имеет формальный заряд +2 на Ca, +2 на S и -1 на все 4 атома O. Он имеет тетраэдрическую форму и орторомбическую кристаллическую структуру. Растворимость гипса (CaSO4)Сколько гипса растворяется в воде при 25 ? Мы решаем эту задачу двумя способами: (i) аналитически (с помощью «карманного калькулятора») и (ii) численно, применяя всю гамму химической термодинамики. Результаты будут значительно отличаться, и мы объясним, почему. Аналитический подход Формула реакции и ее значение log K (при 25°C): СаСО 4 = Ca +2 + SO 4 -2 | log К = -4,58 | |
Расчет основан на двух уравнениях:
| (2) | закон действующих масс: 4 | K ≈ K sp * = [Ca +2 ] · [SO 4 -2 ] = 10 -4,58 |
| (3) | баланс заряда: | [Ca +2 ] = [SO 4 -2 ] |
Подставляя уравнение (3) в уравнение (2), получаем простую квадратичную зависимость:
| (4) | К = [СО 4 -2 ] 2 |
Поскольку растворенное количество гипса равно величине [SO 4 ], сразу получаем результат:
| (5) | ΔГипс | = | К 1/2 |
| (6) | ΔГипс | = | (10 -4,58 ) 1/2 М |
| (7) | ΔГипс | = | 10 -2,29 М = 5,12×10 -3 М = 5,12 мМ |
Прописью: 5,12 ммоль гипса растворяется в 1 л чистой воды. [Обратите внимание, что окончательный результат не зависит от первоначального запаса гипса.]
[Обратите внимание, что окончательный результат не зависит от первоначального запаса гипса.]
Численный подход с aqion
Начнем с чистой воды (кнопка h3O ) и переключимся на молярные единицы (активируем флажок моль ). Чтобы открыть таблицу минералов, нажмите Минералы , затем введите количество 20 ммоль/л гипса (двойным щелчком по строке «Гипс»). 5 Соответствующий снимок экрана показан справа.
Запустите расчет с помощью Start , появится первый обзор схемы. После нажатия на следующий , результаты снова отображаются в выходной таблице. В крайнем правом столбце вы найдете:
| pH | = | 7,07 |
| Ca | = | 15,6 мМ |
| SO4 | = | 15,6 мМ |
Согласно этому расчету, в 1 литре чистой воды растворяется 15,4 ммоль гипса – это в три раза больше, чем в приведенном выше расчете!
Здесь SO4 и Ca обозначают общую концентрацию:
| (8) | [Ка] Т | = | [Ca +2 ] + [CaSO 4 (водн. )] + [CaHSO 4 + ] + [CaOH + ] )] + [CaHSO 4 + ] + [CaOH + ] |
| (9) | [SO4] Т | = | [SO 4 -2 ] + [HSO 4 — ] + [CaSO 4 (водн.)] + [CaHSO 4 + ] |
Соответствующее равновесное соединение указано в таблице
На самом деле крупных игроков всего три: Ca +2 , SO 4 -2 и CaSO 4 (водн. ). Последний вид представляет собой водный комплекс; его не следует путать с гипсом минеральной фазы, который обычно обозначается аббревиатурой CaSO 4 (s).
). Последний вид представляет собой водный комплекс; его не следует путать с гипсом минеральной фазы, который обычно обозначается аббревиатурой CaSO 4 (s).
Резюме
Оба результата значительно различаются:
| (10а) | аналитический подход (карманный калькулятор): | 5,1 мМ |
| (10б) | численный подход (хим. термодинамика): | 15,6 мМ |
Причины недостатка аналитического подхода:
- пренебрежение комплексообразованием (особенно CaSO 4 (водн.))
- пренебрежение поправками на активность (при ионной силе I = 42 мМ, γ = 0,48)
Примечания и сноски
Правильная формула гипса CaSO 4 :2H 2 O. Для упрощения обозначений мы используем здесь краткую форму CaSO 4 .
 ↩
↩Здесь и далее обозначение «log x» используется для десятичного логарифма «log 10 x». ↩
Таблицы значений K sp приведены здесь. ↩
Здесь мы аппроксимируем K sp стехиометрическим произведением растворимости (строго говоря, это применимо только для идеальных растворов, где ионная активность = концентрации). ↩
Начальное количество гипса должно как минимум превышать предел растворимости. Например, если ввести 3 ммоль/л гипса, то это слишком мало (индекс насыщения остается ниже нуля). ↩
[последнее изменение: 09.08.2020]
CaSO4, ангидрит (Ca[SO4] rt) Кристаллическая структура
Неорганические твердые фазы
Получить доступ СИФ Скачать справку (pdf)
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.

Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа |
| |||
| и | ||||
| б | ||||
| с | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| д/к | ||||
| к/с | ||||
| В | ||||
Координаты атома
Стандартизированный
| |||||||||
Детали эксперимента
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Ссылка
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.

3D интерактивная структура
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Об этом контенте
PAULING FILE Multinaries Edition – 2012 г.
sd_1503101
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред.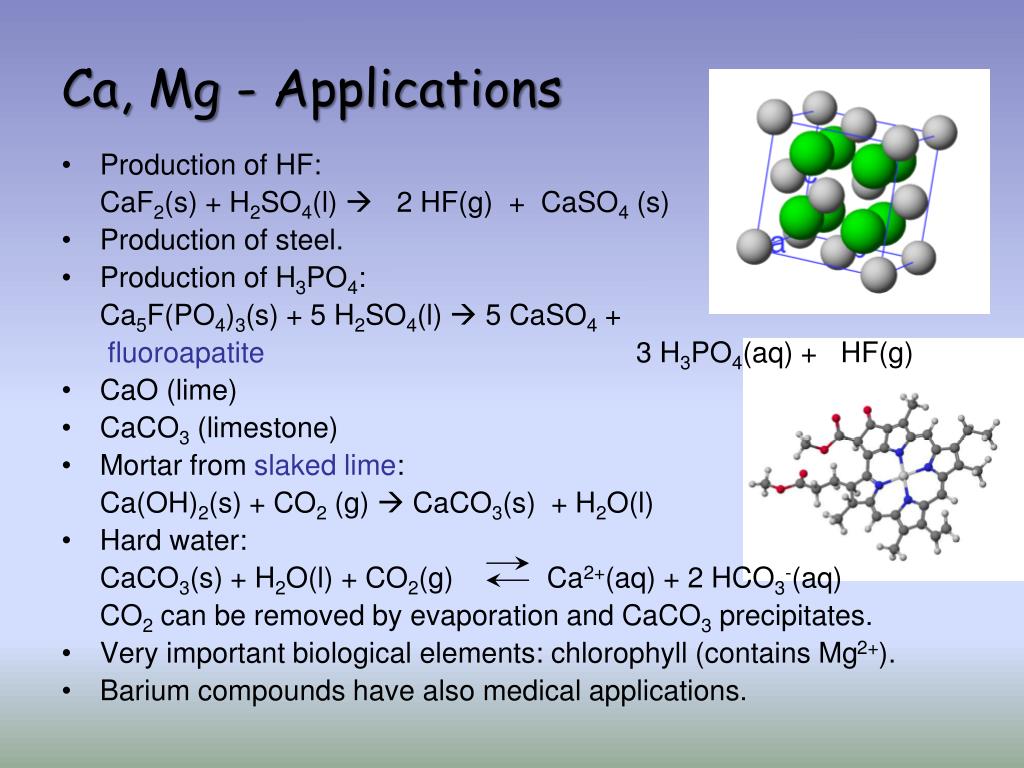 )
SpringerМатериалы
CaSO4, ангидрит (Ca[SO4] rt) Кристаллическая структура
sd_1503101 (Springer-Verlag GmbH, Гейдельберг, © 2016)
)
SpringerМатериалы
CaSO4, ангидрит (Ca[SO4] rt) Кристаллическая структура
sd_1503101 (Springer-Verlag GmbH, Гейдельберг, © 2016)
Скачать эту цитату
Цитата скопирована
sd_1503101
Сульфат кальция (CaSO4) Аквариумное удобрение (банка 1 фунт)
- Артикул:
- 106863
- Текущий запас:
- Описание
- Отзывы клиентов
Описание
Сульфат кальция CaSO4 — удобрение для засаженных растений
- 1 фунт/банка
- обеспечивает растения кальцием (Ca) и серой (S), жизненно важными макроэлементами
- повышает общую жесткость (GH) в мягкой воде
- CaSO4 (сульфат кальция) удобрение для выращивания в аквариумах, необходимо для здорового роста растений, сильных корней и новых листьев.

- Кальций регулирует перенос питательных веществ в растения и удержание питательных веществ. Дефицит проявляется в виде задержки роста растений, скручивания листьев внутрь к жилкам/центру, дефектной или гниющей корневой системы.
- способствует клеточной структуре и росту, фотосинтезу, структуре и росту растений, преобразованию и поглощению азота, а также активатору ферментов
Симптомы дефицита: карликовый деформированный рост, некротические скрученные новые листья, почерневшие коротенькие корни, снижение роста листьев, ожог кончиков листьев
Как дозировать сульфат кальция CaSO4 в вашем аквариуме с растениями
Узнайте все, что вам нужно знать об удобрениях для аквариумных растений, питательных веществах для растений, оптимальных уровнях питательных веществ и методах дозирования самодельных удобрений: калькулятор сухих удобрений и методы внесения удобрений
Ожидайте увеличения Ca на 1 ppm на каждые 163 миллиграмма (эквивалентно менее чем 1/32 чайной ложки + 1/64 чайной ложки) CaSO4. 2h3O, добавленного в ваш 10-галлонный аквариум, чтобы получить:
2h3O, добавленного в ваш 10-галлонный аквариум, чтобы получить:
- Ca — 1 ppm
- S — 0,8 частей на миллион
- дГХ — 0,14
Отзывы покупателей
1 отзыв
Клиенты также просмотрели
The Ultimate GH Booster — Поднимите GH воды обратного осмоса — банка 1 фунт
Ultimate GH Booster — K, Mg, Ca и S для повышения GH мягкой воды 1 фунт / банка обеспечивает аквариумные растения калием (K), магнием (Mg), кальцием (Ca) и серой (S), необходимыми макроэлементами. Наш…
Оценочный индекс (EI) Упаковка питательных веществ для аквариума — банки
$30,00
Расчетный индекс EI — Пакет аквариумных удобрений NPK Наш расчетный индекс EI Пакет включает в себя: GLA EDTA Micromix (M) — 1 фунт/банка Нитрат калия (KNO3) (N) — 1 фунт/банка Монокалийфосфат. ..
..
GLA (EDTA) Удобрение для аквариума Micromix — банка 1 фунт
16,50 $
GLA EDTA Micromix — микропитательное удобрение Plantex CSM+B 1 фунт/банка содержит ЭДТА: хелатное железо (Fe), хелатный марганец (Mn), хелатный цинк (Zn), бор (B), магний (Mg) и микроэлементы к…
Пакет удобрений для аквариумных растений PPS-Pro (EDTA) — банки
40,00 $
PPS-Pro (ЭДТА) Упаковка для аквариумных удобрений — удобрение для водных растений Наш пакет PPS-Pro (EDTA) включает: GLA EDTA Micromix — 1 фунт / банка Нитрат калия (KNO3) — 1 фунт / банка Монокалий…
Сульфат магния (MgSO4) Аквариумное удобрение — банка 1 фунт
Сульфат магния MgSO4 — Питательные вещества для аквариумных растений 1 фунт/банка обеспечивает магний (Mg) и серу (S) для аквариумных растений, жизненно важные макроэлементы. Сульфат магния (MgSO4), жизненно важные…
Сульфат магния (MgSO4), жизненно важные…
Miller Microplex — Смесь питательных микроэлементов — банка 0,5 фунта
10,00 $
Miller Microplex — Удобрение с микроэлементами и железом для аквариумных растений 0,5 фунта в банке содержит ЭДТА: хелатный магний (Mg), хелатный железо (Fe), хелатный марганец (Mn), бор (B) и микроэлементы.
DTPA Хелатное железо (Fe 11%) Аквариумное удобрение — банка 0,5 фунта
10,00 $
Удобрение с содержанием железа для аквариума в форме DTPA — Fe 11% 0,5 фунта/банка Обеспечивает хелатное железо (Fe) в форме DTPA для аквариумных растений, идеально подходит для использования в щелочной аквариумной воде с более высоким pH Железо жизненно важно для выживания растений,…
Нитрат кальция Ca(NO3)2 Аквариумное удобрение — банка 1 фунт
Нитрат кальция Ca(NO3)2 — макроудобрение для аквариумных растений 1 фунт / банка
обеспечивает растения кальцием (Ca) и азотом (N), жизненно важными макроэлементами.





 При помощи какого реактива можно обнаружить катионы Ni2+ в этой смеси ?
При помощи какого реактива можно обнаружить катионы Ni2+ в этой смеси ? Образовался желтый осадок, не растворимый в уксусной кислоте, но растворимый в щелочи. Какие катионы содержал исследуемый раствор?
Образовался желтый осадок, не растворимый в уксусной кислоте, но растворимый в щелочи. Какие катионы содержал исследуемый раствор? Фармакопейной реакцией для обнаружения катиона кальция является реакция с раствором:
Фармакопейной реакцией для обнаружения катиона кальция является реакция с раствором:
 О наличии катионов какой аналитической группы это свидетельствует ?
О наличии катионов какой аналитической группы это свидетельствует ? В результате образуется белый кристаллический осадок МgNH4PO4. Состав магнезиальной смеси следующий:
В результате образуется белый кристаллический осадок МgNH4PO4. Состав магнезиальной смеси следующий:

 Какой анион обусловил этот аналитический эффект?
Какой анион обусловил этот аналитический эффект? Это свидетельствует о присутствии в растворе:
Это свидетельствует о присутствии в растворе:
 Какой реагент является групповым на эти анионы (другая аналитическая группа анионов)?
Какой реагент является групповым на эти анионы (другая аналитическая группа анионов)?
 Это
Это Укажите реагент, который позволяет обнаружить в этом растворе катионы цинка:
Укажите реагент, который позволяет обнаружить в этом растворе катионы цинка: Каков состав полученного осадка?
Каков состав полученного осадка? К смеси добавили щелочной раствор натрий гидроксостанната– образовался черный осадок, что свидетельствует о присутствии катиона:
К смеси добавили щелочной раствор натрий гидроксостанната– образовался черный осадок, что свидетельствует о присутствии катиона: В результате образуется белый кристаллический осадок МgNH4PO4. Состав магнезиальной смеси следующий:
В результате образуется белый кристаллический осадок МgNH4PO4. Состав магнезиальной смеси следующий: Какого цвета осадок при этом образуеттся?
Какого цвета осадок при этом образуеттся? org
org Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. Химическая и физическая характеристика Ca(HCO3)2 ()? В каких химических реакциях используется Ca(HCO3)2 () в качестве реагента?
Химическая и физическая характеристика Ca(HCO3)2 ()? В каких химических реакциях используется Ca(HCO3)2 () в качестве реагента? Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. Обсудим краткие подробности структуры льюиса CaSO 4 .
Обсудим краткие подробности структуры льюиса CaSO 4 . Сделайте связь внутри всех атомов, присутствующих в нем. Сульфат-ион имеет ковалентные связи внутри атомов S и O. Ион Са связан ионной связью с SO 4 ион.
Сделайте связь внутри всех атомов, присутствующих в нем. Сульфат-ион имеет ковалентные связи внутри атомов S и O. Ион Са связан ионной связью с SO 4 ион.  Давайте кратко обсудим валентные электроны структуры Льюиса CaSO 4 .
Давайте кратко обсудим валентные электроны структуры Льюиса CaSO 4 .
 2-.
2-. Ниже приведено подробное описание CaSO 9.0348 4 структура льюиса формальный заряд.
Ниже приведено подробное описание CaSO 9.0348 4 структура льюиса формальный заряд. . , и o atom
. , и o atom  Тетраэдрическая форма CaSO 4 обусловлена только ионом SO 4 2-. В соответствии с теорией VSEPR, он следует общей формуле AX4.
Тетраэдрическая форма CaSO 4 обусловлена только ионом SO 4 2-. В соответствии с теорией VSEPR, он следует общей формуле AX4. 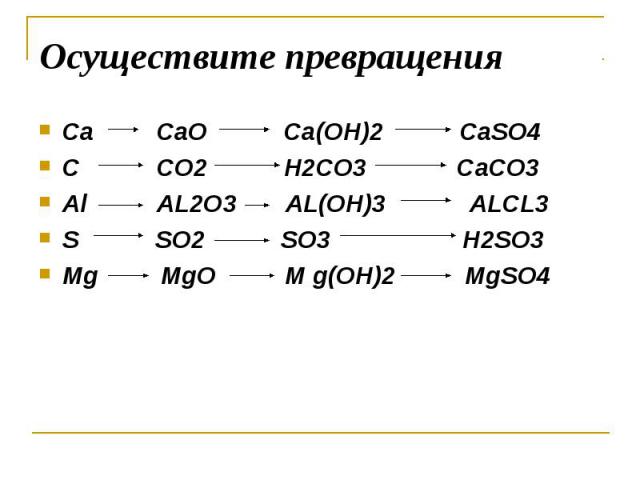 В структуре Льюиса CaSO 4 он имеет перекрытие одной «s» и трех «p»-орбиталей центрального атома S. Это формирует новую гибридную гибридную орбиталь «sp3» с эквивалентной энергией, как и предыдущие орбитали.
В структуре Льюиса CaSO 4 он имеет перекрытие одной «s» и трех «p»-орбиталей центрального атома S. Это формирует новую гибридную гибридную орбиталь «sp3» с эквивалентной энергией, как и предыдущие орбитали.
 Таким образом, каждый атом О имеет 3 координации. Следовательно, каждый катион Ca 2+ и анион SO 4 2- образуют слои в орторомбической элементарной ячейке. Таким образом, это подтверждает его кристаллическую твердую структуру.
Таким образом, каждый атом О имеет 3 координации. Следовательно, каждый катион Ca 2+ и анион SO 4 2- образуют слои в орторомбической элементарной ячейке. Таким образом, это подтверждает его кристаллическую твердую структуру.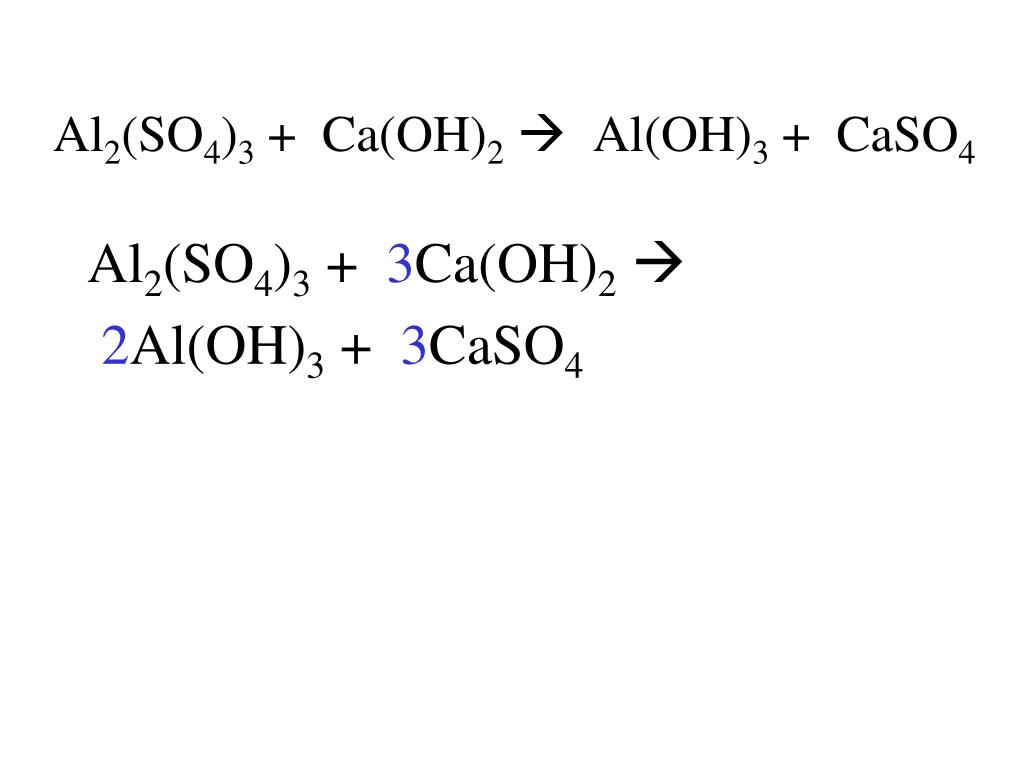 (H 2 O) 2
(H 2 O) 2  Неполярный SO 4 2- связан с катионом Ca 2+ , что делает CaSO 4 полярным по своей природе.
Неполярный SO 4 2- связан с катионом Ca 2+ , что делает CaSO 4 полярным по своей природе.  Он имеет только ионную связь внутри ионов Ca 2+ и SO 4 2-, а не ковалентную связь. Ковалентные связи есть только на SO 4 2-. Все атомы S и O, соединенные ковалентными связями, еще не могут проявлять молекулярную природу. Он имеет заряд и показывает ионный характер.
Он имеет только ионную связь внутри ионов Ca 2+ и SO 4 2-, а не ковалентную связь. Ковалентные связи есть только на SO 4 2-. Все атомы S и O, соединенные ковалентными связями, еще не могут проявлять молекулярную природу. Он имеет заряд и показывает ионный характер. 
 Он имеет высокую энергию решетки и низкую энергию гидратации. Таким образом, он не может полностью ионизироваться в воде из-за плотной упаковки молекулы. Кроме того, он может проводить электричество и вести себя как электролит.
Он имеет высокую энергию решетки и низкую энергию гидратации. Таким образом, он не может полностью ионизироваться в воде из-за плотной упаковки молекулы. Кроме того, он может проводить электричество и вести себя как электролит.  Здесь мы обсуждаем, является ли CaSO 4 соль или нет.
Здесь мы обсуждаем, является ли CaSO 4 соль или нет. Между Ca и молекулами SO 4 происходит обмен электронами, в результате чего образующийся положительный и отрицательный заряд делает его ионным по своей природе.
Между Ca и молекулами SO 4 происходит обмен электронами, в результате чего образующийся положительный и отрицательный заряд делает его ионным по своей природе.  Он имеет sp3-гибридизацию и валентный угол 109,5 0 . Это полярная ионная соль, электролит и растворима в воде.
Он имеет sp3-гибридизацию и валентный угол 109,5 0 . Это полярная ионная соль, электролит и растворима в воде.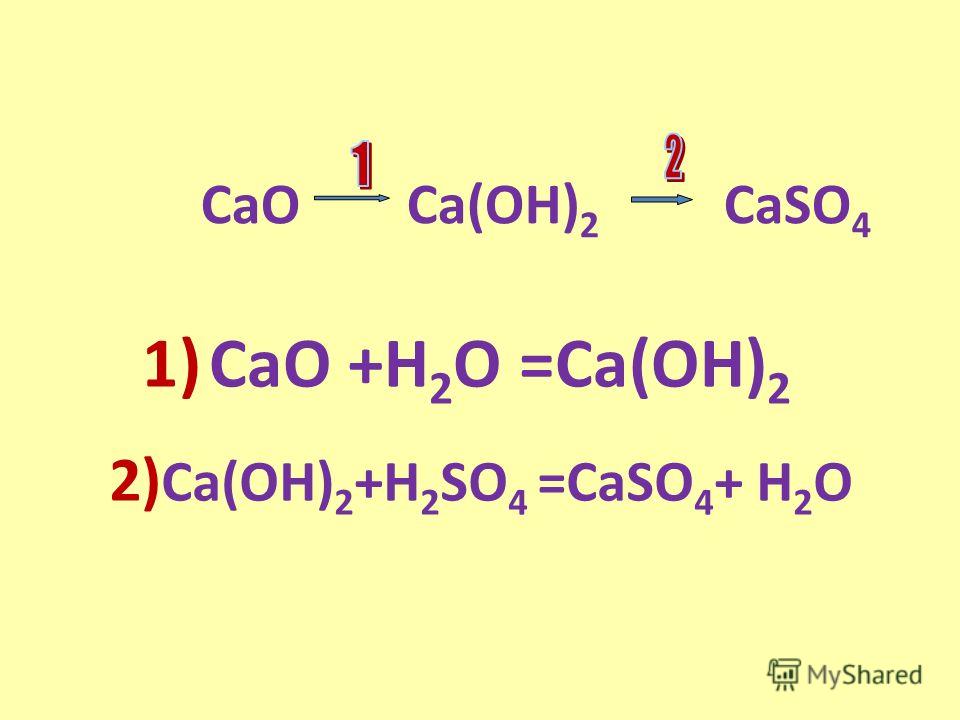 ↩
↩