Серная кислота + гидроксид кальция → Вода +…- Карта разума
Словесное уравнение
Серная кислота + гидроксид кальция → Вода + сульфат кальция
Уравнение скелета
h3SO4(s) + Ca(OH)2 ) → h3O(ж) + CaSO4(тв)
Балансное уравнение
h3SO4(водн.) + Ca(OH)2(тв) → 2h3O(ж) + CaSO4(тв)
Химическая реакция
Что это значит ?
Это процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов.
Существует множество типов химических реакций, таких как синтез, однократное замещение, двойное замещение и т. д.
Какой тип?
Нейтрализация
Что такое нейтрализация?
Это химическая реакция, при которой кислота и основание количественно реагируют друг с другом с образованием соли. Она также известна как реакция двойного замещения.
Примеры из жизни:
Кислотность желудка из-за острой пищи можно уменьшить, приняв антацид (щелочной/основной).
В зависимости от растений, которые вы решили выращивать, существуют способы обработки и нейтрализации слишком кислой или щелочной почвы, чтобы растения росли счастливыми и здоровыми.
Когда растения берут питательные вещества из почвы в свои корни, на них влияет уровень pH окружающих частиц почвы (происходит нейтрализация). .
Соль образуется, когда катион (положительный ион) основания образует соединение с анионом (отрицательный ион) кислоты.
Реагенты?
Гидроксид кальция [Ca(OH)2]
Свойства?
A Бесцветные кристаллы или белый порошок с плотностью 2,21 г/см³ и температурой плавления 580 °C
Серная кислота (h3SO4)
Свойства?
Бесцветная или слегка желтоватая вязкая жидкость с резким запахом. Он имеет плотность 1,84 г/мл.
Продукты?
Сульфат кальция (CaSO4)
Свойства?
Белое аморфное или кристаллическое твердое вещество или порошок без запаха.
Вода (h3O)
Свойства?
Вода – бесцветная жидкость без вкуса. Он имеет высокие температуры плавления и кипения.
Он имеет высокие температуры плавления и кипения.
Энергетические потребности нейтрализации
Эта реакция является экзотермической реакцией, что означает выделение тепла за счет нейтрализации кислоты и основания. Энтальпия нейтрализации отрицательна.
Производство тепла?
H = E + PV — это формула, позволяющая определить количество произведенного тепла. Первый шаг — найти количество молей в уравнении.
Существуют ли другие продукты, которые не используются в этой реакции и считаются отходами?
Нет, все продукты полезны в этой реакции, потому что сульфат кальция является причиной образования гипса и гипса. Другой продукт, вода, не является расточительным. Реагенты — это то, что создает сульфат кальция, поэтому они также не являются отходами.
Откуда берут реагенты?
Серная кислота
Этапы производства серной кислоты (контактный процесс)
1. Получение диоксида серы.
2. Конверсия диоксида серы в триоксид серы.
3. Конверсия образующегося триоксида серы в концентрированный h3SO4.
Гидроксид кальция
Гидроксид кальция получают в промышленных масштабах путем обработки извести водой: CaO + h3O → Ca(OH). В лаборатории его можно приготовить путем смешивания водных растворов хлорида кальция и гидроксида натрия.
Оказывает ли способ получения реагентов какое-либо воздействие на окружающую среду?
Серная кислота
Когда диоксид серы соединяется с водой и воздухом, он образует серную кислоту, которая является основным компонентом кислотных дождей. Кислотные дожди могут: вызвать вырубку лесов и окислить водные пути в ущерб водным обитателям.
Чтобы получить диоксид серы, нам нужно сжечь серу, загрязняя воздух.
Гидроксид кальция
Гидроксид кальция легко поглощает углекислый газ из воздуха, превращаясь в карбонат кальция (CaCO3). По этой причине соединение часто загрязняется карбонатом, если оно не хранится в плотно закрытых контейнерах.
Подтема
Конечный продукт
Сульфат кальция
Что это такое?
Это природная соль кальция.
Типы технологий, использованных в этой реакции?
Гипс.
Что это?
Сульфат кальция широко известен в форме дигидрата, CaSO4∙2h3O, белого или бесцветного порошка, называемого гипсом
Как эта технология делает реакцию более эффективной (лучше протекает)?
Гипс помогает окружающей среде и полезен, без него не было бы кондиционера для почвы. Почвенная добавка, которая улучшает структуру почвы за счет увеличения аэрации, водоудерживающей способности и питательных веществ.
Это также причина, по которой был создан Plaster of Paris, и эта технология также очень полезна.
Как используется?
В виде некальцинированного гипса сульфат используется в качестве кондиционера для почвы.
Обожженный гипс используется для изготовления плитки, стеновых панелей, рейки и различных штукатурок.
Когда гипс нагревается примерно до 120 °C (250 °F), он теряет три четверти воды, превращаясь в полугидрат CaSO4∙1/2h3O, Парижский гипс.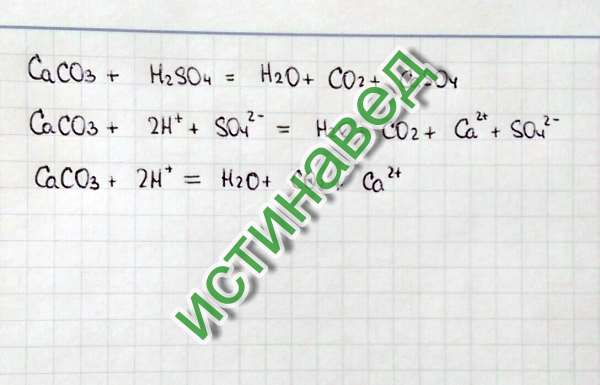
Гипс
Что это такое?
Как это создается?
Парижский гипс получают путем нагревания дигидрата сульфата кальция или гипса до 120–180 °C (248–356 °F) , который твердеет при увлажнении и высыхании.
Преимущество?
Гипс обычно не дает усадки и не трескается при высыхании, что делает его превосходным материалом для литья форм.
Как эта технология делает реакцию более эффективной (работает лучше)?
Plaster of Paris используется, чтобы помогать и приносить пользу людям во многих отношениях, таких как примеры, перечисленные ниже. Гипс делает реакцию более эффективной, так как создает много полезных вещей в жизни, которые люди желают или в которых нуждаются.
Для чего он используется?
Обычно используется для изготовления сборных и удерживающих элементов декоративной штукатурки на потолках и карнизах.
Он также используется для изготовления гипсовых повязок для иммобилизации сломанных костей во время их заживления, хотя многие современные ортопедические повязки.
Когда стоматологи создают модели зубов людей, их можно использовать для сравнения зубов. Особенно в начале процесса ношения брекетов.
Используется для создания произведений искусства путем лепки, так как скорость схватывания гипса придает работе ощущение непосредственности и позволяет скульптору быстро реализовать первоначальную идею.
Существуют ли какие-либо проблемы со здоровьем (токсичность, болезни), связанные с любым из реагентов или продуктов реакции?
Реагенты
Гидроксид кальция
Гидроксид кальция пищевого качества, как правило, безопасен. Однако, если вы работаете с промышленным гидроксидом кальция, его проглатывание может привести к отравлению гидроксидом кальция. Это может привести к тяжелым травмам или смерти.
Серная кислота
Это сильно коррозионное химическое вещество, потенциально взрывоопасное в концентрированной форме. Он может вызвать серьезные ожоги кожи, может раздражать нос и горло и вызывать затруднения дыхания при вдыхании, может обжечь глаза и, возможно, вызвать слепоту, а при проглатывании может прожечь дыры в желудке.
Продукты
Сульфат кальция
Это относительно неопасный химикат. Повторяющийся или продолжительный контакт может вызвать раздражение кожи и глаз. Проглатывание большого количества сульфата кальция может вызвать бронхит, тошноту, расстройство желудка, рвоту и диарею.
Вода
Никаких опасностей, это вода. Не утонуть?! Hahah(:
Что является продуктом этой реакции?
Сульфат кальция
Чем он полезен для нас?
Сульфат кальция полезен для нас, потому что он образует белый или бесцветный порошок, называемый гипсом, который используется для создания почвенные кондиционеры.Почвенные кондиционеры помогают разрыхлить уплотненные почвы, а также пополнить и сохранить питательные вещества для растений, чтобы они процветали.Это действительно хорошо для окружающей среды.
Без сульфата кальция не существовало бы и гипса. Эта технология помогает людям с медицинской точки зрения, и ее можно использовать для моды и искусства.
Годовое производство этой реакции?
Сульфат кальция – Производство и распространение Мировое производство природного гипса составляет около 127 миллионов тонн в год.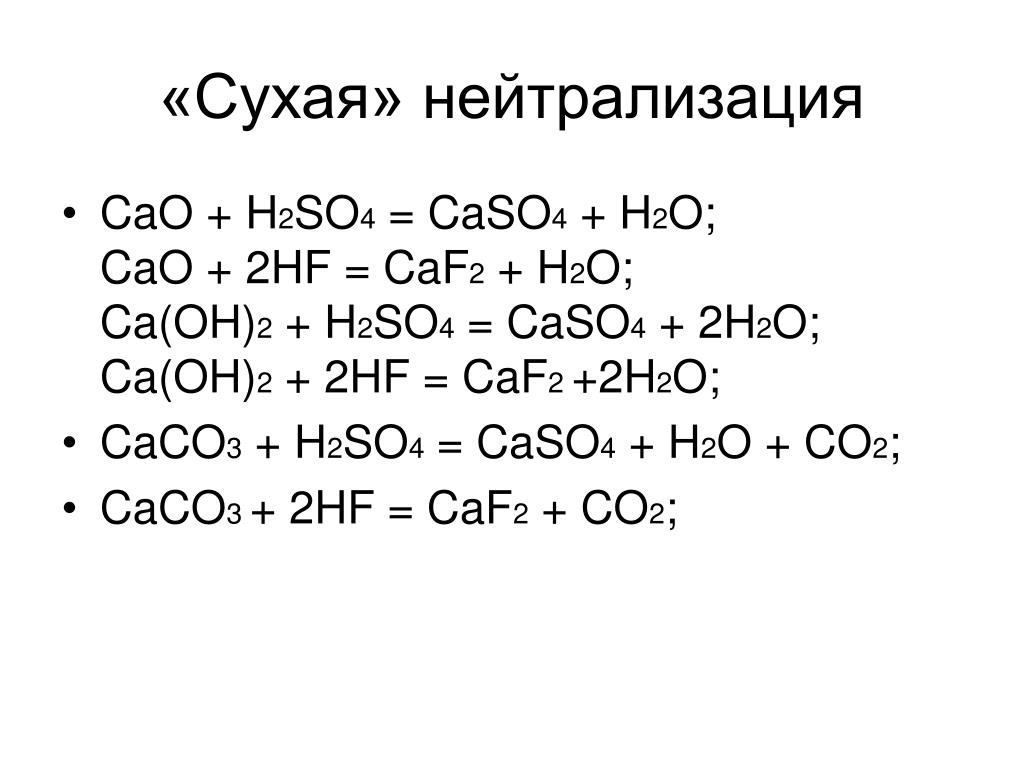
Есть ли государственная политика, регулирующая реакцию?
Да, на сайте правительства есть одна политика: https://laws-lois.justice.gc.ca/eng/regulations/c.r.c.,_c._870/page-65.html?wbdisable=true
Серная кислота была выбрана для оценки риска, потому что это вещество соответствует критериям коррозионных веществ, определенным ОЭСР, которые в случае разлива могут нанести немедленный вред людям и/или окружающей среде.
По данным правительства Канады, было заявлено, что «После оценки риска Министерство окружающей среды Канады рекомендует предложить это вещество для добавления в Список 1 Правил чрезвычайного положения в области окружающей среды в пороговом количестве 3 тонны с минимальной концентрацией 0,1%. и при pH ≤ 2».
Какие затраты связаны с этой реакцией?
В зависимости от того, сколько тонн вы хотите, сульфат кальция стоит от 100 до 125 долларов США.
Один пакет кондиционера для гипсового грунта стоит 12,99 канадских долларов.
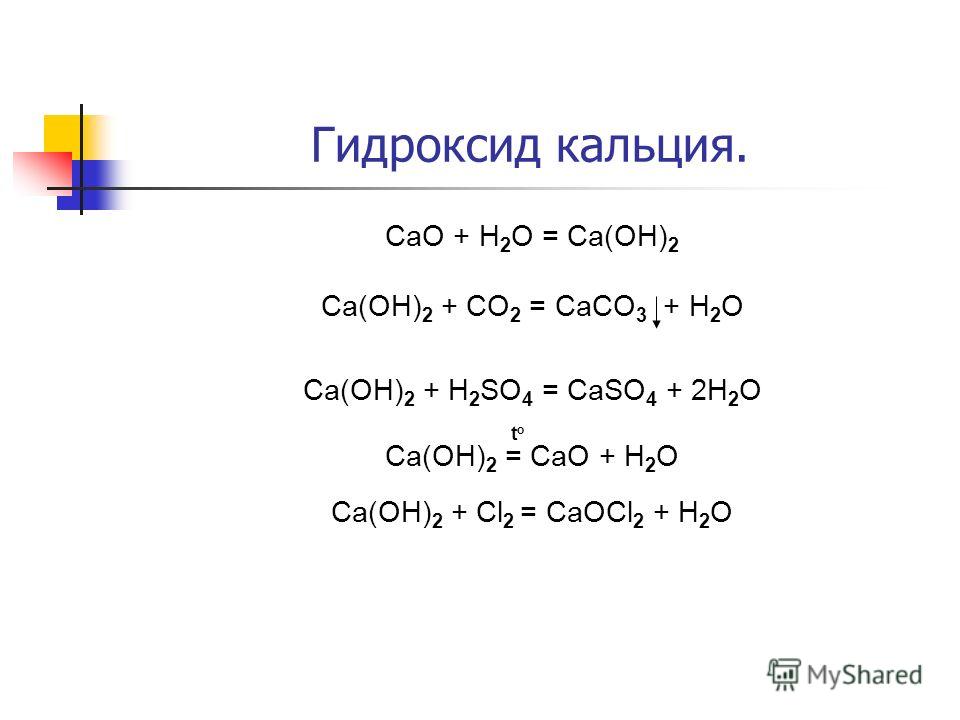
h3SO4 + CaSO3 = h3O + SO2 + CaSO4
| Поиск |
серная кислота + = вода + диоксид серы + сульфат кальция |
Новости Только 5% НАСЕЛЕНИЯ будут знать
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Double-replacement reaction
101348000000-1086. png» substance-weight=»98.0785″> H 2 SO 4 png» substance-weight=»98.0785″> H 2 SO 4 | + | O | + | 121412000000-1087.png» substance-weight=»64.0638″> SO 2 | + | ||||
| 1 | 1 | 1 | 1 | 1 | Hệ số | ||||
| Nguyên — Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении H
2 SO 4 + CaSO 3 → H 2 O + SO 2 + CaSO 4() ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (вода), SO2 (диоксид серы) и CaSO4 (сульфат кальция)?
В полном предложении вы также можете сказать, что h3SO4 (серная кислота) реагирует с CaSO3 () и производит h3O (вода) и SO2 (диоксид серы) и CaSO4 (сульфат кальция)
Явление после того, как h3SO4 (серная кислота) реагирует с CaSO3 ( )
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Дальнейшие вопросы, связанные с химическими реакциями, H
2 SO 4 + CASO 3 → H 2 O + SO 2 + Caso 44444.
 каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента?
каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента?Вопросы, связанные с реагентом CaSO3 ()
Каковы химические и физические характеристики CaSO3 ()? В каких химических реакциях используется CaSO3 () в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O ()?Каковы химические реакции, в которых продуктом является h3O (вода)?
Вопросы, связанные с продуктом SO2 (двуокись серы)
Каковы химические и физические характеристики SO2 ()? Каковы химические реакции, в которых SO2 (двуокись серы) является продуктом?
Вопросы, связанные с продуктом CaSO4 (сульфат кальция)
Каковы химические и физические характеристики CaSO4 ()? Каковы химические реакции, в которых CaSO4 (сульфат кальция) является продуктом?
Essentt — Товары, подобранные вручную
Продукты, подобранные вручную Необходимы для работы из дома!
Уравнения с h3SO4 в качестве реагента
серная кислота
H 2 SO 4
+ NA 2 SO 3 → H 2 O + NA 2 SO 4 + SO 2 SO 4 + SO 2 29 29 29 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 . 2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 H 2 SO 4 + Zn → H 2 + ZnSO 4 Просмотреть все уравнения с h3SO4 в качестве реагента
2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 H 2 SO 4 + Zn → H 2 + ZnSO 4 Просмотреть все уравнения с h3SO4 в качестве реагентаУравнения с CaSO3 в качестве реагента
H 2 O + SO 2 + CASO 3 → CA (HSO 3 ) 2 H 2 SO 4 + CASO
Реклама
Уравнения с CaSO3 в качестве продукта
CA (OH) 2 + SO 2 → H 2 O + Caso 3 CAO + SO 2 → CASO 3 NA 2 → CASO 3 NA 2 → CASO 3 .
