что это и как влияет на вкус кофе
Чашка фильтр-кофе на 98,5% состоит из воды, а её качество имеет большое значение для кофе.
Общая и карбонатная жесткость — ключевые параметры, которые определяют качество воды. За общую жесткость отвечают хлорид кальция (CaCl2), сульфат кальция (CaSO4), хлорид магния (MgCl2) и сульфат магния (MgSO4). За карбонатную — бикарбонат калия (KHCO3) и бикарбонат натрия (NaHCO3).
Соли магния и кальция помогают извлечь из кофе больше вкуса и не выпадают в осадок при кипячении воды. А вот с бикарбонатами все не так просто. Вода, которая перенасыщена карбонатами, образует накипь. При кипячении воды соли выпадают в осадок и могут привести к поломке кофемашины.
Казалось бы, выбирайте воду с низким содержанием карбонатов, и проблема решена. Но недостаточное количество карбоната кальция в воде может вызвать коррозию бойлера и трубок. А главное — содержание бикарбонатов влияет на воспринимаемую кислотность кофе.
А главное — содержание бикарбонатов влияет на воспринимаемую кислотность кофе.
Мы уже рассказывали о том, как состав воды влияет на экстракцию. Теперь разбираемся, как карбонатная жесткость влияет на pH воды и вкус кофе.
Как карбонатная жесткость влияет на pH водыЧтобы стабилизировать pH воды, нужна буферная система. А основная буферная система в воде — это как раз бикарбонаты Ca(HCO3)2. Если в воде будет много бикарбонатов, они «уничтожат» положительную кислотность кофе.
В кофе насчитывается более 40 органических кислот. От вида и соотношения кислот зависит вкус напитка: будет ли это приятная искристая кислотность или неприятная уксусная. Для этого в индустрии спешелти проводят эксперименты с ферментацией — процессом, при котором количество кислот в кофе увеличивается.
От вида и соотношения кислот в кофе зависит вкус напитка. А состав воды определяет экстракцию этих кислот
Большинство кислот в кофе слабые.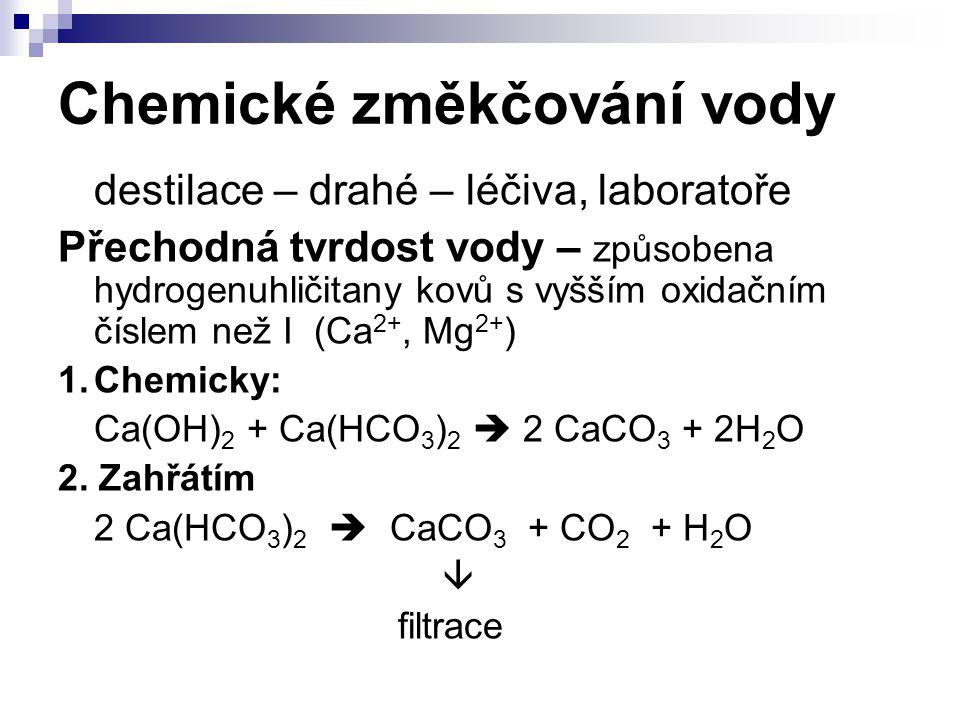 Это значит, что даже незначительные отклонения в составе воды могут сильно повлиять на вкусовые свойства. Если взять воду с разным исходным ppm — уровнем минерализации — ppm кофе на выходе будет одинаковым, а вот вкус разным. Все потому, что разная вода по-разному растворяет вещества из кофе.
Это значит, что даже незначительные отклонения в составе воды могут сильно повлиять на вкусовые свойства. Если взять воду с разным исходным ppm — уровнем минерализации — ppm кофе на выходе будет одинаковым, а вот вкус разным. Все потому, что разная вода по-разному растворяет вещества из кофе.
Итак, вкус кофе меняется в зависимости от параметров воды. Когда уровень pH понижается, растет кислотность воды, и кофе получается кислым. Если уровень pH повышается, во вкусе кофе появляется горечь. Чтобы уровень pH оставался стабильным, в воде должны содержаться бикарбонаты. Нужно только подобрать оптимальное соотношение минеральных веществ в воде.
Как подобрать допустимый диапазон карбонатной жесткостиSpecialty Coffee Association выпустила стандарты, согласно которым допустимый диапазон карбонатной жесткости: ± 40 ppm. Карбонатная жесткость измеряется по шкале KH, а общая — по шкале GH.
Целевые показатели воды от SCA
Спецификация расплывчата, непонятно, что означает «плюс-минус» в отношении диапазона KH. Максвелл Колонна-Дэшвуд и Кристофер Хэндон в книге «Вода для кофе. Наука. История. Руководство» провели серию экспериментов, чтобы проверить, что будет со вкусом кофе при разных соотношениях общей и карбонатной жесткости воды.
Максвелл Колонна-Дэшвуд и Кристофер Хэндон в книге «Вода для кофе. Наука. История. Руководство» провели серию экспериментов, чтобы проверить, что будет со вкусом кофе при разных соотношениях общей и карбонатной жесткости воды.
Проблема. Недостаточно буфера, чтобы экстрагировать сильные кислоты.
Кислотность в кофе получается очень приглушенной.
Максимальная карбонатная жесткость и минимальная общая жесткость (точка B)Проблема. Не экстрагируются сложные вкусоароматические вещества. Не сформировалось тело напитка. Буфер нейтрализовал слабые положительные кислоты.
Вкус плоский, едкий, пережаренный.
Минимальная общая жесткость и минимальная карбонатная жесткость (точка С)Проблема. Вода становится слишком пустой. Она не может извлечь нужное количество соединений из кофе из-за недостаточного количества минералов.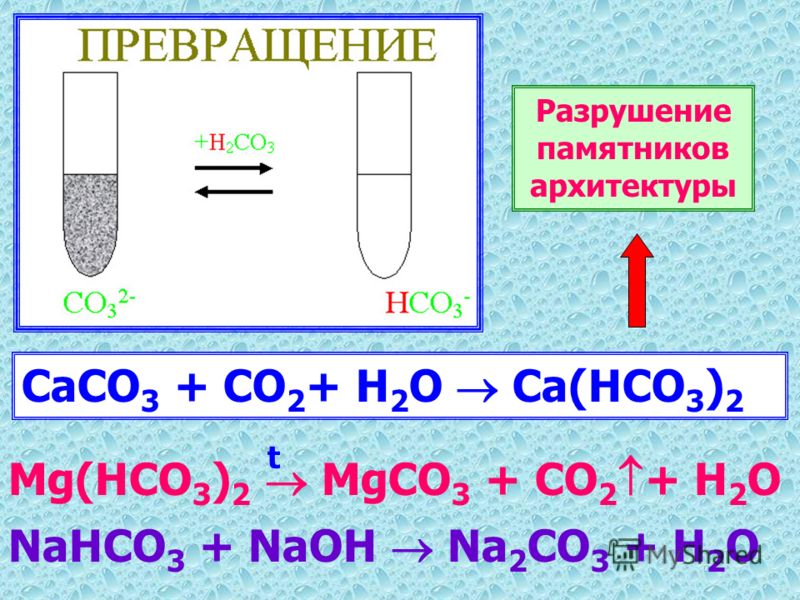 Плохо сформированное тело кофе.
Плохо сформированное тело кофе.
Вкус пустой, слегка уксусный.
Максимальная карбонатная жесткость и максимальная общая жесткость (точка D)Проблема. Из-за максимальной KH вероятность образования накипи резко возрастает. Чтобы компенсировать такую высокую буферную способность, требуется очень высокая экстракция, поэтому GH тоже должна быть высокой. Из-за высокого содержания минеральных веществ вода быстро переэкстрагирует кофе.
Вкус горький, терпкий, пустой.
Итак, чтобы получить сбалансированный вкус, в кофе должны быть кальций, магний и небольшое содержание буфера.
Исследуя карту воды, Максвелл Колонна-Дэшвуд и Кристофер Хэндон постарались найти границы для каждого параметра. Эти точки не являются конкретными значениями, но находятся в пределах погрешности около 10 ppm
Как показали эксперименты Максвелла Колонна-Дэшвуда и Кристофера Хэндона, для стабильного вкуса кофе в воде должно быть сохранено небольшое количество буфера. В качестве отправной точки вы можете использовать соотношение GH и KH 2:1.
В качестве отправной точки вы можете использовать соотношение GH и KH 2:1.
Если баланс нарушен, проверьте состав воды и параметры водоподготовки. Для домашнего приготовления кофе выбирайте бутилированную воду с карбонатной жесткостью 50-70 мг/л при рН 7,0. Бариста могут менять параметры водоподготовки для кофемашины в сторону уменьшения или увеличения солей в воде.
Мы уже рассказывали о том, как выбрать воду для кофе, как контролировать качество воды, которая попадает в кофемашину и как измерить вкус кофе по специальным параметрам. Чтобы понять, как состав вашей воды влияет на готовый напиток, ориентируйтесь на вкус кофе. Экспериментируйте, пробуйте разную воду и меняйте параметры водоподготовки с учетом желаемого вкуса. Так вы сможете получить кофе с яркой приятной кислотности.
Что запомнить-
В воде должно содержаться небольшое количество бикарбонатов — до 70 ppm.
 Они помогают держать pH воды под контролем, что положительно влияет на приятную кислотность кофе.
Они помогают держать pH воды под контролем, что положительно влияет на приятную кислотность кофе. -
Правильно подбирайте воду для заваривания кофе. Обращайте внимание на показатель «гидрокарбонат» на этикетке, оптимальное значение — 50-70 мг/л при рН 7,0.
-
Важно не оценивать общую и карбонатную жесткость по отдельности. Их соотношение влияет на вкус кофе. Рекомендуемое соотношение GH и KH 2:1.
-
При высоком содержании карбоната киcлотность будет не цитрусово-ягодной, а плоской и землистой. При низком содержании карбоната вкус получается уксусным и кислым.
Умягчение воды
Умягчители предназначены для удаления из воды солей кальция и магния путём ионного обмена (замещение ионов кальция и магния на ионы натрия) при помощи ионообменной смолы.
Самый распространенный метод умягчения воды – натрий-катионирование. Метод основан на способности ионообменных материалов обменивать на ионы кальция и магния ионы других веществ, не образующих накипь на теплонапряженной поверхности (трубные экраны котлов, теплообменники, поверхности жаротрубных котлов). Веществ таких немало, но в связи с доступностью и относительной дешевизной хлорида натрия именно он был выбран в качестве реагента для регенерации катионита. Кроме того, продукты регенерации – CaCl2, MgCl2 – хорошо растворимы в воде, в отличие, например, от СаСО3 (регенерация карбонатом натрия (Na2CO3) или CaSO4 (регенерация сульфатом натрия (Na2SO4)).
Реакции обмена ионами (R – комплекс катионита, упрощенно называемый анионитной частью катионита):
- 2 NaR + Ca(HCO3)2 -?CaR2 + 2NaHCO3; (4.3)
- 2 NaR + Mg(HCO3)2 -?MgR2 + 2NaHCO3; (4.4)
- 2 NaR + CaCl2 -?CaR2 + 2NaCl; (4.5)
- 2 NaR + MgSO4 -?MgR2 + Na2SO4; (4.
 6)
6) - 2 NaR + CaSiO3 -?CaR2 + Na2SiO3, (4.7)
Уравнения реакций с солями MgCl2, CaSO4 и MgSiO3 аналогичны уравнениям (4.5), (4.6), (4.7) соответственно. Замена ионов кальция и магния ионом натрия гарантирует отсутствие накипеобразования на греющих поверхностях котлов и теплообменников. По мере пропускания воды через слой катионита количество ионов натрия, способных к обмену, уменьшается, а количество ионов кальция и магния, задержанных на смоле, возрастает, то есть катионит «истощается». Тогда его следует регенерировать – пропустить через слой катионита раствор хлорида натрия, и обменная способность катионита восстанавливается.
Процессы ионного обмена обратимы. Поэтому если в воде ионов натрия становится все больше и больше по сравнению с количеством ионов кальция и магния, то процесс поглощения ионов Ca2+ и Mg2+ замедляется, то есть все больше сдвигается в левую сторону реакций (4.3)–(4.7) и может быть изображен так:
- CaR2 + 2Na+ -?2NaR + Ca2+; (4.
 8)
8) - MgR2 + 2Na+ -?2NaR + Mg2+. (4.9)
- Ионы Na+, Ca2+ и Mg2+ названы противоионами.Это свойство катионитов имеет два следствия. Первое. При увеличении минерализации обрабатываемой воды (увеличение идет, в основном, за счет увеличения содержания в воде натрия и в гораздо меньшей степени – калия) получение глубоко умягченной воды традиционным натрий-катионированием – даже двухступенчатым – становится все более проблематичным.
Второе. Обеспечивается возможность регенерации катионита 5–10%-ным раствором хлорида натрия. Концентрация иона натрия в растворе при этом заведомо и намного больше концентрации ионов кальция и магния в катионите.
В то же время улучшать эффективность регенерации путем увеличения концентрации регенерирующего раствора можно до определенного предела, диктуемого экономическими соображениями, которые вынуждают ограничиваться некоторым расходом раствора, то есть уменьшать объем раствора при увеличении концентрации натрий хлорида. Это, в свою очередь, уменьшает эффективность регенерации, так как вытесненные из катионита ионы Ca2+ и Mg2+ распределяются в меньшем объеме регенерационного раствора, концентрация их увеличивается, и в качестве противоионов они в таких условиях более действенны.
Это, в свою очередь, уменьшает эффективность регенерации, так как вытесненные из катионита ионы Ca2+ и Mg2+ распределяются в меньшем объеме регенерационного раствора, концентрация их увеличивается, и в качестве противоионов они в таких условиях более действенны.
Одновременно уменьшение объема раствора регенеранта снижает полноту регенерации, так как уменьшение количества этого раствора снижает его обмен в пространстве между зернами катионита – желательна трехкратная смена жидкости в этом пространстве.
Для компенсации описанного недостатка рекомендуется двухступенчатая регенерация: сначала разбавленным (2–3%-ным), затем более концентрированным (10–12%-ным) раствором хлорида натрия. Аналог такого способа регенерации – двухступенчатое натрий-катионирование.
В фильтре второй ступени противоионов Ca2+ и Mg2+ очень мало, и они хорошо вытесняются концентрированным раствором NaCl.
Скорость фильтрования регенерационного раствора при ограниченном его расходе всегда меньше скорости фильтрования умягчаемой воды. Для того чтобы диффузия ионов Na+ внутрь зерна катионита и ионов Ca2+ и Mg2+ из зерна в раствор осуществлялась в достаточной мере, нужно время – не менее 15 мин. Этим и определяется максимальная скорость фильтрования регенерационного раствора через слой катионита – 4–6 м/ч (условно принимается, что фильтр пустой).
Для того чтобы диффузия ионов Na+ внутрь зерна катионита и ионов Ca2+ и Mg2+ из зерна в раствор осуществлялась в достаточной мере, нужно время – не менее 15 мин. Этим и определяется максимальная скорость фильтрования регенерационного раствора через слой катионита – 4–6 м/ч (условно принимается, что фильтр пустой).
Температура, как и в большинстве химических процессов, интенсифицирует диффузию ионов, и поэтому там, где возможно, производится нагревание умягчаемой воды и регенерационного раствора хотя бы до 35–40°С.
Значение водородного показателя (рН) умягчаемой воды существенно влияет на обменную емкость катионита в натриевой форме. Чем ниже рН (чем больше в воде ионов Н+), тем больше ионов H+ участвуют в обмене с ионами Na Ионы водорода обладают несколько б ‘ольшим, чем ионы натрия (см. лиотропный ряд в ч. 2, п. 4.3.8), сродством к катиониту, поэтому поглощенные катионитом ионы H+ плохо вытесняются ионами Na+, то есть «законные» места ионов Na+ заняты ионами H+. Значит, обменная емкость катионита по ионам Ca2+ и Mg2+ снижается.
Калькулятор жесткости воды — Мосводоканал
Одним из наиболее часто задаваемых вопросов жителями города Москвы является вопрос о величине жесткости питьевой воды. Это обусловлено широким распространением в быту посудомоечных и стиральных машин, для которых расчет загрузки моющих средств осуществляется исходя из фактического значения жесткости используемой воды.
Узнать значение жесткости воды по своему адресу вы можете с помощью нашего электронного сервиса «Качество воды в районах Москвы».
В России жесткость измеряют в «градусах жесткости», а мировые производители используют принятые в своих странах единицы измерения. Поэтому для удобства жителей создан «Калькулятор жесткости», с помощью которого можно перевести значения жесткости из одной системы измерения в другую, чтобы правильно настроить свою бытовую технику.
°Ж °DH °Clark °F Ppm | = | °Ж °DH °Clark °F Ppm |
Все, что вы хотели знать про жесткость московской воды
Жесткостью называют совокупность свойств воды, связанных с содержанием в ней растворённых солей, главным образом, кальция и магния, так называемых «солей жесткости». Общая жесткость складывается из временной и постоянной. Временную жесткость можно устранить кипячением воды, что обусловлено свойством некоторых солей выпадать в осадок, образуя так называемую накипь на бытовых кухонных приборах.
Жесткость воды является характеристикой конкретного источника водоснабжения и не изменяется в процессе подготовки питьевой воды.
Согласно ГОСТ 31865-2012 «Вода. Единицы жесткости», единица измерения жесткости – градус жесткости (оЖ), величина которого соответствует 1 мг-экв./л. По рекомендации Всемирной организации здравоохранения человек получает магний и кальций в достаточном количестве при условии потребления воды жесткостью примерно 5ºЖ.
Московская водопроводная вода не нуждается в дополнительном умягчении, поскольку ее жесткость находится именно в этих пределах. Не стоит забывать, что магний и кальций – два необходимых элемента, поступающих в организм человека из воды.
Нормативные требования и рекомендации
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды: кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается. Московская питьевая вода по данным показателям соответствует рекомендациям ВОЗ.
Российские нормативные документы (СанПиН 1.2.3685-21, СанПиН 2.1.3684-21) для питьевой воды регламентируют: кальций – норматив не установлен; магний – не более 50 мг/л; жесткость — не более 7°Ж.
Норматив физиологической полноценности бутилированной воды (СанПиН 2.1.4.1116-02): кальций – 25-130 мг/л; магний – 5-65 мг/л; жесткость – 1,5-7°Ж.
По содержанию кальция и магния бутилированная вода высшей категории ничем не лучше воды из-под крана!
В целом московская вода централизованной системы питьевого водоснабжения относится к водам средней жесткости и по фактическим значениям соответствует показателю физиологической полноценности, установленного для бутилированных вод высшей категории качества. Вода не содержит вредных для здоровья человека соединений и безопасна для потребления.
Изменяется ли жесткость воды в течение года?
Основной фактор, влияющий на величину жесткости – растворение горных пород, содержащих кальций и магний (известняки, доломиты), при прохождении через них природной воды.
Основой водоснабжения Москвы являются в поверхностные воды — водные ресурсы рек и водохранилищ. Поверхностные воды, в целом, более мягкие, чем подземные, в частности из артезианских источников.
Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая максимума в зимний период.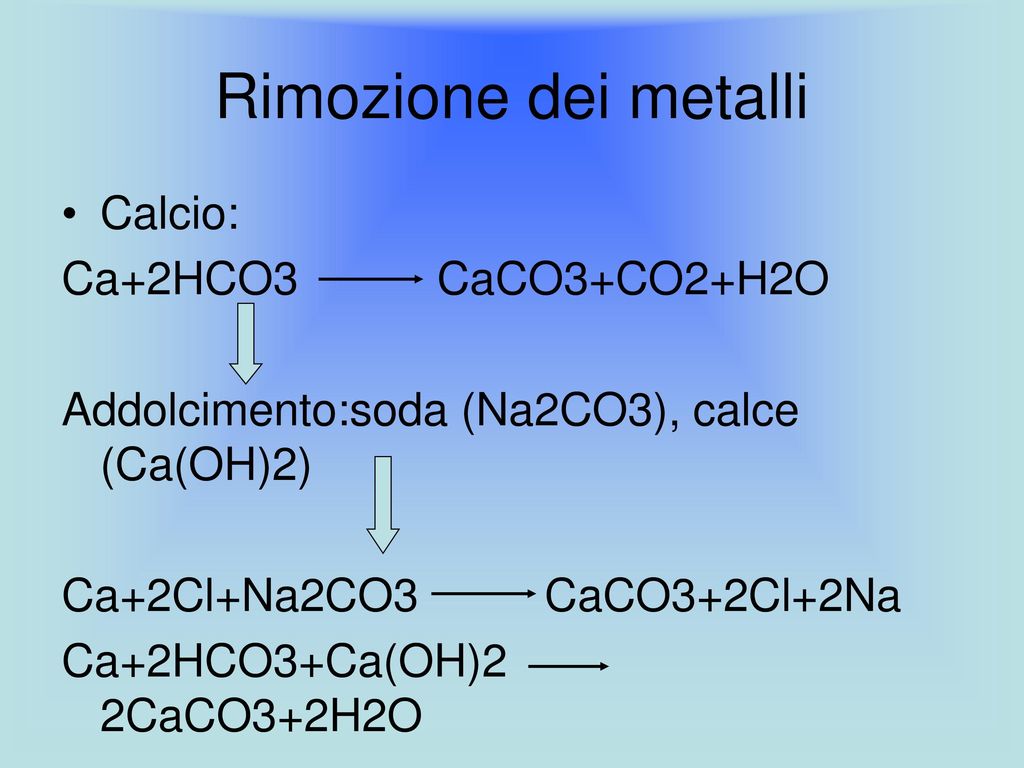 Во всех районах города Москвы ее минимальные и максимальные значения колеблются от 1,9 до 5-5,7 градусов жесткости в зависимости от времени года. Минимальные величины жесткости типичны для периодов половодья или паводка, когда происходит интенсивное поступление в источники водоснабжения мягких талых или дождевых вод.
Во всех районах города Москвы ее минимальные и максимальные значения колеблются от 1,9 до 5-5,7 градусов жесткости в зависимости от времени года. Минимальные величины жесткости типичны для периодов половодья или паводка, когда происходит интенсивное поступление в источники водоснабжения мягких талых или дождевых вод.
Можно ли пить жесткую воду?
Не стоит забывать, что магний и кальций – два необходимых элемента для организма человека. А питьевая вода является одним из ценных источников, поскольку обусловливающие жесткость воды соли кальция и магния в значительной мере поступают в наш организм вместе с водой.
Так, с питьем в организм поступает до 10-15% суточной нормы кальция — он, как известно, залог крепких костей и зубов. А магний — ключевой участник более чем 250 химических реакций в теле человека; он входит в состав всех тканей и клеток. При этом организм не может самостоятельно вырабатывать магний — для этого нужна магниесодержащая вода и пища.
Соответственно, вода не может быть абсолютно мягкой, в ней обязательно должны присутствовать соли магния и кальция. Если постоянно пить чересчур мягкую воду, организму очень скоро может потребоваться фармацевтическая поддержка — витамины, препараты.
Дополнительное умягчение московской воды не требуется для питья и приготовления еды!
Нам с Вами, как жителям средней полосы России, природа подарила оптимальный состав солей жесткости воды, которые нужны для нормальной работы нашего организма, в том числе сердечно-сосудистой системы. Этот состав природной воды из рек и водохранилищ – источников водоснабжения Москвы – сохраняется в процессе подготовки питьевой воды на станциях водоподготовки. Бесконтрольное же умягчение такой воды на бытовой установке доочистки может привести к снижению величины жесткости до слишком маленьких величин, что будет медленно, но неуклонно негативно отражаться на здоровье, и в перспективе потребует приема фармацевтических препаратов, содержащих кальций и магний.
Как настроить работу бытовой техники под жесткость воды?
Это тоже один из популярных вопросов жителей города, вызванный широким распространением в быту посудомоечных и стиральных машин, для которых расчет загрузки моющих средств осуществляется исходя из фактического значения жесткости используемой воды.
В России жесткость измеряют в «градусах жесткости», а мировые производители используют принятые в своих странах единицы измерения.
Поэтому для удобства жителей на сайте Мосводоканала и создан «Калькулятор жесткости», с помощью которого можно перевести значения жесткости из одной системы измерения в другую, чтобы правильно настроить свою бытовую технику.
Узнав на сайте Мосводоканала жесткость воды в своем доме с помощью сервиса «Качество воды в районах Москвы», вы вводите этот показатель в «Калькулятор жесткости». Выбрав требуемую единицу измерения, которая указана в инструкции для вашей техники, вы получите в результате расчета калькулятора значение, которое необходимо выставить на шкале бытового прибора для оптимального режима работы той же посудомоечной машины.
Растворение арагонит-стронцианитовых твердых растворов в нестехиометрических растворах Sr(HCO3)2-Ca(HCO3)2-CO2-h3O
Авторы: Нил Пламмер , Э. Бузенберг, П. Д. Глинн и А. Э. Блюм
Твитнуть
Ссылки
- На складе публикаций нет ссылок на цифровые версии этой публикации по адресу в это время
- Скачать цитату как: РИС | Дублин Ядро
Аннотация
Синтетические твердорастворные минералы стронцианит-арагонит растворяли в насыщенных СО2 нестехиометрических растворах Sr(HCO3)2 и Ca(HCO3)2 при 25??С. Результаты показывают, что ни одна из реакций растворения не достигает термодинамического равновесия. Конгруэнтное растворение в растворах Ca(HCO3)2 либо достигает, либо близко приближается к стехиометрическому насыщению по отношению к растворяющемуся твердому веществу. В растворах Sr(HCO3)2 реакции обычно становятся неконгруэнтными, осаждая Sr-богатую фазу до достижения стехиометрического насыщения. Растворение механических смесей твердых веществ приближается к стехиометрическому насыщению по отношению к наименее стабильному твердому веществу в смеси. Поглощение поверхности из ненасыщенных объемных растворов наблюдалось в первые минуты растворения. Эта поверхностная фаза имеет толщину 0-10 атомных слоев в растворах Sr(HCO3)2 и 0-4 слоя в растворах Ca(HCO3)2, а затем растворяется и/или перекристаллизуется, обычно в течение 6 мин реакции. За начальным переходным процессом поверхностного осаждения (перекристаллизации) следует конгруэнтное растворение исходного твердого вещества, которое продолжается до стехиометрического насыщения или до осаждения более стабильного твердого вещества, богатого Sr.
Результаты показывают, что ни одна из реакций растворения не достигает термодинамического равновесия. Конгруэнтное растворение в растворах Ca(HCO3)2 либо достигает, либо близко приближается к стехиометрическому насыщению по отношению к растворяющемуся твердому веществу. В растворах Sr(HCO3)2 реакции обычно становятся неконгруэнтными, осаждая Sr-богатую фазу до достижения стехиометрического насыщения. Растворение механических смесей твердых веществ приближается к стехиометрическому насыщению по отношению к наименее стабильному твердому веществу в смеси. Поглощение поверхности из ненасыщенных объемных растворов наблюдалось в первые минуты растворения. Эта поверхностная фаза имеет толщину 0-10 атомных слоев в растворах Sr(HCO3)2 и 0-4 слоя в растворах Ca(HCO3)2, а затем растворяется и/или перекристаллизуется, обычно в течение 6 мин реакции. За начальным переходным процессом поверхностного осаждения (перекристаллизации) следует конгруэнтное растворение исходного твердого вещества, которое продолжается до стехиометрического насыщения или до осаждения более стабильного твердого вещества, богатого Sr. Составы вторичных выделений не соответствуют состояниям термодинамического равновесия или стехиометрического насыщения. Рентгенофотоэлектронная спектроскопия (РФЭС) свидетельствует об образовании твердых растворов на поверхности монокристаллов арагонита и стронцианита, погруженных в растворы Sr(HCO3)2 и Ca(HCO3)2 соответственно. В растворах Sr(HCO3)2 сигнал РФЭС снаружи ~ 60 А?? на арагоните указывает на состав 16 мол.% SrCO3 уже через 2 мин контакта и 14-18 мол.% SrCO3 через 3 недели контакта. Поверхность стронцианита составляет в среднем примерно 22 мол.% CaCO3 после 2 мин контакта с раствором Ca(HCO3)2 и составляет 34-39мол.% CaCO3 через 3 недели контакта. Анализ XPS предполагает, что состав поверхности зональный с несколько большим обогащением во внешнем ~ 25 A?? (до 26 мол. % SrCO3 на арагоните и 44 мол. % CaCO3 на стронцианите). Результаты указывают на быстрое образование поверхностной фазы твердого раствора из ненасыщенных водных растворов. Поверхностная фаза постоянно корректирует свой состав в ответ на изменения в составе основного флюида по мере того, как происходит чистое растворение.
Составы вторичных выделений не соответствуют состояниям термодинамического равновесия или стехиометрического насыщения. Рентгенофотоэлектронная спектроскопия (РФЭС) свидетельствует об образовании твердых растворов на поверхности монокристаллов арагонита и стронцианита, погруженных в растворы Sr(HCO3)2 и Ca(HCO3)2 соответственно. В растворах Sr(HCO3)2 сигнал РФЭС снаружи ~ 60 А?? на арагоните указывает на состав 16 мол.% SrCO3 уже через 2 мин контакта и 14-18 мол.% SrCO3 через 3 недели контакта. Поверхность стронцианита составляет в среднем примерно 22 мол.% CaCO3 после 2 мин контакта с раствором Ca(HCO3)2 и составляет 34-39мол.% CaCO3 через 3 недели контакта. Анализ XPS предполагает, что состав поверхности зональный с несколько большим обогащением во внешнем ~ 25 A?? (до 26 мол. % SrCO3 на арагоните и 44 мол. % CaCO3 на стронцианите). Результаты указывают на быстрое образование поверхностной фазы твердого раствора из ненасыщенных водных растворов. Поверхностная фаза постоянно корректирует свой состав в ответ на изменения в составе основного флюида по мере того, как происходит чистое растворение. Скорость растворения конечных элементов значительно снижается в нестехиометрических растворах по сравнению со скоростью растворения, наблюдаемой в стехиометрических растворах. Все твердые вещества растворяются медленнее в растворах с добавлением наименее растворимого компонента ((Sr(HCO3)2)), чем в растворах с добавлением более растворимого компонента (Ca(HCO3)2), и этот эффект становится все более значительным по мере приближения к стехиометрическому насыщению. . Предполагается, что образование нестехиометрической поверхностной реакционной зоны значительно снижает скорость растворения.
Скорость растворения конечных элементов значительно снижается в нестехиометрических растворах по сравнению со скоростью растворения, наблюдаемой в стехиометрических растворах. Все твердые вещества растворяются медленнее в растворах с добавлением наименее растворимого компонента ((Sr(HCO3)2)), чем в растворах с добавлением более растворимого компонента (Ca(HCO3)2), и этот эффект становится все более значительным по мере приближения к стехиометрическому насыщению. . Предполагается, что образование нестехиометрической поверхностной реакционной зоны значительно снижает скорость растворения.
| Тип публикации | Артикул |
|---|---|
| Подтип публикации | Журнальная статья |
| Титул | Растворение арагонит-стронцианитовых твердых растворов в нестехиометрических растворах Sr(HCO3)2-Ca(HCO3)2-CO2-h3O |
| Название серии | Геохимика и Космохимика Acta |
| Том | 56 |
| Выпуск | 8 |
| Год публикации | 1992 |
| Язык | Английский |
| Издатель | Эльзевир |
| Содействующий(ие) офис(а) | Программа гидрологии токсичных веществ |
| Описание | 28 стр. |
| Первая страница | 3045 |
| Последняя страница | 3072 |
| Аналитические метрики Google | Страница показателей |
Как образуется CA HCO3 2? – KnowledgeBurrow.com
Джим Браун Статьи
Содержание
- 1 Как образуется CA HCO3 2?
- 2 Откуда берется бикарбонат кальция?
- 3 Что является продуктом CA HCO3 2?
- 4 Что происходит при нагревании Ca HCO3 2?
- 5 Бикарбонат кальция является щелочным или кислым?
- 6 В чем разница между бикарбонатом кальция и карбонатом кальция?
- 7 Сколько атомов содержит Ca HCO3 2?
- 8 Как рассчитать щелочность HCO3 и CaCO3?
- 9 Что такое коэффициент преобразования CaCO 3 в кальций?
- 10 Как рассчитать молекулярную массу MG (HCO3) 2?
Как образуется CA HCO3 2?
В обратном процессе растворенный диоксид углерода (CO2) в дождевой воде (h3O) реагирует с известняковым карбонатом кальция (CaCO3) с образованием растворимого бикарбоната кальция (Ca(HCO3)2).
Откуда берется бикарбонат кальция?
Бикарбонат кальция, естественным образом присутствующий в жесткой воде, откладывает карбонат кальция на металлических катодах и подавляет реакцию.
Как приготовить смесь бикарбоната кальция?
Ca(HCO3)2
Бикарбонат кальция/Формула
Что является продуктом CA HCO3 2?
| 1 | Ca(HCO3)2 → h3O + CO2 + CaCO3 |
|---|---|
| 2 | HCO3:- + Ca:2+ → h3O + CO2 + CaCO3 |
| 3 | CaCl2 + NaHCO3 → h3O + CO2 + NaCl + CaCO3 |
Что происходит при нагревании Ca HCO3 2?
Ca(HCO3)2. CaCO3 + CO2 + h3O Термическое разложение гидрокарбоната кальция с образованием карбоната кальция, диоксида углерода и воды. Реакция протекает в кипящем растворе.
Существует ли Ca HCO3 2 в твердом состоянии?
LiHCO3, Zn(HCO3)2, AgHCO3 не существует в твердом состоянии, но существует в водном растворе. С другой стороны, бикарбонат натрия и бикарбонат кальция существуют в твердом состоянии.
С другой стороны, бикарбонат натрия и бикарбонат кальция существуют в твердом состоянии.
Бикарбонат кальция является основным или кислым?
Карбонат кальция также считается щелочным резервом, способным поглощать протон, а также предотвращать подкисление бумаги.
В чем разница между бикарбонатом кальция и карбонатом кальция?
Основное различие между карбонатом кальция и бикарбонатом кальция заключается в том, что молекула карбоната кальция состоит из химических элементов Ca, C и O, тогда как бикарбонат кальция состоит из химических элементов Ca, C, O и H. Карбонат кальция представляет собой карбонат кальция, имеющий химическую формулу CaCO3.
Является ли пищевая сода таким же, как карбонат кальция?
Вариант бикарбоната натрия широко доступен как «пищевая сода» и обычно используется в выпечке, но ни в одном из рецептов в этой книге он не используется в качестве ингредиента. Версия пищевой соды с карбонатом кальция иногда продается как «заменитель пищевой соды», а иногда упоминается просто как «пищевая сода».
Сколько атомов содержит Ca HCO3 2?
Сколько атомов содержится в одной формульной единице гидрокарбоната кальция Ca(HCO3)2? Может кто-нибудь объяснить мне, почему ответ 11? Спасибо.
Как рассчитать щелочность HCO3 и CaCO3?
Естественная щелочность находится в диапазоне от 400 до 500 мг/л. Например, рассчитайте щелочность, если в 1 л воды содержится 0,35 г HCO3(-) и 0,12 г карбонат-ионов CO3(2-). Что вам понадобится: Рассчитайте молярную массу HCO3(-), CO3(2-) и CaCO3 как сумму масс всех атомов в молекуле.
Как сбалансировать NaHCO3 с h3O и CO2?
Повторите попытку позже. В этом видео мы сбалансируем уравнение NaHCO3 = Na2CO3 + h3O + CO2 и предоставим правильные коэффициенты для каждого соединения. Чтобы сбалансировать NaHCO3 = Na2CO3 + h3O + CO2, вам нужно обязательно посчитать все атомы с каждой стороны химического уравнения.
Чтобы сбалансировать NaHCO3 = Na2CO3 + h3O + CO2, вам нужно обязательно посчитать все атомы с каждой стороны химического уравнения.
Какой коэффициент преобразования CaCO 3 в кальций?
Тест на кальций откалиброван по CaCO 3 , поэтому коэффициент пересчета 2,5 (50/20) не требуется. Жесткость, магний, щелочность и свободная неорганическая кислота часто указываются в пересчете на CaCO 3 ; указанное значение является массой CaCO 3 , которая химически эквивалентна количеству присутствующего материала.
Как рассчитать молекулярную массу MG (HCO3) 2?
Молярная масса Mg(HCO3)2 = 146,33868 г/моль. Преобразуйте граммы Mg(HCO3)2 в моли или моли Mg(HCO3)2 в граммы. Расчет молекулярной массы:
Почему гидрокарбонат кальция растворяется в воде, а карбонат кальция нерастворим?
Дело в том, что карбонат кальция нерастворим, а бикарбонат кальция растворим в воде. Это немедленно приведет нас к заключению, что энергия гидратации < энергии решетки в карбонате кальция и энергия гидратации > энергии решетки в бикарбонате кальция. Это однострочный ответ. Часть ответа «Почему» подробно описана ниже.
Это немедленно приведет нас к заключению, что энергия гидратации < энергии решетки в карбонате кальция и энергия гидратации > энергии решетки в бикарбонате кальция. Это однострочный ответ. Часть ответа «Почему» подробно описана ниже.
Краткий обзор энергии решетки и энергии гидратации
Когда полярное вещество, такое как соль, добавляется в воду, оно притягивается водой. Но когда в воду добавляется неполярное масло, оно не притягивается полярной водой. Притяжение между растворенным веществом и водой возникает из-за их электростатического притяжения. В то время как полярное или ионное растворенное вещество имеет отрицательно заряженный и положительно заряженный конец, неполярное вещество имеет очень небольшой поверхностный заряд из-за сил Ван-дер-Ваальса. Поверхностный заряд неполярных растворенных веществ слишком мал, чтобы притягивать молекулы воды, и поэтому неполярное вещество, такое как масло, обычно нерастворимо в воде или имеет очень низкую растворимость.
Как ионные соединения растворяются в воде?
Когда ионное вещество, такое как хлорид натрия, добавляется в полярную воду, полярные молекулы растворенного вещества и растворителя притягиваются друг к другу за счет электростатического притяжения. Отрицательно заряженный кислородный конец воды притягивается к положительно заряженному натрию хлорида натрия, а ион Na+ окружается или окутывается О-концом воды. Точно так же положительно заряженный водородный конец воды притягивается к иону хлорида, а ион Cl- окружается Н+ концом молекулы воды. Это разделяет NaCl на два иона, а вода выступает в качестве перегородки между двумя ионами NaCl и, таким образом, предотвращает рекомбинацию ионов Na+ и Cl- в молекулу NaCl. Гидратированные ионы Na+ и Cl- входят в состав воды и растворяются.
Понятие энергии решетки и энергии гидратации
В процессе растворения ионного растворенного вещества в воде участвуют две силы [1] внутриатомное притяжение внутри кристалла растворенного вещества, которое удерживает положительные и отрицательные ионы в молекуле внутри кристалла – это называется энергией решетки [2] межмолекулярные силы притяжения между водой и растворенным веществом – это энергия воды, вытягивающая ионы растворенного вещества из кристалла – до того, как это могут сделать молекулы воды работа, энергия также требуется для разрыва водородных связей между молекулами воды. Суммарная энергия, необходимая воде для вытягивания ионов растворенного вещества из кристалла растворенного вещества, называется энергией гидратации. По определению ч гидратация энергия – это количество энергии, выделяющееся при гидратации одного моля ионов растворенного вещества. Источником этой энергии являются связи воды с ионами растворенных веществ во время гидратации. Это экзотермический процесс.
Суммарная энергия, необходимая воде для вытягивания ионов растворенного вещества из кристалла растворенного вещества, называется энергией гидратации. По определению ч гидратация энергия – это количество энергии, выделяющееся при гидратации одного моля ионов растворенного вещества. Источником этой энергии являются связи воды с ионами растворенных веществ во время гидратации. Это экзотермический процесс.
Растворенное вещество растворяется в воде, когда энергия гидратации > энергии решетки.
Растворенное вещество растворяется в воде до тех пор, пока не достигнет равновесия с растворенными в нем ионами эта температура.
Любая деятельность, которая способствует большему контакту между молекулами растворенного вещества и растворителя, увеличивает растворимость растворенного вещества.
Ключевые факторы
Размер частиц растворенного вещества
Небольшая молекула из-за своей большой площади поверхности способствует большему контакту с растворителем, чем большая молекула с меньшей площадью поверхности, поэтому маленькие молекулы более растворимы.
Перемешивание
Перемешивание сближает молекулы растворенного вещества и растворителя и обеспечивает больший контакт, поэтому перемешивание ускоряет растворение растворенного вещества в растворителе.
Температура
Повышение температуры увеличивает кинетическую энергию как растворителя, так и частиц растворенного вещества, вызывая больше столкновений и, следовательно, больше контактов, и, следовательно, увеличивает растворимость. Существуют вещества, обладающие обратной температурной растворимостью. Это, однако, другая тема, и здесь нет места для обсуждения.
Закон Кулона
Сила притяжения между противоположно заряженными ионами в растворенном веществе подчиняется закону Кулона: F = k * q1 * q2 / r2, где F представляет собой силу притяжения в ньютонах, q1 и q2 представляют собой заряды двух ионов в кулонах, r представляет собой расстояние между ядрами ионов в метрах, а k представляет собой константу пропорциональности.

 Они помогают держать pH воды под контролем, что положительно влияет на приятную кислотность кофе.
Они помогают держать pH воды под контролем, что положительно влияет на приятную кислотность кофе.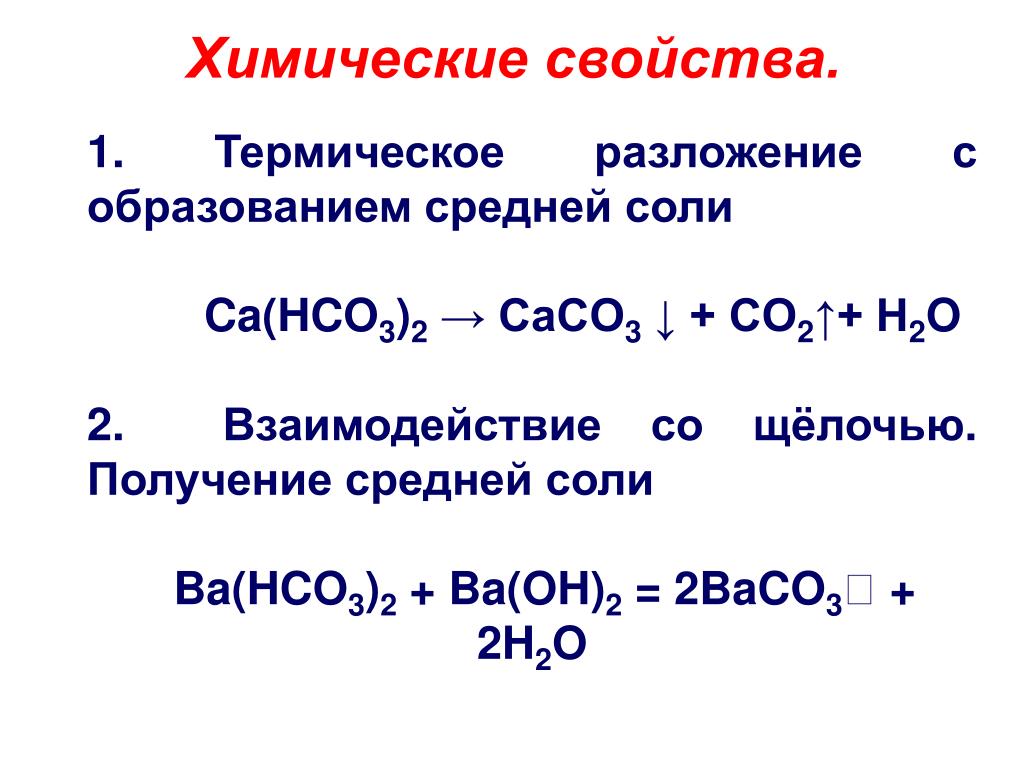 6)
6) 8)
8)