Комплексные соединения — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
[Al(h3O)6]Cl3
катион
NaCl
Ca[Hg(CN)4]
анион
Ca(NO3)2
Строение комплексных соединений
объясняется с позиций
координационной теории
швейцарского учёного А. Вернера.
В комплексном соединении различают 2 сферы:
внешнюю и внутреннюю.
Пример анионного комплекса
Пример катионного комплекса
[Cu(Nh4)4][PtCl4]
Пример катионанионного комплекса
Пример нейтрального комплекса
(соль Пейроне)
Кислоты
Основания
Соли
Неэлектролиты
h3[SiF6] [Cu(Nh4)4](OH)2
Na3[AlF6]
[Ni(CO)4]
Наиболее часто встречаются комплексы
с координационным числом
центрального атома 6 и 4
10.
 Получение • CuSO4 + 4Nh4
Получение • CuSO4 + 4Nh4• Fe(CN )2 + 4KCN
• PtCl2 + 2Nh4
[Cu(Nh4)4]SO4
K4[Fe(CN)6]
[Pt(Nh4)2Cl2]
Если центральный ион входит в состав
комплексного аниона, то анион
называется:
Fe – феррат
Cu – купрат
Ag – аргентат
Au – аурат
Hg – меркурат
Zn – цинкат
Al – алюминат и т.д.
[Cu(Nh4)4]SO4
Сульфат тетраамминмеди(II)
K3[Fe(CN)6]
Гексацианоферрат(III) калия
[Co(Nh4)4(h3O)CN]3(PO4)2
Фосфат цианоакватетраамминкобальта (III)
K3[Ag(S2O3)2]
Дитиосульфатоаргентат(I) калия
[Ru(h3O)(Nh4)4SO3]
Cульфитотетраамминакварутений
Nh5[Cr(SCN)4(Nh4)2]
Диамминтетрацианатохромат(III) аммония
Химические свойства:
1. Диссоциация
• Na2[Zn(OH)4] →2Na+ + [Zn(OH)4]2[Zn(OH)4]2- — комплексный анион
• [Ag(Nh4)2]Cl → [Ag(Nh4)2]+ + Cl[Ag(Nh4)2]+ — комплексный катион
2. Реакция по внешней сфере
.
• [Cu(Nh4)4]SO4+BaCl2 = BaSO4 + [Cu(Nh4)4]Cl2
.
FeCl3 K 4 Fe CN 6 KFe Fe CN 6 3 3KCl
3.
 Подвергаются термическому разложению
Подвергаются термическому разложению[Cu(Nh4)4]SO4
CuSO4 + 4Nh4
4. Разрушаются в результате образования более
устойчивого комплекса
[Ag(Nh4)2]Cl + 2KCN =K[Ag(CN)2] +
+ KCl + 2Nh4
5.Разрушаются под действием кислот
[Ag(Nh4)2]Cl+2HNO3= AgCl↓+2Nh5 NO3
Качественная реакция на Fe2+ (кр. кровяная соль)
FeSO4+K3[Fe(CN)6]→K2SO4+KFe3+[Fe+2(CN)6]
Турнбулева синь
Качественная реакция на Fe3+
(жёлт. кровяная соль)
FeCl3 K 4 Fe CN 6 KFe Fe CN 6 3 3KCl
Берлинская лазурь
3+
+2
Переносчиком кислорода у моллюсков
и членистоногих является не гемоглобин, а
комплексное соединение -гемоцианин
Построить формулы веществ по
названию:
1. Тетрайодомеркурат(II) калия
2. Гексагидроксохромат (III) натрия
3. Нитрат гексаамминникеля(II)
4. Тетрахлораурат (III) водорода
Определить степень окисления
комплексообразователя и
комплексного иона, назвать вещество:
1.
 Na4[Fe(CN)6]
Na4[Fe(CN)6]2. [Ag(Nh4)2]Cl
English Русский Правила
7 фактов о структуре Льюиса Cu[(nh4)4] 2+, характеристики —
By Сарнали Мукерджи
В этой статье будут описаны структура Льюиса Cu[(nh4)4] 2+ и 7 фактов об ионе Cu[(Nh4)4]2+, который в химии называют тетрааминовым ионом меди. Факты будут раскрыты через набросок структуры Льюиса этого сложного соединения.
Факты, которые будут описаны, иллюстрирующие внутренние характеристики соединения:
- Cu[(Nh4)4]2+ Название
- Cu[(Nh4)4]2+ Степень окисления
- Cu[(Nh4)4]2+ Магнитный момент
- Cu[(Nh4)4]2+ Форма
- Cu[(Nh4)4]2+ Цвет
- Cu[(Nh4)4]2+ Координационное число
- Cu[(Nh4)4]2+ структура Льюиса
- Cu[(Nh4)4]2+ Реакция с HCl
Комплексному соединению всегда необходимо иметь конкретное название, которое определяется применением правил, установленных IUPAC (Международным союзом теоретической и прикладной химии) с помощью его химической формулы.
Название, данное ИЮПАК Cu[(Nh4)4]2+, представляет собой тетраамин меди. Тетрааммин определяется выделением четырех аминогрупп, которые присоединены к одному иону меди.
Cu[(Nh4)4]2+ Степень окисленияСтепень окисления является одной из важных характеристик, которая определяет избыток или недостаток электронов в соединениях, то есть приобретение или потерю электрона в центральном атоме.
Степень окисления Cu в тетраамине меди составляет +2, поскольку общий комплексный ион имеет дефицит двух электронов, а соединение (Nh4)4 (аммиак) имеет нулевую степень окисления.
Cu[(Nh4)4]2+ Магнитный моментМагнитный момент относится к характеристике, которая указывает на магнитный дипольный момент, то есть тенденцию объектов или элементов выравниваться с определенной величиной магнитного поля.
Это соединение накладывает парамагнитный эффект. Магнитный момент Cu[(Nh4)4]2+ составляет 1. 73 м.н., это свойство надежно подтверждает факт о количестве n-спаренных электронов в этом соединении. Существует определенная формула, помогающая вычислить количество неспаренных электронов.
73 м.н., это свойство надежно подтверждает факт о количестве n-спаренных электронов в этом соединении. Существует определенная формула, помогающая вычислить количество неспаренных электронов.
Формула: количество неспаренных электронов = √n(n+2), где N относится к величине магнитного момента. Следовательно, это показывает, что один неспаренный электрон присутствует в соединении [√п (п + 2) = √1.73(1.73+2) = 1].
Cu[(Nh4)4]2+ ФормаФорма соединений выявляется путем расчета количества электронов, присутствующих в соединениях. Электронная конфигурация соединений достоверно отражает представление о форме соединения. Электронная конфигурация Куппера в Cu[(Nh4)4]2+: 1s2 2s2 2p6 3s2 3p6 3d0 4s0. Cu демонстрирует гибридизацию dsp2 с одним спаренным электроном. Соединение показывает квадратную планировочную форму в химии вместо тетраэдрической геометрии.
Цвет соединений зависит от обмена электронами на орбиталях. Перемещение электронов с одной орбитали на другую может влиять на степень окисления и отражает определенные элементы соединений.
Cu[(Nh4)4]2+ цвет от ВикипедияВ норме медь не имеет неспаренных электронов с заполненной D10-орбиталью, поэтому выглядит бесцветной. В Cu[(Nh4)4]2+ медь получает неспаренный электрон после добавления аммиака, что придает всему иону темно-синий цвет.
Cu[(Nh4)4]2+ Координационное числоКоординационное число относится к числу атомов, которые координируют или создают связи с другим атомом, участвующим в формировании общей сложной структуры.
Как соединение с четырьмя аммиаками, присоединяйтесь к одному ион Cu2+, что означает факт что соединение имеет четыре координационных числа. Этот комплексный ион имеет четыре сильных лиганда, поэтому он рассматривается как стабильное координационное соединение в ряду.
Число валентных электронов, присутствующих в Cu, равно 1, но в Cu2+ оно становится равным 9. Четыре соединения Nh4 содержат четыре атома азота, каждое из которых имеет одну неподеленную пару после связывания с тремя молекулами водорода. Следовательно, общее число электронов, присутствующих в четырех соединениях Nh4, равно 8.
Для получения стабильности происходит частичное разделение электронов между соединениями Cu2+ и Nh4. Согласно с Метод рисования Льюиса., структура этого соединения Cu занимает центральное положение в геометрии.
Полный эскиз Структура Льюиса показывает, что это соединение создает ковалентную связь, поскольку Cu является металлом, а Nh4 выглядит как неметалл, а как ионное соединение. Эта структура актуальна для представления электронного устройства и отсутствия электронов в комплексном ионе.
Cu[(Nh4)4]2+ Реакция с HClСоляная кислота (HCl) является сильной коррозионной кислотой, которая легко вступает в реакцию с соединениями. Реакция между этим комплексным ионом и HCl является своего рода реакцией, которая вызывает эффект изменения цвета как химическое свойство кислоты при взаимодействии с ионами.
Реакция между этим комплексным ионом и HCl является своего рода реакцией, которая вызывает эффект изменения цвета как химическое свойство кислоты при взаимодействии с ионами.
HCl сначала дает водный раствор тетраамина меди (II) в присутствии кислорода. Затем он дает избыток атома хлора I-й в середине реакции. Сбалансированное химическое уравнение приводится ниже, чтобы описать его процесс и причину проявления эффекта изменения цвета.
Cu[(Nh4)4(h3O)2]2+ + 4Cl = [CuCl]2- + 4Nh4 + 2h3O
Атом хлора добавляется к меди, так как сильное присутствие HCl разрушает ион. Другая часть комплексного иона, представляющая собой Nh4 (аммиак), извлекается из соединения. Это реакция замещения лиганда так как здесь происходит замещение сильного лиганда аммиаком в присутствии сильной кислоты.
Добавление ионов хлорида к меди превращает темно-синий цвет водного раствора тетраамина меди (II) вводят Зеленый цвет. Это происходит за счет перехода электронов. Однако после вытеснения аммиака такое изменение окраски происходит Комплекс тетрахлормеди (II) и молекула воды выступает в качестве основного продукта этой реакции.
Это происходит за счет перехода электронов. Однако после вытеснения аммиака такое изменение окраски происходит Комплекс тетрахлормеди (II) и молекула воды выступает в качестве основного продукта этой реакции.
В этой статье широко обсуждался тетраамин меди (II), один из комплексных ионов и координационных соединений в химии. Исключительный факты об этом соединении и его реакции с соляной кислотой были объяснены в этой статье.
Cu(Nh4)4SO4·h3O (Cu[SO4][Nh4]4[h3O]) Кристаллическая структура — SpringerMaterials
Получить доступ СИФ Скачать справку (pdf)
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа | У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||
| и | ||||
| | ||||
| с | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| б/к | ||||
| к/с | ||||
| В | ||||
Координаты атома
Стандартизированный
У вас нет доступа к этому содержимомуПараметры доступаДополнительные возможности доступа
| |||||||||
Опубликовано
У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||||||
Детали эксперимента
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Ссылка
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
3D интерактивная структура
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Об этом контенте
PAULING FILE Multinaries Edition — 2022 г.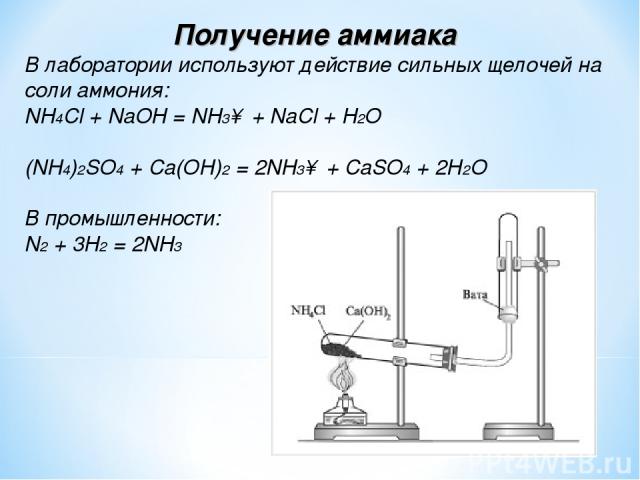
sd_1500625
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред. )
SpringerМатериалы
Cu(Nh4)4SO4·h3O (Cu[SO4][Nh4]4[h3O]) Кристаллическая структура
sd_1500625 (Springer-Verlag GmbH, Гейдельберг, © 2016)
)
SpringerМатериалы
Cu(Nh4)4SO4·h3O (Cu[SO4][Nh4]4[h3O]) Кристаллическая структура
sd_1500625 (Springer-Verlag GmbH, Гейдельберг, © 2016)
Скачать эту цитату
Цитата скопирована
sd_1500625
неорганическая химия — Каков диапазон значений n в [Cu(Nh4)4(h3O)n]SO4?
спросил
Изменено 3 года, 11 месяцев назад
Просмотрено 1к раз
$\begingroup$
В моем учебнике ион меди представлен как «сульфат тетрааминомеди(II)-1-вода», поэтому я предположил, что этот комплексный ион имеет только 1 кристаллизационную воду.
Затем в статье в Википедии ион представлен как $\ce{[Cu(Nh4)4(h3O)_n]SO4}$. Используется та же формула, но количество кристаллизационной воды варьируется и обозначается $n$. Таким образом, $n$ должен иметь диапазон значений.
Используется та же формула, но количество кристаллизационной воды варьируется и обозначается $n$. Таким образом, $n$ должен иметь диапазон значений.
Мой вопрос: что определяет значение $n$? При каком условии $n$ будет больше или меньше?
- неорганическая химия
- вода
- координационные соединения
- ионы
$\endgroup$
1
$\begingroup$
Сульфат тетраамминмеди(II) или сульфат купраммония может быть синтезирован в виде его моногидрата (ссылка 1):
Раствор $\pu{50 г}$ мелкодисперсного $\ce{CuSO4 . 5 ч3O}$ в $\pu{75 мл}$ конц. аммиака и $\pu{50 мл}$ воды фильтруют и осаждают медленным добавлением $\pu{75 мл}$ спирта. Выдержав несколько часов на холоде, кристаллы фильтруют на воронке Бюхнера, промывают смесью спирта и конц. аммиака (1:1), затем спиртом и эфиром и высушивают отсасыванием.
9{16}_{2h}$, с четырьмя молекулами в элементарной ячейке. Определение структуры проводилось с помощью проекций Паттерсона и Фурье на $(001)$ и $(100)$. Структура состоит из слоев, параллельных $(010)$, образованных квадратами $\ce{Cu(Nh4)4}$ и тетраэдрами $\ce{SO4}$, скрепленными молекулами $\ce{h3O}$. Атомы меди, лежащие в плоскостях симметрии, имеют четырех ближайших $\ce{Nh4}$ соседей ($\ce{Cu-N} = \pu{2,04-2,06 Å}$) и еще двух $\ce{h3O}$ соседи ($\ce{Cu-O} = \pu{2,59-3,37 Å}$), которые дополняют искаженную октаэдрическую координационную группу. Каждый тетраэдр $\ce{SO4}$ ($\ce{S-O} = \pu{1,40-1,43-1,46 Å}$) имеет два атома кислорода, связанных водородными связями с соседними молекулами $\ce{h3O}$ ($\ ce{OH…O} = \pu{2,67 Å}$).
Все эти данные относятся к комментарию @andselisk, который утверждает, что сульфат тетраамминмеди (II) представляет собой моногидрат , но, вероятно, поэтому статья Википедии предлагает его как $\ce{[Cu(Nh4)4(h3O)n] SO4}$, что это соединение может быть гигроскопичным, и поэтому его содержание воды может отклоняться (или меняться).

 9{16}_{2h}$, с четырьмя молекулами в элементарной ячейке. Определение структуры проводилось с помощью проекций Паттерсона и Фурье на $(001)$ и $(100)$. Структура состоит из слоев, параллельных $(010)$, образованных квадратами $\ce{Cu(Nh4)4}$ и тетраэдрами $\ce{SO4}$, скрепленными молекулами $\ce{h3O}$. Атомы меди, лежащие в плоскостях симметрии, имеют четырех ближайших $\ce{Nh4}$ соседей ($\ce{Cu-N} = \pu{2,04-2,06 Å}$) и еще двух $\ce{h3O}$ соседи ($\ce{Cu-O} = \pu{2,59-3,37 Å}$), которые дополняют искаженную октаэдрическую координационную группу. Каждый тетраэдр $\ce{SO4}$ ($\ce{S-O} = \pu{1,40-1,43-1,46 Å}$) имеет два атома кислорода, связанных водородными связями с соседними молекулами $\ce{h3O}$ ($\ ce{OH…O} = \pu{2,67 Å}$).
9{16}_{2h}$, с четырьмя молекулами в элементарной ячейке. Определение структуры проводилось с помощью проекций Паттерсона и Фурье на $(001)$ и $(100)$. Структура состоит из слоев, параллельных $(010)$, образованных квадратами $\ce{Cu(Nh4)4}$ и тетраэдрами $\ce{SO4}$, скрепленными молекулами $\ce{h3O}$. Атомы меди, лежащие в плоскостях симметрии, имеют четырех ближайших $\ce{Nh4}$ соседей ($\ce{Cu-N} = \pu{2,04-2,06 Å}$) и еще двух $\ce{h3O}$ соседи ($\ce{Cu-O} = \pu{2,59-3,37 Å}$), которые дополняют искаженную октаэдрическую координационную группу. Каждый тетраэдр $\ce{SO4}$ ($\ce{S-O} = \pu{1,40-1,43-1,46 Å}$) имеет два атома кислорода, связанных водородными связями с соседними молекулами $\ce{h3O}$ ($\ ce{OH…O} = \pu{2,67 Å}$).