Химические свойства оксидов — Персональный сайт учителя химии Куликовой Надежды Владимировны
Химические свойства оксидов: основных, амфотерных, кислотных
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
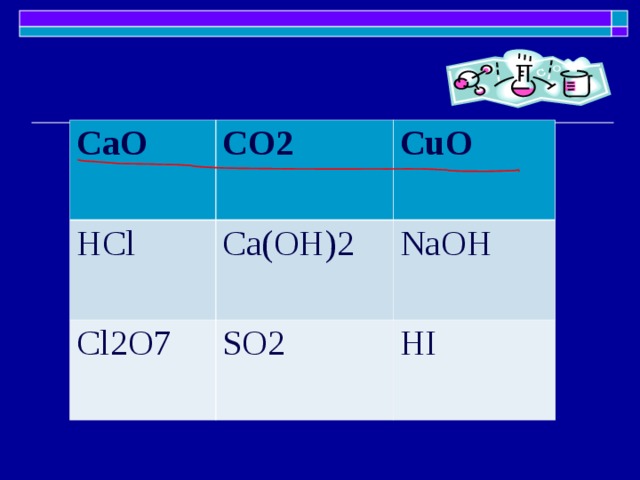
1. Основной оксид + кислота (образуется соль + вода)
Кислоты должны существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная)
Li2O + 2HCl= 2LiCl+ h3O,
NiO + h3SO4 = NiSO4 + h3O
2. Основный оксид + вода (образуется щелочь)
В реакцию вступают только 8 оксидов: IA группа, СаО, SrO, ВаО)
Оксид реагирует с водой только если в результате образуется растворимый гидроксид (щелочь).
Li2O + h3O = 2LiOH
BaO + h3O = Ba(OH)2
3. Основный оксид + кислотный оксид (образуется соль)
Соль должна быть устойчива.
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
CuO + N2O5 = Cu(NO3) 2
СаО + SO2 = CaSO3
4. Реакции оснóвных оксидов с восстановителями.
Многие оснóвные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем
В качестве восстановителей используют: СО, С, водород, алюминий, магний.
С водородом реагируют оксиды неактивных металлов.
FeO + h3 = Fe + h3O (при нагревании)
Fe2O3 + h3 = 2FeO + h3O,
Fe2O3 + CO = 2FeO + CO2.
5. Окисление до более высоких степеней окисления.
Осуществима, если металл может иметь несколько оксидов с разными степенями окисления.
4FeO + O2 = 2Fe2O3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
К кислотным оксидам относятся оксиды неметаллов и некоторые оксиды металлов групп Б, если металлы в этих оксидах находятся в высших степенях окисления (+4,+5,+6,+7) , например, CrO3, Mn2O7.
газы: СО2, N2O3, SO2, SeO2),
жидкости : Mn2O7
твердые вещества : B2O3, SiO2, N2O5, P4O6, P4O10, I2O5, CrO3).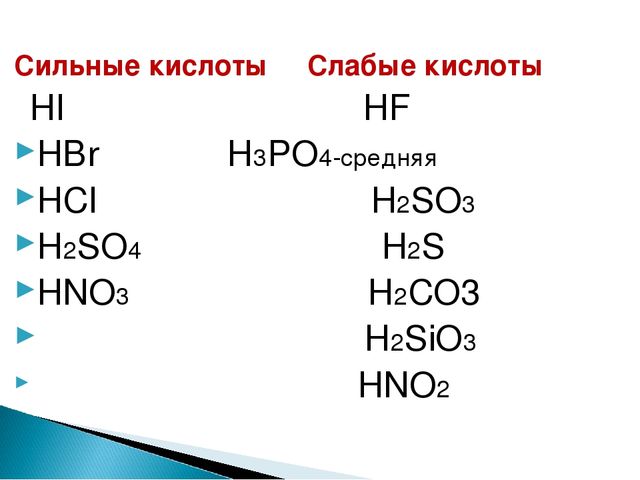
1. Кислотный оксид + вода → кислота
Оксид реагирует с водой, если в результате образуется растворимый гидроксид.
Не реагирует с водой SiO2.
N2O3 + h3O = 2HNO2
SO2 + h3O = h3SO3
N2O5 + h3O = 2HNO3
SO3 + h3O = h3SO4
2. Кислотный оксид + основный оксид→ соль
Соль должна быть устойчива.
CO2 + CaO = CaCO3
P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании)
N2O5 + ZnO = Zn(NO3)2
3. Кислотный оксид + основание (щелочь) → соль + вода
Реакция возможна только со щелочами.
SO3, CrO3, N2O5, Cl2O7) реагирует и с нерастворимыми (слабыми) основаниями.
CO2 + Ca(OH) 2 = CaCO3 + h3O
SiO2 + 2KOH = K2SiO3 + h3O (при нагревании),
SO3 + 2NaOH = Na2SO4 + h3O,
N2O5 + 2KOH = 2KNO3 + h3O.
4. Кислотный оксид + соль более летучей кислоты → соль + летучий оксид
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
SiO2 + K2CO3 = K2SiO3 + CO2
(при нагревании)
4. Окисление оксидов до более высокой степени окисления:
Для элементов, которые образуют несколько оксидов с разной степенью окисления
а) кислородом:
2СО + О2 = 2СО2
2SO2 + O2 ⇆ 2SO3
б) озоном:
NO + O3 = NO2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
К амфотерным оксидам относят ZnO, Al2O3, BeO, PbO, Fe2O3, Cr2O3 и некоторые другие оксиды.
Амфотерные оксиды обладают свойствами и оснóвных, и кислотных оксидов.
ОСНОВНЫЕ СВОЙСТВА
1. Оксид + кислота → соль + вода
Только с сильными кислотами
ZnO + 2HCl = ZnCl2 + h3O
Al2O3 + HNO3 = Al(NO3)3 +h3O
2. Кислотный оксид + амфотерный оксид→ соль
Соль должна быть устойчива
ZnO+ SiO2 = ZnSiO3
КИСЛОТНЫЕ СВОЙСТВА
1. При сплавлении с оксидами металлов образует соли, в которых амфотерный металл образует кислотный остаток :
При сплавлении с оксидами металлов образует соли, в которых амфотерный металл образует кислотный остаток :
ZnO + Na₂O = Na₂ZnO2.
2. Амфотерный оксид + раствор щелочи → раствор гидроксокомплекса
Al2O3 + KOH +h3O = K[Al(OH)4]
ZnO + NaOH + h3O = Na2[Zn(OH)4]
3. Амфотерный оксид + расплав щелочи → соль + вода
Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов.
Al2O3 + 2KOH = 2KAlO2 + h3O (при нагревании)
ZnO + 2KOH =K2ZnO2 + h3O (при нагревании)
Вещества, образуемые катионами амфотерных металлов в щелочной среде
4. Амфотерный оксид + карбонаты щелочных металлов → соль + газ
При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами.
Al2O3 + Na2CO3 = 2NaAlO2 + CO2(при нагревании)
ZnO + Na2CO3 = Na2ZnO2+ CO2(при нагревании)
5. Взаимодействие с сильными восстановителями:
Взаимодействие с сильными восстановителями:
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + h3 = Zn + h3O
Fe2O3 + h3 = 2FeO + h3O,
Fe2O3 + CO = 2FeO + CO2
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ МЕТАЛЛОВ
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ А — ОСНОВНЫЕ ОКСИДЫ:
MgO (жженная магнезия), CaO (негашёная известь, жжёная известь, кипелка. Порошок белого цвета), SrO. ВaО
Негашенная известь при спекании с углеродом дает карбид кальция
СаО + 3С = СаС2 + СО↑
III ГРУППА А ОКСИД АЛЮМИНИЯ А12О3 — АМФОТЕРНЫЙ
с преобладание основных свойств
Al2O3 — очень твердый белого цвета(корунд), тугоплавкий — 2050⁰С.
Реагирует с солями летучих кислотс образованием алюминатов и газообразного вещества.
А12O3 + Na2CO₃ (тв) = 2NaA1O2 + СO2↑
I ГРУППА Б
ОКСИДЫ МЕДИ.
ОКСИД МЕДИ (I) твердое вещество красного цвета, нерастворимые в воде, имеют основный характер.
1. Взаимодействует с разбавленной серной кислотой с образование меди, сульфата меди (II), воды.
Cu2O + h3SO4 = Cu + CuSO4 + h3O
2. Взаимодействует с водным растворoм аммиака с образованием гидроксида диамин меди.
Cu2O + 4Nh4 + h3O = 2[Cu(Nh4)2OH]
ОКСИД МЕДИ (II) твердое вещество черного цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
CuO + NaOH + h3O = Na2[Cu(OН)4] (тетрагидроксокупрат)
Восстанавливается при нагревании водородом, углеродом, угарным газом, аммиаком и более активными металлами
→ медь + соответствующий оксид или неметалл.
ЗСuО + 2Nh4 = ЗСu + N2↑ + 3h3О
II ГРУППА Б
ОКСИД ЦИНКА.
ОКСИД ЦИНКА (II) твердое вещество белого цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
ZnO + NaOH + h3O = Na2[Zn(OН)4] (тетрагидроксоцинкат)
VIII ГРУППА Б
ОКСИДЫ ЖЕЛЕЗА
ОКСИД ЖЕЛЕЗА (II). ОСНОВНЫЙ
порошок черного цвета, нерастворимый в воде.
обладают восстановительными свойствами, соединения железа со степенью окисления железа +2 малоустойчивы они легко превращаются в соединения железа (III) под действием окислителей:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5h3O
Fe₂O₃ — ОКСИД ЖЕЛЕЗА (III) АМФОТЕРНЫЙ
Твердое вещество бурого цвета, нерастворимое в воде
Оксид образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂↑
или при прокаливании солей железа:
2FeSO₄ →Fe₂O₃ + SO₂↑ + SO₃↑
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ НЕМЕТАЛЛОВ
IV группа А ОКСИДЫ УГЛЕРОДА.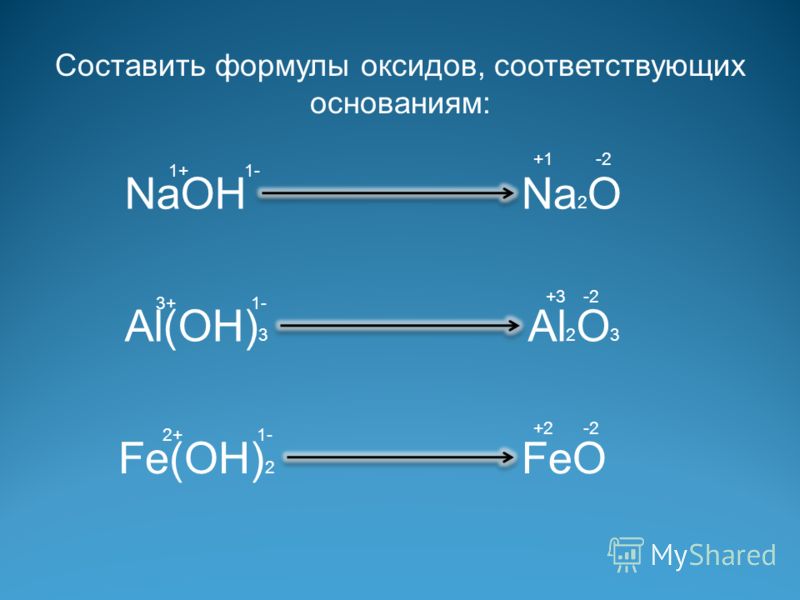
CO — НЕСОЛЕОБРАЗУЮЩИЙ
Угарный газ – бесцветный, без запаха, плохо растворим в воде, токсичен, ядовит
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь, за счѐт дополнительной донорно-акцепторной связи.
CO2 -КИСЛОТНЫЙ
Углекислый газ – без цвета, без запаха, при сжижении образует «сухой лед»
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + h3O.
ОКСИД КРЕМНИЯ (IV) SIO2 – КИСЛОТНЫЙ оксид.
В природе – речной песок, кварц, кремнезем. Оксид без цвета, без запаха, единственный из кислотных нерастворимый
в воде.
Имеет атомную кристаллическую решетку.
1) Из кислот реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + h3O
SiO2 + 6HF(р-р)= h3[SiF6] + 2h3O
2) При температуре выше 1000 °С реагирует с активными металлами, при этом\nобразуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
3) Взаимодействие с неметаллами.
с водородом: SiO2 + 2Н2 = Si + 2Н2O,
с углеродом: SiO2 + 3С = SiС + 2СO.
V ГРУППА А ОКСИДЫ АЗОТА
N₂O ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, «веселящий газ“ НЕСОЛЕОБРАЗУЮЩИЙ
Бесцветный газ, со слабым сладковатым запахом, хорошо растворим в воде.
Разлагается при 700°C с выделением кислорода:
2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + h3 = N2 + Н2O,
с углеродом: N2O + C = N2 + CO
с фосфором: 5N2O + 2Р = 5N2 + Р2O5
NO ОКСИД АЗОТА (II) ОКИСЬ АЗОТА НЕСОЛЕОБРАЗУЮЩИЙ
бесцветный газ, без запаха, плохо растворим в воде.
Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2
Может быть окислителем, переходя в простое вещество азот: в нѐм могут гореть водород, углерод и т. п.
п.
2NO + 2h3 =N2 + 2h3O
NO2 ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ» КИСЛОТНЫЙ
бурый газ, специфический запах, токсичен, взаимодействует с водой — (даѐт 2 кислоты)
1. Кислотный оксид, образует с водой сразу две кислоты: азотную и азотистую:
2NO2 + h3O = HNO3 + HNO2
4NO2 + 2h3O + O2 = 4HNO3
2) со щелочами:
2NO2 +2NaOH =NaNO2+NaNO3 +h3O
2. Окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
N2O5 ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД КИСЛОТНЫЙ
кристаллическое вещество, легко плавится (40°С)
1. Сильный окислитель:
2N2O5 + S = SO2 +4NO2
2. Легко разлагается (при нагревании – со взрывом):
2N2O5 = 4NO2 + O2
P2O5 (ОКСИД ФОСФОРА (V) ФОСФОРНЫЙ АНГИДРИД). КИСЛОТНЫЙ
Белые кристаллы. В парах состоит из молекул P4h20, очень гигроскопичен (используется как осушитель газов и жидкостей).
Реакция с водой – в зависимости от количества воды – образуются разные кислоты
P2O5 + h3O = 2HPO3 (метафосфорная кислота)
P2O5 +3h3O = 2h4PO4 (ортофосфорная кислота)
VI ГРУППА А ОКСИДЫ СЕРЫ
SO2 (СЕРНИСТЫЙ АНГИДРИД; СЕРНИСТЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветный газ с резким запахом, хорошо растворимый в воде. Обладает восстановительными и окислительными свойствами
SO3 (СЕРНЫЙ АНГИДРИД; СЕРНЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветная жидкость с резким запахом, хорошо растворима в воде. Обладает сильными окислительными свойствами
Взаимодействует с концентрированной серной кислотой, образуя олеум.
VII ГРУППА А ОКСИДЫ ГАЛОГЕНОВ
ФТОРИД КИСЛОРОДА ОF2
Кислород проявляет положительную степень окисления. Бесцветный газ, плохо растворимый в воде, распадается на кислород и фтор.
Фтор не образует кислородных кислот, так как не проявляет положительных степеней окисления.
Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества| 12+ Свидетельство СМИ ЭЛ № ФС 77 — 70917 Лицензия на образовательную деятельность №0001058 | Пользовательское соглашение Контактная и правовая информация |
Педагогическое сообщество | Бесплатные всероссийские конкурсы | Бесплатные сертификаты | Нужна помощь? Инструкции для новых участников | Бесплатная онлайн-школа для 1-4 классов |
Всё для аттестацииПубликация в сборникеВебинарыЛэпбукиПрофтестыЗаказ рецензийНовости
Библиотека
▪Учебно-дидактические материалы
▪Задачи / упражнения / практикумы
Материал опубликовала
7
#8 класс #Химия #Учебно-дидактические материалы #Задача / упражнение / практикум #Учитель-предметник #Школьное образование #УМК О. С. Габриеляна
С. Габриеляна
1 группа | 30 | 58 | 74 | 78 | 98 | 100 | 183 |
Na2O2 | п | р | с | т | у | ф | х |
Cl2O7 | ц | ч | ш | щ | ъ | ь | ы |
Ca(OH)2 | в | г | д | е | ё | ж | з |
CaCO3 | и | й | к | л | ю | а | б |
h4PO4 | о | у | э | ю | я | м | н |
NO | д | о | н | с | м | и | т |
h3SO4 | к | л | о | н | а | б | в |
2 группа | 30 | 40 | 58 | 74 | 78 | 98 | 100 | 183 |
Na2O2 | й | и | к | л | м | н | о | п |
Cl2O7 | ф | ы | е | р | т | щ | ш | ы |
Ca(OH)2 | с | м | и | с | ж | э | к | н |
CaCO3 | е | р | я | я | ы | у | т | м |
h4PO4 | в | к | у | а | р | о | х | и |
NO | б | ы | я | ч | с | м | э | т |
h3SO4 | б | п | а | ц | к | о | э | ь |
MgO | ш | й | з | а | х | в | ю | б |
3группа | 30 | 58 | 74 | 78 | 98 | 100 | 183 |
Na2O2 | а | к | к | з | е | о | |
Cl2O7 | я | ч | с | р | л | д | д |
Ca(OH)2 | г | ш | о | д | ю | б | з |
CaCO3 | э | ю | р | о | л | р | э |
h4PO4 | н | а | с | м | о | к | ы |
NO | в | о | р | т | и | е | п |
h3SO4 | б | ю | с | ф | о | у | к |
4группа | 30 | 58 | 74 | 78 | 98 | 100 | 183 |
Na2O2 | р | о | л | к | ь | б | ю |
Cl2O7 | в | ц | е | н | ш | щ | о |
Ca(OH)2 | ы | а | г | и | и | и | б |
CaCO3 | л | р | а | в | у | д | к |
h4PO4 | ь | м | и | а | а | у | е |
NO | н | е | р | о | л | д | ж |
h3SO4 | я | д | э | ю | а | б | э |
5 группа | 30 | 40 | 58 | 74 | 78 | 98 | 100 | 183 |
Na2O2 | й | и | к | л | с | н | о | п |
Cl2O7 | ф | ы | е | р | т | щ | ш | в |
Ca(OH)2 | с | м | и | е | ж | э | к | н |
CaCO3 | е | р | я | я | ы | у | т | м |
h4PO4 | в | к | у | а | р | е | х | и |
NO | е | ы | я | ч | с | м | э | т |
h3SO4 | б | п | а | ц | к | с | э | ь |
MgO | ш | т | з | а | х | в | ю | б |
6 группа | 30 | 58 | 74 | 78 | 98 | 100 | 183 |
Na2O2 | й | к | л | ь | н | о | п |
Cl2O7 | ф | е | р | т | щ | ш | д |
Ca(OH)2 | с | и | р | ж | э | к | н |
CaCO3 | е | я | я | ы | у | у | м |
h4PO4 | в | у | а | р | з | х | и |
NO | ь | я | ч | с | м | э | т |
h3SO4 | б | а | ц | к | я | э | ь |
Опубликовано в группе «Учителя химии»
Манина Ольга Борисовна, 09.10.16 в 15:35 1ОтветитьПожаловаться
Спасибо за интересный материал
Чтобы написать комментарий необходимо авторизоваться.
Закрыть
cl2o7 = hclo4.h3o | Химические уравнения не найдены
| Поиск |
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Поиск в нашей базе данных по более чем 5552 химическим веществам
Класс
2 О 7Диклогептоксит
дихлоргептоксид
Атомный_вес (г/моль) 182.
 9018
9018Искать как реагент Искать как продукт
Подробнее
HClO
4 .H 2 Oкороткая форма
ClH 3 О 5Перхлорный гидрат Axit
Гидрат хлорной кислоты
Атомный_вес (г/моль) 118.4738
Искать как реагент Искать как продукт
Подробнее
Реакция объединения
Также известна как реакция синтеза. Одним из часто встречающихся комбинированных реакций является реакция элемента с кислородом с образованием оксида. При определенных условиях металлы и неметаллы легко реагируют с кислородом. После воспламенения магний вступает в реакцию быстро и бурно, реагируя с кислородом воздуха с образованием мелкодисперсного порошка оксида магния.
O 2 + Si → SiO 2 Cl 2 + Be → BeCl 2 СаО + СО 2 → CaCO 3 2Cu + O 2 → 2CuO Br 2 + H 2 → 2HBr BaO + H 2 O → Ba(OH) 2 2P + 5S → P 2 S 5 Просмотреть все Комбинированная реакция
Реклама
Реакция разложения
Многие реакции разложения включают тепло, свет или электричество для ввода энергии. Бинарные соединения — это соединения, состоящие только из двух элементов. Простейшая реакция на разложение — это когда бинарное соединение распадается на его элементы. Оксид ртути (II), красное твердое вещество, при нагревании разлагается с образованием ртути и газообразного кислорода.
Кроме того, реакция считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением. Карбонат металла распадается с образованием оксида металла и углекислого газа. Карбонат кальция, например, разлагается на оксид кальция и диоксид углерода.
Бинарные соединения — это соединения, состоящие только из двух элементов. Простейшая реакция на разложение — это когда бинарное соединение распадается на его элементы. Оксид ртути (II), красное твердое вещество, при нагревании разлагается с образованием ртути и газообразного кислорода.
Кроме того, реакция считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением. Карбонат металла распадается с образованием оксида металла и углекислого газа. Карбонат кальция, например, разлагается на оксид кальция и диоксид углерода.
C 2 H 6 → C 2 H 4 + H 2 3HClO 3 → H 2 O + 2ClO 2 + HClO 4 4Al(NO 3 ) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2 MgCO 3 → MgO + CO 2 2HgO → 2Hg + O 2 2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O С 4 Н 1 0 → С 2 Н 4 + С 2 Н 6 Просмотреть все Реакция разложения
Реклама
Окислительно-восстановительная реакция
Окислительно-восстановительная (окислительно-восстановительная) реакция представляет собой тип химической реакции, включающей перенос электронов между двумя частицами. Окислительно-восстановительная реакция — это любая химическая реакция, в которой степень окисления молекулы, атома или иона изменяется путем приобретения или потери электрона. Окислительно-восстановительные реакции являются обычными и жизненно важными для некоторых основных функций жизни, включая фотосинтез, дыхание, горение, коррозию или ржавчину.
Окислительно-восстановительная реакция — это любая химическая реакция, в которой степень окисления молекулы, атома или иона изменяется путем приобретения или потери электрона. Окислительно-восстановительные реакции являются обычными и жизненно важными для некоторых основных функций жизни, включая фотосинтез, дыхание, горение, коррозию или ржавчину.
5O 2 + 4P → 2P 2 O 5 C + 6NaOH → 3H 2 + 2Na + 2Na 2 CO 3 2HNO 3 + CuFeS 2 → Cu(NO 3 ) 2 + 9H 2 O + 2H 2 SO 4 + 7NO 2 + Fe(NO 3 ) 3 О 2 + 2В 2 О 4 → 2В 2 О 5 4K 2 SO 3 → 4K 2 S + 3K 2 СО 4 2NH 3 + 2B → 3H 2 + 2BN 3Mg + 2Fe(№ 3 ) 3 → 2Fe + 3Mg(№ 3 ) 2 Просмотреть все Окислительно-восстановительная реакция
Реклама
Реакция с одной заменой
A + BC → AC + B
Элемент А представляет собой металл в этой общей реакции и заменяет элемент В, который также является металлом в соединении. Если замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и это становится общим уравнением.
Многие металлы легко реагируют с кислотами, и одним из продуктов реакции при этом является газообразный водород. Цинк реагирует с водным раствором хлорида цинка и водородом с соляной кислотой (см. рисунок ниже).
Если замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и это становится общим уравнением.
Многие металлы легко реагируют с кислотами, и одним из продуктов реакции при этом является газообразный водород. Цинк реагирует с водным раствором хлорида цинка и водородом с соляной кислотой (см. рисунок ниже).
CH 4 + Cl 2 → CH 3 Cl + HCl Cu(NO 3 ) 2 + Fe → Cu + Fe(NO 3 ) 2 С + ZnO → СО + Zn 2Na + 2NH 3 → H 2 + 2NaNH 2 CH 3 CH 2 CH 2 OH + C 2 H 5 COOH → H 2 O + C 2 H 5 COOCH 2 CH 2 5 2 CH 2 . 2HCl + Zn → H 2 + ZnCl 2 Zn + CuCl 2 → Cu + ZnCl 2 Просмотреть все Реакция с одной заменой
Реклама
Реакция двойной замены
AB + CD → AD + CB
В этой реакции А и С являются положительно заряженными катионами, а В и D — отрицательно заряженными анионами. Реакции двойного замещения обычно происходят в водном растворе между соединениями. Чтобы вызвать реакцию, один из продуктов обычно представляет собой твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного реагента объединяются с образованием нерастворимого ионного соединения с анионами другого реагента. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
Реакции двойного замещения обычно происходят в водном растворе между соединениями. Чтобы вызвать реакцию, один из продуктов обычно представляет собой твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного реагента объединяются с образованием нерастворимого ионного соединения с анионами другого реагента. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
CA (HCO 3 ) 2 + 2C 1 7 H 3 5 COOH → 2H 2 O + 2CO 2 + CA (C 1 3 3 3 3 3 3 3 3 3 3 3 3 3 2 2 . 5 СОО) 2 2NaOH + MgBr 2 → Mg(OH) 2 + 2NaBr 2HCl + Na 2 HPO 4 → 2NaCl + H 3 PO 4 6CaF 2 + H 2 SO 4 + 7SO 3 + Na 2 B 4 O 7 → Na 2 SO 4 + 6CaSO 4 + 4BF 3 CH 4 + Cl 2 → CH 3 Cl + HCl 2HCl + Na 2 ZnO 2 → 2NaCl + Zn(OH) 2 NaOH + NH 4 NO 3 → H 2 O + NaNO 3 + NH 3 Просмотреть все Реакция двойной замены
Реклама
Реклама
Вы не нашли ?
Воспользуйтесь нашей настраиваемой системой поиска, чтобы сосредоточиться только на результатах поиска Google Chemistry
Уравнения с Cl2O7 в качестве реагента
дихлоргептоксид
H 2 O + Cl 2 O 7 → 2HClO 4 2NaOH + Cl 2 O 7 → H 2 O + 2NaClO 4 2Cl 2 O 7 → 2Cl 2 + 7O 2 Просмотреть все уравнения с Cl2O7 в качестве реагента
Реклама
Уравнения с HClO4.
 h3O как произведение
h3O как произведениеГидрат хлорной кислоты
3HClO 4 → Cl 2 O 7 + HClO 4 .H 2 O Просмотреть все уравнения с HClO4.h3O как продукт
Реклама
Реклама
3.4: Молекулярные и ионные соединения (проблемы)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98719
ЗАДАЧА \(\PageIndex{1}\)
Используя периодическую таблицу, предскажите, являются ли следующие хлориды ионными или ковалентными: KCl, NCl 3 , ICl, MgCl 2 , PCl 5 и CCl 4 .
- Ответить
Ионные: KCl, MgCl 2 ; Ковалентный: NCl 3 , ICl, PCl 5 , CCl 4
ЗАДАЧА \(\PageIndex{2}\)
Используя периодическую таблицу, предскажите, являются ли следующие хлориды ионными или ковалентными: SiCl 4 , PCl 3 , CaCl 2 , CsCl, CuCl 2 , и CrCl 3 .
- Ответить
Ионные: CaCl 2 , CuCl 2 , CsCl, CrCl 3 ; Ковалентный: SiCl 4 , ПКл 3
ЗАДАЧА \(\PageIndex{3}\)
Для каждого из следующих соединений укажите, является ли оно ионным или ковалентным. Если он ионный, напишите символы соответствующих ионов:
(a) NF 3
(b) BaO
(c) (NH 4 ) 2 CO 3
(d) Sr( H 2 PO 4 ) 2
(e) IBr
(f) Na 2 O
- Ответ на 92-}\)
- Ответ d
ионный, Sr 2+ , \(\ce{h3PO4-}\)
- Ответ e
ковалентный
- Ответ f
ионная, Na + , O 2−
ЗАДАЧА \(\PageIndex{4}\)
Для каждой из следующих пар ионов запишите символ формулы соединения, которое они образуют: 93-}\)
- Ответить на
КАС
- Ответ b
(NH 4 ) 2 CO 3
- Ответ c
АлБр 3
- Ответ d
Na 2 HPO 4
- 93-}\)
- Ответить на
К 2 О
- Ответ b
(NH 4 ) 3 Заказ на покупку 4
- Ответ c
Ал 2 О 3
- Ответ d
Na 2 CO 3
- Ответ e
Ба 3 (ПО 4 ) 2
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/s2Q6EFT91Eg?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
- Ответить на
хлорид цезия
- Ответ b
оксид бария
- Ответ c
сульфид калия
- Ответ d
хлорид бериллия
- Ответ e
бромистый водород
- Ответ f
фторид алюминия
- Ответ a
фторид натрия
- Ответ b
Оксид рубидия
- Ответ c
трихлорид бора
- Ответ d
селенид водорода
- Ответ e
гексаоксид тетрафосфора
(если вы гуглите ответы на домашнее задание, Google может с вами не согласиться.
 Но мы называем имена на основе только что изученных правил, поэтому не стоит доверять Google ответы на домашнее задание)
Но мы называем имена на основе только что изученных правил, поэтому не стоит доверять Google ответы на домашнее задание)- Ответ f
Трихлорид йода
- Ответ a
руббр
- Ответ b
MgSe
- Ответ c
Нет 2 О
- Ответ d
CaCl 2
- Ответ e
ВЧ
- Ответ f
ГаП
- Ответ г
АлБр 3
- Ответ ч
(NH 4 ) 2 SO 4
- Ответ a
Ли 2 СО 3
- Ответ b
NaClO 4
- Ответ c
Ва(ОН) 2
- Ответить д
(NH 4 ) 2 CO 3
- Ответ e
H 2 SO 4
- Ответ f
Ca(C 2 H 3 O 2 ) 2
- Ответ г
мг 3 (ПО 4 ) 2
- Ответ ч
Нет 2 SO 3
- Ответ a
ClO 2
- Ответ b
Н 2 О 4
- Ответ c
К 3 Р
- Ответ d
Серебряный 2 С
- Ответ e
АлН
- Ответ f
SiO 2
- Ответ a
BaCl 2
- Ответ b
Мг 3 Н 2
- Ответ c
SO 2
- Ответ d
НКл 3
- Ответ e
Н 2 О 3
- Ответ ф
SnCl 4
- Ответить на
оксид хрома(III)
- Ответ b
железа(II) хлорид
- Ответ c
оксид хрома(VI)
- Ответ d
хлорид титана(IV)
- Ответ e
оксид кобальта(II)
- Ответить f
сульфид молибдена(IV)
- Ответить на
карбонат никеля (II)
- Ответ b
Оксид молибдена (VI)
- Ответ c
нитрат кобальта (II)
- Ответ d
оксид ванадия (V)
- Ответ e
марганца (IV) оксид
- Ответ f
железа (III) оксид
- Ответить на
К 3 Заказ на поставку 4
- Ответ b
CuSO 4
- Ответ c
CaCl 2
- Ответ d
TiO 2
- Ответ e
NH 4 НЕТ 3
- Ответ f
NaHSO 4
- Ответ a
кальция дигидрофосфат
- Ответ b
железа (II) сульфат
- Ответ c
карбонат кальция
- Ответ d
оксид магния
- Ответить по электронной почте
нитрит натрия
- Ответ f
калия йодид
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.

ЗАДАЧА \(\PageIndex{6}\)
Назовите следующие соединения:
(a) CsCl
(b) BaO
(c) K 2 S
(d) BeCl 2
(e) HBr
(f) AlF 3
ЗАДАЧА \(\PageIndex{7}\)
Назовите следующие соединения:
(a) NaF
(b) Rb 2 O
(c) BCl 3
(d) H
6 Se
(e) P 4 O 6
(f) ICl 3
ЗАДАЧА \(\PageIndex{8}\)
Напишите формулы следующих соединений:
(a) бромид рубидия
(b) селенид магния
(c) оксид натрия
(d) хлорид кальция
(e) фтороводород
(f) фосфид галлия
(g) бромид алюминия
(h) сульфат аммония
ЗАДАЧА \(\PageIndex{9}\)
Напишите формулы следующих соединений:
(a) карбонат лития
(b) перхлорат натрия
(c) гидроксид бария
(d) карбонат аммония
(e) серная кислота
(f) ацетат кальция
(g) фосфат магния
(h) сульфит натрия
ЗАДАЧА \(\PageIndex{10}\)
Напишите формулы следующих соединений:
(a) диоксид хлора
(b) тетраоксид азота
(c) фосфид калия
(d) сульфид серебра(I)
(e) нитрид алюминия
(f) диоксид кремния
ЗАДАЧА \(\PageIndex{11}\)
Напишите формулы следующих соединений:
(a) хлорид бария
(b) нитрид магния
(c) диоксид серы
(d) трихлорид азота
(e) триоксид диазота
(f) хлорид олова(IV)
ПРОБЛЕМА \(\PageIndex{12}\)
Каждое из следующих соединений содержит металл, который может иметь более одного ионного заряда. Назовите эти соединения:
Назовите эти соединения:
(a) Cr 2 O 3
(b) FeCl 2
(c) CrO 3
(d) TiCl 4
3 (f) Co MoS 2
ПРОБЛЕМА \(\PageIndex{13}\)
Каждое из следующих соединений содержит металл, который может иметь более одного ионного заряда. Назовите эти соединения:
(a) NICO 3
(b) MOO 3
(C) CO (№ 3 ) 2
(D) V 2 O 5
(E) V 2 O 5
33333333333 (E 2 O 5
(D) V 2 O 5
(D) V 2 O 5
(D) V 2 ).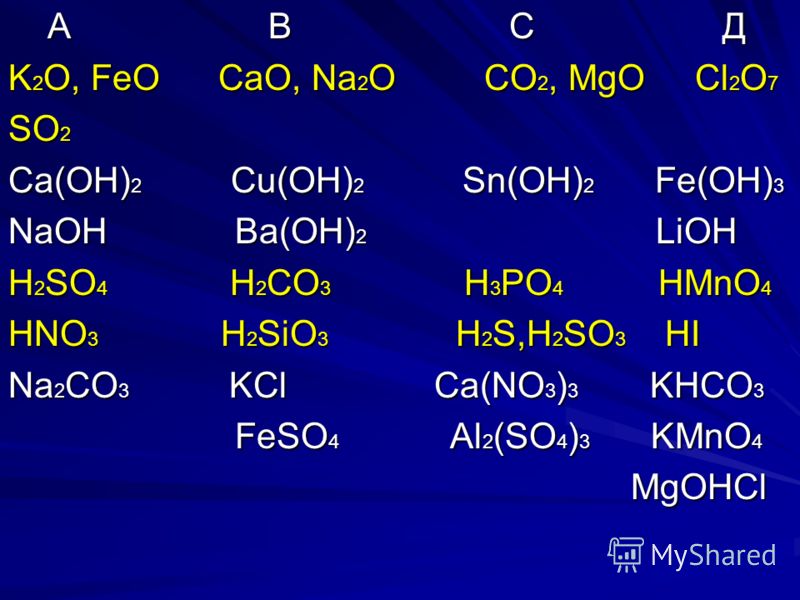 ) MnO 2
) MnO 2
(е) Fe 2 O 3
ПРОБЛЕМА \(\PageIndex{14}\)
В обычных бытовых товарах содержатся следующие ионные соединения. Напишите формулы для каждого соединения:
(а) фосфат калия
(б) сульфат меди(II)
(в) хлорид кальция
(г) диоксид титана
(д) нитрат аммония
(е) гидросульфат натрия (общий название гидросульфата натрия)
ПРОБЛЕМА \(\PageIndex{15}\)
Следующие ионные соединения встречаются в обычных бытовых товарах.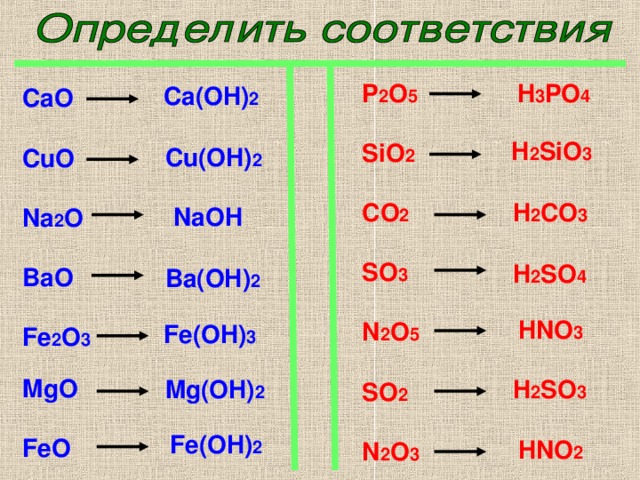 Назовите каждое из соединений:
Назовите каждое из соединений:
(a) Ca(H 2 PO 4 ) 2
(b) FeSO 4
(c) CaCO 3
(d) MgO0033 (e) NaNO 2
(f) KI

 Но мы называем имена на основе только что изученных правил, поэтому не стоит доверять Google ответы на домашнее задание)
Но мы называем имена на основе только что изученных правил, поэтому не стоит доверять Google ответы на домашнее задание)