ФГБОУ ВО ПГФА Минздрава России
Пермская государственная
фармацевтическая академия
Для слабовидящих
Осторожно, грипп!!!
…
Правила здоровья
…
еще …
Наши новости
Поздравление Министра здравоохранения Российской Федерации М.А. Мурашко с праздником 8 Марта
07 марта 2023
ПГФА открывает прием на обучение в Королевстве Марокко
03 февраля 2023
еще …
Наши события
85 лет Молоховой Лилии Георгиевне (1938-2007)
03 марта 2023
Концерт «Сквозь мечты» 3 марта 2023 года в 18:00
02 марта 2023
еще . ..
..
Конференции, олимпиады, форумы…
Исследования учёных ПГФА получили высокую оценку на конференции по цифровизации фармации в Тюмени
22 февраля 2023
Приглашение к участию в Международном литературном конкурсе «Живая латынь»
09 января 2023
I международная научно-практическая Олимпиада по философии для студентов медвузов
15 декабря 2022
еще …
Новости спорта
Первый профсоюзный фестиваль комплекса «ГТО» Пермского края
13 марта 2023
II этап I Спартакиады «Физическая культура и спорт — вторая профессия врача» по мини-футболу
07 марта 2023
Игры по волейболу, посвященные Международному женскому дню 8-е марта
06 марта 2023
еще …
Button
Коммерческое предложение ПК 2023
Ученый совет
Научный полк
Обращение советов ректоров вызов Пермского края
Мисс Фармация-2019
День открытых дверей
Информация об аккредитации специалистов
Галерея новостей
Видеообзор — введение в профессию
Ректор ПГФА Алексей Юрьевич Турышев рассказывает о перспективах специальности и приёме в 2019 году
В ПГФА имеется 200 бюджетных мест для абитуриентов. Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Смотреть все видеообзоры о професии
Условия проживания студентов в общежитии № 2 (более новое первое общежитие не показано). Съёмка 2016 года.
Имеющиеся у ПГФА два общежития неизменно входят в десятку лучших общежитий образовательных учреждений города Перми. В общежитиях имеются столовая, кухни на каждом этаже, библиотека, спортзал, бытовая, душевая и постирочная комнаты (общежитие № 1 новее).
Первокурсники на лабораторных занятиях по физике в ПГФА. Съёмка 25 февраля 2019 года
На первом курсе студенты изучают биологию, физиологию, математику, физику, неорганическую химию, физическую химию, латинский язык, информатику, экономическую теорию, историю. Основной предмет — химия. За годы учёбы её будет 9 видов.
Впечатления первокурсника
после двух месяцев учёбы в 2018 году.
Ректор
Проректоры
Помощник ректора по воспитательной работе
Ученый совет
Административно — управленческие подразделения
Ведущий юрисконсульт
Учебные подразделения
Кафедры
Научные подразделения
Корпуса и общежития
Отдел качества
Региональный испытательный центр «Фарматест»
Полиграфический отдел
Стоматологическая клиника
Столовая
Здравпункт
Музей
Профком сотрудников
Профком студентов
Социально-психологическая служба
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Описание химических реакций — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 34831
CHEMTUTOR
Химическая реакция – это превращение материала из исходной массы в результирующее вещество. Отличительной чертой химической реакции является создание нового материала или материалов вместе с исчезновением массы, которая изменилась, чтобы создать новый. это не означает , что были изготовлены новые элементы. Чтобы образовались новые элементы, необходимо изменить состав ядра. Существуют значительные различия в количестве энергии в обычных химических реакциях по сравнению с ядерными реакциями. Энергия перестройки ядер атомов для превращения в новые элементы огромна по сравнению с меньшими энергиями химических превращений. Алхимики, пытавшиеся заменить менее дорогие металлы золотом, не имели фундаментального понимания того, что они пытались сделать, чтобы оценить разницу.
Отличительной чертой химической реакции является создание нового материала или материалов вместе с исчезновением массы, которая изменилась, чтобы создать новый. это не означает , что были изготовлены новые элементы. Чтобы образовались новые элементы, необходимо изменить состав ядра. Существуют значительные различия в количестве энергии в обычных химических реакциях по сравнению с ядерными реакциями. Энергия перестройки ядер атомов для превращения в новые элементы огромна по сравнению с меньшими энергиями химических превращений. Алхимики, пытавшиеся заменить менее дорогие металлы золотом, не имели фундаментального понимания того, что они пытались сделать, чтобы оценить разницу.
Введение
Химическое уравнение — это способ описания того, что происходит в ходе химической реакции, фактических изменений в материале. Химические уравнения записываются символами материалов, включая элементы, ионные или ковалентные соединения, водные растворы, ионы или частицы. Вправо есть стрелка, указывающая на действие реакции. Материалы слева от стрелки — это реагентов , или материалов, которые будут реагировать. Материалы справа от стрелки — это продукты или материалы, полученные в результате реакции. Закон сохранения массы гласит, что в химической реакции масса не теряется и не увеличивается. Закон сохранения массы применим к отдельным типам атомов. Можно сказать, что для любого элемента нет потери или увеличения этого элемента в химической реакции. Есть такие вещи, как обратимые реакции, реакции, в которых продукты собираются заново, чтобы стать исходными продуктами. Обратимые реакции обозначаются в химических уравнениях двунаправленной стрелкой, но остается стандартом называть материалы слева реагентами, а материалы справа — продуктами.
Материалы слева от стрелки — это реагентов , или материалов, которые будут реагировать. Материалы справа от стрелки — это продукты или материалы, полученные в результате реакции. Закон сохранения массы гласит, что в химической реакции масса не теряется и не увеличивается. Закон сохранения массы применим к отдельным типам атомов. Можно сказать, что для любого элемента нет потери или увеличения этого элемента в химической реакции. Есть такие вещи, как обратимые реакции, реакции, в которых продукты собираются заново, чтобы стать исходными продуктами. Обратимые реакции обозначаются в химических уравнениях двунаправленной стрелкой, но остается стандартом называть материалы слева реагентами, а материалы справа — продуктами.
ПРИМЕРЫ ХИМИЧЕСКИХ ИЗМЕНЕНИЙ
Химические реакции, также называемые химическими изменениями, происходят не только в химической лаборатории. Вот несколько примеров химических реакций с соответствующими химическими уравнениями:
Тускнеет серебряная ложка. Серебро реагирует с серой в воздухе, образуя сульфид серебра, черный материал, который мы называем тусклым.
Серебро реагирует с серой в воздухе, образуя сульфид серебра, черный материал, который мы называем тусклым.
2 Ag + S Ag 2 S
Железный прут ржавеет. Железо реагирует с кислородом воздуха, образуя ржавчину.
4 Fe + 3 O2 2 Fe2O3
Горение метана. Метан соединяется с кислородом воздуха, образуя углекислый газ и водяной пар.
Ch5 + 2 O2 CO2 + 2 h3O
Антацид (гидроксид кальция) нейтрализует желудочную кислоту (соляную кислоту).
Ca(OH)2 + 2 HCl CaCl2 + 2 h3O
Глюкоза (простой сахар) сбраживается до этилового спирта и углекислого газа. Сахар в винограде или из зерна сбраживается дрожжами с образованием спирта и углекислого газа. Углекислый газ — это газ, выделяющийся из пива или шампанского.
C6h22O6 (глюкоза) 2 C2H5OH (этиловый спирт) + 2 CO2
Спирт плюс кислород становится уксусом и молекулой воды. Как и при ферментации глюкозы, это более сложная реакция, чем здесь кажется, потому что это биохимическая реакция.
C2H5OH + O2 HC2h4O2 + h3O
Как правило, биохимические явления являются плохими примерами основных химических реакций для первого курса химии, потому что реальная реакция протекает внутри живых существ и под контролем ферментов.
ПРИМЕРЫ ФИЗИЧЕСКИХ ИЗМЕНЕНИЙ
Вот несколько примеров изменений, которые НЕ являются химическими реакциями. В каждом случае исходный материал или материалы могут быть восстановлены с помощью физических процессов.
- Вода выкипает из чайника или конденсируется на холодном стекле.
- Алюминиевый горшок ставится на плиту и нагревается.
- Сухой лед превращается из твердой в газообразную форму двуокиси углерода ( сублимация ).
- Золото плавится или затвердевает.
- Песок перемешан с солью.
- Кусок мела растирается в пыль.
- Разбитое стекло.
- Железный стержень намагничивается.
- Кусок сахара растворяется в воде.
СЕРЫЕ ЗОНЫ МЕЖДУ ХИМИЧЕСКИМИ И ФИЗИЧЕСКИМИ ИЗМЕНЕНИЯМИ
Серые зоны еще более показательны. Являются ли эти изменения химическими или физическими? Почему? (Нажимайте * ссылку на обсуждение после каждого, чтобы обсудить, почему этот пример является серой областью.)
Являются ли эти изменения химическими или физическими? Почему? (Нажимайте * ссылку на обсуждение после каждого, чтобы обсудить, почему этот пример является серой областью.)
- Поваренная соль растворяется в воде. *
- Гидратированный кристалл, такой как медный купорос, сушат при нагревании. *
- Молния производит озон (O3) из кислорода (O2). Затем озон превращается в кислород. *
- Углекислый газ растворяется в воде. *
- Газообразный аммиак растворяется в воде. *
- Под давлением и нагреванием графит превращается в алмаз. *
- Яйцо сварено.*
- Дерево умирает. *
ХИМИЧЕСКИЕ УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Чтобы написать уравнения химических реакций, вы должны сначала знать формулы соответствующих материалов. Формулы должны быть написаны справа от стрелки — — реагенты («до») слева и продукты («после») справа. Порядок, в котором написаны реагенты и продукты, не имеет значения, пока каждый материал находится на правильной стороне. Как только материалы, участвующие в реакции, написаны правильно, НЕ ПРИКАСАЙТЕСЬ К НИМ. Если вам нужно обвести каждого участника реакции рамкой, чтобы ваши грязные лапы не касались материалов, сделайте это.
Как только материалы, участвующие в реакции, написаны правильно, НЕ ПРИКАСАЙТЕСЬ К НИМ. Если вам нужно обвести каждого участника реакции рамкой, чтобы ваши грязные лапы не касались материалов, сделайте это.
Очень часто вы увидите описания материалов в реакции в скобках после материала. Газ показан ( г ). Твердый материал показан (s). Жидкость показана (l). Вещество, растворенное в воде (водный раствор), обозначено (водн.). Стрелка, указывающая вверх (), указывает на образование газа, а стрелка, указывающая вниз, указывает на образование твердого осадка.
УРАВНЕНИЯ БАЛАНСИРОВКИ
Теперь самое интересное, балансировка реакции. Закон сохранения массы гласит, что в химической реакции нет потери массы. Каждый тип элемента будет иметь одинаковое количество до реакции и после реакции или в качестве реагента и продукта. Но вы не можете изменить материалы, участвующие в реакции, поэтому вы должны написать целочисленный коэффициент перед (слева) от каждого материала в реакции, чтобы убедиться, что каждый тип атома имеет одинаковый номер с каждой стороны.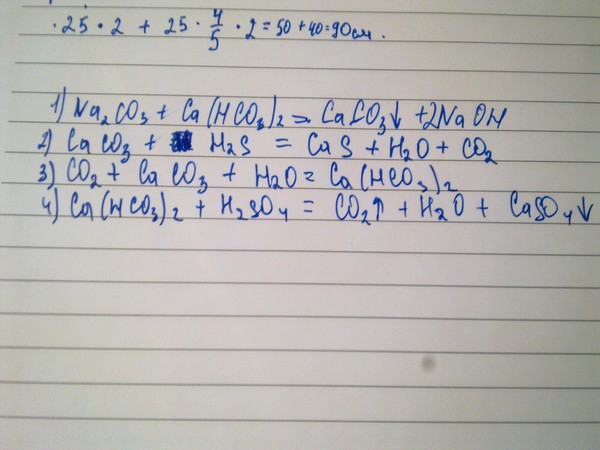 Реакция. Начнем с реакции процесса Габера:
Реакция. Начнем с реакции процесса Габера:
Газообразный азот плюс газообразный водород под давлением и при высокой температуре превращаются в аммиак. Сначала правильно напишите материалы. Азот и водород являются двухатомными газами. Аммиак — бинарная ковалентная память. Азот и водород являются реагентами, а аммиак является продуктом. Оставьте место для коэффициентов перед материалами.
_ N2( г ) + _ h3( г ) _ Nh4( г )
Вы можете начать либо с азота, либо с водорода. Слева два атома азота, а справа только один. Чтобы сбалансировать атомы азота, поставьте «2» перед аммиаком.
_ N2 + _ h3 2 Nh4
Два атома водорода слева и шесть справа. Мы уравновешиваем водороды, помещая «3» перед газообразным водородом.
_ К2 + 3 h3 2 Кh4
Теперь вернитесь и проверьте, все ли уравновешено. По обе стороны реакции есть два атома азота и шесть атомов водорода. Он сбалансирован. Перед азотом не указан коэффициент. Нет необходимости писать единицы как коэффициенты. Уравнение реакции:
Уравнение реакции:
N2 + 3 h3 2 Nh4
БАЛАНСИРОВКА ИОННЫХ УРАВНЕНИЙ С ПОЛИАТОМНЫМИ ИОНАМИ
Растворы нитрата серебра и хлорида кальция при объединении дают осадок хлорида серебра и раствор нитрата кальция. На этот раз у нас есть ионные соединения в реакции. Пока вы не уверены в соединениях, вы можете записать ионные материалы как ионы, как показано здесь.
_ Ag + (NO3) — (водн.) + _ Ca 2+ Cl2 (водн.) _ Ag + Cl — + _ Ca 2+ (NO3) — 2 (водн.)
Обратите внимание, что с одной стороны на другую нитрат-ион не изменяется. В этом случае вы можете считать нитрат-ион целиком, а не разделять его на азот и кислород. Ваши мысли могут пойти по этому пути: сколько серебра справа? Один. Сколько серебра слева? Один. Они одинаковые. Сколько нитратов слева? Один. Сколько нитратов слева? Один. Сколько нитратов справа? Два. Нам нужно поставить коэффициент два перед нитратом серебра.
2 AgNO3 + _ CaCl2 _ AgCl + _ Ca (NO3)2
Это изменяет баланс серебра, поэтому мы должны поставить двойку перед хлоридом серебра.
2 AgNO3 + _ CaCl2 2 AgCl + _ Ca (NO3)2
Теперь проверим еще раз. По два серебра с каждой стороны. По две нитраты с каждой стороны. Один кальций с каждой стороны и два хлорида с обеих сторон. Сбалансированная реакция:
2 AgNO3 + CaCl2 2 AgCl + Ca (NO3)2
УРАВНЕНИЯ БАЛАНСА С ВОДОЙ КАК ПРОДУКТ
Серная кислота и гидроксид калия нейтрализуют друг друга, образуя воду и сульфат калия. Вот кислотно-щелочная нейтрализация. Из них получают соль (не обязательно обычную поваренную соль) и воду. (Обратите внимание, что ионные материалы записываются в виде ионов, поэтому они обязательно будут правильными. Вода и серная кислота являются элементами памяти, и их не нужно записывать в ионной форме, хотя вы можете написать ионы, чтобы убедиться, что они правильные. )
_ h3SO4(водн.) + _ K + (OH) — (водн. ) _ K + 2(SO4) 2+ (водн.)+ _ h3O(ж)
) _ K + 2(SO4) 2+ (водн.)+ _ h3O(ж)
Вода состоит из иона водорода кислоты и гидроксид-иона основания. Обратите внимание, что намного легче понять, как сбалансировать реакцию, если вы пишете воду, как если бы она была ионным соединением.
_ h3(SO4)+ _ K + (OH) — _ K + 2(SO4) 2+ + _ H + (OH) —
Теперь это проще, потому что водород в кислоте не путают с водородом в гидроксиде основания. Два атома водорода с каждой стороны. Один сульфат с обеих сторон. Два калия и два гидроксида с каждой стороны.
h3(SO4)+ 2 K(OH) K2(SO4) + 2 H(OH)
Теперь реакция сбалансирована.
Далее приведен пример повторного обхода уравнения. Фосфорная кислота и гидроксид кальция реагируют с образованием воды и фосфата кальция.
_ h4PO4(водн.) + _ Ca 2+ (OH) -2 _ H + (OH) — (l)+ _ Ca 2+ 3(PO4)
5- 2 Сначала поставьте тройку на воду, чтобы сбалансировать водород в фосфорной кислоте.
_ h4PO4 + _ Ca(OH)2 3 H(OH)+ _ Ca3(PO4)2
Теперь поставьте двойку на фосфорную кислоту, чтобы сбалансировать фосфат от фосфата кальция.
2 h4PO4 + _ Ca(OH)2 3 H(OH)+ Ca3(PO4)2
Мы изменили количество иона водорода, поэтому нам придется снова изменить его справа.
2 h4PO4 + _ Ca(OH)2 6 H(OH)+ Ca3(PO4)2
И измените коэффициент перед Ca(OH)2, чтобы он соответствовал кальцию с правой стороны.
2 h4PO4 + 3 Ca(OH)2 6 H(OH)+ Ca3(PO4)2
Только теперь остальная часть уравнения уравновешивается шестью атомами водорода, шестью гидроксидами, двумя фосфатами и тремя кальциями с каждой стороны.
БАЛАНСИРОВКА РЕАКЦИЙ ГОРЕНИЯ
Большинство реакций горения представляют собой окисление топливного материала газообразным кислородом. При полном сгорании образуется двуокись углерода из всего углерода в топливе, вода из водорода в топливе и двуокись серы из любой серы в топливе. Газообразный метан (Ch5) сгорает на воздухе (используя кислород) с образованием углекислого газа и воды (водяного пара).
_ Ch5(г) + _ O2(г) _ h3O(г) + _ CO2(г)
Легко. Поставьте двойку перед водой, чтобы позаботиться обо всех атомах водорода, и двойку перед кислородом. Все, что вам нужно собрать (любой атом, который поступает из двух или более источников в реагентах или распределяется между двумя или более продуктами), следует рассматривать в последнюю очередь.
Ch5 + _ O2 2 h3O + CO2
Ch5 + 2 O2 2 h3O + CO2
Что делать, если кислород выходит неправильно? Рассмотрим уравнение горения бутана C4h20.
_ C4h20 + _ O2 _ CO2 + _ h3O
Введите коэффициенты для углекислого газа и воды.
_ C4h20 + _ O2 4 CO2 + 5 h3O
Теперь у нас есть два атома кислорода слева и тринадцать атомов кислорода справа. Настоящая проблема заключается в том, что мы должны писать кислород как двухатомный газ. Химическое уравнение ничем не отличается от алгебраического уравнения тем, что вы можете умножать обе части на одно и то же и не изменять уравнение. Умножьте обе части на два, чтобы получить следующее.
2 C4h20 + _ O2 8 CO2 + 10 h3O
Теперь кислород легко сбалансировать. Справа двадцать шесть атомов кислорода, поэтому коэффициент для кислорода слева должен быть равен тринадцати.
2 C4h20 + 13 O2 8 CO2 + 10 h3O
Теперь правильно сбалансировано. Что, если вы наконец сбалансируете то же уравнение с:
4 C4h20 + 26 O2 16 CO2 + 20 h3O
или
6 C4h20 + 39 O2 24 CO2 + 30 h3O
Любое уравнение сбалансировано, но не до наименьшего целого числа . Алгебраически вы можете разделить эти уравнения на два или три, чтобы получить наименьшие целые коэффициенты перед всеми материалами в уравнении.
Теперь, когда мы полные пироманы, давайте попробуем сжечь изопропиловый спирт, C 3 H 7 OH.
_ C3H7OH(ж) + _ O2(г) _ CO2(г) + _ h3O(г)
Сначала займитесь углеродом и водородом.
_ C3H7OH + _ O2 3 CO2 + 4 h3O
Но опять сталкиваемся с кислородной проблемой. Здесь работает тот же процесс. Умножьте все уравнение (кроме кислорода) на два.
Умножьте все уравнение (кроме кислорода) на два.
2 C3H7OH + _ O2 6 CO2 + 8 h3O
Теперь цифра девять соответствует кислородному коэффициенту. (Вы понимаете, почему?) Уравнение уравновешено шестью атомами углерода, шестнадцатью атомами водорода и двадцатью атомами кислорода с каждой стороны.
2 C3H7OH + 9 O2 6 CO2 + 8 h3O
БАЛАНСИРОВКА ПО ОБЗОРУ
Некоторые уравнения просто жалкие, неприятные и гнилые, и вам не под силу сбалансировать их. Для некоторых из этих уравнений полезен процесс, который я называю обзором. Возьмем, к примеру, плавку магнетита, железной руды.
_ Fe3O4(s) + _ CO(g) _ CO2(g) + _ Fe(l)
Если только вы случайно не попали в точку, вы вряд ли сбалансируете это уравнение методом проб. (Попробуйте, прежде чем читать дальше.)
Обзор реакции показывает, что на каждый кислород, который есть в магнетите, один монооксид углерода должен превратиться в диоксид углерода. Окись углерода и двуокись углерода должны иметь коэффициент, в четыре раза превышающий коэффициент магнетита. Оставьте коэффициент магнетита и поставьте «4» перед окисью углерода и двуокисью углерода.
Оставьте коэффициент магнетита и поставьте «4» перед окисью углерода и двуокисью углерода.
_ Fe3O4 + 4 CO 4 CO2 + _ Fe
Углерод и кислород сбалансированы, остается только железо.
Fe3O4 + 4 CO 4 CO2 + 3 Fe
БАЛАНСИРОВКА Окислительно-восстановительных уравнений
Балансировка уравнений, включающих восстановление и окисление, будет рассмотрена в главе, посвященной окислительно-восстановительным реакциям (реакции восстановления и окисления).
ТИПЫ ОБЫЧНЫХ ИОННЫХ РЕАКЦИЙ
РЕАКЦИИ СИНТЕЗА
ТАКЖЕ НАЗЫВАЕМЫЕ РЕАКЦИЯМИ КОМБИНИРОВАНИЯ, КОНСТРУКЦИИ ИЛИ КОМПОЗИЦИИ
Заголовок этого раздела содержит четыре названия для одного и того же типа реакции. Ваш текст может использовать любой из них. Chemtutor предпочитает первое из названий и будет использовать «синтез», если в вашем тексте может использоваться одно из других слов. Отличительной чертой реакции синтеза является единственный продукт. Реакцию синтеза можно обозначить следующим образом:
A + B AB
Два материала, элемента или соединения объединяются в единый продукт. Некоторые примеры реакций синтеза: Газообразный водород и газообразный кислород сгорают с образованием воды.
Некоторые примеры реакций синтеза: Газообразный водород и газообразный кислород сгорают с образованием воды.
2 h3(г) + O2(г) 2 h3O(г) и
триоксид серы реагирует с водой с образованием серной кислоты.
h3O(г) + SO3(г) h3SO4(г)
Что бы вы увидели в «пробирке», если бы стали свидетелем реакции синтеза? Вы увидите, как сочетаются два разных материала. Появляется один новый материал.
РЕАКЦИИ РАЗЛОЖЕНИЯ
ТАКЖЕ НАЗЫВАЕМЫЕ ДЕСИНТЕЗОМ, РАЗЛОЖЕНИЕМ ИЛИ РАЗЛОЖЕНИЕМ
Из названий этого типа реакции Chemtutor снова предпочитает первое. Моцарт сочинял до 35 лет. После этого он разложился. Да, разложение есть разложение. Один реагент распадается на два или более продуктов, обозначенных как:
XZ X + Z
Некоторые примеры реакций разложения: хлорат калия при нагревании распадается на газообразный кислород и хлорид калия
2 KClO3(т) 2 KCl(т) + 3 O2(г)
и при нагревании бикарбоната натрия выделяется вода, диоксид углерода и карбонат натрия.
6 NaHCO3(т) 3 Na2CO3(т) + 3 h3O(г) + 3 CO2(г)
В «пробирке» вы увидите, как один материал распадается на более чем один новый материал.
ОДИНОЧНАЯ РЕАКЦИЯ ЗАМЕЩЕНИЯ
ТАКЖЕ НАЗЫВАЕТСЯ ОДИНАРНЫМ ЗАМЕЩЕНИЕМ, ОДИНОЧНОЙ ЗАМЕНОЙ ИЛИ ЗАМЕНОЙ АКТИВНОСТИ
Вот пример реакции одиночного замещения: в раствор нитрата серебра помещают кусок меди. Раствор начинает синеть, и кажется, что медь исчезает. Вместо этого появляется серебристо-белый материал.
2 AgNO3(водн.) + Cu(s) Cu(NO3)2(водн.) + 2 Ag
Раствор ионного соединения содержит элемент. Элемент замещает один из ионов в растворе, и из иона в растворе появляется новый элемент. Этот тип реакции называется заменой, потому что свободный элемент замещает один из ионов в соединении. Существует два типа реакций одинарного замещения: анионные и катионные. Катионная одиночная замена — это то, что произошло в случае замены серебра медью в приведенной выше реакции, потому что и серебро, и медь могут образовывать только катионы. Возможна также анионная одинарная замена. В раствор иодида калия барботируют газообразный хлор. Хлор израсходован, и раствор становится пурпурно-коричневым от йода. Это пример анионной реакции одинарного замещения.
Возможна также анионная одинарная замена. В раствор иодида калия барботируют газообразный хлор. Хлор израсходован, и раствор становится пурпурно-коричневым от йода. Это пример анионной реакции одинарного замещения.
2 KI(водн.) + Cl2(г) 2 KCl(водн.) + I2(г)
Не могли бы вы начать с нитрата меди II и металлического серебра и получить нитрат серебра и металлическую медь, или вы могли бы начать с хлорида калия и йода и получить йодид калия и хлор? Нет. Реакции так не работают. Вы можете расположить катионы или анионы в списке, какой ион заменит следующий. Этот тип списка представляет собой серию действий. Ряд активности катионных элементов (металлов) показывает, что золото является наименее активным металлом. В этом нет ничего удивительного, ведь золото не тускнеет. Если бы мы рассматривали элементы группы 1 только в списке активности, литий был бы наименее активным, а франций — наиболее активным, причем каждый более крупный элемент был бы более активным, чем меньший над ним в периодической таблице. На другой стороне диаграммы мы могли бы рассмотреть ряд активности анионов. Взяв только галогены, самый маленький галоген, фтор является наиболее активным. По мере того, как размер галогена увеличивается вниз по диаграмме, активность уменьшается. Если элемент более активен, чем элемент того же знака в ионном растворе, то более активный элемент заменит его.
На другой стороне диаграммы мы могли бы рассмотреть ряд активности анионов. Взяв только галогены, самый маленький галоген, фтор является наиболее активным. По мере того, как размер галогена увеличивается вниз по диаграмме, активность уменьшается. Если элемент более активен, чем элемент того же знака в ионном растворе, то более активный элемент заменит его.
РЕАКЦИИ ДВОЙНОГО ЗАМЕЩЕНИЯ
ТАКЖЕ НАЗЫВАЕМЫЕ ДВОЙНЫМ ЗАМЕЩЕНИЕМ ИЛИ МЕТАТЕЗИСОМ
В некоторых текстах реакции одинарного и двойного замещения называются реакциями в растворе или ионными реакциями. Это понятно, учитывая, что в основном это делается в растворах, в которых основные материалы, которые мы будем рассматривать, находятся в ионной форме. Химтутор считает, что есть веская причина называть реакции двойного замещения деионизирующими реакциями, потому что в этих реакциях из раствора забирается пара ионов. Возьмем пример.
AgNO3(водн.) + KCl(водн.) AgCl( s ) + KNO3(водн.)
Выше показано, как реакция может быть опубликована в книге, но уравнение не раскрывает всей истории. Растворенный нитрат серебра становится раствором ионов серебра и нитрат-ионов. Хлористый калий ионизируется таким же образом. Когда два раствора сливаются вместе, ионы серебра и ионы хлора находят друг друга и образуют твердый осадок. (Они «дождятся» или выпадают из раствора, на этот раз в твердом виде.) Поскольку хлорид серебра нерастворим в воде, ионы поглощают друг друга из раствора.
Растворенный нитрат серебра становится раствором ионов серебра и нитрат-ионов. Хлористый калий ионизируется таким же образом. Когда два раствора сливаются вместе, ионы серебра и ионы хлора находят друг друга и образуют твердый осадок. (Они «дождятся» или выпадают из раствора, на этот раз в твердом виде.) Поскольку хлорид серебра нерастворим в воде, ионы поглощают друг друга из раствора.
Ag + + (NO3) — + K + +Cl — AgCl + K + + (NO3) —
Вот еще один способ извлечь ионы из раствора. Соляная кислота и гидроксид натрия (кислота и основание) нейтрализуют друг друга, образуя воду и соль. Опять же, раствор соляной кислоты представляет собой раствор водорода (ионы гидроксония в кислотной и основной секциях) и ионов хлора. Другой раствор, который нужно добавить к нему, гидроксид натрия, содержит ионы натрия и гидроксид-ионы. Ионы водорода и гидроксида поглощают друг друга из раствора, образуя ковалентное соединение (воду).
HCl(водн.) + NaOH(водн.) HOH(л) + NaCl(водн.) или
H + + Cl — + Na + + (OH) — HOH + Na + + Cl —
Еще один способ извлечения ионов из воды — это выход части ионов в виде газа.
CaCO3(s) + 2 HCl(aq) CaCl2(aq) + h3O(l) + CO2(g)
Ca 2+ + (CO3) 2- + 2 H + + 2 Cl — Са 2+ + 2 Класс — + h3O + CO2
Ионы карбоната и водорода превратились в воду и углекислый газ. Углекислый газ теряется в виде газа с ионным раствором, поэтому уравнение не может вернуться назад.
Один из способов рассмотрения реакций двойного замещения заключается в следующем: два раствора ионных соединений на самом деле представляют собой просто наборы растворенных ионов, каждый раствор содержит положительный и отрицательный ионный материал. Эти два добавляются вместе, образуя смесь четырех ионов. Если два иона могут образовывать (1) нерастворимый материал, (2) ковалентный материал, такой как вода, или (2) газ, который может выделяться, это квалифицируется как реакция.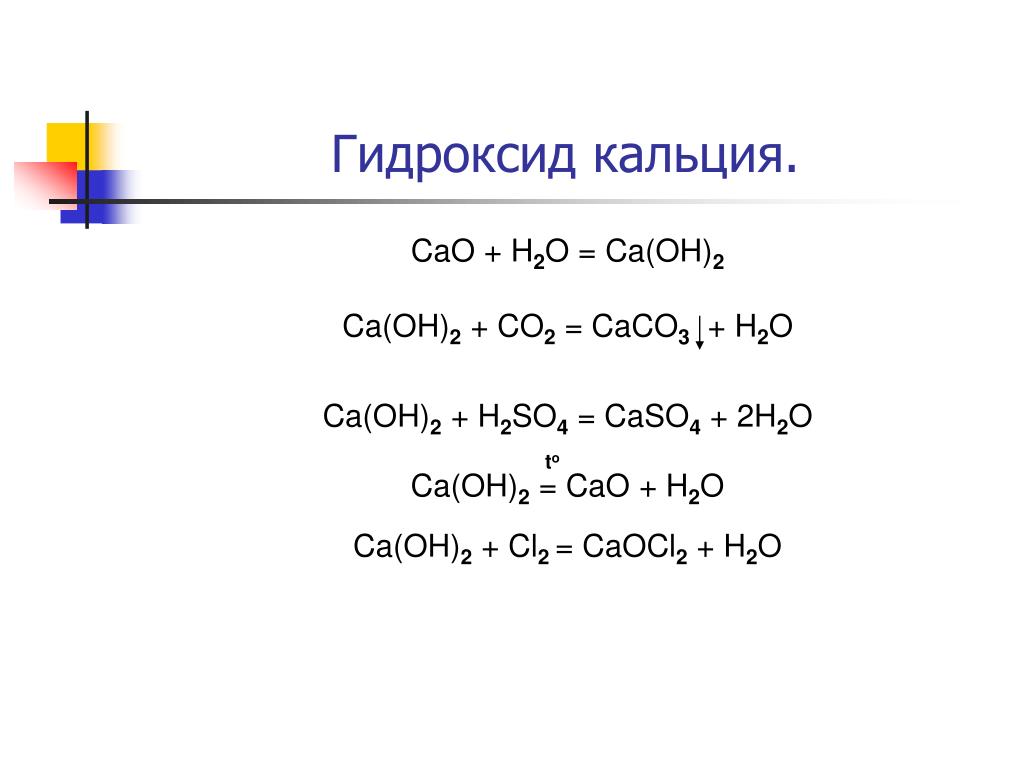 Не все ионы действительно участвуют в реакции. Те ионы, которые остаются в растворе после завершения реакции, называются ионами-спектаторами, т. е. не участвуют в реакции. Есть некоторый вопрос, могут ли они видеть действие других ионов, но это то, как они называются.
Не все ионы действительно участвуют в реакции. Те ионы, которые остаются в растворе после завершения реакции, называются ионами-спектаторами, т. е. не участвуют в реакции. Есть некоторый вопрос, могут ли они видеть действие других ионов, но это то, как они называются.
Проблемы
ПРАВИЛЬНО НАПИШИТЕ ФОРМУЛУ ДЛЯ КАЖДОГО МАТЕРИАЛА И ЗАТЕМ СОСТАВЬТЕ УРАВНЕНИЕ. ЕСТЬ НЕКОТОРЫЕ РЕАКЦИИ, КОТОРЫЕ ТРЕБУЮТ ЗАВЕРШЕНИЯ. ДЛЯ КАЖДОЙ РЕАКЦИИ УКАЖИТЕ, КАКОЙ ТИП РЕАКЦИИ ЯВЛЯЕТСЯ.
- Триоксид серы и вода объединяются для получения серной кислоты.
- Нитрат свинца II и йодид натрия реагируют с образованием йодида свинца и нитрата натрия.
- фторид кальция и серная кислота образуют сульфат кальция и фтороводород (фтористоводородную кислоту) 9Карбонат кальция 0003 распадается при нагревании, оставляя оксид кальция и углекислый газ.
- Газообразный аммиак при попадании в воду образует гидроксид аммония.
- гидроксид натрия нейтрализует угольную кислоту
- сульфид цинка и кислород превращаются в оксид цинка и серу.

- оксид лития и вода образуют гидроксид лития
- гидроксид алюминия и серная кислота нейтрализуют с образованием воды и сульфата алюминия.
- сера сгорает в кислороде с образованием диоксида серы.
- Гидроксид бария и серная кислота образуют воду и сульфат бария.
- сульфат алюминия и гидроксид кальция становятся гидроксидом алюминия и сульфатом кальция.
- металлическая медь и нитрат серебра реагируют с образованием металлического серебра и нитрата меди II.
- Металлический натрий и хлор реагируют с образованием хлорида натрия.
- Из фосфата кальция и серной кислоты получают сульфат кальция и фосфорную кислоту.
- фосфорная кислота плюс гидроксид натрия.
- сжигание пропана (с кислородом)
- сульфат цинка и меди II дают сульфат цинка и металлическую медь
- серная кислота реагирует с цинком
- уксусная кислота ионизирует.
- паровой метан для получения водорода и диоксида углерода
- оксид кальция и алюминия для получения оксида алюминия и кальция
- газообразный хлор и бромид натрия для получения хлорида натрия и брома
ОТВЕТЫ
1. SO3 + h3O h3SO4
SO3 + h3O h3SO4
СИНТЕЗ
2. Pb(NO3)2 + 2NaI PbI2 + 2NaNO3
двойная замена (осадки йодида II II)
3. CAF2 + H3SO4 CASO4 + 2 HF
Двойная замена (осадки сульфата кальция)
4. CACO3 CAO + CO2
DECOPOTION 6. 2 NaOH + H3CO3 NA2CO3 + 2 H3O
Двойная замена или нейтрализация кислотной базы
7. 2 ZnS + O2 2 ZnO + 2 S
Анионическая замена
8. LI2O + H3O 2 LIOH
Синтез
9. 2 Al(OH)3 + 3 h3SO4 6 h3O + Al2(SO4)3
ДВОЙНАЯ ЗАМЕНА ИЛИ КИСЛОТНО-ОСНОВНАЯ НЕЙТРАЛИЗАЦИЯ
10. S + O2 SO2
СИНТЕЗ
11. Ba(OH)2 + h3SO4 2 h3O + BaSO4
ДВОЙНАЯ ЗАМЕНА ИЛИ КИСЛОТНО-ОСНОВНАЯ НЕЙТРАЛИЗАЦИЯ 2.Al
14. 2Na + Cl2 2 NaCl
СИНТЕЗ
15. Ca3(PO4)2 + 3 h3SO4 3 CaSO4 + 2 h4PO4
Двойная замена
16. H4 (PO4) + 3 NaOH NA3PO4 + 3 H3O
Двойная замена (нейтрализация)
17. C3H8 + 5 O2 4 H3O + 3 CO2
Сжигание углеворонового
18. + CU
катионная отдельная замена
19. H3SO4 + Zn ZnSO4 + H3
H3SO4 + Zn ZnSO4 + H3
Катионная отдельная замена
20. HC2H4O2 H + + (C2H4O2) —
ionsization (Обратите внимание, что IT ITSERSIBLIBLE)
IONICATICAITION (Обратите внимание, а это. h3O + Ch5 4 h3 + CO2
22. 3 CaO + 2 Al Al2O3 + 3 Ca
КАТИОННЫЙ ОДИНАРНАЯ ЗАМЕНА
23. Cl2 + 2 NaBr 2 NaCl + Br2
АНИОНОВЫЙ ОДИНОЧНАЯ ЗАМЕНА
Участники
9000http://)Copyright © 1997-2009 Chemtutor, LLC. Все права защищены. |
Публикация любой части запрещена без предварительного письменного согласия, за исключением использования инструктором для публикации в собственных классах инструктора. Все печатные материалы, распространяемые в соответствии с этим исключением, должны иметь на каждой странице размещено ссылка на http://www.chemtutor. |
Дополнительная литература
Виртуальный учебник органической химии штата Мичиган
Химическая реактивность
Реагенты и реактивы
Презентации слайдов
Реакции и механизмы
Description of Chemical Reactions распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- На этой странице нет тегов.
Рабочий лист уравнений балансировки Вы должны показать свою работу! 1. К2 + h3 Кh4 2. Ч5 + О2 СО2 + Н3О 3. Р4 + О2 Р2О3 4. h3 + NO N2 + h3O 5. Na + Cl2 NaCl 6. TiCl4 + Na NaCl + Ti 7. S8 + О2 SO3 8. KClO3 O2 KCl 9. Na3PO4 + Fe(NO3)3 FePO4 + NaNO3 10. Ca(OH)2 + h4PO4 Ca3(PO4)2 + h3O 11. HNO3 + NaHCO3 NaNO3 + h3O + CO2 12. h3O2 h3O + O2 13. С3Н8 + О2 СО2 + Н3О 14. Н3О + СО2 О2 + С6х22О6 15. AgNO3 + Cu Cu(NO3)2 + Ag 16. CBr4 + Cl2 CCl4 + Br2 17. Cu + h3SO4 CuSO4 + h3O + SO2 18. Na2S + Fe(NO3)3 Fe2S3 + NaNO3 19. Pb(OH)2 + HCl·h3O + PbCl2 20. AlBr3 + K2SO4 KBr + Al2(SO4)3 21. Na3PO4 + CaCl2 NaCl + Ca3(PO4)2 22. Al + HCl·h3 + AlCl3 23. Nh4 + h3SO4 (Nh5)2SO4 24. С8х28 + О2 СО2 + Н3О 25. CaCO3 + HCl·h3O + CO2 + CaCl2 26.Na2O + h3O NaOH 27. NaHCO3·h3O + CO2 + Na2CO3 28. Р4 + О2 Р2О3 29.
 Fe(NO3)3 + NaOH Fe(OH)3 + NaNO3
30. Na + h3O h3 + NaOH
31. Na2SO3 + HCl·h3O + SO2 + NaCl
32. Zn + Cu(NO3)2 Cu + Zn(NO3)2
33. С2х3 + О2 СО2 + Н3О
34. h3SO4 + KNO2 HNO2 + K2SO4
35. Cu + HNO3 Cu(NO3)2 + NO2 + h3O
36.I2 + NaOH NaI + NaIO3 + h3O
Fe(NO3)3 + NaOH Fe(OH)3 + NaNO3
30. Na + h3O h3 + NaOH
31. Na2SO3 + HCl·h3O + SO2 + NaCl
32. Zn + Cu(NO3)2 Cu + Zn(NO3)2
33. С2х3 + О2 СО2 + Н3О
34. h3SO4 + KNO2 HNO2 + K2SO4
35. Cu + HNO3 Cu(NO3)2 + NO2 + h3O
36.I2 + NaOH NaI + NaIO3 + h3OВопрос
Рабочий лист уравнений баланса
Вы должны показать свою работу!
1. ____ К2 + ____ h3 _____ Кh4
2. ____ Ch5 + ____ O2 ____ CO2 + ____ h3O
3. ____ Р4 + ____ О2 ____ Р2О3
4. ____h3 + ____NO______N2 + ______h3O
5. ____Na + ____Cl2 ____NaCl
6. ____ TiCl4 + ____ Na ____ NaCl + ____ Ti
7. ____ S8 + ____ O2 ____ SO3
8. ____ KClO3 ____ O2 ____ KCl
9. ____ Na3PO4 + ____ Fe(NO3)3 ____ FePO4 + ____ NaNO3
10.____ Ca(OH)2 + ____ h4PO4 ____ Ca3(PO4)2 + ____ h3O
11.____ HNO3 + ____ NaHCO3 ____ NaNO3 + ____ h3O + _____CO2
12.____ ч3О2 ____ ч3О + ____ О2
13.____ C3H8 + ____ O2 ____ CO2 + ____ h3O
14.____ ч3О + ____ СО2 ____ О2 + ____ С6ч22О6
15.____ AgNO3 + ____ Cu ____ Cu(NO3)2 + ____ Ag
16.____ CBr4 + ____ Cl2 ____ CCl4 + ____ Br2
17.____ Cu + ____ h3SO4 ____ CuSO4 + ____ h3O + _____SO2
18. ____ Na2S + ____ Fe(NO3)3 ____ Fe2S3 + ____ NaNO3
19.____ Pb(OH)2 + ____ HCl ____ h3O + ____ PbCl2
20.____ AlBr3 + ____ K2SO4 ____ KBr + ____ Al2(SO4)3
21.____ Na3PO4 + ____ CaCl2 ____ NaCl + ____ Ca3(PO4)2
22.____ Al + ____ HCl ____ h3 + ____ AlCl3
23.____ Кh4 + ____ h3SO4 ____ (Кh5)2SO4
24.____ C8h28 + ____ O2 ____ CO2 + ____ h3O
25.____ CaCO3 + ____ HCl ____ h3O + ______CO2 + ____ CaCl2
26.______Na2O + ____h3O ____NaOH
27.____ NaHCO3 ____ h3O + ____ CO2 + _____Na2CO3
28._____ Р4 + ____ О2 ____ Р2О3
29.____ Fe(NO3)3 + ____ NaOH ____ Fe(OH)3 + ____ NaNO3
30.____Na + ____h3O ____h3 + ____NaOH
31.____ Na2SO3 + ____ HCl ____ h3O + ______SO2 + ____ NaCl
32. ____ Zn + ____ Cu(NO3)2 ____ Cu + _____ Zn(NO3)2
33.____ C2h3 + ____ O2 ____ CO2 + ____ h3O
34.____ h3SO4 + ____ KNO2 ____ HNO2 + ____ K2SO4
35. ________Cu + _____HNO3 _____Cu(NO3)2 + _____NO2 + ______h3O
36.________I2 + _______NaOH _____NaI + _____NaIO3 + ______h3O
____ Na2S + ____ Fe(NO3)3 ____ Fe2S3 + ____ NaNO3
19.____ Pb(OH)2 + ____ HCl ____ h3O + ____ PbCl2
20.____ AlBr3 + ____ K2SO4 ____ KBr + ____ Al2(SO4)3
21.____ Na3PO4 + ____ CaCl2 ____ NaCl + ____ Ca3(PO4)2
22.____ Al + ____ HCl ____ h3 + ____ AlCl3
23.____ Кh4 + ____ h3SO4 ____ (Кh5)2SO4
24.____ C8h28 + ____ O2 ____ CO2 + ____ h3O
25.____ CaCO3 + ____ HCl ____ h3O + ______CO2 + ____ CaCl2
26.______Na2O + ____h3O ____NaOH
27.____ NaHCO3 ____ h3O + ____ CO2 + _____Na2CO3
28._____ Р4 + ____ О2 ____ Р2О3
29.____ Fe(NO3)3 + ____ NaOH ____ Fe(OH)3 + ____ NaNO3
30.____Na + ____h3O ____h3 + ____NaOH
31.____ Na2SO3 + ____ HCl ____ h3O + ______SO2 + ____ NaCl
32. ____ Zn + ____ Cu(NO3)2 ____ Cu + _____ Zn(NO3)2
33.____ C2h3 + ____ O2 ____ CO2 + ____ h3O
34.____ h3SO4 + ____ KNO2 ____ HNO2 + ____ K2SO4
35. ________Cu + _____HNO3 _____Cu(NO3)2 + _____NO2 + ______h3O
36.________I2 + _______NaOH _____NaI + _____NaIO3 + ______h3O
Шаг за шагом Ответ:
Шаг 1/27
1. N2 + h3 _____ Nh4
N2 + h3 _____ Nh4
Шаг 2/27
2. Ch5 + O2 ____ CO2 + h3O
Шаг 3/27
3. P4 + O2 ____ P2O3
3 Лучший ответ Видео 4
Решено проверенным экспертом
Вопрос о лучшем совпадении
Пошаговые ответы
Рабочий лист уравнений балансировки
Вы должны показать свою работу!
1. ____ К2 + ____ h3 _____ Кh4
2. ____ Ch5 + ____ O2 ____ CO2 + ____ h3O
3. ____ Р4 + ____ О2 ____ Р2О3
4. ____h3 + ____NO______N2 + ______h3O
5. ____Na + ____Cl2 ____NaCl
6. ____ TiCl4 + ____ Na ____ NaCl + ____ Ti
7. ____ S8 + ____ O2 ____ SO3
8. ____ KClO3 ____ O2 ____ KCl
9. ____ Na3PO4 + ____ Fe(NO3)3 ____ FePO4 + ____ NaNO3
10.____ Ca(OH)2 + ____ h4PO4 ____ Ca3(PO4)2 + ____ h3O
11.____ HNO3 + ____ NaHCO3 ____ NaNO3 + ____ h3O + _____CO2
12.____ ч3О2 ____ ч3О + ____ О2
13.____ C3H8 + ____ O2 ____ CO2 + ____ h3O
14.____ ч3О + ____ СО2 ____ О2 + ____ С6ч22О6
15.____ AgNO3 + ____ Cu ____ Cu(NO3)2 + ____ Ag
16.____ CBr4 + ____ Cl2 ____ CCl4 + ____ Br2
17.____ Cu + ____ h3SO4 ____ CuSO4 + ____ h3O + _____SO2
18. ____ Na2S + ____ Fe(NO3)3 ____ Fe2S3 + ____ NaNO3
19.____ Pb(OH)2 + ____ HCl ____ h3O + ____ PbCl2
20.____ AlBr3 + ____ K2SO4 ____ KBr + ____ Al2(SO4)3
21.____ Na3PO4 + ____ CaCl2 ____ NaCl + ____ Ca3(PO4)2
22.____ Al + ____ HCl ____ h3 + ____ AlCl3
23.____ Кh4 + ____ h3SO4 ____ (Кh5)2SO4
24.____ C8h28 + ____ O2 ____ CO2 + ____ h3O
25.____ CaCO3 + ____ HCl ____ h3O + ______CO2 + ____ CaCl2
26.______Na2O + ____h3O ____NaOH
27.____ NaHCO3 ____ h3O + ____ CO2 + _____Na2CO3
28._____ Р4 + ____ О2 ____ Р2О3
29.____ Fe(NO3)3 + ____ NaOH ____ Fe(OH)3 + ____ NaNO3
30.____Na + ____h3O ____h3 + ____NaOH
31.____ Na2SO3 + ____ HCl ____ h3O + ______SO2 + ____ NaCl
32. ____ Zn + ____ Cu(NO3)2 ____ Cu + _____ Zn(NO3)2
33.____ C2h3 + ____ O2 ____ CO2 + ____ h3O
34.____ h3SO4 + ____ KNO2 ____ HNO2 + ____ K2SO4
35. ________Cu + _____HNO3 _____Cu(NO3)2 + _____NO2 + ______h3O
36.________I2 + _______NaOH _____NaI + _____NaIO3 + ______h3O
____ Na2S + ____ Fe(NO3)3 ____ Fe2S3 + ____ NaNO3
19.____ Pb(OH)2 + ____ HCl ____ h3O + ____ PbCl2
20.____ AlBr3 + ____ K2SO4 ____ KBr + ____ Al2(SO4)3
21.____ Na3PO4 + ____ CaCl2 ____ NaCl + ____ Ca3(PO4)2
22.____ Al + ____ HCl ____ h3 + ____ AlCl3
23.____ Кh4 + ____ h3SO4 ____ (Кh5)2SO4
24.____ C8h28 + ____ O2 ____ CO2 + ____ h3O
25.____ CaCO3 + ____ HCl ____ h3O + ______CO2 + ____ CaCl2
26.______Na2O + ____h3O ____NaOH
27.____ NaHCO3 ____ h3O + ____ CO2 + _____Na2CO3
28._____ Р4 + ____ О2 ____ Р2О3
29.____ Fe(NO3)3 + ____ NaOH ____ Fe(OH)3 + ____ NaNO3
30.____Na + ____h3O ____h3 + ____NaOH
31.____ Na2SO3 + ____ HCl ____ h3O + ______SO2 + ____ NaCl
32. ____ Zn + ____ Cu(NO3)2 ____ Cu + _____ Zn(NO3)2
33.____ C2h3 + ____ O2 ____ CO2 + ____ h3O
34.____ h3SO4 + ____ KNO2 ____ HNO2 + ____ K2SO4
35. ________Cu + _____HNO3 _____Cu(NO3)2 + _____NO2 + ______h3O
36.________I2 + _______NaOH _____NaI + _____NaIO3 + ______h3O
Расшифровка
Тогда это уравновешивающая партия уравнения. Нам нужно сбалансировать 36 уравнений, и я не буду переписывать все 36. Поэтому, если вы видите число, например, эти двойки и тройки в первом 1, пожалуйста, предположите, что это снова нижние индексы. Есть 36 уравнений, я не переписываю все 36, поэтому просто предположим, что это какие-то обрывки, поэтому первое 1 у нас есть газообразный азот с газообразным водородом, образуя аммиак, так что сразу мы видим, что есть 2 конца или 2 точки азота. . Итак, мы собираемся поставить 2 здесь, так что есть баланс азота, а затем наш h 3. Итак, у нас есть 2 умножить на 3 равно 6. Итак, мы собираемся поставить 3 здесь метан и кислород, образующие воду и углекислый газ. Итак, у нас есть 1 углерод 1 углерод. У нас есть 4 водорода и 2 здесь, поэтому мы собираемся поставить 2 перед этой водой. Это означает, что у нас теперь 4 кислорода справа, поэтому мы просто поставим 2 здесь, чтобы иметь 4 слева. У нас есть фосфор и кислород, поэтому, поскольку у нас слева 4 фосфора, мы собираемся поставить 2 здесь, чтобы сбалансировать тот фосфор, который дает нам 6 кислорода.
Нам нужно сбалансировать 36 уравнений, и я не буду переписывать все 36. Поэтому, если вы видите число, например, эти двойки и тройки в первом 1, пожалуйста, предположите, что это снова нижние индексы. Есть 36 уравнений, я не переписываю все 36, поэтому просто предположим, что это какие-то обрывки, поэтому первое 1 у нас есть газообразный азот с газообразным водородом, образуя аммиак, так что сразу мы видим, что есть 2 конца или 2 точки азота. . Итак, мы собираемся поставить 2 здесь, так что есть баланс азота, а затем наш h 3. Итак, у нас есть 2 умножить на 3 равно 6. Итак, мы собираемся поставить 3 здесь метан и кислород, образующие воду и углекислый газ. Итак, у нас есть 1 углерод 1 углерод. У нас есть 4 водорода и 2 здесь, поэтому мы собираемся поставить 2 перед этой водой. Это означает, что у нас теперь 4 кислорода справа, поэтому мы просто поставим 2 здесь, чтобы иметь 4 слева. У нас есть фосфор и кислород, поэтому, поскольку у нас слева 4 фосфора, мы собираемся поставить 2 здесь, чтобы сбалансировать тот фосфор, который дает нам 6 кислорода.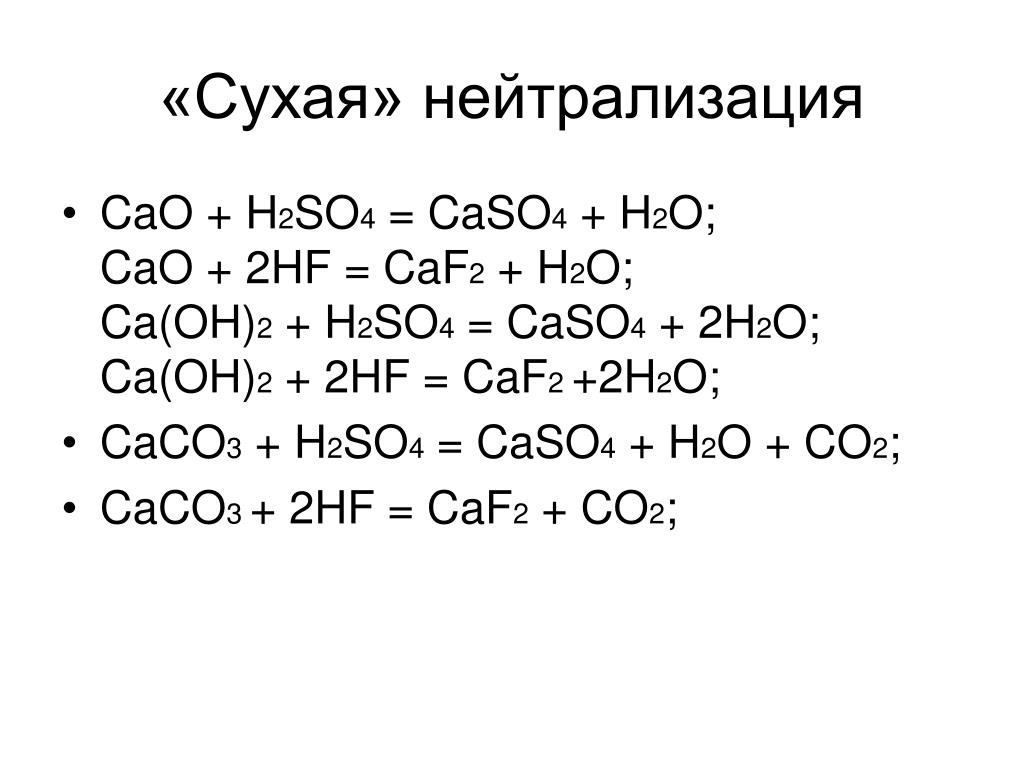 Итак, мы собираемся поставить 3 на левый вопрос 4. У нас есть водород и закись азота вместе, поэтому у нас есть 2 азота справа. Итак, мы собираемся поместить 2 слева, и у нас есть 2 водорода справа, у нас есть 2 слева, и у нас есть 1 кислород. Но теперь мы умножили его на 2, поэтому мы поставим здесь 2. Это означает, что мы должны поставить 2 в вопросе 5. У нас есть натрий, смешанный с газообразным хлором, с образованием хлорида натрия или поваренной соли, поэтому нам нужно будет поставить 2 перед хлоридом натрия и 2 перед натрием, который заботится о 2 для хлора номер 6. У нас есть хлорид натрия справа, сбоку, но есть только 1 хлор, поэтому нам придется умножить это на 4, чтобы сбалансировать хлор здесь . Это означает, что мы должны поставить 4 перед этим числом натрия 7. У нас есть сера и кислород, образующие сульфит или триоксид серы, поэтому, поскольку у нас есть 8 серы, это должно быть записано как s 8. У нас есть 8 серы, поэтому это означает, что мы должны поставить 8 перед серой.
Итак, мы собираемся поставить 3 на левый вопрос 4. У нас есть водород и закись азота вместе, поэтому у нас есть 2 азота справа. Итак, мы собираемся поместить 2 слева, и у нас есть 2 водорода справа, у нас есть 2 слева, и у нас есть 1 кислород. Но теперь мы умножили его на 2, поэтому мы поставим здесь 2. Это означает, что мы должны поставить 2 в вопросе 5. У нас есть натрий, смешанный с газообразным хлором, с образованием хлорида натрия или поваренной соли, поэтому нам нужно будет поставить 2 перед хлоридом натрия и 2 перед натрием, который заботится о 2 для хлора номер 6. У нас есть хлорид натрия справа, сбоку, но есть только 1 хлор, поэтому нам придется умножить это на 4, чтобы сбалансировать хлор здесь . Это означает, что мы должны поставить 4 перед этим числом натрия 7. У нас есть сера и кислород, образующие сульфит или триоксид серы, поэтому, поскольку у нас есть 8 серы, это должно быть записано как s 8. У нас есть 8 серы, поэтому это означает, что мы должны поставить 8 перед серой. Итак, теперь у нас есть 8 умножить на 3 для нашего кислорода, что равняется 24 очкам. Таким образом, мы должны поставить 12 здесь, чтобы сбалансировать кислород номер 8. У нас есть хлорат калия, распадающийся на хлорид калия и кислород. Ключ с кислородом, если у вас когда-нибудь будет 3 и 2. Все, что вам нужно сделать, это поменять местами эти значения. Кислород станет баллонным. Нам просто нужно поставить 2 перед k c l, потому что, если вы заметите, что kcl остается вместе, мы можем просто сбалансировать. Это 1 вещь. Вот еще одно место, где мы можем просто взглянуть на многоатомные ионы. Если мы видим здесь, у нас есть фосфаты, которые остаются вместе, а также наши нитраты, которые остаются вместе. Таким образом, мы можем относиться к ним так, как если бы они были всего лишь одним соединением. Итак, давайте посмотрим на наш натрий. У нас 3 слева. У нас есть 1 справа, поэтому давайте сбалансируем их, поставив 3 сейчас, так как наши нитраты остаются вместе, и 3 из них слева и 3 справа — нитраты сбалансированы.
Итак, теперь у нас есть 8 умножить на 3 для нашего кислорода, что равняется 24 очкам. Таким образом, мы должны поставить 12 здесь, чтобы сбалансировать кислород номер 8. У нас есть хлорат калия, распадающийся на хлорид калия и кислород. Ключ с кислородом, если у вас когда-нибудь будет 3 и 2. Все, что вам нужно сделать, это поменять местами эти значения. Кислород станет баллонным. Нам просто нужно поставить 2 перед k c l, потому что, если вы заметите, что kcl остается вместе, мы можем просто сбалансировать. Это 1 вещь. Вот еще одно место, где мы можем просто взглянуть на многоатомные ионы. Если мы видим здесь, у нас есть фосфаты, которые остаются вместе, а также наши нитраты, которые остаются вместе. Таким образом, мы можем относиться к ним так, как если бы они были всего лишь одним соединением. Итак, давайте посмотрим на наш натрий. У нас 3 слева. У нас есть 1 справа, поэтому давайте сбалансируем их, поставив 3 сейчас, так как наши нитраты остаются вместе, и 3 из них слева и 3 справа — нитраты сбалансированы. Теперь, если мы посмотрим на наши фосфаты и наше железо, они уже сбалансированы. Итак, давайте взглянем на пункт номер 10: у нас есть гидроксид кальция с фосфорной кислотой и посмотрите, как получается фосфат кальция в воде. Опять же, наши фосфаты остаются вместе. Таким образом, мы можем просто рассматривать их как 1 объект, но давайте посмотрим на этот bosatif, если вы видите, что слева их 2, или, извините, 2 справа и только 1 слева. Итак, давайте умножим это на 2 пункта, далее идут кальции. У нас есть 3 справа, поэтому нам понадобится 3 слева. Теперь, если это поможет, мы можем написать нашу воду как h, oh h, обратите внимание. Что значит его и их о, есть, разделены и похожи. Они, с левой стороны, сбоку, так что у нас для нашего. О, у нас есть 2 умножить на 3, что равняется 6 для нашего его. У нас есть 2 умножить на 3, что равно 6, так что нам просто нужно поставить 6 перед нашими водами. Смешивание азотной кислоты с бикарбонатом натрия. Итак, давайте посмотрим на наш co 2 или у нас есть 1 углерод и у нас есть 3 кислорода или 2 кислорода.
Теперь, если мы посмотрим на наши фосфаты и наше железо, они уже сбалансированы. Итак, давайте взглянем на пункт номер 10: у нас есть гидроксид кальция с фосфорной кислотой и посмотрите, как получается фосфат кальция в воде. Опять же, наши фосфаты остаются вместе. Таким образом, мы можем просто рассматривать их как 1 объект, но давайте посмотрим на этот bosatif, если вы видите, что слева их 2, или, извините, 2 справа и только 1 слева. Итак, давайте умножим это на 2 пункта, далее идут кальции. У нас есть 3 справа, поэтому нам понадобится 3 слева. Теперь, если это поможет, мы можем написать нашу воду как h, oh h, обратите внимание. Что значит его и их о, есть, разделены и похожи. Они, с левой стороны, сбоку, так что у нас для нашего. О, у нас есть 2 умножить на 3, что равняется 6 для нашего его. У нас есть 2 умножить на 3, что равно 6, так что нам просто нужно поставить 6 перед нашими водами. Смешивание азотной кислоты с бикарбонатом натрия. Итак, давайте посмотрим на наш co 2 или у нас есть 1 углерод и у нас есть 3 кислорода или 2 кислорода.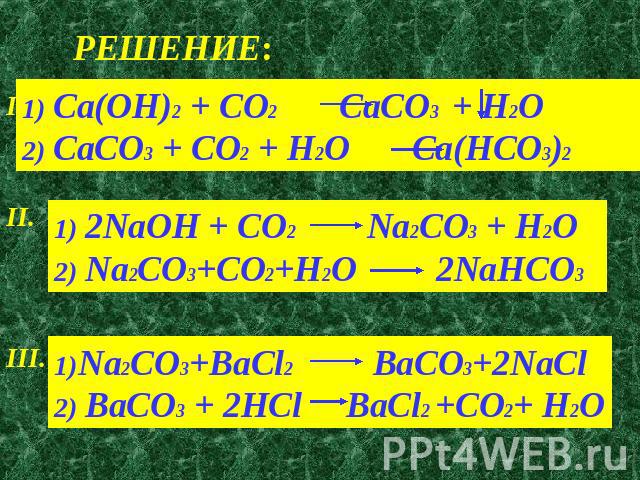 Скорее, наши натрии сбалансированы. Нитраты держатся вместе, каждого по 1, значит, они сбалансированы. Итак, у нас есть 2, водорода 1212 и у нас есть 3 кислорода 123. Так что это сбалансировано, так как перекись распадается на воду и кислород. Если вы заметили, наш водород уже сбалансирован, у нас есть 2 кислорода, а затем у нас есть 3 справа. Итак, наш кислород не уравновешен, поэтому нам нужно будет поставить 2 перед здесь и 2 перед и здесь, чтобы сбалансировать наш кислород. Это дает нам 4 кислорода слева, на руке, сбоку и 2 плюс 2, что равняется 4 справа, и наш водород все еще сбалансирован. Давайте посмотрим на пункт номер 13. Если мы посмотрим на наши атомы углерода, то увидим, что слева их 3, а справа 1. Итак, давайте сбалансируем их прямо сейчас. Теперь у нас 8. Водород слева и 2 справа, так что мы поместим туда 4. Теперь давайте посчитаем наш кислород, у нас есть 3 умножить на 2, что равняется 6 плюс 4, что равняется 10 баллам. Так что мы собираемся поставить 5 перед этим тоже.
Скорее, наши натрии сбалансированы. Нитраты держатся вместе, каждого по 1, значит, они сбалансированы. Итак, у нас есть 2, водорода 1212 и у нас есть 3 кислорода 123. Так что это сбалансировано, так как перекись распадается на воду и кислород. Если вы заметили, наш водород уже сбалансирован, у нас есть 2 кислорода, а затем у нас есть 3 справа. Итак, наш кислород не уравновешен, поэтому нам нужно будет поставить 2 перед здесь и 2 перед и здесь, чтобы сбалансировать наш кислород. Это дает нам 4 кислорода слева, на руке, сбоку и 2 плюс 2, что равняется 4 справа, и наш водород все еще сбалансирован. Давайте посмотрим на пункт номер 13. Если мы посмотрим на наши атомы углерода, то увидим, что слева их 3, а справа 1. Итак, давайте сбалансируем их прямо сейчас. Теперь у нас 8. Водород слева и 2 справа, так что мы поместим туда 4. Теперь давайте посчитаем наш кислород, у нас есть 3 умножить на 2, что равняется 6 плюс 4, что равняется 10 баллам. Так что мы собираемся поставить 5 перед этим тоже. Хитрость в том, что когда у вас есть углеводород, сгорающий в кислороде, всегда двигайтесь в таком порядке, сначала уравновешивайте углероды, затем водород, а затем ваш кислород, третий, всегда двигайтесь в этом порядке, и это станет намного проще. Вопрос 14: у нас есть вода и углекислый газ образуют кислород и вот это прекрасное соединение, так что у нас есть 6 атомов углерода с правой стороны. Итак, давайте сбалансируем их прямо сейчас. Ну, у нас есть 6 там. Теперь давайте сбалансируем наш водород: у нас 12 справа и 2 слева, поэтому нам нужно поставить 6 перед ними. Итак, теперь давайте посмотрим на наш кислород, 6 плюс 6 умножить на 2, что в сумме дает 18 баллов. У нас уже учтено 6, так что у нас есть 18 минус 6. Значит, нам нужно еще 12. Так что мы просто поставим 6 перед кислородом. Итак, нитраты и медь снова объединяются, заметьте. Наши копы остаются вместе. Если у нас есть 2 справа, нам нужно 2 слева, поэтому давайте поместим 2 перед этими серебряными, и теперь все сбалансировано.
Хитрость в том, что когда у вас есть углеводород, сгорающий в кислороде, всегда двигайтесь в таком порядке, сначала уравновешивайте углероды, затем водород, а затем ваш кислород, третий, всегда двигайтесь в этом порядке, и это станет намного проще. Вопрос 14: у нас есть вода и углекислый газ образуют кислород и вот это прекрасное соединение, так что у нас есть 6 атомов углерода с правой стороны. Итак, давайте сбалансируем их прямо сейчас. Ну, у нас есть 6 там. Теперь давайте сбалансируем наш водород: у нас 12 справа и 2 слева, поэтому нам нужно поставить 6 перед ними. Итак, теперь давайте посмотрим на наш кислород, 6 плюс 6 умножить на 2, что в сумме дает 18 баллов. У нас уже учтено 6, так что у нас есть 18 минус 6. Значит, нам нужно еще 12. Так что мы просто поставим 6 перед кислородом. Итак, нитраты и медь снова объединяются, заметьте. Наши копы остаются вместе. Если у нас есть 2 справа, нам нужно 2 слева, поэтому давайте поместим 2 перед этими серебряными, и теперь все сбалансировано. Давайте посмотрим на пункт номер 16: начнем с наших бромов, у нас 4 слева и 2 справа. Итак, давайте сбалансируем их прямо сейчас. Теперь наш бром сбалансирован. Наши хлорки — нет. Нам просто нужно поставить 2 перед газообразным хлором, чтобы сбалансировать хлор, и наши углероды все еще сбалансированы. Число. 17. У нас есть медь и серная кислота. Итак, если мы сразу же начнем с наших медей, мы заметим, что они сбалансированы, и мы заметим, что наш водород сбалансирован. Однако наш сульфат, хотя и остается вместе, он 1, все же распадается и образует двуокись серы. Итак, нам нужно сбалансировать их, все, что нам нужно сделать, это поставить 2, чтобы сбалансировать эту дополнительную серу, которая выходит, а затем 2 перед нашими водами. Давайте взглянем на число 18. Если мы сразу заметим, что наши нитраты остаются вместе, давайте поставим 3 перед этим нитратом натрия, чтобы сбалансировать эти нитраты железа. Теперь у нас есть 2 утюга справа, поэтому нам нужно поставить 2 здесь слева, чтобы сбалансировать наш водород.
Давайте посмотрим на пункт номер 16: начнем с наших бромов, у нас 4 слева и 2 справа. Итак, давайте сбалансируем их прямо сейчас. Теперь наш бром сбалансирован. Наши хлорки — нет. Нам просто нужно поставить 2 перед газообразным хлором, чтобы сбалансировать хлор, и наши углероды все еще сбалансированы. Число. 17. У нас есть медь и серная кислота. Итак, если мы сразу же начнем с наших медей, мы заметим, что они сбалансированы, и мы заметим, что наш водород сбалансирован. Однако наш сульфат, хотя и остается вместе, он 1, все же распадается и образует двуокись серы. Итак, нам нужно сбалансировать их, все, что нам нужно сделать, это поставить 2, чтобы сбалансировать эту дополнительную серу, которая выходит, а затем 2 перед нашими водами. Давайте взглянем на число 18. Если мы сразу заметим, что наши нитраты остаются вместе, давайте поставим 3 перед этим нитратом натрия, чтобы сбалансировать эти нитраты железа. Теперь у нас есть 2 утюга справа, поэтому нам нужно поставить 2 здесь слева, чтобы сбалансировать наш водород. Но сейчас наши сульфаты не сбалансированы. Итак, давайте заменим это 3 на 6. Итак, теперь у нас здесь 6 натрия, а слева только 2, поэтому мы поместим туда 3, и это сбалансирует нашу серу. Так что теперь мы позволили нашему оксиду свинца и соляной кислоте заметить, что они вместе. Наши проводники сбалансированы, а хлор не такой, давайте поставим 2 перед h cl, и у нас будет 2 кислорода и 2 водорода слева. Таким образом, мы должны сбалансировать тех, кто находится справа. Итак, если мы поставим 2 перед водой, это означает, что у нас будет 2 умножить на 2 плюс 2 для нашего водорода, что равно 4 с обеих сторон. Так что наш водород сбалансирован. Пункт номер 20. Если мы сразу посмотрим на наши брови и наш калий, у нас будет 3 броина и 2 калия слева, но у нас есть только 1 каждого из них справа. Итак, бром, давайте поставим 3 перед tr, а затем нам придется поставить 3 перед нашим калием. Так что теперь это не сбалансировано. Но тогда, если мы посмотрим на наш алюминий, у нас будет 2 справа и только 1 слева.
Но сейчас наши сульфаты не сбалансированы. Итак, давайте заменим это 3 на 6. Итак, теперь у нас здесь 6 натрия, а слева только 2, поэтому мы поместим туда 3, и это сбалансирует нашу серу. Так что теперь мы позволили нашему оксиду свинца и соляной кислоте заметить, что они вместе. Наши проводники сбалансированы, а хлор не такой, давайте поставим 2 перед h cl, и у нас будет 2 кислорода и 2 водорода слева. Таким образом, мы должны сбалансировать тех, кто находится справа. Итак, если мы поставим 2 перед водой, это означает, что у нас будет 2 умножить на 2 плюс 2 для нашего водорода, что равно 4 с обеих сторон. Так что наш водород сбалансирован. Пункт номер 20. Если мы сразу посмотрим на наши брови и наш калий, у нас будет 3 броина и 2 калия слева, но у нас есть только 1 каждого из них справа. Итак, бром, давайте поставим 3 перед tr, а затем нам придется поставить 3 перед нашим калием. Так что теперь это не сбалансировано. Но тогда, если мы посмотрим на наш алюминий, у нас будет 2 справа и только 1 слева. Итак, давайте поставим 2 перед этим алюминием, и теперь наши бромы равны 6. Таким образом, мы можем поставить 6 перед k. R, и теперь наш калий, бром и алюминий сбалансированы, и наш сульфат остается вместе, и они также сбалансированы. Итак, давайте посмотрим на 21, если мы заметим, что наши фосфаты остаются вместе, как и наш хлор. Итак, давайте начнем балансировать наши фосфаты. Есть 2 справа, сбоку, но только 1 слева. Итак, давайте поставим 2 или натрий в 2 раза. 3 равно 6. Итак, давайте поставим 6 перед хлоридом натрия, чтобы сбалансировать их, и, если вы заметили, у нас есть 3 кальция, поэтому нам понадобится 3. Итак, теперь наши хлоры сбалансированы и поглощают наш кальций. У нас есть алюминий и соляная кислота, образующие хлорид алюминия и газообразный водород, так что сразу. Давайте взглянем на наш хлор. Справа 3, поэтому нам нужно поместить 3 слева, но теперь наш водород не сбалансирован. У нас есть 3 водорода слева, но только 2 справа, отбросьте эти значения, и вы получите 6 водорода справа.
Итак, давайте поставим 2 перед этим алюминием, и теперь наши бромы равны 6. Таким образом, мы можем поставить 6 перед k. R, и теперь наш калий, бром и алюминий сбалансированы, и наш сульфат остается вместе, и они также сбалансированы. Итак, давайте посмотрим на 21, если мы заметим, что наши фосфаты остаются вместе, как и наш хлор. Итак, давайте начнем балансировать наши фосфаты. Есть 2 справа, сбоку, но только 1 слева. Итак, давайте поставим 2 или натрий в 2 раза. 3 равно 6. Итак, давайте поставим 6 перед хлоридом натрия, чтобы сбалансировать их, и, если вы заметили, у нас есть 3 кальция, поэтому нам понадобится 3. Итак, теперь наши хлоры сбалансированы и поглощают наш кальций. У нас есть алюминий и соляная кислота, образующие хлорид алюминия и газообразный водород, так что сразу. Давайте взглянем на наш хлор. Справа 3, поэтому нам нужно поместить 3 слева, но теперь наш водород не сбалансирован. У нас есть 3 водорода слева, но только 2 справа, отбросьте эти значения, и вы получите 6 водорода справа. Итак, давайте поставим 6, они поставят 2 перед хлоридами алюминия, чтобы сбалансировать наш хлор. Это означает, что нам понадобится 2 перед нашим алюминием. Теперь у нас есть аммоний и серная кислота, которые вместе образуют сульфат аммония. Теперь наш сульфат остается вместе? Так что мы не беспокоимся об этом, но у нас есть 2, азот, а затем 2 раза по 4 или 8 водорода. Итак, поскольку у нас есть 2 азота, нам нужно поставить 2 перед нашим nh 3. Итак, теперь у нас есть 2 умножить на 3, что равно 6 плюс 2, больше водорода, что равно 8 пунктам. Так что все сбалансировано. 24 пункт снова: давайте сначала проследим за углеродом, у нас есть 8 на левой стороне, поэтому мы поместим 8 на правой руке. Сбоку теперь наш водород, там 18 точка, значит, поставим 9перед нашими водами. Теперь давайте посчитаем наш кислород, у нас есть 8 умножить на 2 плюс 9 баллов? Теперь у нас есть 16 плюс 9, что равно 25 очкам. Это может быть пугающим числом, потому что оно не делится на 2 без остатка, но вот. Что мы можем сделать здесь, так это аккуратный маленький трек.
Итак, давайте поставим 6, они поставят 2 перед хлоридами алюминия, чтобы сбалансировать наш хлор. Это означает, что нам понадобится 2 перед нашим алюминием. Теперь у нас есть аммоний и серная кислота, которые вместе образуют сульфат аммония. Теперь наш сульфат остается вместе? Так что мы не беспокоимся об этом, но у нас есть 2, азот, а затем 2 раза по 4 или 8 водорода. Итак, поскольку у нас есть 2 азота, нам нужно поставить 2 перед нашим nh 3. Итак, теперь у нас есть 2 умножить на 3, что равно 6 плюс 2, больше водорода, что равно 8 пунктам. Так что все сбалансировано. 24 пункт снова: давайте сначала проследим за углеродом, у нас есть 8 на левой стороне, поэтому мы поместим 8 на правой руке. Сбоку теперь наш водород, там 18 точка, значит, поставим 9перед нашими водами. Теперь давайте посчитаем наш кислород, у нас есть 8 умножить на 2 плюс 9 баллов? Теперь у нас есть 16 плюс 9, что равно 25 очкам. Это может быть пугающим числом, потому что оно не делится на 2 без остатка, но вот. Что мы можем сделать здесь, так это аккуратный маленький трек. Брать. Это число поместите здесь перед этим кислородом, а затем умножьте все на 2. По сути, удвоив его, и теперь все будет сбалансировано. Давайте взглянем на число: 25, кальций, хлор и h c l. Итак, если мы посмотрим на наши 8 арочных хлоров, мы сразу заметим, что 2 справа и 1 слева. Итак, давайте перейдем к 2 перед этим h, cl кальций сбалансирован, углероды сбалансированы, наш водород сбалансирован. Давайте проверим наш кислород. У нас 3 слева и 1 плюс 2 справа, что равно 3 — это кислород, уравновешиваются 26 точками. Мы замечаем, что у нас есть 2 натрия, слева, сбоку и только 1 справа, так что их нужно сбалансировать сразу. Итак, теперь у нас есть 2 кислорода и 2 водорода справа и столько же слева. Все сбалансировано. 27 пункт. Если мы посмотрим сразу, мы увидим, что наш натрий не сбалансирован. Итак, давайте начнем с этого, и мы сбалансируем наш натрий. Итак, теперь мы должны удвоить все здесь, так что теперь у нас есть 2 и 2 Hes, а затем 2 углерода и 6 кислорода. Вот и все, с левой стороны.
Брать. Это число поместите здесь перед этим кислородом, а затем умножьте все на 2. По сути, удвоив его, и теперь все будет сбалансировано. Давайте взглянем на число: 25, кальций, хлор и h c l. Итак, если мы посмотрим на наши 8 арочных хлоров, мы сразу заметим, что 2 справа и 1 слева. Итак, давайте перейдем к 2 перед этим h, cl кальций сбалансирован, углероды сбалансированы, наш водород сбалансирован. Давайте проверим наш кислород. У нас 3 слева и 1 плюс 2 справа, что равно 3 — это кислород, уравновешиваются 26 точками. Мы замечаем, что у нас есть 2 натрия, слева, сбоку и только 1 справа, так что их нужно сбалансировать сразу. Итак, теперь у нас есть 2 кислорода и 2 водорода справа и столько же слева. Все сбалансировано. 27 пункт. Если мы посмотрим сразу, мы увидим, что наш натрий не сбалансирован. Итак, давайте начнем с этого, и мы сбалансируем наш натрий. Итак, теперь мы должны удвоить все здесь, так что теперь у нас есть 2 и 2 Hes, а затем 2 углерода и 6 кислорода. Вот и все, с левой стороны. Если мы посмотрим на правую сторону, у нас есть 2 водорода, у нас есть 1 плюс 2, что равняется 3 кислорода, а затем у нас есть 2 разных натрия и у нас есть 2 углерода и плюс дополнительные 3 кислорода, всего 6 имеют любые вещи сбалансированы. Итак, теперь у нас есть фосфор и кислород, поэтому у нас есть 2 фосфора справа и сбоку слева. Итак, давайте поместим 2 там, и тогда у нас будет 6 кислорода справа. Итак, давайте поставим 3 перед этим двухатомным слева 29Пункт: если мы посмотрим сразу, наши нитраты не сбалансированы, все еще ругательство 3 перед натрием, чтобы сбалансировать наши нитраты и наш натрий одновременно. Итак, теперь давайте удостоверимся, что наши утюги сбалансированы. Они сбалансированы, давайте проверим наш гидроксид, если заметим, что они остаются вместе, и их по 3 с обеих сторон. Итак, теперь все уравновешено: число 30. У нас есть натрий и вода, образующие натрий или оксид натрия и газообразный водород. Итак, давайте посчитаем наш водород, у нас есть 2 плюс 1, что равно 3, и наш кислород? У нас есть только или 1 очко, поэтому, поскольку здесь у нас 20 часов, нам нужно будет поставить 3 перед этим, чтобы мы получили 6 часов и 30.
Если мы посмотрим на правую сторону, у нас есть 2 водорода, у нас есть 1 плюс 2, что равняется 3 кислорода, а затем у нас есть 2 разных натрия и у нас есть 2 углерода и плюс дополнительные 3 кислорода, всего 6 имеют любые вещи сбалансированы. Итак, теперь у нас есть фосфор и кислород, поэтому у нас есть 2 фосфора справа и сбоку слева. Итак, давайте поместим 2 там, и тогда у нас будет 6 кислорода справа. Итак, давайте поставим 3 перед этим двухатомным слева 29Пункт: если мы посмотрим сразу, наши нитраты не сбалансированы, все еще ругательство 3 перед натрием, чтобы сбалансировать наши нитраты и наш натрий одновременно. Итак, теперь давайте удостоверимся, что наши утюги сбалансированы. Они сбалансированы, давайте проверим наш гидроксид, если заметим, что они остаются вместе, и их по 3 с обеих сторон. Итак, теперь все уравновешено: число 30. У нас есть натрий и вода, образующие натрий или оксид натрия и газообразный водород. Итак, давайте посчитаем наш водород, у нас есть 2 плюс 1, что равно 3, и наш кислород? У нас есть только или 1 очко, поэтому, поскольку здесь у нас 20 часов, нам нужно будет поставить 3 перед этим, чтобы мы получили 6 часов и 30. Итак, теперь мы должны сбалансировать наш кислород, поэтому мы Поставлю 3 перед натрием, и теперь у нас есть 3 и 3 кислорода, а затем мы просто добавили еще 3 к общему количеству водорода, что равно 6. Все сбалансировано. 31 пункт: давайте посмотрим или натрия: 2 слева, сбоку и 1 справа. Итак, давайте сбалансируем те хлоры, которые сейчас не сбалансированы. Итак, поставим 2. Наша сера сбалансирована. Итак, давайте проверим наш водород. Наш водород сбалансирован, и у нас есть 3 кислорода и 1 плюс 2, что равняется 3 точкам кислорода. Так что теперь все уравновешено. Давайте вместе проверим 32 нитрата, те сбалансированы, цинкки, тоже сбалансированы, и наши котлы сбалансированы. Все проверяется 33 пункт: у нас есть еще одна проблема с углеводородами, так что давайте по порядку. Чоуэлл должен поставить 2 перед нашими углеродами, чтобы сбалансировать их. Итак, теперь у нас есть 2 и 2 точка. Водород был запущен с 2. Слева сбоку у нас есть 2 справа, сбоку кислород. У нас 2? С левой стороны у нас есть 2 умножить на 2 плюс 1, что равно 5.
Итак, теперь мы должны сбалансировать наш кислород, поэтому мы Поставлю 3 перед натрием, и теперь у нас есть 3 и 3 кислорода, а затем мы просто добавили еще 3 к общему количеству водорода, что равно 6. Все сбалансировано. 31 пункт: давайте посмотрим или натрия: 2 слева, сбоку и 1 справа. Итак, давайте сбалансируем те хлоры, которые сейчас не сбалансированы. Итак, поставим 2. Наша сера сбалансирована. Итак, давайте проверим наш водород. Наш водород сбалансирован, и у нас есть 3 кислорода и 1 плюс 2, что равняется 3 точкам кислорода. Так что теперь все уравновешено. Давайте вместе проверим 32 нитрата, те сбалансированы, цинкки, тоже сбалансированы, и наши котлы сбалансированы. Все проверяется 33 пункт: у нас есть еще одна проблема с углеводородами, так что давайте по порядку. Чоуэлл должен поставить 2 перед нашими углеродами, чтобы сбалансировать их. Итак, теперь у нас есть 2 и 2 точка. Водород был запущен с 2. Слева сбоку у нас есть 2 справа, сбоку кислород. У нас 2? С левой стороны у нас есть 2 умножить на 2 плюс 1, что равно 5. Так что мы собираемся использовать этот трюк. Мы поставим здесь 5, а все остальное удвоим, и теперь все сбалансировано. У нас есть серная кислота и нитрит калия, и они объединяются в вопросе 34, обратите внимание, наши нитриты остаются вместе, а наши сульфаты остаются вместе, они просто обмениваются партнерами, поэтому мы просто поставим 2 перед нитратом калия и 2 перед нитрат водорода. И теперь все уравновешено: число 35. У нас есть медь и азотная кислота, соединяясь вместе, чтобы сразу образовать медь, нитрат, азот, закись азота и воду. Мы замечаем, что наши нитраты не сбалансированы. Итак, давайте начнем с этого, поэтому нам нужно, чтобы у нас было 2 справа. Так что нам нужно 2 слева, они выглядят, наши нитраты сбалансированы и наш водород. Однако в итоге у нитрата выскочил лишний конец. Так что в конечном итоге мы просто удвоим количество азотной кислоты до 4, а затем удвоим количество нитратов и удвоим количество воды. А сейчас все уравновешено. Давайте проверим это. У нас есть углерод, у нас есть водород, у нас есть и.
Так что мы собираемся использовать этот трюк. Мы поставим здесь 5, а все остальное удвоим, и теперь все сбалансировано. У нас есть серная кислота и нитрит калия, и они объединяются в вопросе 34, обратите внимание, наши нитриты остаются вместе, а наши сульфаты остаются вместе, они просто обмениваются партнерами, поэтому мы просто поставим 2 перед нитратом калия и 2 перед нитрат водорода. И теперь все уравновешено: число 35. У нас есть медь и азотная кислота, соединяясь вместе, чтобы сразу образовать медь, нитрат, азот, закись азота и воду. Мы замечаем, что наши нитраты не сбалансированы. Итак, давайте начнем с этого, поэтому нам нужно, чтобы у нас было 2 справа. Так что нам нужно 2 слева, они выглядят, наши нитраты сбалансированы и наш водород. Однако в итоге у нитрата выскочил лишний конец. Так что в конечном итоге мы просто удвоим количество азотной кислоты до 4, а затем удвоим количество нитратов и удвоим количество воды. А сейчас все уравновешено. Давайте проверим это. У нас есть углерод, у нас есть водород, у нас есть и. .. и я собираюсь переместить сюда кислород, так как у меня кончается счетчик е, все в порядке, чтобы убедиться, что все сбалансировано. 1, медь с обеих сторон. У нас есть 4 водорода 4 водорода с обеих сторон. У нас 4 нитрата и, извините, 4. Азот с обеих сторон, и теперь у нас 4 умножить на 3, что равняется 12 кислорода, а затем, на правой стороне, у нас 2 раза 3 плюс 2 раза 2 плюс 2 раза 1. Для нашего кислорода. Не поэтому ли вы всегда оставляете кислород напоследок и, надеюсь, вместе, если возможно, так что у нас есть 6 плюс 4 плюс 2, что равняется 12 очкам. Все сбалансировано и, наконец, последнее 1 по 36 очко. Я собираюсь пойти дальше и написать все, что у нас есть, слева, сбоку и справа, сбоку, и я собираюсь расположить их в том же порядке, чтобы мы могли сравнить значения, как они идут, так и есть. начальные значения йода. У нас 2 натрия по 1 и кислорода, а водород по 1 слева, сбоку справа, сбоку. У нас есть 2 йода, у нас есть 2 натрия 3 кислорода плюс 1 больше, чем равно 4, и тогда я на самом деле собираюсь стереть ту маленькую силу, чтобы мы не запутались, и тогда наш водород.
.. и я собираюсь переместить сюда кислород, так как у меня кончается счетчик е, все в порядке, чтобы убедиться, что все сбалансировано. 1, медь с обеих сторон. У нас есть 4 водорода 4 водорода с обеих сторон. У нас 4 нитрата и, извините, 4. Азот с обеих сторон, и теперь у нас 4 умножить на 3, что равняется 12 кислорода, а затем, на правой стороне, у нас 2 раза 3 плюс 2 раза 2 плюс 2 раза 1. Для нашего кислорода. Не поэтому ли вы всегда оставляете кислород напоследок и, надеюсь, вместе, если возможно, так что у нас есть 6 плюс 4 плюс 2, что равняется 12 очкам. Все сбалансировано и, наконец, последнее 1 по 36 очко. Я собираюсь пойти дальше и написать все, что у нас есть, слева, сбоку и справа, сбоку, и я собираюсь расположить их в том же порядке, чтобы мы могли сравнить значения, как они идут, так и есть. начальные значения йода. У нас 2 натрия по 1 и кислорода, а водород по 1 слева, сбоку справа, сбоку. У нас есть 2 йода, у нас есть 2 натрия 3 кислорода плюс 1 больше, чем равно 4, и тогда я на самом деле собираюсь стереть ту маленькую силу, чтобы мы не запутались, и тогда наш водород. У нас их 2, и на самом деле я собираюсь разделить наш натрий и наш йод, потому что нам придется сбалансировать их по отдельности, что внесет небольшую положительную черту. Итак, сразу же, наши йоды сбалансированы или натрии не так, давайте поставим 2 перед нашим оксидом натрия гидроксидом натрия с левой стороны. Итак, теперь все умножается на 2, и у нас есть 2 натрия, 2 кислорода и 2 водорода. Итак, теперь наш натрий сбалансирован, а кислород — нет. Мы должны умножить это. Гидроксид натрия нужно было умножить на 2 или изменить на 4. Итак, теперь все будет умножено на 4, так что все это. Так что теперь у нас есть 4 всего, кроме нашего йода. Итак, теперь наш кислород сбалансирован, а натрий и водород — нет. Итак, давайте начнем с нашего водорода: давайте поставим 2 перед этой водой, и это означает, что 1 кислород будет умножен на 2 балла. Так что теперь мы должны сбалансировать наши натрия. Что я собираюсь сделать, так это просто поработать с этим йодом натрия, чтобы не возиться с кислородом.
У нас их 2, и на самом деле я собираюсь разделить наш натрий и наш йод, потому что нам придется сбалансировать их по отдельности, что внесет небольшую положительную черту. Итак, сразу же, наши йоды сбалансированы или натрии не так, давайте поставим 2 перед нашим оксидом натрия гидроксидом натрия с левой стороны. Итак, теперь все умножается на 2, и у нас есть 2 натрия, 2 кислорода и 2 водорода. Итак, теперь наш натрий сбалансирован, а кислород — нет. Мы должны умножить это. Гидроксид натрия нужно было умножить на 2 или изменить на 4. Итак, теперь все будет умножено на 4, так что все это. Так что теперь у нас есть 4 всего, кроме нашего йода. Итак, теперь наш кислород сбалансирован, а натрий и водород — нет. Итак, давайте начнем с нашего водорода: давайте поставим 2 перед этой водой, и это означает, что 1 кислород будет умножен на 2 балла. Так что теперь мы должны сбалансировать наши натрия. Что я собираюсь сделать, так это просто поработать с этим йодом натрия, чтобы не возиться с кислородом. Итак, я поставлю четвертую перед этим йодом натрия, что означает, что этот йод будет умножен на 4, а этот 1 натрий будет умножен на 4, все еще было сделано, потому что теперь у нас есть 5 йода и на правая рука, сторона, и у нас есть только 2 слева, поэтому давайте просто сбалансируем это, поставив 3 перед йодом, так что это означает, что у нас есть 6 йодов. Значит, поставим другой. Давайте добавим это 4, теперь это будет 1 в точке 5. Наши йодиды сбалансированы. Наши натрии теперь не сбалансированы. Теперь это 5 плюс 1, что равняется 6, поэтому мы просто поставим 6 здесь, мы просто избавимся от всего этого. Итак, теперь у нас есть 66 и 6 для нашего натрия или кислорода, и наш водород почти готов. Давайте проверим наш водород, теперь наш йод слева, сторона равна 6 или натрий равен 6. Наш кислород равен 3 плюс 3, что равно 6. Водород. Они не сбалансированы, они все еще на уровне 4. Итак, давайте поместим это в 3, извините, что должно быть боб 5 для нашего кислорода, и теперь это становится 3 плюс 3, что равняется 6.
Итак, я поставлю четвертую перед этим йодом натрия, что означает, что этот йод будет умножен на 4, а этот 1 натрий будет умножен на 4, все еще было сделано, потому что теперь у нас есть 5 йода и на правая рука, сторона, и у нас есть только 2 слева, поэтому давайте просто сбалансируем это, поставив 3 перед йодом, так что это означает, что у нас есть 6 йодов. Значит, поставим другой. Давайте добавим это 4, теперь это будет 1 в точке 5. Наши йодиды сбалансированы. Наши натрии теперь не сбалансированы. Теперь это 5 плюс 1, что равняется 6, поэтому мы просто поставим 6 здесь, мы просто избавимся от всего этого. Итак, теперь у нас есть 66 и 6 для нашего натрия или кислорода, и наш водород почти готов. Давайте проверим наш водород, теперь наш йод слева, сторона равна 6 или натрий равен 6. Наш кислород равен 3 плюс 3, что равно 6. Водород. Они не сбалансированы, они все еще на уровне 4. Итак, давайте поместим это в 3, извините, что должно быть боб 5 для нашего кислорода, и теперь это становится 3 плюс 3, что равняется 6.

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав
 com в качестве источника. В соответствии с тем же исключением, предоставленным классным руководителям, должно быть дано полное признание Chemtutor, когда все или любая часть включена в любое другое электронное представление, такое как веб-сайт, путем прямого включения или гиперссылки.
com в качестве источника. В соответствии с тем же исключением, предоставленным классным руководителям, должно быть дано полное признание Chemtutor, когда все или любая часть включена в любое другое электронное представление, такое как веб-сайт, путем прямого включения или гиперссылки. 