Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония
Углеаммонийная сольПолученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Оксид цинкаZn + CO2 → ZnO + CO
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
Горение газа на плитеCH4 + 2O2 → CO2 + 2H2O + 891кДж
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
Молекула этанолаC2H5OH + 3O2 = 3H2O + 2CO2 + Q
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
youtube.com/embed/ZDWODmh3yNQ» allowfullscreen=»allowfullscreen»>Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
Образование глюкозы6CO2 + 6H2O → C6H12O6 + 6O2
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрияОбразование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.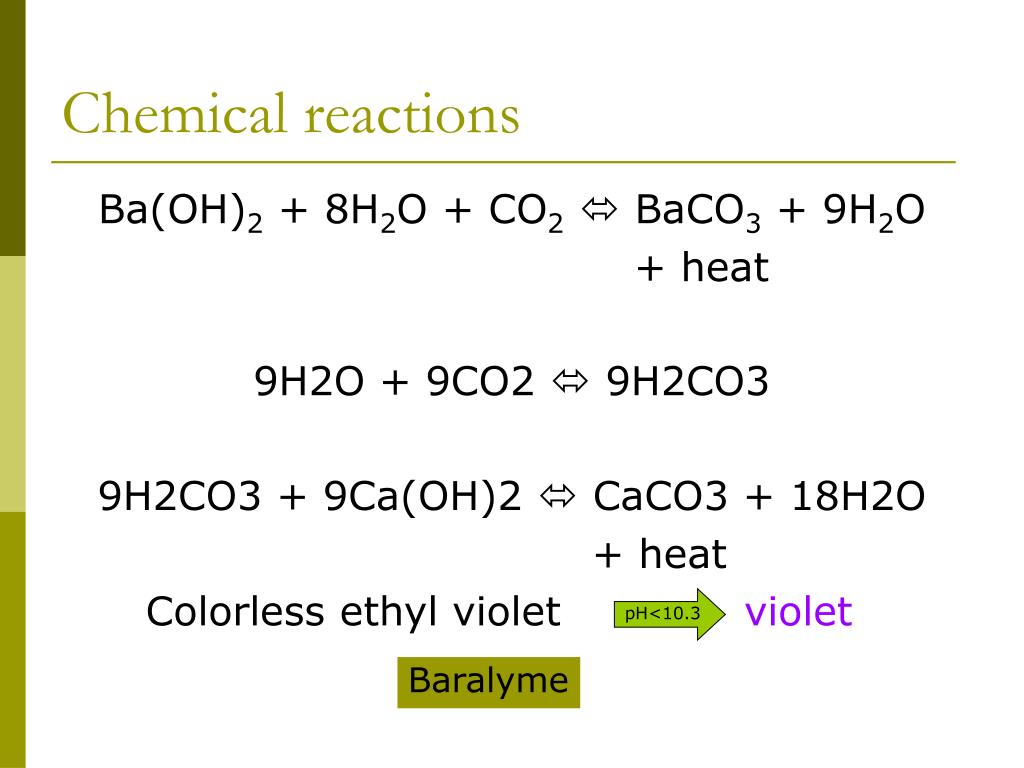
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Задачи Химическая термодинамика и термохимия
1. Задача Расчёт тепловых эффектов химической реакции.
Рассчитать тепловой эффект реакции (ΔН р-ции) при гашении 100 кг извести (CaO) водой, если теплоты образования оксида кальция, воды и гидроксида кальция соответственно равны -635,1; -285,84 и -986,2 кДж/моль.
Решение задачи. Термохимическое уравнение имеет вид:
CaO(т) + h3O(ж) → Ca(OH)2(т), где т, ж – твёрдое и жидкое агрегатное состояние.
Рассчитываем тепловой эффект реакции в стандартных условиях (ΔH°р-ции), используя следствие из закона Гесса:
ΔH°р-ции = -986,2 – (-635,1 – 285,84) = -65,26 кДж/моль
Рассчитаем тепловой эффект реакции с учётом количества вещества оксида кальция:
ΔHр-ции = nCaO* ΔH°р-ции; nCaO = = 1,79*103 моль →
ΔHр-ции = 1,79*103 * (-65,26) = -116,5*103 кДж.
2. Задача Расчёт теплот образования веществ.
При растворении 16 г карбида кальция (CaC2) в воде выделяется 31,3 кДж теплоты. Рассчитать теплоту образования гидроксида кальция (ΔH°Ca(OH)2), если теплоты образования (ΔH°) воды, карбида кальция, ацетилена (C2h3) соответственно равны – 285,84; -62,7; 226,75 кДж/моль.
Решение задачи. Термохимическое уравнение имеет вид:
CaC2(т) + 2h3O(ж) → Ca(OH)2(т) + C2h3(г), где т, ж и г – соответственно, твёрдое, жидкое и газообразное агрегатное состояние.
Рассчитаем тепловой эффект реакции в стандартных условиях (ΔH°р-ции):
ΔH°р-ции = →
ΔH°р-ции = = -125,2 кДж/моль.
Выразим и рассчитаем теплоту образования гидроксида кальция, используя следствие из закона Гесса:
ΔH°р-ции = ΔH° Ca(OH)2 + ΔH° C2h3 – (ΔH° CaС2 – 2*ΔH° h3О), при этом учитываем стехиометрические коэффициенты в уравнении реакции.
→ ΔH° Ca(OH)2 = – 125,2 – 861,13 = — 986,33 кДж/моль.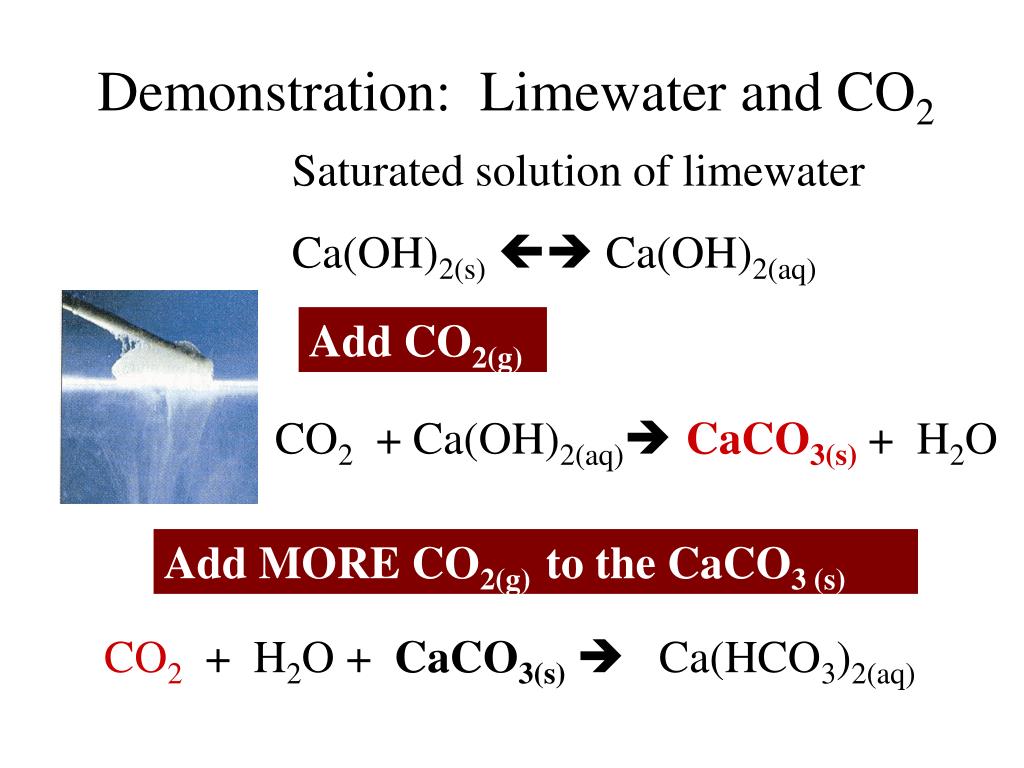
3. Задача Расчёт теплоты растворения.
Рассчитать теплоту растворения кристаллогидрата сульфита натрия (Na2SO3 * 7H2O), если теплота растворения безводного сульфита натрия равна 11,34 кДж/моль, а теплота образования кристаллогидрата этой соли (теплота гидратации) равна 58,4 кДж/моль.
Решение задачи. Теплота растворения безводного сульфита натрия складывается из теплоты, пошедшей на разрушение кристаллической решётки безводной соли, и теплоты, выделившейся при гидратации соли:
Na2SO3 + 7h3O → Na2SO3 * 7h3O,
ΔH° растворения = ΔH° разруш. крист. решётки + ΔH° гидратации;
ΔH° кристаллогидрата = ΔH° разруш. крист. решётки = ΔH° растворения — ΔH° гидратации; →
теплота растворения кристаллогидрата равна:
ΔH° кристаллогидрата = — 11,34 – (-58,4) = 47,04 кДж/мол
Задача Расчёт теплоты сгорания.
Рассчитать стандартную теплоту сгорания этилового спирта, исходя из реакции биохимического брожения глюкозы:
C6H12O6(т) → 2C2H5OH(ж) + 2СО2(г), ΔH°р-ции = -83,3 кДж/моль.
Теплоты сгорания (ΔH°сгор.) глюкозы, спирта и углекислого газа равны соответственно -2817,1; -1366,9 и 0 кДж/моль.
Решение задачи. Используем ещё одно следствие из закона Гесса: тепловой эффект реакции равен разности между суммами теплот сгорания исходных веществ и суммами теплот сгорания продуктов реакции: ΔH°р-ции = ΔH°сгор.С6Н12О6 – (2*ΔH°сгор.С2Н5ОН + 2ΔH°СО2). Поскольку углекислый газ уже не может окисляться, то его теплота сгорания (окисления) равна нулю.
ΔH°сгор.С2Н5ОН = =
= 866,9 кДж/моль.
Задачи по теме Расчёт изменения внутренней энергии при химических реакциях и фазовых переходах.
Задача 1. Рассчитать изменение внутренней энергии системы в стандартных условиях (ΔU°) при протекании реакции
2Cl2 + 2H2O(г) → 4HCl(г) + O2, если станд. теплоты образования воды и хлороводорода (HCl) соответственно равны -241,84 и 92,3 кДж/моль.
Решение. Изменение внутренней энергии рассчитывается по формуле ΔU=ΔH-A, для газов A (работа расширения) = Δn*R*T →
ΔU = ΔH — Δn*R*T,
где Δn — изменение числа моль газообразных продуктов реакции и исходных веществ. Для данной реакции Δn = 5-4 = 1 моль.
Рассчитаем ΔH°р-ции, используя следствие из закона Гесса:
ΔH°р-ции = 4*ΔH°HCl — 2ΔH° h3О = 4*(-92,3)-2*(-241,84)=114,48 кДж/моль; R – газовая постоянная, равна 8,3*10
Рассчитываем изменение внутренней энергии:
ΔU° = 114,48 – 1*8,3*10-3*298 = 112,0 кДж/моль.
Следовательно, в процессе реакции внутренняя энергия увеличилась на 112 кДж/моль.
Задача 2. Рассчитать изменение внутренней энергии при испарении 250 г воды при 20°С (пары подчиняются законам идеальных газов). Объёмом жидкости по сравнению с объёмом пара можно пренебречь. Удельная теплота парообразования воды равна 2451 Дж/г.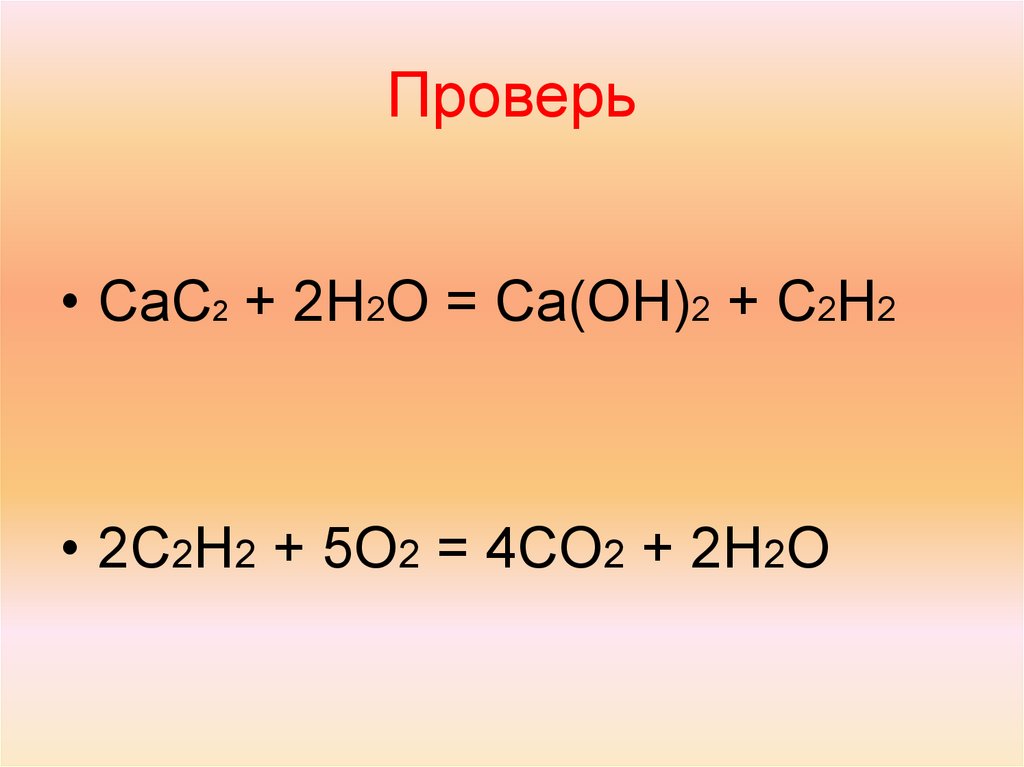
Решение. При испарении воды (h3O ж → h3O пар) Δn = 1 моль (изменение количества газообразных веществ). Изменение внутренней энергии системы при испарении воды рассчитываем по формуле: ΔU = ΔH — Δn*R*T. Рассчитаем молярную теплоту парообразования воды по формуле:
ΔH = 2451 Дж/г * 18 г/моль = 44,12 кДж/моль,
n h3О(ж) = = 13,89 моль → ΔU = (ΔH — Δn*R*T)*13,89 = =(44,12-1*8,3*10-3*293)*13,89 = 579,0 кДж.
Следовательно, внутренняя энергия системы увеличилась на 579,0 кДж.
Примеры решения типовых задач по второму началу термодинамики.
При решении задач указывать и учитывать агрегатное состояние веществ.
Задачи по Определение изменения энтропии в различных процессах.
Особенностью химических и физико-химических превращений является участие в них большого числа частиц. Для таких систем наиболее вероятно состояние беспорядка (частицы менее связаны, менее упорядочены), которое характеризуется энтропией (S). Количественно изменение энтропии можно рассчитать на основе следствия закона Гесса. Чем большее увеличение энтропии в каком-либо процессе, тем этот процесс более вероятен. Качественно знак изменения энтропии можно оценить (определить), сопоставляя число частиц до и после реакции и агрегатное состояние исходных веществ и продуктов реакции.
Количественно изменение энтропии можно рассчитать на основе следствия закона Гесса. Чем большее увеличение энтропии в каком-либо процессе, тем этот процесс более вероятен. Качественно знак изменения энтропии можно оценить (определить), сопоставляя число частиц до и после реакции и агрегатное состояние исходных веществ и продуктов реакции.
Энтропия связана с теплотой и возрастает при увеличении беспорядка:
— переход из твёрдого состояния жидкое, из жидкого – в газообразное;
— расширение газов;
— растворение кристаллов;
— увеличение числа частиц.
Энтропия уменьшается при возрастании упорядоченности (взаимодействие частиц увеличивается):
— конденсация паров, сжижение;
— сжатие газа;
— полимеризация, кристаллизация;
— уменьшение числа частиц.
Задача 1. Определить знак изменения энтропии в реакциях:
- NH4NO3 (т) → N2O + 2H2O (г)
- 2H2 (г) + O2 (г) = 2 H2O (ж)
- N2 + 3H2 → 2Nh4 или N2 + h3 → NH3
Решение. Знак изменения энтропии можно установить по количеству частиц исходных и конечных веществ:
Знак изменения энтропии можно установить по количеству частиц исходных и конечных веществ:
Δn = nкон. – nисх., где Δn – изменение количества частиц; если Δn > 0, то энтропия возрастает; при Δn < 0 – энтропия уменьшается; если Δn = 0 — энтропия не изменяется. Кроме этого, учитывают агрегатное состояние исходных веществ и продуктов реакции.
- Δn = 3-1 = 2 → Δn > 0, → ΔS > 0, т.е. энтропия возрастает, тем более, что образуются газы.
- Δn = 2-3 = -1 → Δn < 0, → ΔS < 0, т.е. энтропия уменьшается, тем более, что газы (большой беспорядок) превращаются в жидкость (упорядоченность больше).
- Δn = 1 – (+) = -1, → Δn < 0, → ΔS < 0, т.е. энтропия убывает.
Задача 2. Рассчитать изменение энтропии при реакции N2+ h3 → Nh4, если стандартные энтропии (S°) азота, водорода и аммиака соответственно равны 191,6; 130,6 и 192,8 Дж/моль*К.
Решение. В соответствии со следствием из закона Гесса рассчитаем ΔS при реакции: ΔS°р-ции = S°Nh4 — S°N2 — S°h3, →
ΔS°р-ции = 192,8 — * 191,6 — * 130,6 = -98,9 Дж/моль*К
Следовательно, ΔS°р-ции < 0 и самопроизвольно реакция не идёт.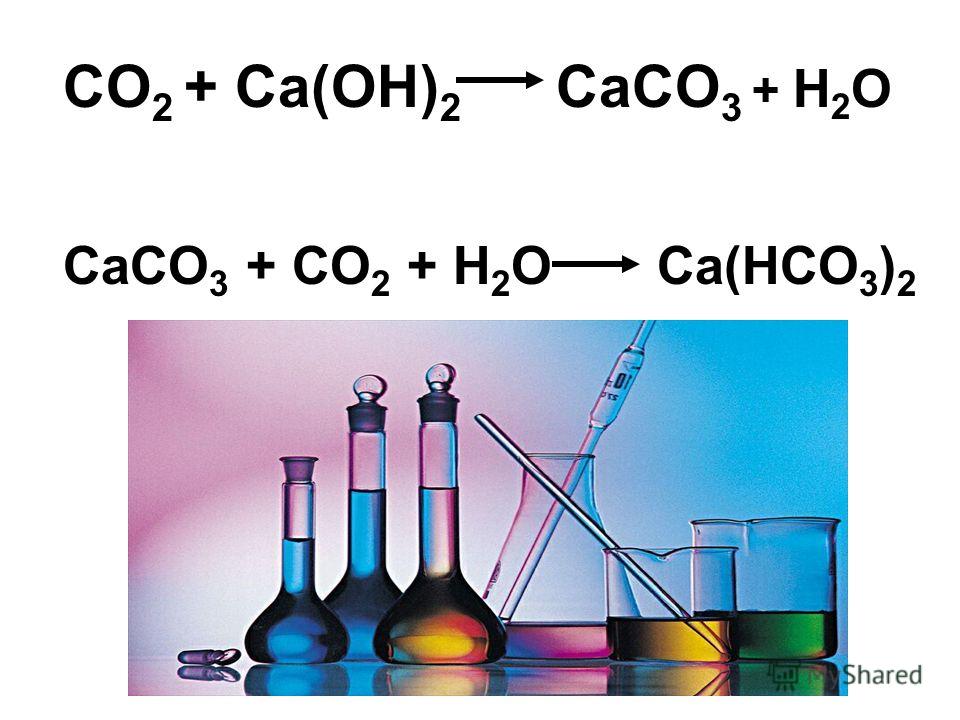
Задача 3. Рассчитать изменение энтропии при плавлении 10 г льда, если уд. теплота плавления (q) равна 19,12 Дж/г.
Решение. Плавление – фазовый переход – изотермический обратимый процесс → ΔS = ; tплавл. льда = 0°С или 273°К →
ΔS==0,070 Дж/К*г, при плавлении 10г льда ΔS=0,070*10=0,7 Дж/К*г
Задачи по тем Определение возможности и направления химических реакций.
В неизолированных системах критерием самопроизвольного протекания реакции является убыль свободной энергии Гиббса (изобарно-изотермического потенциала), т.е. ΔG < 0. Чем меньше величина ΔG, тем больше вероятность протекания химической реакции.
Задача 1. Возможно ли совместное хранение на складе этиленгликоля (антифризная жидкость) и калиевой селитры (удобрение)?
Решение. Между указанными веществами может протекать реакция:
3C2H6O2 + 10KNO3 → 6CO2 + 4H2O + 10NO + 10KOH
Реакция возможна, если свободная энергия Гиббса уменьшается, т. е. ΔGр-ции < 0. Для расчёта ΔG используем следствие из закона Гесса:
е. ΔGр-ции < 0. Для расчёта ΔG используем следствие из закона Гесса:
ΔG°р-ции = (6ΔG°CO2 + 4ΔG°h3O(г) + 10ΔG°NO + 10ΔG°KOH) – (3*ΔG°C2H6O2 — 10ΔGKNO3).
Подставим справочные данные:
ΔGр-ции = 6 * 394,6 + 4 * (-228,8) + 10 * 80,6 + 10 * (-379,3) –
— (3 * (-319,4)) + 10 * (-393,4)) = -1377,6 (кДж).
Рассчитаем ΔG в пересчёте на 1 моль этиленгликоля:
ΔG°р-ции =-459,2 кДж/моль.
В процессе реакции свободная энергия уменьшается, следовательно, реакция может протекать самопроизвольно при обычной температуре (25°С), поэтому совместное хранение этиленгликоля и калийной селитры недопустимо, т.к. может произойти самовозгорание.
Задача 2. Рассчитать ΔG° для реакции Nh4(г) + HCl(г) → NH4Cl(т)
Решение задачи.
Используем формулу:
ΔG°р-ции = ΔH° — T * ΔS°
Для расчета ΔH° и ΔS° используем следствие из закона Теса:
ΔH°р-ции = ΔH°Nh5Cl — ΔH°Nh4 — ΔH°HCl и
ΔS°р-ции = ΔS°Nh5Cl — ΔS° Nh4 — ΔS°HCl , числовые значения ΔH° и ΔS° веществ берем из справочника.
ΔH°р-ции = -315,39 – (- 46,19)- (-92,3) = -176,9 кДж
ΔS°р-ции = 94,56 – 192,5 – 186,7 = -284,64 = 0,28464;
Т = 273 + 25 = 298;
ΔG°р-ции = -176,9 – 298 * (-0,28464) = -92,08
Следовательно, ΔG°р-ции < 0 и в стандартных условиях реакция возможна.
Задача 3. Рассчитать свободную энергию Гиббса для реакции
2NO + O2 ↔ 2NO2 при температурах 1050, 1100, 1150и 1200К, построить график ΔG – Т, сделать вывод о направлении реакции при разных температурах.
Решение.
Запишем уравнение реакции в стандартном виде:
NO + O2 ↔ NO2
Используем следствие из закона Гесса, значения S° и ΔH° возьмем из справочника.
Учесть что теплоты образования простых веществ (O2, N2, h3 и т.д.) приняты за ноль (ΔH° = 0),
ΔS°р-ции = S°NO2 — S°NO — S° O2 = 240 -211 — * 161 = -51,5
ΔH°р-ции = ΔH°NO2 — ΔH°NO = 33 – 91 = -58
Вычислим температуру, при которой достигается равновесие (ΔGр-ции = 0):
ΔG = ΔH° — Т * ΔS° → ТΔS° = ΔH°→T = = =1126 К
рассчитаем ΔGр-ции при разных температурах (1050, 1100, 1150, 1200)
ΔGр-ции = -58 + 51,5 * 10-3 * Т;
ΔG1050 = -3,92; ΔG1100 = -1,35; ΔG1150 = 1,23 и ΔG1200 = 3,8
На основании полученных данных построим график:
При Т < Tравн преобладает прямая реакция, а при T > Tравн – обратная.
Наступление равновесия возможно, если знак изменения функций ΔH и Δ S одинаков
Задачи по расчету констант равновесия.
Зависимость константы равновесия от свободной энергии Гиббса выражается уравнением:
ΔG = -2,3 R * TlgK, где К – константа равновесия, R – универсальная газовая постоянная. В стандартных условиях lg298K = — 0,175 ΔG°298
Задача. Константа равновесия реакции С(Т) + СО2(г)↔ 2СО (г) при 1700°К равна 2,4. Рассчитать ΔGр-ции при 1700°К и константу равновесия в стандартных условиях (298°К).
Решение задачи.
ΔG1700 = -2,3 * R * TlgK = -2.3 * 8.3 * 1700 * lg2.4 = — 123370Дж = -123,37 кДж;
ΔG1700 < 0 → равновесие реакции сдвинуто вправо, т.е. в сторону прямой реакции.
Находим константу равновесия при 298°K (стандартные условия):
lgK298 = -0.175ΔG°298; необходимые данные берем из справочника.
ΔG°р-ции = 2 * ΔG°СО — ΔG°СО2 = 2( — 137,1) – ( — 394,2) = 120;
ΔG°р-ции = -2,3 * 8,3 *10-3 lgK * T = -2. 3 * 8.3 *10-3 * 298 lgK,
3 * 8.3 *10-3 * 298 lgK,
lgK = = -21,05 → К = 10-21,05 → К << 1
При 298°К (25°С) реакция практически не идет, равновесие смещено влево.
Влияние CO2 на термохимические системы накопления тепла Ca(OH)2 и Mg(OH)2
Автор
Перечислено:
- Ян Дж.
- Чжао, К.Ю.
- Пан, З.Х.
Зарегистрировано:
Abstract
Циклическая стабильность является ключевым фактором при проектировании термохимических систем хранения тепла. Поскольку диоксид углерода (CO2) может вступать в реакцию с материалами, аккумулирующими тепло, и приводить к снижению эффективности накопления энергии, в этом исследовании исследуется влияние CO2 на системы Ca(OH)2/CaO и Mg(OH)2/MgO. Экспериментальные результаты показывают, что СО2 реагирует с СаО в водяном паре, возникающем в процессе тепловыделения. Следовательно, при проектировании систем Ca(OH)2/CaO CO2 необходимо удалять из системы. Результаты для систем Mg(OH)2/MgO показывают, что CO2 лишь незначительно реагирует с MgO и Mg(OH)2 во время процессов накопления и выделения тепла. Это исследование показывает, что угольная кислота (h3CO3) может легко реагировать с CaO/Ca(OH)2 с образованием CaCO3 в процессе выделения тепла. Как правило, оставшийся CO2 снижает обратимость систем Ca(OH)2/CaO, но лишь незначительно влияет на системы Mg(OH)2/MgO. Кроме того, экспериментальные результаты показывают, что карбонатная оболочка не существует при регидратации для обоих образцов CaO/MgO, но влияние СО2 на весь процесс увеличивается после каждого цикла.
Результаты для систем Mg(OH)2/MgO показывают, что CO2 лишь незначительно реагирует с MgO и Mg(OH)2 во время процессов накопления и выделения тепла. Это исследование показывает, что угольная кислота (h3CO3) может легко реагировать с CaO/Ca(OH)2 с образованием CaCO3 в процессе выделения тепла. Как правило, оставшийся CO2 снижает обратимость систем Ca(OH)2/CaO, но лишь незначительно влияет на системы Mg(OH)2/MgO. Кроме того, экспериментальные результаты показывают, что карбонатная оболочка не существует при регидратации для обоих образцов CaO/MgO, но влияние СО2 на весь процесс увеличивается после каждого цикла.
Предлагаемое цитирование
Обработчик: RePEc:eee:energy:v:124:y:2017:i:c:p:114-123
DOI: 10.1016/j.energy.2017.02.034
как
HTMLHTML с абстрактным простым текстомпростой текст с абстрактнымBibTeXRIS (EndNote, RefMan, ProCite)ReDIFJSON
Скачать полный текст от издателя
URL-адрес файла: http://www. sciencedirect.com/science/article/pii/S0360544217302086
sciencedirect.com/science/article/pii/S0360544217302086 Ограничение на загрузку: Полный текст только для подписчиков ScienceDirect
URL-адрес файла: https://libkey.io/10.1016 /j.energy.2017.02.034?utm_source=ideas
Ссылка LibKey : если доступ ограничен и если ваша библиотека использует эту услугу, LibKey перенаправит вас туда, где вы можете использовать свою библиотечную подписку для доступа к этому элементу
— >
Поскольку доступ к этому документу ограничен, вы можете найти другую его версию.
Ссылки, перечисленные в IDEAS
как
HTMLHTML с абстрактным простым текстомпростой текст с абстрактнымBibTeXRIS (EndNote, RefMan, ProCite)ReDIFJSON
- Ли, Ган и Чжэн, Сюэфэй, 2016 г. « Интеграция системы хранения тепловой энергии для устойчивого будущего «, Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 62(С), страницы 736-757.
- Пардо П. и Дейдье А. и Анксионназ-Минвьель З.
 и Руже С. и Кабассуд М. и Когнет П., 2014. Обзор высокотемпературного термохимического накопителя тепловой энергии ,»
Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 32(С), страницы 591-610.
и Руже С. и Кабассуд М. и Когнет П., 2014. Обзор высокотемпературного термохимического накопителя тепловой энергии ,»
Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 32(С), страницы 591-610. - Ли, Тинсян и Ван, Ружу и Киплагат, Иеремия К. и Кан, ЮнТэ, 2013 г. » Анализ производительности интегрированной термохимической сорбционной системы твердого газа для хранения и модернизации энергии для сезонного хранения солнечной тепловой энергии ,» Энергия, Эльзевир, том. 50(С), страницы 454-467.
- Вальверде, Хосе М. и Санчес-Хименес, Педро Э. и Перехон, Антонио и Перес-Македа, Луис А., 2013 г. Термический анализ с постоянной скоростью для улучшения долгосрочного захвата CO2 CaO в условиях Ca-петли ,» Прикладная энергия, Elsevier, vol. 108(С), страницы 108-120.
- Айхара, Масахико и Нагаи, Тосиюки и Мацусита, Джунро и Негиши, Ёити и Оя, Харухико, 2001 г.
» Разработка пористого твердого реагента для хранения тепловой энергии и повышения температуры с использованием реакции карбонизации/декарбонизации ,»
Прикладная энергия, Elsevier, vol.
 69(3), страницы 225-238, июль.
69(3), страницы 225-238, июль. - Эррандо, Мария и Маркидес, Христос Н. и Хеллгардт, Клаус, 2014 г. « Оценка гибридных фотоэлектрических и солнечно-тепловых систем для домашнего отопления и электроснабжения в Великобритании: производительность системы «, Прикладная энергия, Elsevier, vol. 122(С), страницы 288-309.
- Пан, Чжихао и Чжао, Китай, 2015 г. » Дегидратация / гидратация химической системы хранения тепла MgO/h3O ,» Энергия, Эльзевир, том. 82(С), страницы 611-618.
- Кенисарин Мурат и Махкамов Хамид, 2007 г. Хранение солнечной энергии с использованием материалов с фазовым переходом ,» Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 11(9), стр. 1913-1965, декабрь.
- Ли, Банда, 2015 г. « Оценка энергетических и эксергетических характеристик систем хранения тепловой энергии со скрытой теплотой », Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 51(С), страницы 926-954.
- Шао Х.
 и Нагель Т. и Росскопф К. и Линдер М. и Вернер А. и Колдитц О., 2013.
» Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 2 — Одномерная вычислительная модель реакционной системы с гидроксидом кальция ,»
Энергия, Эльзевир, том. 60(С), страницы 271-282.
и Нагель Т. и Росскопф К. и Линдер М. и Вернер А. и Колдитц О., 2013.
» Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 2 — Одномерная вычислительная модель реакционной системы с гидроксидом кальция ,»
Энергия, Эльзевир, том. 60(С), страницы 271-282. - Мишель, Бенуа и Мазе, Натали и Моран, Сильвен и Ститу, Дрисс и Сюй, Цзин, 2012 г. » Термохимический процесс для сезонного хранения солнечной энергии: Характеристика и моделирование реактивного слоя высокой плотности ,» Энергия, Эльзевир, том. 47(1), страницы 553-563.
- Фриман, Джеймс и Хеллгардт, Клаус и Маркидес, Христос Н., 2015 г. » Оценка систем с органическим циклом Ренкина, работающих на солнечной энергии, для комбинированного производства тепла и электроэнергии в бытовых целях в Великобритании ,» Прикладная энергия, Elsevier, vol. 138(С), страницы 605-620.
- Нагель Т. и Шао Х. и Сингх А.К. и Ватанабе, Н., и Росскопф, К., и Линдер, М., и Вернер, А.
 , и Колдитц, О., 2013.
« Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 1 – Концептуальная модель ,»
Энергия, Эльзевир, том. 60(С), страницы 254-270.
, и Колдитц, О., 2013.
« Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 1 – Концептуальная модель ,»
Энергия, Эльзевир, том. 60(С), страницы 254-270. - Э. Дж. (Бен) Энтони, 2011 г. » Ca петлевая технология: текущее состояние, развитие и будущие направления ,» Парниковые газы: наука и технологии, Blackwell Publishing, vol. 1(1), страницы 36-47, март.
- Ли, Банда, 2016 г. « Оценка запаса тепла и эксергии явного тепла ,» Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 53(С), страницы 897-923.
- Ли, Ган и Цянь, Суксин и Ли, Хосон и Хван, Юнхо и Радермахер, Рейнхард, 2014 г. « Экспериментальное исследование энергетических и эксергетических характеристик краткосрочного адсорбционного аккумулирования тепла для жилых помещений «, Энергия, Эльзевир, том. 65(С), страницы 675-691.
- Tatsidjodoung, Parfait & Le Pierrès, Nolwenn & Luo, Lingai, 2013.
« Обзор потенциальных материалов для хранения тепловой энергии в строительстве «,
Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol.
 18(С), страницы 327-349.
18(С), страницы 327-349. - Чжан, Хуэй и Ван, Хун и Чжу, Сюнь и Цю, Юн-Джун и Ли, Кай и Чен, Ронг и Ляо, Цян, 2013 г. « Обзор технологий рекуперации отходящего тепла в расплавленный шлак в сталелитейной промышленности ,» Прикладная энергия, Elsevier, vol. 112(С), страницы 956-966.
- Ли, Ган и Хван, Юнхо и Радермахер, Рейнхард и Чун, Хо-Хван, 2013 г. « Обзор материалов для холодильных камер для применения при отрицательных температурах «, Энергия, Эльзевир, том. 51(С), страницы 1-17.
- Прието, Кристина и Купер, Патрик и Фернандес, А. Инес и Кабеса, Луиза Ф., 2016 г. « Обзор технологии: Термохимическое накопление энергии для концентрированных солнечных электростанций ,» Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 60(С), страницы 909-929.
Полные ссылки (включая те, которые не соответствуют элементам в IDEAS)
Цитаты
Цитаты извлекаются проектом CitEc, подпишитесь на его RSS-канал для этого элемента.
как
HTMLHTML с абстрактным простым текстомпростой текст с абстрактнымBibTeXRIS (EndNote, RefMan, ProCite)ReDIFJSON
Процитировано:
- Ван, Мэнъи и Чен, Ли и Чжоу, Юхао и Тао, Вэнь-Цюань, 2022. Численное моделирование реакции дегидратации системы гидроксид кальция/оксид кальция в кожухотрубном реакторе ,» Прикладная энергия, Elsevier, vol. 312 (С).
- Сюй, Техас и Тиан, К.К. и Хоса, А.А. и Ян, Дж., Е, К., и Чжао, К.Ю., 2021 г. » Характеристики реакции термохимического накопления энергии CaCO3 / CaO с легирующей примесью TiO2 и экспериментальное исследование в реакторе с неподвижным слоем ,» Энергия, Эльзевир, том. 236 (С).
- Пан З.Х. и Чжао, К.Ю., 2017. Газо-твердотопливные термохимические теплоаккумулирующие реакторы для высокотемпературных применений ,» Энергия, Эльзевир, том. 130(С), страницы 155-173.
- Ся, Б.К. и Чжао, К.Ю. и Ян, Дж., и Хоса, А.А., 2020.
« Разработка гранулированного термохимического теплоаккумулирующего композита на основе оксида кальция «,
Возобновляемые источники энергии, Elsevier, vol.
 147 (P1), страницы 969-978.
147 (P1), страницы 969-978. - Пелай, Уго и Луо, Лингай и Фан, Илин и Ститоу, Дрисс и Кастелен, Кэти, 2019 г. » Интеграция термохимической системы накопления энергии в цикл Ренкина, управляемый концентрацией солнечной энергии: анализ энергии и эксергии ,» Энергия, Эльзевир, том. 167(С), страницы 498-510.
- Сунку Прасад, Дж. и Мутхукумар, П., и Десаи, Фенил и Басу, Дипанкар Н. и Рахман, Мухаммад М., 2019. « Критический обзор высокотемпературных обратимых термохимических систем накопления энергии «, Прикладная энергия, Elsevier, vol. 254 (С).
Наиболее похожие товары
Это элементы, которые чаще всего цитируют те же работы, что и этот, и цитируются теми же работами, что и этот.
- Дизаджи, Хоссейн Бейдаги и Хоссейни, Ханнане, 2018 г.
» Обзор скрининга материалов в системах термохимического накопления энергии (TCES) из чистых и смешанных оксидов металлов для приложений концентрированной солнечной энергии (CSP) ,»
Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol.
 98(С), страницы 9-26.
98(С), страницы 9-26. - Пан З.Х. и Чжао, К.Ю., 2017. » Газо-твердотопливные термохимические теплоаккумулирующие реакторы для высокотемпературных применений ,» Энергия, Эльзевир, том. 130(С), страницы 155-173.
- Ян, Дж. и Чжао, К.Ю., 2016. « Экспериментальное исследование CaO/Ca(OH)2 в реакторе с неподвижным слоем для термохимического накопления тепла ,» Прикладная энергия, Elsevier, vol. 175(С), страницы 277-284.
- Бенничи, Симона и Дютурнье, Патрик и Каталан, Джереми и Збаир, Мохамед и Нгуен, Минь Хоанг и Скуиллер, Эллиот и Воло, Сирил, 2022 год. » Аккумулирование тепла: исследование гидратации композитов MgSO4/активированный углерод, от разработки материалов до сценариев бытового применения ,» Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 158 (С).
- Мохамед Збаир и Симона Бенничи, 2021 г.
«Краткий обзор по гидратам солей и композитам, используемым в термохимическом сорбционном хранении тепла: обзор »,
Энергии, МДПИ, вып.
 14(11), страницы 1-33, май.
14(11), страницы 1-33, май. - Лю, Сиджия и Винтер, Микаэла и Леверенц, Мейнерт и Беккер, Ян и Зауэр, Дирк Уве и Ма, Зею и Цзян, Цзючунь, 2019 г. Анализ характеристик циклического старения коммерческих аккумуляторов на основе Li4Ti5O12 при комнатной температуре ,» Энергия, Эльзевир, том. 173(С), страницы 1041-1053.
- Пантано, Фабио и Капата, Роберто, 2017 г. » Выбор расширителя для бортовой системы рекуперации энергии ORC ,» Энергия, Эльзевир, том. 141(С), страницы 1084-1096.
- Зейнелабдейн, Рами и Омер, Сиддиг и Ган, Гохуэй, 2018 г. « Критический обзор систем накопления скрытого тепла для естественного охлаждения в зданиях «, Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 82 (P3), страницы 2843-2868.
- Карро, А. и Чакартеги, Р. и Ортис, К. и Карнейро, Дж. и Бесерра, Дж. А., 2022.
» Интеграция систем накопления энергии на основе транскритического CO2: Концепция электротермальной энергии на основе CO2 и геологического хранения ,»
Энергия, Эльзевир, том.
 238 (ПА).
238 (ПА). - Нагель, Томас и Беккерт, Штеффен и Леманн, Кристоф и Глезер, Роджер и Колдитц, Олаф, 2016 г. Мультифизические континуальные модели термохимического накопления и преобразования тепла в пористых средах и порошковых слоях — Обзор ,» Прикладная энергия, Elsevier, vol. 178(С), страницы 323-345.
- Мариас, Фойвос и Невё, Пьер и Танги, Гвеннин и Папийон, Филипп, 2014 г. « Термодинамический анализ и экспериментальное исследование твердотопливного реактора, работающего в открытом режиме «, Энергия, Эльзевир, том. 66(С), страницы 757-765.
- Ли, Цзянь и Лю, Цян и Гэ, Чжун и Дуань, Юаньюань и Ян, Чжэнь и Ди, Цзявэй, 2017 г. Оптимизированные термодинамические состояния с разделительной жидкостью для рабочих тел органических циклов Ренкина с конденсацией с разделительной жидкостью ,» Энергия, Эльзевир, том. 141(С), страницы 652-660.
- Ли, Цзяци и Ту, Ранг и Лю, Мэндан и Ван, Сыци, 2021 г.
» Эксергетический анализ нового многоступенчатого накопителя скрытой теплоты на основе однородности полей разности температур ,»
Энергия, Эльзевир, том.
 221 (С).
221 (С). - Биглариан, Хасан и Аббаспур, Маджид и Саиди, Мохаммад Хасан, 2018 г. » Оценка переходной модели скважинного теплообменника в динамическом моделировании системы геотермального теплового насоса ,» Энергия, Эльзевир, том. 147(С), страницы 81-93.
- Сонг, Чунхэ и Цзин, Вэй и Цзэн, Пэн и Розенберг, Кэтрин, 2017 г. « Анализ энергопотребления циркуляционных насосов жилых бассейнов для управления пиковыми нагрузками ,» Прикладная энергия, Elsevier, vol. 195(С), страницы 1-12.
- Паломба, Валерия и Сапиенца, Алессио и Аристов, Юрий, 2019. Динамика и полезная теплота разрядной стадии адсорбционных циклов для долговременного хранения тепла ,» Прикладная энергия, Elsevier, vol. 248(С), страницы 299-309.
- Пелай, Уго и Луо, Лингай и Фан, Илин и Ститоу, Дрисс и Руд, Марк, 2017 г.
« Системы накопления тепловой энергии для концентрированных солнечных электростанций «,
Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol.
 79(С), страницы 82-100.
79(С), страницы 82-100. - Ван, Чжэньфэн и Сюй, Гуанъинь и Линь, Жоцзюэ и Ван, Хэн и Рен, Цзинчжэн, 2019 г. » Заключение договоров с гарантированными энергопоказателями, факторы риска и последствия для политики: выявление и анализ рисков на основе сетевого метода наилучшего-наихудшего ,» Энергия, Эльзевир, том. 170(С), страницы 1-13.
- Чжу, Ф.К. и Цзян, Л. и Ван, Л.В. и Ван Р.З., 2016 г. » Экспериментальное исследование резорбционной системы MnCl2CaCl2Nh4 для когенерации тепла и холода ,» Прикладная энергия, Elsevier, vol. 181(С), страницы 29-37.
- Флегкас С. и Биркельбах Ф. и Винтер Ф. и Фрейбергер Н. и Вернер А., 2018. Реакторы с псевдоожиженным слоем для концепций твердогазового термохимического накопления энергии. Моделирование и технологические ограничения ,» Энергия, Эльзевир, том. 143(С), страницы 615-623.
Подробнее об этом изделии
Ключевые слова
Термохимический аккумулятор тепла; циклическая стабильность; Углекислый газ (CO2); оксид щелочноземельного металла;
Все эти ключевые слова.
Классификация JEL:
Статистика
Доступ и статистика загрузки
Исправления
Все материалы на этом сайте предоставлены соответствующими издателями и авторами. Вы можете помочь исправить ошибки и упущения. При запросе исправления, пожалуйста, укажите дескриптор этого элемента: RePEc:eee:energy:v:124:y:2017:i:c:p:114-123 . См. общую информацию о том, как исправить материал в RePEc.
По техническим вопросам, касающимся этого элемента, или для исправления его авторов, названия, реферата, библиографической информации или информации для загрузки, обращайтесь: . Общие контактные данные поставщика: http://www.journals.elsevier.com/energy .
Если вы создали этот элемент и еще не зарегистрированы в RePEc, мы рекомендуем вам сделать это здесь. Это позволяет связать ваш профиль с этим элементом. Это также позволяет вам принимать потенциальные ссылки на этот элемент, в отношении которых мы не уверены.
Если CitEc распознал библиографическую ссылку, но не связал с ней элемент в RePEc, вы можете помочь с помощью этой формы .
Если вы знаете об отсутствующих элементах, ссылающихся на этот, вы можете помочь нам создать эти ссылки, добавив соответствующие ссылки таким же образом, как указано выше, для каждого ссылающегося элемента. Если вы являетесь зарегистрированным автором этого элемента, вы также можете проверить вкладку «Цитаты» в своем профиле RePEc Author Service, так как некоторые цитаты могут ожидать подтверждения.
По техническим вопросам относительно этого элемента или для исправления его авторов, названия, реферата, библиографической информации или информации для загрузки обращайтесь: Кэтрин Лю (адрес электронной почты доступен ниже). Общие контактные данные поставщика: http://www.journals.elsevier.com/energy .
Обратите внимание, что фильтрация исправлений может занять пару недель.
различные услуги RePEc.
Разработка усовершенствованных сорбентов для выделения СО2 из дымовых газов в широком диапазоне температур при сжигании угля (Технический отчет)
Разработка усовершенствованных сорбентов для выделения СО2 из дымовых газов в широком диапазоне температур при сжигании угля (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
- Смирниотис, Панайотис Г.
- Дата публикации:
- Исследовательская организация:
- Унив.
 Цинциннати, Огайо (США)
Цинциннати, Огайо (США)
- Организация-спонсор:
- USDOE
- Идентификатор ОСТИ:
- 876541
- Номер контракта с Министерством энергетики:
- ФГ26-03НТ41810
- Тип ресурса:
- Технический отчет
- Страна публикации:
- США
- Язык:
- Английский
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Смирниотис, Панайотис Г. Разработка усовершенствованных сорбентов для выделения СО2 из дымовых газов в широком диапазоне температур при сжигании угля . США: Н. П., 2005.
Веб. дои: 10.2172/876541.
США: Н. П., 2005.
Веб. дои: 10.2172/876541.
Копировать в буфер обмена
Смирниотис, Панайотис Г. Разработка усовершенствованных сорбентов для выделения СО2 из дымовых газов в широком диапазоне температур при сжигании угля . Соединенные Штаты. https://doi.org/10.2172/876541
Копировать в буфер обмена
Смирниотис, Панайотис Г. 2005.
«Разработка улучшенных сорбентов для отделения CO2 от дымовых газов в широком диапазоне температур при сжигании угля». Соединенные Штаты. https://doi.org/10.2172/876541. https://www.osti.gov/servlets/purl/876541.
Копировать в буфер обмена
@статья{osti_876541,
title = {Разработка улучшенных сорбентов для отделения CO2 от дымовых газов в широком диапазоне температур при сжигании угля},
автор = {Смирниотис, Панайотис Г},
abstractNote = {},
дои = {10.

 и Руже С. и Кабассуд М. и Когнет П., 2014. Обзор высокотемпературного термохимического накопителя тепловой энергии ,»
Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 32(С), страницы 591-610.
и Руже С. и Кабассуд М. и Когнет П., 2014. Обзор высокотемпературного термохимического накопителя тепловой энергии ,»
Обзоры возобновляемых и устойчивых источников энергии, Elsevier, vol. 32(С), страницы 591-610. 69(3), страницы 225-238, июль.
69(3), страницы 225-238, июль. и Нагель Т. и Росскопф К. и Линдер М. и Вернер А. и Колдитц О., 2013.
» Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 2 — Одномерная вычислительная модель реакционной системы с гидроксидом кальция ,»
Энергия, Эльзевир, том. 60(С), страницы 271-282.
и Нагель Т. и Росскопф К. и Линдер М. и Вернер А. и Колдитц О., 2013.
» Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 2 — Одномерная вычислительная модель реакционной системы с гидроксидом кальция ,»
Энергия, Эльзевир, том. 60(С), страницы 271-282. , и Колдитц, О., 2013.
« Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 1 – Концептуальная модель ,»
Энергия, Эльзевир, том. 60(С), страницы 254-270.
, и Колдитц, О., 2013.
« Неравновесный термохимический аккумулирование тепла в пористой среде: Часть 1 – Концептуальная модель ,»
Энергия, Эльзевир, том. 60(С), страницы 254-270. 18(С), страницы 327-349.
18(С), страницы 327-349. 147 (P1), страницы 969-978.
147 (P1), страницы 969-978. 98(С), страницы 9-26.
98(С), страницы 9-26.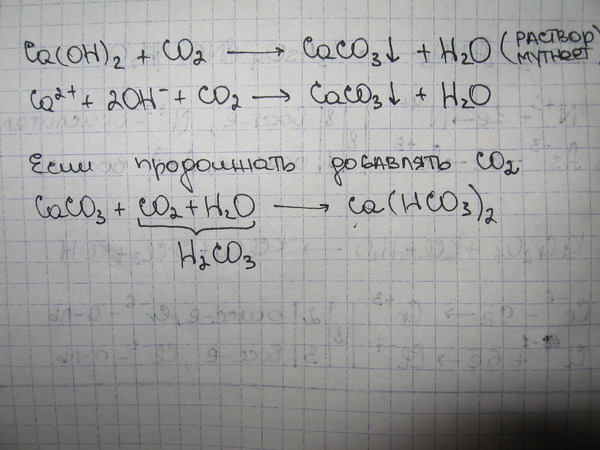 14(11), страницы 1-33, май.
14(11), страницы 1-33, май. 238 (ПА).
238 (ПА). 221 (С).
221 (С). 79(С), страницы 82-100.
79(С), страницы 82-100. Цинциннати, Огайо (США)
Цинциннати, Огайо (США)