15. Азотистая кислота и ее соли. Роль в окислительно-восстановительных процессах. Применение.
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны. Соли азотистой кислоты (нитриты) получают восстановлением нитратов: NaNO2+HCI = NaCI+HNO2.
-Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (Н2О2, KMnO4) окисляется в HNO3: 2HNO2 + 2HI → 2NO↑ + I2↓ + 2h3O; 5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3h3O; HNO2 + Cl2 + h3O → HNO3 + 2HCl.
применяется для диазотирования первичных ароматических
аминов и образования солей диазония.
Нитриты применяются в органическом
синтезе при производстве органических
красителей.
Из химических свойств HNO2 сильнее выражены окислительные, при этом сама она восстанавливается до NO
Однако можно привести много примеров таких реакций, где азотистая кислота проявляет восстановительные свойства
Определить присутствие азотистой кислоты и ее солей в растворе можно, если прибавить раствор иодида калия и крахмала. Нитрит-ион окисляет анион иода. Эта реакция требует присутствия Н+, т.е. протекает в кислой среде.
16. Биологическая роль азота и фосфора. Применение.
— Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др.
-Фосфор присутствует
в живых клетках в виде орто- и пирофосфорной
кислот, входит в состав нуклеотидов,
нуклеиновых кислот, фосфопротеидов,
фосфолипидов, коферментов, ферментов.
Кости человека состоят из гидроксилапатита
3Са3(РО4)3·Ca(OH)2.
-В промышленности газ азот используют главным образом для получения аммиака. Инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах. Жидкий азот широко используют как хладагент. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения.
Основную долю всего добываемого фосфора (~ 90%) используют для получения P2O5 и так называемой термической фосфорной кислоты, применяемой в производстве различных фосфорных удобрений и разнообразных фосфатов, в том числе для животноводства (минеральных подкормок). Используют фосфор также для получения разнообразных фосфорсодержащих неорганических и органических соединений. Белый фосфор применяют в качестве дымообразующего и зажигательного средства, для изготовления трассирующих боеприпасов.
Красный фосфор
используют в спичечной промышленности
как основной компонент обмазки
зажигательной поверхности спичечных
коробков, как компонент термопластичных
композиций, в производстве ламп
накаливания — как газопоглотитель.
17. Мышьяк и его соединения. Обнаружение. Влияние на живой организм. Применение.
Мышья́к — химический элемент 15-й группы четвёртого периода периодической системы; имеет атомный номер 33, обозначается символом As. Простое вещество представляет собой хрупкий полуметалл стального цвета. B соединениях Мышьяк имеет степени окисления +5, +3 и -3. При нагревании на воздухе выше 400 °C Мышьяк горит, образуя As2O3. С галогенами Мышьяк соединяется непосредственно; при обычных условиях AsF5 — газ; AsF3, AsCl3, AsBr3 — бесцветные легко летучие жидкости; AsI3 и As2I4 — красные кристаллы. При нагревании Мышьяка с серой получены сульфиды: оранжево-красный As 4S4 и лимонно-желтый As2S3.
Обнаружение:
Мышьяк —
рассеянный элемент. Содержится в земной
коре, в морской воде.
В небольших
концентрациях часто содержится в
свинцовых, медных и серебряных рудах. —
—
Классическим методом обнаружения мышьяка при химико-токсикологическом анализе является известный метод Марша предложенный английским химиком Джемсом Маршем в 1836 г.
В основу метода Марша положены следующие реакции:
Н2SO4 + Zn = ZnSO4 + 2H h4AsO4 + 8Н = h4As + 4Н2O
Влияние. Мышьяк и все его соединения ядовиты. При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. На территориях, где в почве и воде избыток мышьяка, он накапливается в щитовидной железе у людей и вызывает эндемический зоб. Мышьяк употребляетcя и в ветеринарии, как довольно эффективное противогельминтозное средство для лечения овец. В некоторых живых организмах мышьяк является необходимым элементом, занимая место фосфора в биохимических реакциях.
Применение.
используется для синтеза полупроводниковых
материалов — арсенидов и сложных
алмазоподобных полупроводников.
Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи.
В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (ярко-белое пламя).
Многие из мышьяковых соединений в очень малых дозах применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний, так как оказывают клинически значимое стимулирующее влияние на ряд функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство.
Азот — презентация онлайн
1. Не начавши — думай, а начавши – делай Народная мудрость
2. V группа
3.
 N, P, As, Sb, Bir,Э0
N, P, As, Sb, Bir,Э0r,Э3+
п
Степени окисления
N
0,71
O,16
3,07
P
1,10
0,44
2,06
-3,(-2),(-1), 0,
+1,+2,+3,+4,+5
-3,(-2),(-1), 0, +3, +5
As 1,40
0,58
2,20
-3, 0, +3, +5
Sb 1,61
0,76
1,82
(-3), 0, +3, +5
Bi
1,03
1,67
(-3), 0, +3, (+5)
1,86
4. Распространенность и минералы
N – 18 место, N2, NaNO3 (селитра)P – 13 место; Ca3(PO4)2 (фосфорит),
Ca3(PO4)2•Ca(OH,F)2 (апатит)
As – 51 место, As4S4 (реальгар), FeAsS
(арсенопирит)
Sb – 59 место, Sb2S3 (антимонит)
Bi – 60 место, Bi2S3 (висмутит)
5. Открытие элементов
• N – 1772 г., англ. Кавендиш, Резерфорд +Пристли, швед Шееле, француз Лавуазье;
от греч. «отрицающий жизнь»
• P – 1669 г., немец Бранд, от греч. «несущий
огонь»
• As — известен давно, от греч.
«принадлежность к муж. роду»
• Sb – известен давно, от греч. «противник
уединения»
• Bi – 1739 г.
 , Потт, от нем. «Weise materia»
, Потт, от нем. «Weise materia»6. N и P
• Химия N и P резко отличаются• N в высших степенях окисления
– сильные окислители, P – нет
• N — 4-ковалентный (октет), P – 5
ковалентный
• Простые вещества:
N2 (тройная связь), P4 одинарные связи
• Термически молекула
устойчива (не
диссоциирует) до 3000оС
8. В атмосфере
Ионизация:• N2 + h N2+ + e• N2 + e- N2+ + 2 eДиссоциативная
рекомбинация:
• N2+ + e- N2* 2 N
9. Реакции обмена
N2+ + O NO+ + N
O+ + N2 NO+ + N
O+ + N2 N2O+
O2+ + NO NO3+
O2+ + N2 NO+ + NO
O2+ + N NO+ + O
10. В атмосфере
• Ядерные реакции14 N + 1 n 12 C + 3 H
7
0
6
1
14 N + 1 n 15 N 14 C + 1 Н
7
0
7
6
1
• Распад
14 C 14 N + e- ( -излучение)
6
7
Период полураспада 5568 лет
12. Связь N-N
• Связь N N по энергии (224,5 ккал/моль)эквивалентна шести одинарным
связям N-N
• Энергия связи С С (199 ккал/моль)
эквивалентна двум с половиной
одинарным связям С-С
• Связь N-N значительно менее прочна
(38,4 ккал/моль), чем одинарная связь
С-С (83,1 ккал/моль)
13.
 Реакции молекулярного азота
Реакции молекулярного азота15. Галогениды NГ3
• Г = F, Cl, I• Кроме NF3 чрезвычайно
взрывчатые вещества
• Получают:
4 Nh4 + 3 F2 NF3 + 3 Nh5F
Nh5Cl + 3 Cl2 NCl3 + 4 HCl
2 Nh4(р) + 3 I2 NI3 Nh4 + 3 HI
16. Шмель-спаситель
• Моноаммиакат нитридатрииода I3N∙Nh4
2 (I3N∙Nh4) = 2 N2↑ +
3 I2↑ + 3 h3↑
17. 3 Br2 + 2 Nh4 N2 + 6 HBr 3 Cl2 + 2 Nh4 N2 + 6 HCl
3 Br2 + 2 Nh4N2 + 6 HBr
3 Cl2 + 2 Nh4
N2 + 6 HCl
18. Галогениды NГ3
NCl3 + 3 h3O Nh4 + 3 HOCl2 NF3 + 3 h3O N2O3 + 6 HF
19. Соединения с серой
• Наиболее устойчивое S4N4 –темно-красная жидкость
(азотистая сера)
16 Nh4 (ж) + 10 S
6 (Nh5)2S + S4N4
20. Соединения с серой
• Медленно разлагается2 S4N4 + 15 h3O
2 (Nh5)2S3O6 + (Nh5)2S2O3 +
2 Nh4
• С восстановителями
S4N4 + 20 HI 4 h3S + 10 I2 +
4 Nh4
21. Соединения с серой
• При нагревании разлагаетсяS4N4 S2N2
Бесцветный с запахом йода
• Другие нитриды
S4N2, S11N2
• Гептасульфуримид S7NH
22.
 Нитриды• Получение
Нитриды• Получение6 Na + N2 2 Na3N
3 Cu2O + 2 Nh4 2 Cu3N + 3 h3O
CrCl3 + Nh4 CrN + 3 HCl
23. Нитриды
• СвойстваAlN + 3 h3O Nh4 + Al(OH)3
Mg3N2 + 6 HCl 2 Nh4 + 3 MgCl2
• Cu3N – очень устойчив
24. Нитриды
• Металлоподобные нитридыTiN, Ti3N, Cr2N, CrN, Mn6N5
Тугоплавки, устойчивы к
действию воды и кислот
• Используются для создания
высокопрочных материалов
25. Цианид калия
KCN + Н2О + СO2 =KНСО3 + HCN↑
4 HCN + 5 О2 =
2 Н2О + 4 СО2↑ + 2 N2↑
2 KCN + O2 = 2 KNCO
KCN + 2 h3O = HCOOK + Nh4↑
26. Растворение золота
4 Au + 8 NaCN + 2 h3O + О2 =4 Na[Au(CN)2] + 4 NaOH
• В 1844 г. русский инженер
Багратион
2 Na[Au(CN)2] + Zn=
Na2[Zn(CN)4] + 2 Au↓
27. Цианамид кальция CaCN2
• ПолучениеCaC2 + N2 CaCN2 + C
темно-серый порошок
• Разлагается водой
CaCN2 + 3 h3O
CaCO3 + 2 Nh4
28. «Гремучая ртуть»
Фульминат ртути Hg(CNO)2 инициатор взрывовHg + 4 HNO3 + 2 C2H5OH =
Hg(CNO)2 + N2↑ + 2 СО2↑ + 8 Н2О
• при случайном касании, а тем
более при ударе, трении,
нагреве:
Hg(CNO)2 = Hg + N2↑ + 2 CO↑
29.
 Соединения с водородом• Аммиак
Соединения с водородом• Аммиак• Гидразин
• Азидоводород
30. Аммиак
• В жидком состоянииассоциирован за счет
водородных связей (Nh4)x
• Валентный угол 107о
• Длина связи N-H
0.101 нм
• Энергия связи 380 кДж/моль
32. Аммиак
33. Аммиак
• Восстановитель:3 Nh4 + 4 KClO3 + 3 KOH
3 КNO3 + 4 KCl + 6 h3O
34. Аммиак
• ОснованиеNh4 + h3O Nh5+ + OHNh4 h3O
Nh4 + HCl Nh5Cl
• Лиганд в комплексных
соединениях
[Ag(Nh4)2]OH
35. Изобретение Швейцера
• При фильтровании раствора[Cu(Nh4)4](OH)2
фильтровальная бумага
растворилась
• При добавлении серной
кислоты выпал белый
волокнистый осадок (вата)
36. Аммиак
• Реакции замещения водорода:2 Nh4 + 2 Na 2 NaNh3 + h3
2 Nh4 + 3 Mg Mg3N2 + 3 h3
4 Nh4 + 2 F2 NF3 + 3 Nh5F
37. Амиды металлов
H — C C — H + Na Nh3Более сильная
кислота
Br 2CH CH 2 CH 3
CH 2Br CHBr CH 3
Более
сильное
основание
H — C C Na + H—Nh3
Более
слабое
основание
2NaNH 2
CH
(NH 3 жидк.
 )
)C
Более
слабая
кислота
CH 3 + 2NaBr +
2NH 3
38. Амиды металлов
*Cl
KNh3
*
Nh3
*
+
N h4
+
N
Nh3
T
NaNh3
-h3
N
Nh3
39. Аммиак
2 Nh4 + CO2 + h3O = (Nh5)2CO32 Nh4 + СО2 = (Nh3COO)Nh5.
карбаминат аммония – соль
карбаминовой кислоты
Nh3COOH
(Nh3COO)Nh5 + Н2О = (NН4)2СO3
• при высокой температуре и
большом давлении:
2 NН3 + СО2 = (NН2)2СО + Н2О
40. Легче пробки
• Карбамидоформальдегиднаясмола:
n НСНО + n (Nh3)2CO =
(-СН2-NН-СО-NH-СН2-)n + n Н2О
• пористая белая масса пеноаминопласт (0,01 г/см3, что в
100 раз меньше плотности воды, в
десять и более раз легче корковой
пробки)
41. Аммиак
C2H5I + Nh4иодэтан
NH 3
Ch4COOH
Nh4
[C2H5Nh4]Iэтиламмонийиодид
ROH
Al2O 3, T
Nh4
-Nh5I
C2H5Nh3
этиламин
RNH 2
ROH
Al2O 3, T
O
—
Ch4COO
+
Nh5
ацетат аммония
-h3O
Ch4 C
Nh3
ацетамид
42.
 Соли аммония• Большинство бесцветны и
Соли аммония• Большинство бесцветны ихорошо растворяются в воде
• Гидролизуются
• Nh5Cl – нашатырь
(при паянии)
4 CuO + 2 Nh5Cl
3 Cu + CuCl2 + N2 + 4 h3O
43. Соли аммония
• Nh5NO3 – входит в составаммонала (72%)
• Nh5ClO4 – входит в состав
твердого ракетного топлива
44. Соли аммония
• Термически неустойчивы(Nh5)2CO3 2 Nh4 + CO2 + h3O
• Соли нелетучих кислот
(Nh5)2SO4 Nh4 + Nh5HSO4
Nh5h3PO4 Nh4 + h4PO4
45. Соли аммония
• Внутримолекулярноевосстановление-окисление
Nh5NO2 N2 + 2 h3O
Nh5NO3 N2O + 2 h3O
(Nh5)2Cr2O7 N2 + Cr2O3 + 2 h3O
46. Гидразин N2h5
• Ядовитая жидкость, ВВ2 Nh4 + NaOCl
N2h5 + NaCl + h3O
• Сильный восстановитель
N2h5 + O2 N2 + 2 h3O
N2h5 + 2 I2 N2 + 4 HI
47. Гидразин N2h5
• При действии восстановителейN2h5 + Zn + 4 HCl
2 Nh5Cl + ZnCl2
• При нагревании
3 N2h5 N2 + 4 Nh4
48. Гидразин N2h5
• ОснованиеN2h5 + h3O N2H5+ + OHN2h5 h3O
N2h5 + HCl [N2H5]Cl
N2h5 + 2 HCl [N2H6]Cl2
49.
 Гидразин N2h5• Лиганд в комплексных
Гидразин N2h5• Лиганд в комплексныхсоединениях
[Zn(N2h5)2]Cl2
50. Гидразин
RR
C
R’
O + Nh3Nh3
гидразин
C
-h3O
R
N
Nh3
гидразон
51. Азотистоводородная кислота
HN3• Жидкость, ВВ, слабая
-5
кислота (К = 10 )
N2h5 + HNO2 HN3 + 2 h3O
53. Азотистоводородная кислота
• ОкислительHN3 + 4 h3 3 Nh4
• Смесь с HCl аналогична
царской водке
HN3 + 2 HCl 2 Cl + N2 + Nh4
54. Азотистоводородная кислота
• С сильными окислителями10 HN3 + 2 KMnO4 + 3 h3SO4
15 N2 + 2 MnSO4 + K2SO4
+ H 2O
55. Азотистоводородная кислота
HN3 + HClO ClN3 + h3OХлоразид
• Все галогеназиды
чрезвычайно взрывчаты
NaNh3 + N2O NaN3 + h3O
• Растворимы в воде (кроме Ag
(I), Pb (II), Hg22+), взрывчаты
(за исключением азидов
щелочных металлов, LiN3 взрывчат)
• При нагревании:
NaN3 N2 + Na
• Pb(N3)2 – применяется для
снаряжения капсюлейдетонаторов
58.
 Гидроксиламин Nh3OH• Бесцветные кристаллы
Гидроксиламин Nh3OH• Бесцветные кристаллы• Образуется при
электролизе азотной
кислоты
HNO3 + 6 H Nh3OH + 2 h3O
NO3- + 7 H+ + 6e = Nh3OH + 2 h3O
59. Гидроксиламин Nh3OH
• Основные свойства(Nh3OH HCl)
• Окислительные и
восстановительные свойства
4 FeSO4 + 2 Nh3OH + 3 h3SO4
2 Fe2(SO4)3 + (Nh5)2SO4 +
2 h3 O
60. Гидроксиламин Nh3OH
61. Гидроксиламин Nh3OH
• В щелочной средеразлагается
3 Nh3OH Nh4 + N2 + 3 h3O
62. Гидроксиламин
RR
C
R’
O + Nh3OH
C
-h3O
гидроксиламин
R
N
оксим
OH
64. Оксиды
• Все (кроме NO) термическинеустойчивы
• При комнатной температуре
разлагаются N2O3 и N2O5,
остальные при умеренном
нагревании
65. Оксиды
66. Оксиды
2 N2O 2 N2 + O2В атмосфере
• N2O + h O* + N2
Оксид азота (I) – окислитель
различных субстратов
68. Оксид азота (I) – окислитель
69.
 Оксид азота (I) – электрофил• Промышленное производство
Оксид азота (I) – электрофил• Промышленное производство• Метод Несмеянова получения
диазоферроцена
70. Высокоэнергетические олигомеры оксида азота (I)
71. Оксид NO
• ПолучениеNaNO2 + FeCl2 + 2 HCl
FeCl3 + NO + NaCl + h3O
2 NaNO2 + h3SO4
Na2SO4 + NO + NO2 + h3O
72. Оксиды
N2O3 NO + NO22 NO2 O2 + 2 NO
73. Взаимодействие монооксида азота с радикалами
• Образующиеся нитрозосоединения– эффективные спиновые ловушки
(спиновые метки) – ингибируют
свободнорадикальные процессы
в полимерах
74. Оксиды
• Окислитель10 NO + P4 P4O10 + 5 N2
2 NO + SO2 SO3 + N2O
75. Оксиды
• C сильными окислителями:2 NO + Г2 2 NOГ (Г=F,Cl,Br,I)
(нитрозилгалогениды)
76. Оксиды
• C сильными окислителями:2NO + K2Cr2O7 + 4h3SO4
2HNO3 + Cr2(SO4)3 + K2SO4 +
3h3O
• NO склонен к
комплексообразованию
[Fe(h3O)6]SO4 + NO
[Fe(h3O)5NO]SO4 + h3O
77.
 Оксиды• В жидком аммиаке
Оксиды• В жидком аммиакеNa + NO NaNO
• С расплавленной щелочью
6 NO + 4 KOH =
N2 + 4KNO2 + 2h3O
• Соли нитрозония
NOHSO4, NOClO4, (NO)2SeO4
78. Оксиды
N2O3 NO + NO279. Оксиды
2 NO2 O2 + 2 NON2O4 2 NO2
80. Оксиды
• Окислитель2 NO2 + 2 S 2 SO2 + N2
81. Оксиды
• C сильными окислителями:2NO2 + F2 + 2h3O
2HNO3 + 2HF
82. Оксид N2O5
• Получение2 HNO3 + P2O5
2 HPO3 + N2O5
N2O3 + 2 O3 2 O2 + N2O5
NO2Cl + AgNO3 AgCl + N2O5
83. Оксиды
2 N2O5 O2 + 4 NO284. Оксиды
• Сильный окислительN2O5 + I2 = I2O5 + N2
85. Кислоты
Азотная и другие89. Химические свойства
• Окрашивает белки воранжево-желтый цвет (при
попадании на кожу рук –
«ксантопротеиновая
реакция»)
90. Азотная кислота
CH 3CH 2CH 3+HNO3
CH 3CH 2CH 2NO 2 + CH 3CHCH 3 + CH 3CH 2NO 2 + CH 3NO 2
25 %
NO 2
40 %
10 %
25 %
91.
 Меллитовая кислота12 С + 6 НNО3 =
Меллитовая кислота12 С + 6 НNО3 =С6(СООН)6 + 6 NO↑
• бензолгексакарбоновая кислота
• Нитраты в кислых
растворах растворяют
металлы
3 Cu + 2 KNO3 + 4 h3SO4
3 CuSO4 + K2SO4 + NO +
4 h3 O
• Разлагаются при
нагревании (с выделением
кислорода)
4 LiNO3 2 Li2O + 4 NO2 + O2
94. Разложение нитратов при T
Nh5NO3 = N2O + 2 h3ONaNO3 = NaNO2 + ½ O2
(Щ. и ЩЗ металлы)
Pb(NO3)2 = PbO + 2 NO2 + ½ O2
AgNO3 = Ag + NO2 + ½ O2
95. Определение NO3-
ОпределениеNO3
• C дифениламином в
присутствии
концентрированной серной
кислоты – синий
дифенилдифенохинондиимин
96. Определение NO3-
Определение2
NO3
N
N
N
H
H
H
дифенилбензидин (бесцветный)
N
N
H
H
+ 2 H+ .
(1.195)
дифенилбензидин (бесцветный)
N
N
дифенилдифенохинондиимин (синий)
+ 2 H +.
(1.196)
97. Формы азотной кислоты
• С химически связаннойводой
• NO(OH)3, N(OH)5 не
известны, но соли
получены
98.
 ОРТОНИТРАТЫ• Продолжительное, в течение
ОРТОНИТРАТЫ• Продолжительное, в течениенескольких дней, взаимодействие
нитрата и оксида ЩЭ (серебряный
тигель, 300°С) приводит к образованию
кристаллического вещества белого
цвета:
NaNO3 + Na2O = Na3NO4
• Чувствителен к действию влаги воздуха
и СО2:
Na3NO4 + СО2 = NaNO3 + Na2CO3
99. Кислоты
Царская водка• Смесь HNO3 и HCl (1:3)
HNO3 + 3 HCl
Cl2 + NOCl + 2 h3O
NOCl NO + Cl
Au + HNO3 + 3 HCl
AuCl3 + NO + 2 h3O
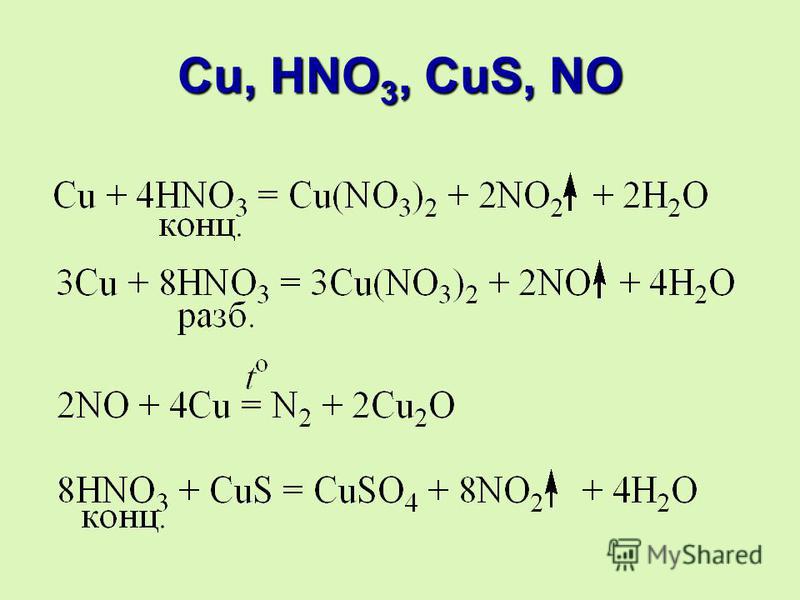
• Если избыток HCl: H[AuCl4]
101. Химические свойства
Царская водка
HNO3 + 4 HCl + Au =
H[AuCl4] + NO + 2 h3O
4 HNO3 + 18 HCl + Pt =
3 h3[PtCl6] + 4 NO + 8 h3O
• Существует только в
растворах
• С восстановителями
2 HNO2 + h3S
S + 2 NO + h3O
• С окислителями
5 HNO2 + 2 KMnO4 + 3 h3SO4
5 HNO3 +
K2SO4 + 2 MnSO4 + 3 h3O
• При нагревании
3 HNO2
HNO3 + 2 NO + h3O
• Нитриты
• Все, кроме AgNO2, хорошо
растворимы в воде
ClCH 2COOH
Хлоруксусная
кислота
O 2N
N aOH
CH 2
ClCH 3COON a
N aN O 2
SN 2
O 2N CH 2COON a
100 o C
CH 3N O 2
COO H
— CO 2 Н итрометан
H 3O
+
N+
O
нитрозил-катион
NaNO2
C6H5
HCl
-NaCl
HO
Nh3 + +[N
анилин
N
O]Cl-
нитрозилхлорид
O
HCl
-h3O
+
N
C6H5 N
O + Cl-
Cl
+ h3O
N
бензолдиазонийхлорид
108
109.
 Определение NO2-Определение
Определение NO2-ОпределениеNO2
• Соли кобальта и нитрит калия в
уксуснокислой среде образуют
желтый кристаллический
осадок:
Co2+ + NO2 + 2 Ch4COOH
NO + 2 Ch4COO + Co3+ + h3O
Co3+ + 6 NO2 [Co(NO2)6]3[Co(NO2)6]3- + 3 K+ K3[Co(NO2)6]
110. h3N2O2 (N2O•Н2О)
• Азотноватистая кислота(гипоазотистая)
• Белое кристаллическое
взрывчатое вещество
• Соли (Э2N2O2) – гипонитриты,
трудно растворимы в воде
• Получение
Nh3OH + HNO2 h3N2O2 + h3O
Na2N2O2 + 2HX 2NaX + h3N2O2
• Свойства
h3N2O2 N2O + 2 h3O
112. ДИНИТРАЗОВАЯ КИСЛОТА
• Динитрамид, HN3O4 — бесцветнаяподвижная жидкость
• Легко разлагается:
HN3O4 = HNO3 + N2O
• Разбавленные растворы HN3O4 в воде и
органических растворителях устойчивы
продолжительное время
• Одна из сильнейших кислот
113. Соли HN3O4
• Соли HN3O4, как правило,стабильны
• Получают:
2 Nh4 + 2 NО2X = Nh5N3О4 + 2 НХ
(X = BF4-)
• Аммониевая соль Nh5N3O4
применяется как окислитель для
твердого ракетного топлива
• Надазотистая кислота
(при окислении НNO2
посредством Н2О2)
• Сама не устойчива, но ее
анион в щелочной среде
устойчив
• Азотноватая кислота (не
выделена)
• Образуется при нитрозировании
гидроксиламина
• Гипонитраты натрия и 2-х
валентных металлов получены
Na2N2O3
• Гидроазотистая кислота
(не получена)
• Известны соли
NaNO2 + Na Na4N2O4
(в жидком аммиаке)
Разлагается со взрывом
117.
 Боразол – B3N3H6• Неорганический бензол
Боразол – B3N3H6• Неорганический бензол• У бензола и боразола почти
идентичное строение, близкие
физические и химические свойства
(правда, в большинстве реакций
боразол ведет себя активнее
бензола), причем не только у самих
веществ, но и у аналогичных их
производных
118. Боразол – B3N3H6
119. Боразол – B3N3H6
• Получают• Известны
120. Боразол – B3N3H6
121. Соединения бора с азотом и водородом
122. Азотсодержащие органические соединения
НитросоединенияНитрозосоединения
Гидроксиламины
R
NO2
R
..
NO
R
..
N
H
OH
122
123. Азотсодержащие органические соединения
Нитрилы
R-C N
Амиды карбоновых кислот R-C(O)Nh3
Аминосоединения
R-Nh3
Аминокислоты
HOOC-X-Nh3
Гетероциклические соединения
124. Азотсодержащие соединения
R ..N
1
R
Гидразины
Диазосоединения
R
+ N2 X
2
.
 . R
. RN
3
R
R
CN2
R’
Азосоединения
R
..
N
..
N
R’
124
pH обычных кислот и оснований
Расчетные значения pH обычных кислот и оснований для 1, 10 и 100 ммоль/л (действительно для стандартных условий при 25 , 1 атм; константы кислотности взяты отсюда):
| • кислоты: | , отсортированные по pH или формуле |
| • основания: | , отсортированные по pH или формуле |
| • органика: | органические кислоты и соли |
| • другие реакции: Бесплатное программное обеспечение (Пример) Демонстрация: онлайн-калькулятор pH |
pH кислот — Сортировка по pH
| Кислота | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| H 2 SeO 4 | селеновая кислота | 2,74 | 1,83 | 0,97 | |
| Н 2 SO 4 | серная кислота | 2,75 | 1,87 | 1. 01 01 | |
| Привет | йодистоводородная кислота | 3.01 | 2.04 | 1,08 | |
| HBr | бромистоводородная кислота | 3.01 | 2.04 | 1,08 | |
| HCl | соляная кислота | 3.01 | 2.04 | 1,08 | |
| HNO 3 | азотная кислота | 3.01 | 2.04 | 1,08 | |
| H 3 Заказ на покупку 4 | ортофосфорная кислота | 3,06 | 2,26 | 1,63 | |
| Н 3 АсО 4 | мышьяковая кислота | 3,08 | 2,31 | 1,70 | |
| H 2 SeO 3 | селенистая кислота | 3,15 | 2,47 | 1,90 | |
| H 2 CrO 4 | хромовая кислота | 3,03 | 2,33 | 2,06 | |
| h4цитрат | лимонная кислота, C 6 H 8 O 7 | 3,24 | 2,62 | 2,08 | |
| ВЧ | фтористоводородная кислота | 3,27 | 2,65 | 2. 12 12 | |
| HNO 2 | азотистая кислота | 3,28 | 2,67 | 2,13 | |
| Гидроцианат | изоциановая кислота, HOCN | 3,35 | 2,76 | 2,23 | |
| HFormate | муравьиная кислота, CH 2 O 2 (метановая кислота) | 3,47 | 2,91 | 2,38 | |
| Н 2 Се | селенид водорода | 3,49 | 2,93 | 2,41 | |
| H 2 MoO 4 | молибденовая кислота | 3,46 | 2,94 | 2,43 | |
| ГЛактат | молочная кислота, C 3 H 6 O 3 (молочная кислота) | 3,51 | 2,96 | 2,44 | |
| ХАцетат | уксусная кислота, C 2 H 4 O 2 (этановая кислота) | 3,91 | 3,39 | 2,88 | |
| H | угольная кислота | 4,68 | 4. 18 18 | 3,68 | |
| В 2 Ю | сероводород | 4,97 | 4,47 | 3,97 | |
| Н 3 АсО 3 | мышьяковистая кислота | 6.07 | 5,58 | 5,09 | |
| Гидроцианид | синильная кислота, HCN | 6.11 | 5,62 | 5.12 | |
| Н 3 БО 3 | борная кислота | 6.12 | 5,62 | 5.12 | |
| H 4 SiO 4 | кремниевая кислота | 6,40 | 5,91 | 5,42 | |
| H 4 SiO 4 | кремниевая кислота (с SiO 2 (a) осаждением) | 6,40 | 6,26 | 6,26 |
рН кислот — отсортировано по формуле
| Кислота | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| H 2 CO 3 | угольная кислота | 4,68 | 4. 18 18 | 3,68 | |
| H 2 CrO 4 | хромовая кислота | 3,03 | 2,33 | 2,06 | |
| H 2 MoO 4 | молибденовая кислота | 3,46 | 2,94 | 2,43 | |
| В 2 Ю | сероводород | 4,97 | 4,47 | 3,97 | |
| Н 2 Се | селенид водорода | 3,49 | 2,93 | 2,41 | |
| H 2 SeO 3 | селенистая кислота | 3,15 | 2,47 | 1,90 | |
| H 2 SeO 4 | селеновая кислота | 2,74 | 1,83 | 0,97 | |
| Н 2 SO 4 | серная кислота | 2,75 | 1,87 | 1. 01 01 | |
| Н 3 АсО 3 | мышьяковистая кислота | 6.07 | 5,58 | 5,09 | |
| Н 3 АсО 4 | мышьяковая кислота | 3,08 | 2,31 | 1,70 | |
| Н 3 БО 3 | борная кислота | 6.12 | 5,62 | 5.12 | |
| H 3 Цитрат | лимонная кислота, C 6 H 8 O 7 | 3,24 | 2,62 | 2.08 | |
| Н 3 Заказ на покупку 4 | ортофосфорная кислота | 3,06 | 2,26 | 1,63 | |
| H 4 SiO 4 | кремниевая кислота | 6,40 | 5,91 | 5,42 | |
| H 4 SiO 4 | кремниевая кислота (с осаждением SiO2(a)) | 6,40 | 6,26 | 6,26 | |
| ХАцетат | уксусная кислота, C 2 H 4 O 2 (этановая кислота) | 3,91 | 3,39 | 2,88 | |
| HBr | бромистоводородная кислота | 3. 01 01 | 2.04 | 1,08 | |
| HCl | соляная кислота | 3.01 | 2.04 | 1,08 | |
| Гидроцианат | изоциановая кислота, HOCN | 3,35 | 2,76 | 2,23 | |
| Гидроцианид | синильная кислота, HCN | 6.11 | 5,62 | 5.12 | |
| ВЧ | фтористоводородная кислота | 3,27 | 2,65 | 2.12 | |
| HFormate | муравьиная кислота, CH 2 O 2 (метановая кислота) | 3,47 | 2,91 | 2,38 | |
| Привет | йодистоводородная кислота | 3. 01 01 | 2.04 | 1,08 | |
| ГЛактат | молочная кислота, C 3 H 6 O 3 (молочная кислота) | 3,51 | 2,96 | 2,44 | |
| HNO 2 | азотистая кислота | 3,28 | 2,67 | 2,13 | |
| HNO 3 | азотная кислота | 3.01 | 2.04 | 1,08 |
pH оснований — Сортировка по pH
Учитывается ограниченная растворимость гидроксидов (как указано в сносках в последней колонке).
| Основание | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| Ва(ОН) 2 | бария гидроксид | 11. 27 27 | 12.22 | 13.08 | 1 |
| Sr(ОН) 2 | гидроксид стронция | 11.27 | 12.22 | 13.09 | |
| NaOH | гидроксид натрия | 10,98 | 11,95 | 12,88 | |
| КОН | гидроксид калия (калий едкий) | 10,98 | 11,95 | 12,88 | |
| Na 2 SiO 3 | метасиликат натрия | 11.00 | 11,91 | 12,62 | |
| Са(ОН)2 | гидроксид кальция (известь, CaO:H 2 O) | 11.27 | 12.20 | 12,46 | 2 |
| Нет данных 3 Заказ на поставку 4 | тринатрийфосфат | 10,95 | 11,71 | 12. 12 12 | |
| К 2 CO 3 | карбонат калия | 10,52 | 11.00 | 11.36 | |
| Na 2 CO 3 | карбонат натрия (кальцинированная сода) | 10,52 | 10,97 | 11.26 | |
| НХ 4 ОХ | гидроксид аммония (NH 3 :Н 2 О) | 10.09 | 10,61 | 11.12 | |
| Мг(ОН) 2 | гидроксид магния (MgO:H 2 O) | 10.40 | 10.40 | 10.40 | 3 |
| CaCO 3 | карбонат кальция (кальцит) | 9,91 | 9,91 | 9,91 | 4 |
| Fe(OH) 2 | гидроксид железа(II) (гидроксид железа) | 9,45 | 9,45 | 9,45 | 5 |
| Cd(ОН) 2 | кадмия гидроксид | 9,36 | 9,36 | 9,36 | 6 |
| Нет 2 В 4 О 7 | борат натрия (бура) | 9. 21 21 | 9.17 | 9.05 | |
| Со(ОН) 2 | гидроксид кобальта(II) | 9,15 | 9,15 | 9,15 | 7 |
| Zn(OH) 2 | гидроксид цинка | 8,88 | 8,88 | 8,88 | 8 |
| Ni(ОН) 2 | никеля(II) гидроксид | 8,37 | 8,37 | 8,37 | 9 |
| KАцетат | ацетат калия (CH 3 COOK) | 7,87 | 8,33 | 8,75 | |
| Ацетат натрия | ацетат натрия (CH 3 COONa) | 7,87 | 8,33 | 8,75 | |
| КНСО 3 | гидрокарбонат калия | 8,27 | 8,25 | 8. 13 13 | |
| NaHCO 3 | гидрокарбонат натрия | 8,27 | 8,22 | 8.02 | |
| Бе(ОН) 2 | гидроксид бериллия | 7,90 | 7,90 | 7,90 | 10 |
| Cu(OH) 2 | гидроксид меди(II) | 7,69 | 7,69 | 7,69 | 11 |
| Pb(OH) 2 | гидроксид свинца(II) | 7,54 | 7,54 | 7,54 | 12 |
| Cr(OH) 3 | хрома(III)гидроксид | 7.04 | 7.04 | 7.04 | 13 |
| Рт(ОН) 2 | ртути(II) гидроксид | 7. 03 03 | 7.03 | 7.03 | 14 |
pH оснований — отсортировано по формуле
| Основание | Имя | 1 мМ | 10 мМ | 100 мМ | |
|---|---|---|---|---|---|
| Ва(ОН) 2 | бария гидроксид | 11.27 | 12.22 | 13.08 | 1 |
| Бе(ОН) 2 | гидроксид бериллия | 7,90 | 7,90 | 7,90 | 10 |
| Са(ОН) 2 | гидроксид кальция (известь, CaO:H 2 O) | 11.27 | 12.20 | 12,46 | 2 |
| CaCO 3 | карбонат кальция (кальцит) | 9,91 | 9,91 | 9,91 | 4 |
| Cd(ОН) 2 | кадмия гидроксид | 9,36 | 9,36 | 9,36 | 6 |
| Со(ОН) 2 | гидроксид кобальта(II) | 9,15 | 9,15 | 9,15 | 7 |
| Cr(OH) 3 | хрома(III) гидроксид | 7. 04 04 | 7.04 | 7.04 | 13 |
| Cu(OH) 2 | гидроксид меди(II) | 7,69 | 7,69 | 7,69 | 11 |
| Fe(OH) 2 | гидроксид железа(II) (гидроксид железа) | 9,45 | 9,45 | 9,45 | 5 |
| Рт(ОН) 2 | ртути(II) гидроксид | 7.03 | 7.03 | 7.03 | 14 |
| К 2 СО 3 | карбонат калия | 10,52 | 11.00 | 11.36 | |
| KАцетат | ацетат калия (CH 3 COOK) | 7,87 | 8,33 | 8,75 | |
| КНСО 3 | гидрокарбонат калия | 8,27 | 8,25 | 8. 13 13 | |
| КОН | гидроксид калия (калий едкий) | 10,98 | 11,95 | 12,88 | |
| Мг(ОН) 2 | гидроксид магния (MgO:H 2 O) | 10.40 | 10.40 | 10.40 | 3 |
| Нет 2 В 4 О 7 | борат натрия (бура) | 9.21 | 9.17 | 9.05 | |
| Na 2 CO 3 | карбонат натрия (кальцинированная сода) | 10,52 | 10,97 | 11.26 | |
| Na 2 SiO 3 | метасиликат натрия | 11.00 | 11,91 | 12,62 | |
| Нет данных 3 Заказ на поставку 4 | тринатрийфосфат | 10,95 | 11,71 | 12. 12 12 | |
| Ацетат натрия | ацетат натрия (CH 3 COONa) | 7,87 | 8,33 | 8,75 | |
| NaHCO 3 | гидрокарбонат натрия | 8,27 | 8,22 | 8.02 | |
| NaOH | гидроксид натрия | 10,98 | 11,95 | 12,88 | |
| НХ 4 ОХ | гидроксид аммония (NH 3 :Н 2 О) | 10.09 | 10,61 | 11.12 | |
| Ni(ОН) 2 | никеля(II) гидроксид | 8,37 | 8,37 | 8,37 | 9 |
| Pb(OH) 2 | гидроксид свинца(II) | 7,54 | 7,54 | 7,54 | 12 |
| Sr(ОН) 2 | гидроксид стронция | 11. 27 27 | 12.22 | 13.09 | |
| Zn(OH) 2 | гидроксид цинка | 8,88 | 8,88 | 8,88 | 8 |
Примечания и сноски
Гидроксиды являются сильными основаниями, но имеют низкую растворимость, что ограничивает значение pH до верхней границы. Это достигается включением соответствующей твердой фазы в расчет равновесия.
в равновесии с твердой фазой Ba(OH) 2 :8H 2 O ↩ ↩ 2
в равновесии с твердой фазой Портландит ↩ ↩ 2
в равновесии с твердой фазой Брусит ↩ ↩ 2
в равновесии с твердой фазой Кальцит ↩ ↩ 2
в равновесии с твердой фазой Fe(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Cd(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Co(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Zn(OH) 2 -c ↩ ↩ 2
в равновесии с твердой фазой Ni(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Be(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Cu(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Pb(OH) 2 ↩ ↩ 2
в равновесии с твердой фазой Cr(OH) 3 (a) ↩ ↩ 2
в равновесии с твердой фазой Hg(OH) 2 ↩ ↩ 2
[последнее изменение: 17 января 2021 г. ]
]
h4po4-sr-oh-2 — Google
AlleBilderVideosNewsMapsShoppingBücher
suchoptionen
Tipp: Begrenze diesuche auf deutschsprachige Ergebnisse. Du kannst deinesuchsprache in den Einstellungen ändern.
3 Sr(OH)2 + 2 h4PO4 → Sr3(PO4)2 + 6 h3O
chemequations.com › … PO4)2 + 6 ч3О с полными продуктами. Anwendung zur vervollständigung on …
h4PO4 + Sr(OH)2 = (SrOH)3PO4 + h3O 3ч3О. Отказ от ответственности за информацию о реакции. Тип реакции Doppelte Umsetzung (Метатеза). Реактандэн. Фосфорная кислота — h4PO4.
Sr(OH)2 + h4PO4 = Sr3(PO4)2 + h3O — Chemical Equation Balancer
; Фосфорная кислота [h4PO4] реагирует с образованием одного моля твердого вещества; Фосфат стронция [Sr3(PO4)2] и шесть молей …
Как написать результирующее ионное уравнение для Sr(OH)2 + h4PO4 … — YouTube
www.youtube.com › смотреть
31.10.2020 · Есть три основных шага для написания результирующего ионного уравнения для Sr(OH)2 + h4PO4 = Sr3(PO4)2 . ..
..
Dauer: 3:25
Прислан: 31.10.2020
Решенная часть A h4PO4(aq)+Sr(OH)2(aq)→ Express ваш ответ как
www.chegg.com › вопросы и ответы
Вопрос: Часть A h4PO4(вод)+Sr(OH)2(вод)→ Представьте свой ответ в виде химического уравнения. Определите все этапы в своем ответе.
Завершите и сбалансируйте следующую кислотно-щелочную реакцию. h4PO4(водн. …
homework.study.com › … › Химическое уравнение
Ответ на: Дополните и уравновесьте следующую кислотно-щелочную реакцию. h4PO4(водн.) + Sr(OH)2(водн.) arrow Зарегистрировавшись, вы получите тысячи пошаговых…
Реакция гидроксида стронция с фосфорной кислотой
chemiday.com › реакция
03.10.2015 · Sr(OH)2 + h4PO4 → SrHPO4 + 2h3O · Изображение реакции: img1 BB html · Код для поиска: SrOh3 + h4PO4 = SrHPO4 + 2 h3O · Добавлено / Отредактировано: 12.08.2015 …
Balance Химическое уравнение — Online Balancer
www.
