Основания (гидроксиды). Свойства, получение, применение In-chemistry.ru
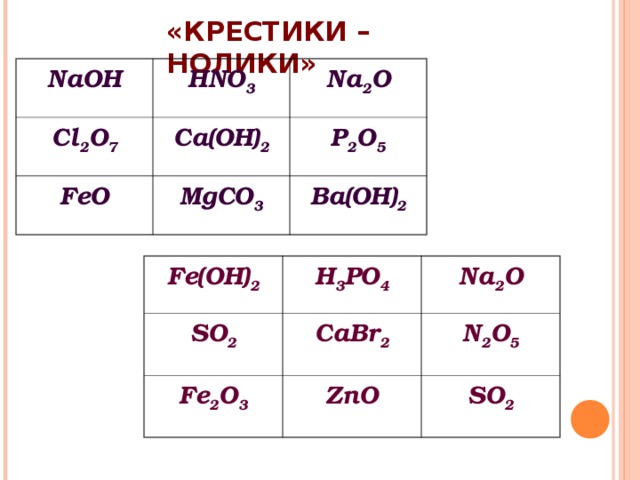
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).

- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода. Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
ПолучениеВзаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2 + CI2
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.
Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН —.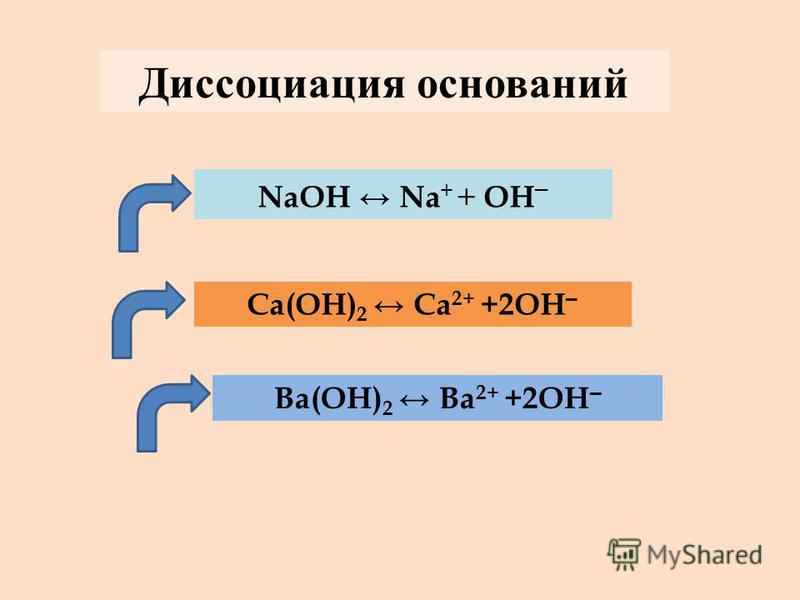
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + H2SO4 → K2SO4 + 2H2O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
нерастворимое
Взаимодействие с кислотными оксидами:
2KOH + SO3 → K2SO4 + H2O
Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + H2O,
NaOH + AI(OH)3 → NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H
NaOH + AI(OH)3 → Na[AI(OH)4].
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 → CaO + H2O,
Cu(OH)2 → CuO + H2O.
Гидроксид натрия — хим. свойства и получение
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
1. Гидроксид натрия получают электролизом раствора хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет.
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3NaOH + H3PO4 → Na3PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
NaOH + H3PO4 → NaH2PO4 + H2O
2. Гидроксид натрия реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
NaOH + NaHCO3 → Na2CO3 + H2O
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2) + 2H2O
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
3NaOH + P4 + 3H2O = 3NaH2PO2 + PH3↑
2NaOH(холодный) + Cl2 = NaClO + NaCl + H2O
6NaOH(горячий) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
Сера взаимодействует с гидроксидом натрия только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Гидроксид натрия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Гидроксид натрия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2NaOH + Zn → Na2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями.
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8.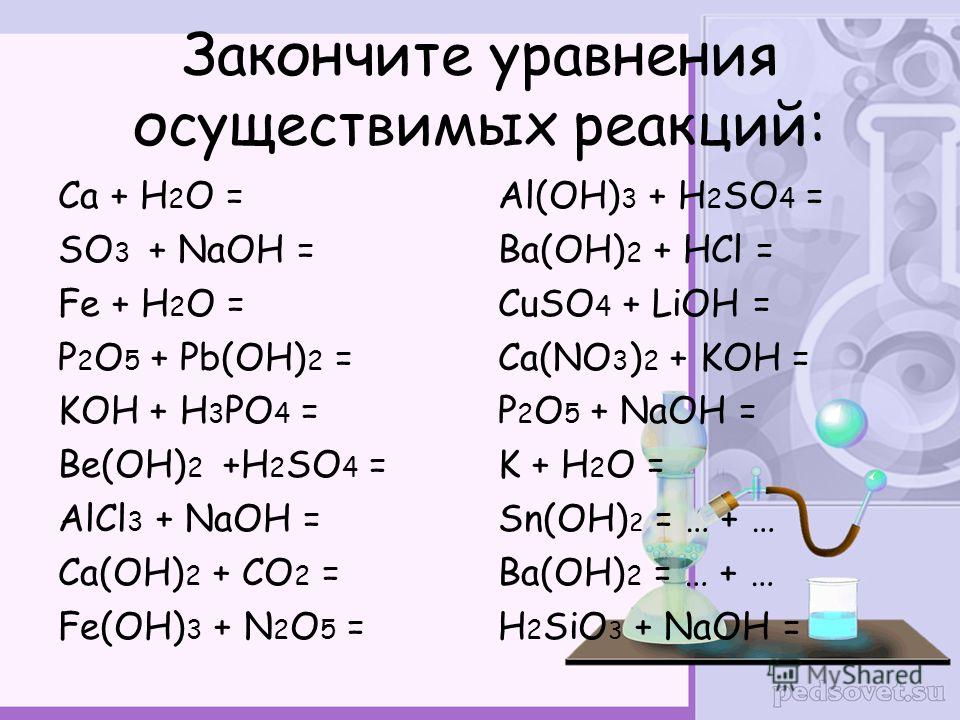 Гидроксид натрия разлагается при нагревании до температуры 600°С:
Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
9. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксид натрия в расплаве подвергается электролизу. При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Понравилось это:
Нравится Загрузка…
2 NABr + Ca(OH)2 = CaBr2 + 2 NaOH Сколько молей NaBr потребуется для реакции с 187,34 г гидроксида кальция?
Химия Химия
Китти К.
Благодарен за любую помощь! 🙂
Подписаться І 1
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Чиненые Г. ответил 09.06.21
Репетитор
Новое в Византе
Репетитор по химии, биологии и статистике
Смотрите таких репетиторов
Смотрите таких репетиторов
Сначала вы хотите начать с получения молей гидроксида кальция Ca(OH)2, данных в задаче.
Вам не даются граммы или моли для NaBr, и это то, что вы пытаетесь найти, так что это просто попытка увидеть, можете ли вы использовать стехиометрию, чтобы найти сбалансированное соотношение и пропорции, чтобы увидеть, что можно получить на основе СБАЛАНСИРОВАННОГО уравнение.
Это не вопрос обязательного определения ограничивающего реагента.
Итак, что вам нужно сделать, так это преобразовать граммы гидроксида кальция Ca(OH)2 в моли этого вещества, используя его атомный вес и размерный анализ:
Сначала рассчитайте атомный вес Ca(OH)2
Ca = 40,078 x 1
O = 16 x 2 (помните, что у вас есть 2 снаружи иона OH, поэтому вы умножаете на 2)
H= 1 x 2 (помните, что у вас есть 2 снаружи иона OH, поэтому вы умножаете на 2)
атомный вес для Ca(OH)2 = 74,078 г/моль
Я люблю ждать до конца, чтобы округлить числа для весов, потому что это увеличивает точность и точность.
Итак, теперь используйте размерный анализ, пока все, что у вас есть, это родинки:
187,34 г x 1 моль/74,078 г
вы должны написать атомный вес в обратном порядке, что означает просто переключение единиц измерения и запись числа в обратном порядке, чтобы в качестве конечных единиц у вас были моли, граммы отменяют граммы сверху вниз.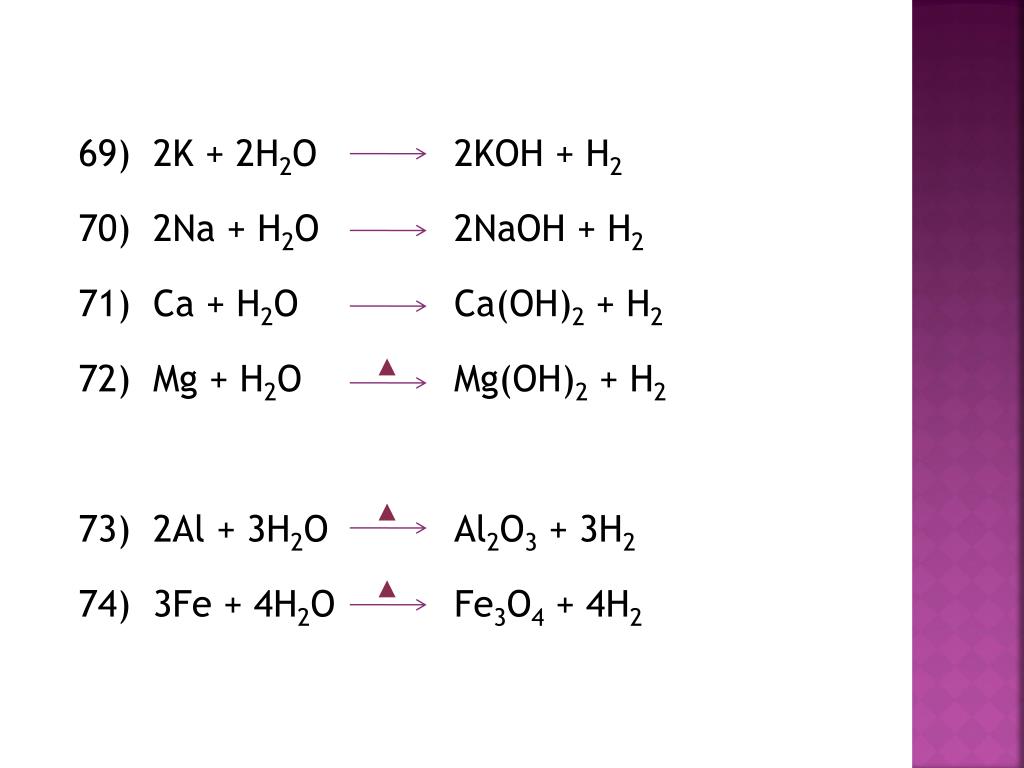
Итак, 187,34/74,078 = 2,528956 молей
Теперь, когда у вас есть моли
Посмотрите на ваше уравнение, оно сбалансировано? 2 сбн с обеих сторон
1 Са с обеих сторон
2 иона ОН с обеих сторон
Итак, это сбалансированное уравнение реакция NaBr с 1 молем Ca(OH)2:
Итак, как мы рассчитали из 187,34 г Ca(OH)2, что 2,528956 моль
Теперь установим соотношение того, что будет получено:
2 NaBr — —> 1Ca(OH)2
X NaBr——> 2,528956 Ca(OH)2
Теперь перекрестно умножьте, разделите и решите для X, и вы найдете, что моли NaBr основаны на этом: ближайшие значащие цифры основаны на информации, приведенной в тесте, но если просто сообщить до ближайшего целого числа, это будет
Голосовать за 1 голос против
Еще
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Гидролиз, подкисление и обезвоживание отработанного активного ила в щелочных условиях: совместное воздействие NaOH и Ca(OH)2
. 2013 май; 136: 237-43.
doi: 10.1016/j.biortech.2013.03.024. Epub 2013 13 марта.
Гаоцян Су 1 , Минсинь Хо, Чжиго Юань, Шуин Ван, Юнчжэнь Пэн
принадлежность
- 1 Ключевая лаборатория Пекинского научного центра по изучению качества воды и восстановлению водной среды, Пекинский центр инженерных исследований, Пекинский технологический университет, Пекин 100124, Китай.
 [email protected]
[email protected]
- PMID: 23567686
- DOI: 10.1016/j.biortech.2013.03.024
Гаоцян Су и др. Биоресурсная технология. 2013 май.
. 2013 май; 136: 237-43.
doi: 10.1016/j.biortech.2013.03.024. Epub 2013 13 марта.
Авторы
Гаоцян Су 1 , Минсинь Хо, Чжиго Юань, Шуин Ван, Юнчжэнь Пэн
принадлежность
- 1 Ключевая лаборатория Пекинского научного центра по изучению качества воды и восстановлению водной среды, Пекинский центр инженерных исследований, Пекинский технологический университет, Пекин 100124, Китай.
 [email protected]
[email protected]
- PMID: 23567686
- DOI: 10.1016/j.biortech.2013.03.024
Абстрактный
Гидролиз, подкисление и обезвоживаемость отработанного активного ила (ОИО) исследовали при рН 10, регулируемом добавлением NaOH, Ca(OH)2 или их смесей в различных соотношениях. Одинаковая эффективность солюбилизации САВ наблюдалась во всех случаях на уровне 38-40%. Производство высоколетучих жирных кислот (ЛЖК) и хорошая обезвоживаемость осадка не могут быть достигнуты одновременно путем добавления только NaOH или Ca(OH)2, но могут быть достигнуты путем добавления смесей NaOH и Ca(OH)2. Продукция ЛЖК при добавлении только Са(ОН)2 (1201 мг(ХПК)/л) была ниже, чем при добавлении NaOH или его смесей с Са(ОН)2 (1813-1868 мг(ХПК)/л).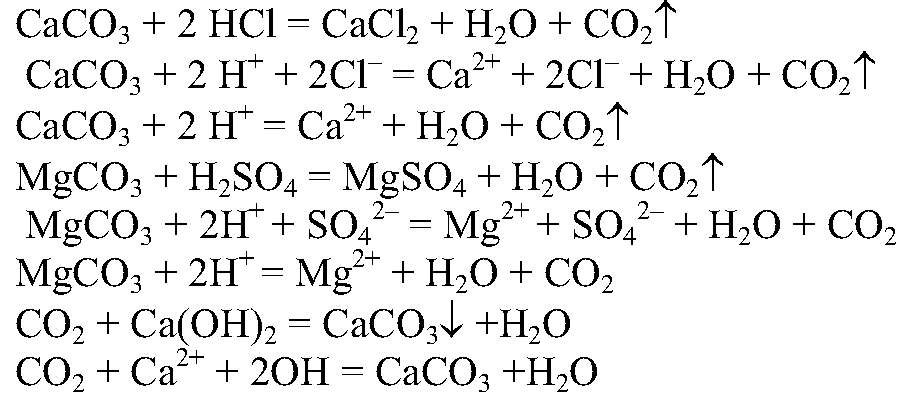
Copyright © 2013 Elsevier Ltd. Все права защищены.
Похожие статьи
Щелочное брожение активного ила в пилотном масштабе, отделение ферментационной жидкости и применение ферментационной жидкости для улучшения биологического удаления питательных веществ.
Ли С, Чен Х, Ху Л, Ю Л, Чен Ю, Гу Г. Ли Х и др. Технологии экологических наук. 2011 март 1; 45 (5): 1834-9. дои: 10.1021/es1031882. Epub 2011 31 января. Технологии экологических наук. 2011. PMID: 21280571
Влияние типов щелочей на ферментацию отработанного активного ила (ВАО) и микробные сообщества.

Ли С, Пэн Ю, Ли Б, Ву С, Чжан Л, Чжао Ю. Ли Х и др. Хемосфера. 2017 ноябрь; 186: 864-872. doi: 10.1016/j.chemosphere.2017.08.017. Epub 2017 8 августа. Хемосфера. 2017. PMID: 28826134
Длительное влияние типов щелочей на гидролитическое подкисление отработанного активного ила и микробное сообщество при низкой температуре.
Джин Б., Ван С., Син Л., Ли Б., Пэн Ю. Джин Б. и др. Биоресурсная технология. 2016 янв; 200:587-97. doi: 10.1016/j.biortech.2015.10.036. Epub 2015 19 октября. Биоресурсная технология. 2016. PMID: 26546788
Эффекты и модель обработки щелочных отходов активным илом.
Ли Х, Джин И, Махар Р, Ван З, Не И. Ли Х и др. Биоресурсная технология. 2008 г., июль; 99 (11): 5140-4.
 doi: 10.1016/j.biortech.2007.090,019. Epub 2007 22 октября.
Биоресурсная технология. 2008.
PMID: 17945487
doi: 10.1016/j.biortech.2007.090,019. Epub 2007 22 октября.
Биоресурсная технология. 2008.
PMID: 17945487Обзор анаэробного реактора с восходящим потоком воздуха.
Бал А.С., Дхагат Н.Н. Бал А.С. и соавт. Индийская компания J Environ Health. 2001 г., апрель; 43 (2): 1–82. Индийская компания J Environ Health. 2001. PMID: 12397675 Обзор.
Посмотреть все похожие статьи
Цитируется
Биоинженерия анаэробного сбраживания летучих жирных кислот, производства водорода или метана: критический обзор.
Вайнайна С., Лукитавеса, Кумар Авасти М., Тахерзаде М.Дж. Вайнайна С. и др. Биоинженерия. 2019 дек;10(1):437-458. дои: 10.1080/21655979.2019.





 doi: 10.1016/j.biortech.2007.090,019. Epub 2007 22 октября.
Биоресурсная технология. 2008.
PMID: 17945487
doi: 10.1016/j.biortech.2007.090,019. Epub 2007 22 октября.
Биоресурсная технология. 2008.
PMID: 17945487