Получение биокомпозитных имплантатов на основе β-Ca3(PO4)2/поли(d,l-лактид)а и β-Ca3(PO4)2/поли(ε- капролактон)а для замещения костной ткани — статья
В связи с техническими работами в центре обработки данных, часть прикреплённых файлов в настоящее время недоступна.
скрыть
Получение биокомпозитных имплантатов на основе β-Ca3(PO4)2/поли(d,l-лактид)а и β-Ca3(PO4)2/поли(ε- капролактон)а для замещения костной тканистатья Исследовательская статья
Статья опубликована в журнале из списка RSCI Web of Science
Статья опубликована в журнале из перечня ВАКДата последнего поиска статьи во внешних источниках: 10 августа 2018 г.
- Авторы:
Зуев Д.М.,
Климашина Е.
 С.,
Евдокимов П.В.,
Филиппов Я.Ю.,
Путляев В.И.
С.,
Евдокимов П.В.,
Филиппов Я.Ю.,
Путляев В.И. - Журнал: Неорганические материалы
- Том: 54
- Номер: 1
- Год издания: 2018
- Первая страница: 94
- Последняя страница: 103
- DOI: 10.7868/S0002337X18010165
- Аннотация:
Методом термоэкструзионной 3D-печати из высоконаполненных композитных кордов β-Ca3(PO4)2/поли(D,L-лактид) (со степенью заполнения до 50 вес.
 %), β-Ca3(PO4)2/поли(ε-капролактон) (со степенью заполнения до 70 вес.%) изготовлены высокопроницаемые макропористые имплантаты с различной архитектурой для костной пластики. Для модификации поверхности композитных макропористых имплантатов, с целью улучшения их смачивания физиологическими растворами, предложена их обработка в плазме катодного разряда (2.5 Вт, плазмообразующий газ – воздух) в сочетании с дальнейшим травлением в растворе 0.5М лимонной кислоты. Показано, что основной вклад в изменение смачиваемости (краевого угла) композитов вносит изменение рельефа после травления в низкотемпературной плазме и лимонной кислоте. Альтернативным способом модифицирования поверхности композитов являлось осаждения слоя карбонатгидроксиапатита из раствора искусственной межтканевой жидкости, пересыщенного относительно природного аналога в 5 раз (5хSBF).
Ключевые слова: 3D-печать, биорезорбируемые материалы, композиты, трикальциевый фосфат, термоэкструзия, плазменная обработка, гидрофильность поверхности.
%), β-Ca3(PO4)2/поли(ε-капролактон) (со степенью заполнения до 70 вес.%) изготовлены высокопроницаемые макропористые имплантаты с различной архитектурой для костной пластики. Для модификации поверхности композитных макропористых имплантатов, с целью улучшения их смачивания физиологическими растворами, предложена их обработка в плазме катодного разряда (2.5 Вт, плазмообразующий газ – воздух) в сочетании с дальнейшим травлением в растворе 0.5М лимонной кислоты. Показано, что основной вклад в изменение смачиваемости (краевого угла) композитов вносит изменение рельефа после травления в низкотемпературной плазме и лимонной кислоте. Альтернативным способом модифицирования поверхности композитов являлось осаждения слоя карбонатгидроксиапатита из раствора искусственной межтканевой жидкости, пересыщенного относительно природного аналога в 5 раз (5хSBF).
Ключевые слова: 3D-печать, биорезорбируемые материалы, композиты, трикальциевый фосфат, термоэкструзия, плазменная обработка, гидрофильность поверхности.
- Добавил в систему: Климашина Елена Сергеевна
Прикрепленные файлы
| № | Имя | Описание | Имя файла | Размер | Добавлен |
|---|
Фосфор
Главная > Справочник по образованию > Энциклопедия де-факто > Естественные науки > Химия > Рефераты > Фосфор
Распространенность в природе. Массовая доля фосфора в земной коре составляет 0,08%. Важнейшими минералами фосфора, встречающимися в природе, являются фторапатит Ca5(PO4)3F и фосфорит Ca3(PO4)2.
Свойства. Фосфор образует несколько аллотропных модификаций, которые заметно различаются по свойствам. Белый фосфор — мягкое кристаллическое вещество. Состоит из молекул P4. Плавится при температуре 44,1С. Очень хорошо растворим в сероуглероде CS2. Черезвычайно ядовит и легко загорается.
Белый фосфор — мягкое кристаллическое вещество. Состоит из молекул P4. Плавится при температуре 44,1С. Очень хорошо растворим в сероуглероде CS2. Черезвычайно ядовит и легко загорается.
При нагревании белого фосфора образуется Красный фосфор. Он представляет собой смесь нескольких модификаций, которые имеют различную длину молекул. Цвет красного фосфора в зависимости от способа и условий получения может меняться от светло-красного до фиолетового и темно-коричневого. Температура его плавления 585-600.
Черный фосфор — наиболее устойчивая модификация. По внешнему виду он похож на графит. В отличие от белого фосфора красный и черный фосфор не растворяются в сероуглероде, они не ядовиты и не огнеопасны.
Фосфор химически более активен, чем азот. Химическая активность фосфора зависит от аллотропной модификации, в которой он находится. Так, наиболее активен белый фосфор, а наимнее активен черный фосфор.
В уравнениях химических реакций белый фосфор обычно записывают формулой P4, которая соответствует составу его молекул.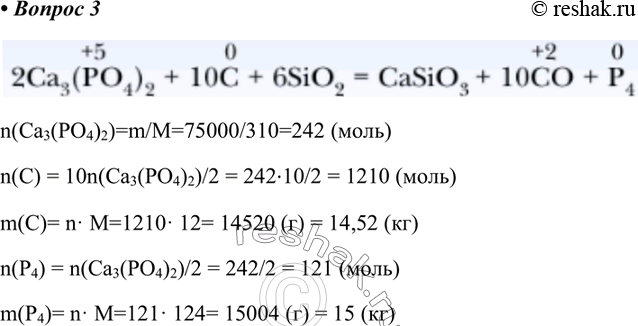 Красная и черная модификации фосфора обычно записываются формулой P. Этот же символ используют, если модификация неизвестна или может быть любой.
Красная и черная модификации фосфора обычно записываются формулой P. Этот же символ используют, если модификация неизвестна или может быть любой.
1. Взаимодействие с простыми веществами — неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с водородом фосфор не реагирует. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V), например:
2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr5
2. Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды:
3Mg + 2P = Mg3P2
Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина Ph4:
Mg3P2 + 6h3O = 3Mg(OH)2 + 2Ph4
Фосфин Ph4 по химическим свойствам похож на аммиак Nh4.
3. Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует:
0 -3 +1
P4 + 3NaOH + 3h3O = Ph4 + 3Nah3PO2
Получение. Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов и фторапатитов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора.
Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора.
В качестве восстановителя соединений фосфора используют кокс (углерод). Для связывания соединений кальция в реакционную систему добавляют кварцевый песок SiO2. Процесс проводят в электопечах (производство относят к электротермическим). Реакция протекает по уравнению:
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 + 10CO
Продукт реакции — белый фосфор. Из-за наличия примесей технический фосфор имеет желтый цвет, поэтому в промышленности его называют желтым фосфором.
Фосфорные удобрения. Фосфор, так же как и азот, является важным элементом для обеспечения роста и жизнедеятельности растений. Растения извлекают фосфор из почвы, поэтому его запасы необходимо восполнять, периодически добавляя фосфорные удобрения. Фосфорные удобрения производят из фосфата кальция, который входит в состав природных фосфоритов и фторапатитов.
Простейшее фосфорное удобрение — фосфоритная мука представляет собой перемолотый фосфорит Ca3(PO4)2. Это удобрение труднорастворимо, оно может усваиваться растениями только на кислых почвах.
Это удобрение труднорастворимо, оно может усваиваться растениями только на кислых почвах.
Действием серной кислоты на фосфат кальция получают простой суперфосфат, основным компонентом которого является дигидрофосфат кальция Ca(h3PO4)2. Это — растворимое вещество, и оно хорошо усваивается растениями. Метод получения простого суперфосфата основан на реакции
Ca3(PO4)2 + 2h3SO4 = Ca(h3PO4)2 + 2CaSO4
Кроме основного компонента суперфосфат содержит до 50% сульфата кальция, который является балластом. Для повышения содержания фосфора в удобрении проводят обработку фосфорита фосфорной кислотой:
Ca3(PO4)2 + 4h4PO4 = 3Ca(h3PO4)2
Получаемое удобрение называется двойным суперфосфатом. Еще одно фосфорное удобрение с высоким содержанием фосфора — преципитат CaHPO42h3O.
Высококонцентрированные фосфорные удобрения приготавливают на основе суперфосфорной кислоты — смеси полифосфорных кислот h5P2O7, H5P3O10, H6P4O13 и др. Эти кислоты образуются при нагреавнии фосфорной кислоты h4PO4 в вакууме.
При взаимодействии полифосфорных кислот с аммиаком образуются полифосфаты аммония, которые используются как комплексные азотно-фосфорные удобрения.
Вместе с азотом фосфор входит в состав некоторых других комплексных удобрений, например аммофоса Nh5h3PO4 и диаммофоса (Nh5)2HPO4.
Уткин Евгений Валерьевич
СПбРТ, гр. 9В-144
При написании реферата была использована
следующая литература:
1. И.Г. Хомченко ‘Общая химия’, М. ‘Химия’ 1987
2. Г.П. Хомченко ‘Химия для поступающих в ВУЗы’,
М.’Высшая школа’ 1994
Другие записи
10.06.2016. Уран
1. Химические свойства четырех и шести валентного урана.Уран -белый металл плотностью 18,3 г/см, плавящийся притемпературе 1133 градуса. Металл достаточно активен при слабомнагревании он загорается в присутствии…
10.06.2016. Становление понятий о химическом элементе
Теоретические представления о химических явлениях рассматривались в курсе философии в свете общих представлений о возникновении и исчезновении веществ. Эксперементальной же работой в области химии занимались…
Эксперементальной же работой в области химии занимались…
10.06.2016. Сильнодействующие ядовитые вещества. Гидразин и его производные
Гидразин (Nh3Nh3) – это сильно гигроскопическая жидкость, обладающая заметной способностью поглощать из воздуха углекислоту и кислород. Замерзает гидразин при температуре плюс 1,5, кипит при температуре…
10.06.2016. Некоторые химические элементы
БОРБор в основном применяется в виде буры. БУРА натриевая соль тераборной кислоты.Она широко применяется при производстве легкоплавкой глазури для фаянсовых и фарфоровых изделий и особенно для чугунной…
10.06.2016. Платина
применение платины.Историческая справка.“Белое золото”, “гнилое золото”… Под этими названиями платина фигурирует в литературе XVIII в. Этот металл известен давно, его белые тяжелые зерна находили при добыче…
Первая находка мерриллита Ca3(PO4)2 в земной среде в виде включения в нижне-мантийном алмазе | Американский минералог
Skip Nav Destination
Исследовательская статья|
01 августа 2022 г.
Каминский Феликс Владимирович;
Зедгенизов Дмитрий Анатольевич
Информация об авторе и статье
* Электронная почта: [email protected]
Издательство: Минералогическое общество Америки.
Полученный: 08 июн 2021
Принял: 18 авг 2021 г.
Первый онлайн: 01 авг 2022
ISSN в сети: 1945-3027
ISSN для печати: 0003-004X
Copyright © 2022 Минералогического общества Америки
Минералогическое общество Америки
Американский минералог (2022) 107 (8): 1652–1655.
https://doi.org/10.2138/am-2022-8175
История статьи
Получено:
08 июня 2021 г.
Принято:
18 августа 2021 г.
Первый онлайн:
01 августа 2022 г.
Цитата
Каминский Ф.В., Зедгенизов Д.А.; Первая находка мерриллита, Ca 3 (PO 4 ) 2 , в земной среде как включение в нижней мантии алмаза.
Скачать файл цитирования:
- Рис (Зотеро)
- Реф-менеджер
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- Конечная примечание
- РефВоркс
- Бибтекс
Расширенный поиск
Merrillite, в идеале Ca 18 Na 2 Mg 2 (PO 4 ) 14 (Dana No: 38.03.04.04; Strunz No: 08.AC. 4 5), аналог синтетического трикальцийфосфата β -Ca 3 (PO 4 ) 2 был идентифицирован как включение в алмазах нижней мантии из района Рио-Сорисо, Бразилия. Он связан с бывшим бриджманитом, CaSi- и CaTi-перовскитами, ферропериклазом. Это первое сообщение о мерриллите в земной среде; ранее он был известен только в метеоритах и лунных породах. Составы мерриллита различаются в разных местах; проба Рио-Соризо была обогащена SO 3 (2,03 мас.%). Мерриллит из алмазов нижней мантии может быть ретроградной фазой туита [γ-Ca 3 (PO 4 ) 2 ]. Благодаря своей кристаллической структуре и меррилит, и туит могут быть важными потенциальными носителями редкоземельных элементов (РЗЭ) и крупноионных литофильных элементов (LILE), включая Sr и Ba, в недрах Земли. Находка мерриллита предполагает большее разнообразие минеральных видов в нижней мантии, чем предполагалось ранее.
4 5), аналог синтетического трикальцийфосфата β -Ca 3 (PO 4 ) 2 был идентифицирован как включение в алмазах нижней мантии из района Рио-Сорисо, Бразилия. Он связан с бывшим бриджманитом, CaSi- и CaTi-перовскитами, ферропериклазом. Это первое сообщение о мерриллите в земной среде; ранее он был известен только в метеоритах и лунных породах. Составы мерриллита различаются в разных местах; проба Рио-Соризо была обогащена SO 3 (2,03 мас.%). Мерриллит из алмазов нижней мантии может быть ретроградной фазой туита [γ-Ca 3 (PO 4 ) 2 ]. Благодаря своей кристаллической структуре и меррилит, и туит могут быть важными потенциальными носителями редкоземельных элементов (РЗЭ) и крупноионных литофильных элементов (LILE), включая Sr и Ba, в недрах Земли. Находка мерриллита предполагает большее разнообразие минеральных видов в нижней мантии, чем предполагалось ранее.
У вас нет доступа к этому контенту. Если вы считаете, что вам нужен доступ, обратитесь к администратору учреждения.

 С.,
Евдокимов П.В.,
Филиппов Я.Ю.,
Путляев В.И.
С.,
Евдокимов П.В.,
Филиппов Я.Ю.,
Путляев В.И. %), β-Ca3(PO4)2/поли(ε-капролактон) (со степенью заполнения до 70 вес.%) изготовлены высокопроницаемые макропористые имплантаты с различной архитектурой для костной пластики. Для модификации поверхности композитных макропористых имплантатов, с целью улучшения их смачивания физиологическими растворами, предложена их обработка в плазме катодного разряда (2.5 Вт, плазмообразующий газ – воздух) в сочетании с дальнейшим травлением в растворе 0.5М лимонной кислоты. Показано, что основной вклад в изменение смачиваемости (краевого угла) композитов вносит изменение рельефа после травления в низкотемпературной плазме и лимонной кислоте. Альтернативным способом модифицирования поверхности композитов являлось осаждения слоя карбонатгидроксиапатита из раствора искусственной межтканевой жидкости, пересыщенного относительно природного аналога в 5 раз (5хSBF).
Ключевые слова: 3D-печать, биорезорбируемые материалы, композиты, трикальциевый фосфат, термоэкструзия, плазменная обработка, гидрофильность поверхности.
%), β-Ca3(PO4)2/поли(ε-капролактон) (со степенью заполнения до 70 вес.%) изготовлены высокопроницаемые макропористые имплантаты с различной архитектурой для костной пластики. Для модификации поверхности композитных макропористых имплантатов, с целью улучшения их смачивания физиологическими растворами, предложена их обработка в плазме катодного разряда (2.5 Вт, плазмообразующий газ – воздух) в сочетании с дальнейшим травлением в растворе 0.5М лимонной кислоты. Показано, что основной вклад в изменение смачиваемости (краевого угла) композитов вносит изменение рельефа после травления в низкотемпературной плазме и лимонной кислоте. Альтернативным способом модифицирования поверхности композитов являлось осаждения слоя карбонатгидроксиапатита из раствора искусственной межтканевой жидкости, пересыщенного относительно природного аналога в 5 раз (5хSBF).
Ключевые слова: 3D-печать, биорезорбируемые материалы, композиты, трикальциевый фосфат, термоэкструзия, плазменная обработка, гидрофильность поверхности.